一种遗传编码的光交联非天然氨基酸盐及其制备方法与应用
1.本发明涉及生物化学中蛋白
‑
蛋白相互作用研究技术领域,尤其涉及一种活细胞光交联方法用于分析和富集蛋白
‑
蛋白相互作用。
背景技术:
2.蛋白
‑
蛋白相互作用在生命过程中起关键作用,不仅构成了细胞生物化学反应网络的一个主要组成部分,并且对于调控细胞及其信号有着重要意义。尤其是瞬时和低亲和力蛋白质相互作用复合物的形成在许多信号传导和调节途径中是必不可少的。然而,由于瞬时蛋白
‑
蛋白相互作用本质上是动态的,以便能够快速响应不同的刺激和环境条件,因此关于瞬时蛋白相互作用网络的分析和表征仍然非常具有挑战性。传统生物学方法,例如酵母双杂交系统、噬菌体展示技术、荧光能量转移分析(fret)、免疫共沉淀、以及亲和纯化等,尽管已被广泛用于研究蛋白
‑
蛋白相互作用,但这些方法均有一定的缺陷,如分辨率低、假阳性高等。更重要的是,这些方法均无法在生理状态下(如活细胞中)研究低亲和力、微弱的、瞬时的蛋白
‑
蛋白相互作用。
3.近年来,化学交联剂已开始成为一种研究蛋白
‑
蛋白相互作用的有力工具。化学交联剂的亲电基团可与天然氨基酸的亲核侧链发生化学反应形成共价键,从而稳定低亲和力的蛋白
‑
蛋白相互作用,便于验证和表征低亲和力的、瞬时的蛋白质相互作用复合物并促进其结构研究。然而,此类方法通常效率较低,对活细胞有一定的毒性,并且对蛋白质相互作用复合物的距离和几何构型有一定的要求。蛋白质相互作用复合物共价交联的另一种方法依赖于经过光活化原位生成的高反应性中间体,例如二苯甲酮或双吖丙啶官能团在紫外光照射条件下产生的双自由基或卡宾中间体。这些光激发产生的自由基物质比化学交联剂具有更广泛的反应性,能在完整细胞中与附近蛋白质分子中的n
‑
h,o
‑
h,以及c
‑
h键等高效地、不可逆地形成共价键,这一过程也称为“光交联”。此外,光诱导产生的自由基中间体比化学交联剂反应活性更高、寿命更短,这有可能提高蛋白质交联的效率并减少脱靶交联。光交联策略结合生化分析以及质谱鉴定,为在天然环境中研究低亲和力的瞬时蛋白
‑
蛋白相互作用提供了一种有效的途径。
4.然而,光交联策略需要将适当的光交联基团掺入目标蛋白质分子中,这在一定程度上限制了该策略的广泛应用。目前,在目标蛋白质(或多肽)中引入光交联基团主要通过化学合成(多肽)、化学修饰、蛋白质翻译后修饰或残基特异(residue
‑
specific)的非天然氨基酸掺入等方法来实现。但是,现有的这些技术存在一些问题和挑战:1.难以用于完整的活细胞研究。基于化学合成和修饰的方法虽然可以对蛋白质进行定点引入光交联基团,但其实验操作较为繁琐,并且由此获得的蛋白质难以递送进入完整的活细胞。2.非特异掺入。基于蛋白质翻译后修饰和残基特异的非天然氨基酸虽然可以在完整的活细胞内对目标蛋白质引入光交联基团,但无法实现位点特异的光交联标记,同时也会在细胞内对其它蛋白质引入光交联基团,从而造成潜在的光交联背景和假阳性。3.依赖于抗体进行检测和富集。由于光交联复合物丰度较低,为了实现其生化检测和质谱鉴定,需要对光交联复合物进行
富集。上述方法大都依赖抗体对目标蛋白质和光交联复合物进行检测和富集,但是抗体价格昂贵,并且往往富集效率较低。
5.蛋白质通常由20种天然氨基酸组成。近年来,利用遗传密码扩展技术(genetic code expansion)进行人工扩展遗传密码,使得将具有不同侧链的非天然氨基酸在蛋白质翻译过程中掺入蛋白质成为了可能。为了将非天然氨基酸特异性地掺入蛋白质的特定位点中,需要使用将非天然氨基酸识别到其同源trna上的正交氨酰基trna合成酶(aars)。这允许在mrna翻译期间特异性掺入非天然氨基酸以响应放置在目的基因中的自定义位点的琥珀终止密码子(即tag)。正交性是指aars和trna的相互特异性识别,用于在选择的宿主中识别非天然氨基酸而不干扰内源性合成酶、trna和天然氨基酸。正交aars/正交合成酶可以通过定向进化方法获得,并且迄今为止可以使用工程化的mjtyrrs或pylrs突变体将超过250个非天然氨基酸在原核和真核细胞中引入目的蛋白的特定位点上。
技术实现要素:
6.本发明的目的在于提供一种遗传编码的非天然氨基酸,以解决现有技术中难以用于完整的活细胞研究、非特异掺入、检测和富集成本价格高且效率低等问题。
7.为了达到上述目的本发明采用如下技术方案:
8.一种非天然氨基酸盐yndipk,其结构式是:
9.其中x=cl或cf3coo。
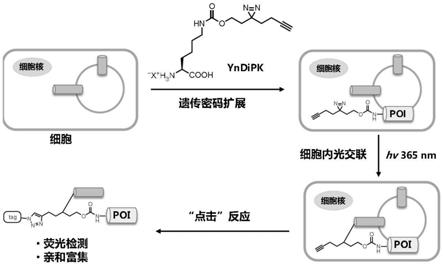
10.非天然氨基酸盐yndipk是一种赖氨酸类似物,包含一个双吖丙啶光交联基团、以及一个炔基富集基团。如图1所示,双吖丙啶基团受光照激活之后产生高活性的卡宾自由基,与周围分子发生交联形成共价键;炔基则可与含有叠氮的荧光团发生点击化学反应对光交联复合物进行荧光检测,或与含有叠氮的生物素发生点击化学反应,然后利用链霉亲和素琼脂糖(agarose)或磁珠实现对光交联复合物的亲和富集。
11.识别并将非天然氨基酸盐yndipk以位点特异方式掺入目的蛋白的正交吡咯赖氨酰trna合成酶:
12.其是以从野生型吡咯赖氨酰
‑
trna合成酶为基础,通过各种方法导入突变来制作得到的,其能将非天然氨基酸盐yndipk在原核和真核细胞中引入目的蛋白的特定位点上。
13.有些实施例中,识别并将非天然氨基酸盐yndipk以位点特异方式掺入目的蛋白的正交的吡咯赖氨酰trna合成酶,其氨基酸序列如:seq id no.1、seq id no.2或seq id no.3所示。
14.本发明还提供包含所述非天然氨基酸盐yndipk的化合物。
15.本发明还提供包含所述非天然氨基酸盐yndipk的蛋白质表达系统、翻译系统和细胞。
16.本发明还提供包含所述非天然氨基酸盐yndipk和所述识别并将非天然氨基酸盐yndipk以位点特异方式掺入目的蛋白的正交吡咯赖氨酰trna合成酶的蛋白质表达系统、翻译系统和细胞。
17.本发明还提供所述非天然氨基酸盐yndipk在定点插入蛋白质中的应用。
18.本发明还提供所述非天然氨基酸盐yndipk在蛋白
‑
蛋白相互作用的分析、表征和富集上的应用。
19.本发明与现有技术相比具有以下优点:
20.设计并合成了具有光交联基团(双吖丙啶)和富集基团(炔基)的双功能非天然氨基酸盐yndipk,然后筛选正交吡咯赖氨酰trna合成酶,使之对yndipk特异,利用遗传密码扩展技术(genetic code expansion)将yndipk定点插入到目标蛋白中琥珀终止密码子(tag)编码的位置,从而实现在表达宿主内目标蛋白分子中位点特异地掺入光交联基团和富集基团。在光照条件下,光交联基团被激活形成高反应性自由基中间体,与其附近的互相作用蛋白发生交联形成共价蛋白质复合物。之后,经过富集基团(炔基)与含有叠氮的荧光团或生物素发生点击化学反应,实现光交联复合物的荧光检测或亲和富集。
附图说明
21.此处所说明的附图用来提供对本发明的进一步理解,构成本技术的一部分,并不构成对本发明的不当限定,在附图中:
22.图1:遗传编码的光交联非天然氨基酸yndipk在活细胞内捕获、检测和富集蛋白
‑
蛋白相互作用示意图。
23.图2:非天然氨基酸yndipk的合成路线图。
24.图3:哺乳动物细胞中考察将yndipk插入gfp
‑
y39tag的吡咯赖氨酰trna合成酶突变体结果图。(a)荧光(gfp)检测不同吡咯赖氨酰trna合成酶突变体将yndipk插入gfp
‑
y39tag蛋白。(b)免疫印迹(anti
‑
gfp)检测不同吡咯赖氨酰trna合成酶突变体将yndipk插入gfp
‑
y39tag蛋白。
25.图4:野生型吡咯赖氨酰trna合成酶与突变体合成酶的氨基酸序列比对图。
26.图5:利用荧光光谱和免疫印迹检测哺乳动物细胞(hek293t细胞)中yndipk位点特异性插入gfp
‑
y39tag结果图。(a)荧光(gfp)检测yndipk以浓度依赖的方式插入gfp
‑
y39tag蛋白。(b)免疫印迹(anti
‑
gfp)检测yndipk以浓度依赖的方式插入gfp
‑
y39tag蛋白。
27.图6:在大肠杆菌中yndipk位点特异性插入到gfp中结果图。免疫印迹(anti
‑
gfp)和考马斯亮蓝染色(cb)检测大肠杆菌中yndipk位点特异地插入gfp
‑
y39tag蛋白,箭头标示gfp蛋白。
28.图7:利用免疫印迹和胶内荧光检测哺乳动物细胞(hek293t细胞)中yndipk位点特异性插入h2b
‑
v18tag蛋白以及在光照条件下交联h2b相互作用蛋白复合物结果图。(a)免疫印迹(anti
‑
ha)检测yndipk位点特异性插入h2b
‑
v18tag蛋白以及在光照条件下交联h2b相互作用蛋白复合物。(b)胶内荧光(az
‑
rho)检测yndipk位点特异性插入h2b
‑
v18tag蛋白以及在光照条件下交联h2b相互作用蛋白复合物,以考马斯亮蓝染色(cb)为上样量对照。
29.图8:利用免疫印迹和胶内荧光检测优化哺乳动物细胞(hek293t细胞)中yndipk在光照条件下交联h2b相互作用蛋白复合物条件结果图。(a)免疫印迹(anti
‑
ha)检测不同浓度的yndipk以及在不同光照时间条件下交联h2b相互作用蛋白复合物。(b)胶内荧光(az
‑
rho)检测不同浓度的yndipk以及在不同光照时间条件下交联h2b相互作用蛋白复合物,以考马斯亮蓝染色(cb)为上样量对照。
30.图9:利用免疫印迹(anti
‑
ha)检测通过炔基富集h2b光交联蛋白复合物结果图。
31.图10:利用免疫印迹(anti
‑
myc)检测h2b
‑
set光交联蛋白复合物结果图。
32.图11:利用免疫印迹和胶内荧光检测哺乳动物细胞(hek293t细胞)中yndipk位点特异性插入h3蛋白以及在光照条件下交联h3相互作用蛋白复合物结果图。(a)免疫印迹(anti
‑
ha)检测yndipk位点特异性插入h3蛋白以及在光照条件下交联h3相互作用蛋白复合物。(b)胶内荧光(az
‑
rho)检测yndipk位点特异性插入h3蛋白以及在光照条件下交联h3相互作用蛋白复合物,以考马斯亮蓝染色(cb)为上样量对照。
具体实施方式
33.下面将结合附图以及具体实施例来详细说明本发明,在此以本发明的示意性实施例及说明用来解释本发明,但并不作为对本发明的限定。
34.部分术语定义
35.本发明所用的术语“遗传编码”是指:活细胞将dna或mrna序列中编码的遗传物质信息翻译为蛋白质。
36.本发明所述的“遗传编码的非天然氨基酸”是指:能够参与遗传编码的非天然氨基酸。
37.本发明所用的术语“吡咯赖氨酰trna合成酶”是指:催化吡咯赖氨酸激活并共价结合在相应的trna分子3’端的酶。吡咯赖氨酸(pyl)在产甲烷菌的甲胺甲基转移酶中发现,是目前已知的第22种参与蛋白质生物合成的氨基酸。与标准氨基酸不同的是,吡咯赖氨酸(pyl)由终止密码子uag的有义编码形成。与之对应的,在产甲烷菌中也含有特异的吡咯赖氨酰
‑
trna合成酶(pylrs)和吡咯赖氨酸trna(trna pyl),其具有不同于经典trna的特殊结构。产甲烷菌通过直接途径和间接途径生成吡咯赖氨酰
‑
trna pyl(pyl
‑
trna pyl),它可能通过mrna上的特殊结构以及其他还未发现的机制,控制uag编码成为终止密码子或者吡咯赖氨酸。野生型吡咯赖氨酰
‑
trna合成酶(pylrs),例如可以从作为产甲烷古细菌的马氏甲烷八叠球菌(methanosarcina mazei)、巴氏甲烷八叠球菌(methanosarcina barkeri)和噬乙酸甲烷八叠球菌(methanosarcina acetivorans)等取得,但不限于这些。
38.本发明所用的术语“吡咯赖氨酰trna合成酶突变体”是指:以从野生型吡咯赖氨酰
‑
trna合成酶(pylrs)为基础,通过各种方法导入突变来制作。野生型pylrs所能够活化的赖氨酸衍生物的种类有限,例如本发明中吡咯赖氨酰trna合成酶突变体mm
‑
af即属于一种“吡咯赖氨酰
‑
trna合成酶突变体”,通过本发明的吡咯赖氨酰
‑
trna合成酶突变体,即便是对于采用野生型吡咯赖氨酰
‑
trna合成酶时无活性的非天然氨基酸盐yndipk,也能高效地导入蛋白质。
39.本发明所用的术语“琥珀终止密码子tag”是指:在蛋白质基因dna上转录形成mrna上终止密码子uag所对应的三联多核苷酸,即tag。在本发明中,“tag”和“uag”分别指对应dna和mrna上的琥珀终止密码子。
40.本发明所用的术语“非天然氨基酸”是指:不在20种常见天然氨基酸之列的任何氨基酸,修饰的氨基酸和/或氨基酸类似物。例如,本发明可使用非天然氨基酸盐yndipk。
41.本发明所用的术语“翻译系统”是指:将氨基酸掺入延伸中的多肽链(蛋白质)的各组分。翻译系统的组分可包括,例如核糖体、trna、合成酶、mrna等。本发明的o
‑
trna和/或o
‑
rs可加入体外或体内翻译系统或是其一部分,例如存在于非真核细胞,如细菌(如大肠杆
菌)中,或存在于真核细胞中,如酵母菌、哺乳动物细胞、植物细胞、藻类细胞、真菌细胞、昆虫细胞等。
42.本发明所用的术语“pbs”是指:磷酸缓冲盐溶液,即phosphate buffer saline,为本领域技术人员熟知并广泛使用。
43.实施例1:化学合成非天然氨基酸盐yndipk
44.非天然氨基酸盐yndipk的化学合成路线如图2所示,即α
‑
n
‑
boc
‑
赖氨酸(n
α
‑
boc
‑
l
‑
lys)在碱性条件下与化合物1发生活化酯反应生成赖氨酸衍生物化合物2,之后在酸性条件下(hcl或tfa)脱除boc保护基,从而制备得到相应的非天然氨基酸盐yndipk(盐酸盐或三氟乙酸盐),并用核磁共振确认。具体过程如下:
45.1.1化合物2的合成
46.在0℃下,向化合物1(1eq)的ch2cl2溶液中加入吡啶(1.2eq)和氯甲酸4
‑
硝基苯酯(1.2eq)。将反应混合物在25℃下搅拌10h,并用水淬灭。分离各层,水层用ch2cl2萃取。合并的有机层用饱和nh4cl水溶液和盐水洗涤,用无水na2so4干燥,并在减压下浓缩,得到无色油状的粗产物。上述粗产物直接溶于dmf,并在0℃下滴加入n
α
‑
boc
‑
l
‑
lys(1eq)、dipea(1.5eq)和dmap(0.2eq)的dmf溶液中。将反应混合物在25℃下搅拌10h,并用水淬灭。分离各层,水层用ch2cl2萃取。合并的有机层用1n hcl和盐水洗涤,用无水na2so4干燥,并在减压下浓缩。残余物通过硅胶柱色谱法纯化,得到白色固体化合物2(64%产率)。1h nmr(500mhz,meod)δ4.11
–
4.02(m,1h),3.92(t,j=6.3hz,2h),3.10(t,j=6.8hz,2h),2.26(t,j=2.6hz,1h),2.03(td,j=7.4,2.7hz,2h),1.84
–
1.76(m,1h),1.71(t,j=6.3hz,2h),1.67
–
1.62(m,3h),1.55
–
1.48(m,2h),1.47
–
1.41(m,11h).
13
c nmr(126mhz,meod)δ174.89,157.31,156.74,82.31,79.16,69.07,59.22,53.46,40.08,32.34,32.14,31.13,29.09,27.45,26.19,22.74,12.50.hrms:c
19
h
30
n4o6na[m+na]
+
计算值:433.2063,实测值:433.2058。
[0047]
1.2yndipk的合成
[0048]
向化合物2的1,4
‑
二氧六环溶液中加入hcl(4m)的1,4
‑
二氧六环溶液,将反应混合物在25℃下搅拌2h。减压除去溶剂,即得到yndipk盐酸盐的白色固体(94%产率)。1h nmr(300mhz,meod)δ4.03
–
3.88(m,3h),3.14(t,j=6.5hz,2h),2.29(t,j=2.7hz,1h),2.04(td,j=7.5,2.7hz,2h),2.02
–
1.86(m,2h),1.73(t,j=6.3hz,2h),1.66(t,j=7.4hz,2h),1.62
–
1.41(m,4h).
13
c nmr(75mhz,meod)δ170.53,157.47,82.37,69.15,59.34,52.57,39.94,32.35,32.20,29.89,29.14,26.28,21.93,12.56.hrms:c
14
h
23
n4o4[m+na]
+
计算值:311.1719,实测值:311.1720。
[0049]
或向化合物2的二氯甲烷溶液中加入三氟乙酸,将反应混合物在25℃下搅拌2h。减压除去溶剂,即得到yndipk三氟乙酸盐的淡黄色固体(98%产率)。1h nmr(300mhz,meod)δ4.03
–
3.88(m,3h),3.14(t,j=6.5hz,2h),2.29(t,j=2.7hz,1h),2.04(td,j=7.5,2.7hz,2h),2.02
–
1.86(m,2h),1.73(t,j=6.3hz,2h),1.66(t,j=7.4hz,2h),1.62
–
1.41(m,4h).
13
c nmr(75mhz,meod)δ170.53,157.47,82.37,69.15,59.34,52.57,39.94,32.35,32.20,29.89,29.14,26.28,21.93,12.56.hrms:c
14
h
23
n4o4[m+na]
+
计算值:311.1719,实测值:311.1720。
[0050]
实施例2:识别yndipk的吡咯赖氨酰trna合成酶突变体的筛选
[0051]
本发明为获得能够插入yndipk的吡咯赖氨酰trna合成酶的活性位点突变体,利用常规分子克隆方法构建并测试了一系列基于野生型吡咯赖氨酰trna合成酶的活性位点突变体,见下表1和图4。
[0052]
表1
[0053][0054]
为了测试上述突变体识别插入yndipk的能力,本发明以gfp为模型蛋白,在哺乳动物细胞(hek293t细胞)中对它们的活性进行了考察。具体而言,将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,在添加或不添加yndipk(1mm)的条件下,使用聚乙烯亚胺(polyethylenimine,即pei;每孔2.5μg)将含有琥珀密码子tag的gfp质粒,即gfp
‑
y39tag(每孔0.65μg)和相应的表1中所示的表达吡咯赖氨酰trna合成酶突变体的质粒(每孔0.35μg)共转染进hek293t细胞。转染24小时后,通过荧光显微镜检测gfp的荧光。每个荧光成像实验随机选择每孔至少三个视野。在image j中量化每个图像的荧光强度,并分组以进行统计分析。之后,通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。最后,将细胞裂解物在常规sds
‑
page凝胶上分离并通过免疫印迹进行分析。
[0055]
结果如图3所示,在哺乳动物hek293t细胞中,吡咯赖氨酰trna合成酶的突变体,如mm
‑
af、mb
‑
asf和mb
‑
mga,可以将非天然氨基酸yndipk插入gfp蛋白中,既可以通过荧光显微镜观察到gfp的荧光,也可以通过免疫印迹分析检测gfp蛋白的表达。而在野生型吡咯赖氨酰trna合成酶的样品中,通过荧光显微镜基本观察不到gfp的荧光;与此相符地,通过免疫印迹实验也基本检测不到gfp的表达。
[0056]
因此,本发明发现吡咯赖氨酰trna合成酶突变体,如mm
‑
af、mb
‑
asf和mb
‑
mga,可有效地将yndipk引入gfp
‑
y39tag蛋白中。mm
‑
af、mb
‑
asf和mb
‑
mga的序列分别如seq id no.1、2和3所示。
[0057]
seq id no.1(mm
‑
af)序列如下:
[0058][0059]
seq id no.2(mb
‑
asf)序列如下:
[0060][0061][0062]
seq id no.3(mb
‑
mga)序列如下:
[0063][0064]
实施例3:yndipk以浓度依赖的方式插入哺乳动物细胞的蛋白质中
[0065]
将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,在不添加或添加不同浓度(6.25μμ、12.5μμ、25μμ、50μμ、100μμ、200μμ、400μμ、800μμ)yndipk的条件下,使用pei(每孔2.5μg)将含有琥珀密码子tag的gfp质粒,即gfp
‑
y39tag(每孔0.65μg)和表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒(每孔0.35μg)共转染进细胞。转染24小时后,通过荧光显微镜检测gfp的荧光。每个荧光成像实验随机选择每孔至少三个视野。在image j中量化每个图像的荧光强度,并分组以进行统计分析。之后,通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。最后,将去除细胞碎片的细胞裂解物在自制的sds
‑
page凝胶上分离并通过免疫印迹进行分析。
[0066]
结果如图5所示,可见在哺乳动物hek293t细胞中,只有当培养基中存在yndipk时,全长gfp蛋白才会表达,并且gfp蛋白的表达量与yndipk的浓度相关。
[0067]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0068]
实施例4:yndipk定点插入大肠杆菌的蛋白质中
[0069]
将含有琥珀密码子tag的gfp质粒(gfp
‑
y39tag),与表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒共转化大肠杆菌菌株bl21(de3)。转化的细菌在含卡那霉素(40μg/ml)和氯霉素(34μg/ml)的lb培养基中于37℃过夜生长,然后以1:100稀释接种到补充有卡那霉素(40μg/ml)和氯霉素(34μg/ml)的新鲜tb培养基(ph=8.0)中并在37℃下振荡培养。当od600达到0.6时,将yndipk加入细菌培养物中,其终浓度为1mm。孵育1小时后,通过加入1mm异丙基
‑1‑
硫代
‑
β
‑
d
‑
半乳糖吡喃糖苷(iptg)诱导蛋白表达10小时。之后离心收集细菌并在95℃下用4%sds裂解缓冲液(4%sds,150mm nacl,50mm三乙醇胺,ph 7.4)裂解。将所得的细菌裂解物在室温下以16,000x g离心5分钟以去除细菌碎片。通过bca测定法测定蛋白质浓度。最后,将细菌裂解物在自制的sds
‑
page凝胶上电泳分离,并通过免疫印迹和考马斯亮蓝染色进行分析。
[0070]
结果如图6所示,空白对照组和yndipk组相比较,只有当培养基中存在yndipk时,全长gfp蛋白才会表达。因此,yndipk成功在大肠杆菌中整合到gfp的y39位点。
[0071]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0072]
综上结果表明,在大肠杆菌和哺乳动物细胞中,yndipk均能被吡咯赖氨酰trna合成酶突变体(mm
‑
af、mb
‑
asf、mb
‑
mga)位点特异地编码到gfp蛋白中。
[0073]
实施例5:yndipk在哺乳动物细胞中光交联h2b相互作用蛋白复合物
[0074]
将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,在不添加或添加yndipk(0.5mm)的条件下,使用pei(每孔2.5μg)将含有琥珀密码子tag的h2b质粒,即h2b
‑
v18tag(每孔0.65μg)和表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒(每孔0.35μg)共转染进细胞。转染24小时后,将培养基换成pbs溶液,并用365nm光照处理10min。通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。之后,利用铜催化的炔基
‑
叠氮点击反应(clickreaction)将裂解液与叠氮
‑
罗丹明进行偶联。最后,将偶联的细胞裂解液在自制的sds
‑
page凝胶上分离并通过胶内荧光和免疫印迹进行分析。
[0075]
如图7所示,胶内荧光和免疫印迹分析结果均表明,在哺乳动物hek293t细胞中,只有当培养基中存在yndipk时,全长h2b蛋白才会表达;在光照条件下,可以观察到高分子量的光交联蛋白质复合物的形成。
[0076]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0077]
实施例6:yndipk在哺乳动物细胞中光交联h2b相互作用蛋白复合物的条件优化
[0078]
将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,在不添加或添加不同浓度yndipk(终浓度分别为0μm、25μm、50μm、100μm或200μm)的条件下,使用pei(每孔2.5μg)将含有琥珀密码子tag的h2b质粒,即h2b
‑
v18tag(每孔0.65μg)和表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒(每孔0.35μg)共转染进细胞。转染24小时后,将培养基换成pbs溶液,并用365nm光照处理不同的时间(0min、5min、10min、
15min、20min)。通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。之后,利用铜催化的炔基
‑
叠氮点击反应(click reaction)将裂解液与叠氮
‑
罗丹明进行偶联。最后,将偶联的细胞裂解液在自制的sds
‑
page凝胶上分离并通过胶内荧光和免疫印迹进行分析。
[0079]
如图8所示,胶内荧光和免疫印迹分析结果均表明,在哺乳动物hek293t细胞中,只有当培养基中存在yndipk时,全长h2b蛋白才会表达;在光照条件下,可以观察到高分子量的光交联蛋白质复合物的形成。并且,随着yndipk浓度的升高以及光照时间的延长,光交联蛋白质复合物的形成逐渐增多。
[0080]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0081]
实施例7:yndipk在哺乳动物细胞中光交联并富集h2b相互作用蛋白复合物
[0082]
将hek293t细胞接种在多聚赖氨酸包被的100mm培养皿上,并在10ml生长培养基中培养过夜。第二天,在不添加或添加yndipk(0.2mm)的条件下,使用pei(25μg)将含有琥珀密码子tag的h2b质粒,即h2b
‑
v18tag(6.5μg)和表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒(3.5μg)共转染进细胞。转染24小时后,将培养基换成pbs溶液,并用365nm光照处理10min。通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。之后,利用铜催化的炔基
‑
叠氮点击反应(click reaction)将裂解液与叠氮
‑
生物素进行偶联,然后利用链霉亲和素琼脂糖(agarose)富集生物素修饰的蛋白质。最后,将富集后的蛋白质用sds
‑
page上样缓冲液洗脱,在自制的sds
‑
page凝胶上分离并通过免疫印迹进行分析。
[0083]
如图9所示,免疫印迹分析结果表明,yndipk在光照条件下形成的h2b光交联蛋白质复合物可以通过链霉亲和素琼脂糖得到分离和富集(pull
‑
down)。
[0084]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0085]
实施例8:yndipk在哺乳动物细胞中光交联h2b
‑
set相互作用蛋白复合物
[0086]
为了进一步验证yndipk能够在哺乳动物细胞内光交联相互作用蛋白复合物,本发明挑选组蛋白h2b的潜在伴侣蛋白set,考察了yndipk光交联h2b与set蛋白
‑
蛋白相互作用的能力。
[0087]
将hek293t细胞接种在多聚赖氨酸包被的100mm培养皿上,并在10ml生长培养基中培养过夜。第二天,在添加yndipk(0.2mm)的条件下,使用pei(25μg)将含有琥珀密码子tag的h2b质粒,即h2b
‑
v18tag(4μg)、表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒(2μg),以及表达set蛋白的质粒(4μg)共转染进细胞。转染24小时后,将培养基换成pbs溶液,不采用光照或用365nm光照处理10min。通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片,上清液用含有1%tritonx
‑
100的溶液稀释,通过bca测定法测定蛋白质浓度。之后,利用偶
联ha标签抗体的磁珠富集h2b蛋白以及h2b
‑
set光交联复合物,将富集后的蛋白质用sds
‑
page上样缓冲液洗脱,在自制的sds
‑
page凝胶上分离并通过免疫印迹进行分析。
[0088]
如图10所示,免疫印迹分析结果表明,只有在光照条件下才能观察到高分子量的h2b
‑
set光交联复合物,并且其分子量约为h2b和set蛋白分子量之和,从而证实了yndipk的确可以在哺乳动物细胞内光交联蛋白
‑
蛋白相互作用。
[0089]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0090]
实施例9:yndipk在哺乳动物细胞中光交联h3相互作用蛋白复合物
[0091]
将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,在添加yndipk(0.2mm)的条件下,使用pei(每孔2.5μg)将含有琥珀密码子tag的h3质粒(每孔0.65μg)和表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒(每孔0.35μg)共转染进细胞。转染24小时后,将培养基换成pbs溶液,不采用光照或用365nm光照处理10min。通过超声处理和涡旋,用含有蛋白酶抑制剂的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000x g离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。之后,利用铜催化的炔基
‑
叠氮点击反应(click reaction)将裂解液与叠氮
‑
罗丹明进行偶联。最后,将偶联的细胞裂解液在自制的sds
‑
page凝胶上分离并通过胶内荧光和免疫印迹进行分析。
[0092]
如图11所示,胶内荧光和免疫印迹分析结果均表明,在哺乳动物hek293t细胞中,仅在光照条件下,可以观察到具有高分子量的h3蛋白的光交联相互作用蛋白复合物的形成。
[0093]
分别采用表达吡咯赖氨酰trna合成酶突变体mb
‑
asf的质粒、表达吡咯赖氨酰trna合成酶突变体mb
‑
mga的质粒来替代表达吡咯赖氨酰trna合成酶突变体mm
‑
af的质粒进行上述实验操作,同样能够到达相同或相当技术效果。
[0094]
以上对本发明实施例所提供的技术方案进行了详细介绍,本文中应用了具体个例对本发明实施例的原理以及实施方式进行了阐述,以上实施例的说明只适用于帮助理解本发明实施例的原理;同时,对于本领域的一般技术人员,依据本发明实施例,在具体实施方式以及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101]
[0102][0103]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1