一种提高桑黄胞内多酚积累量的方法
1.本发明涉及生物发酵工程技术领域,具体涉及利用不饱和脂肪酸提升桑黄胞内多酚积累的方法。
背景技术:
2.桑黄属担子菌门的药用真菌,并且是我国民间珍贵的药材。在《本草纲目》中记载桑黄具有“利五脏,宣肠胃气,排毒气”等功能。研究表明,桑黄中含有多糖、三萜、多酚和有机酸等多种活性成分,这些成分在抗肿瘤、保护肝脏、抗氧化、抗菌消炎和增强机体免疫力等方面具有显著的活性[1
‑
4]。多酚类化合物由一个或多个羟基构成,主要分为黄酮类化合物、吡喃酮类化合物、呋喃酮类化合物等,均具有较高的抗氧化活性[5]。黄酮类化合物具有抗氧化、抗肿瘤、扩张血管和抑菌的功效;吡喃酮类化合物具有较强的清除自由基能力和抑制nf
‑
κb途径的生物活性;呋喃酮类化合物具有抗菌、抗病毒和抗补体等活性作用[6
‑
7]。
[0003]
虽然野生型桑黄可以产生多种活性物质,但是在自然界中,桑黄的生长对环境要求严格,并且子实体生长缓慢。随着市场需求量的不断增大,野生资源越来越少,人工培育桑黄成为了人们关注的热点。但是在人工发酵培养条件下,桑黄次级代谢产物积累量很低,无法满足生产需要。这是由于桑黄在人工培养条件下合成次级代谢产物的相关基因均处于低表达或沉默状态。研究发现,真菌在受到外界环境的刺激后,菌体会产生一系列的应答反应,从而影响基因生物表达水平、改变酶活性,最终提高次级代谢产物的积累量。
[0004]
液体发酵培养具有条件可控且生长周期短等特点,然而,在桑黄的发酵过程存在活性成分产量低的问题,因此在液体发酵情况下,如何通过激发子提高桑黄活性成分含量成为一个重要研究内容。
[0005]
参考文献:
[0006]
1.ge qing,mao jianwei,zhang anqiang,wang yongjiang,sun peilong.purification,chemical characterization,and antioxidant activity of a polysaccharide from the fruiting bodies of sanghuang mushroom(phellinus baumii pil
á
t)[j].food sci biotech,2013,22(2):384
‑
389.
[0007]
2.yayeh t,lee wm,ko d,park sc,cho jy,park hj,lee ik,kim sh,hong sb,kim s,yun bs,rhee mh.phellinus baumii ethyl acetate extract alleviated collagen type ii induced arthritis in dba/1mice[j].j nat med,2013,67(4):807
‑
813.
[0008]
3.hwang bs,lee ik,choi hj,yun bs.anti
‑
influenza activities of polyphenols from the medicinal mushroom phellinus baumii[j].bioorg med chem lett,2015,25(16):3256
‑
3260.
[0009]
4.noh jr,lee ik,kim yh,gang gt,hwang jh,ly sy,yun bs,lee ch.antiatherogenic effect of antioxidant polyphenols from phellinus baumii in apolipoprotein e
‑
deficient mice[j].ann nutr metab,2011,59(2
‑
4):145
‑
153.
[0010]
5.昝立峰,包海鹰,李丹花.“桑黄”类真菌中多酚物质及其生物活性研究进展[j].天然产物研究与开发,2016,(1):147
‑
155.
[0011]
6.黄孝闻,俞忠明,董宇,等.桑黄在古代中医典籍中的应用记载及其现代药用研究进展[j].中华中医药学刊,2014,032(009):2249
‑
2252.
[0012]
7.吴长生.药用真菌桑黄化学成分的研究[d].山东大学,2011.
技术实现要素:
[0013]
本发明的目的是提供一种提升发酵培养桑黄的胞内多酚积累的方法。
[0014]
为实现上述发明目的,本发明的技术方案具体如下:
[0015]
利用不饱和脂肪酸提升桑黄胞内多酚积累的方法,包括:向桑黄的培养基中加入不饱和脂肪酸。
[0016]
进一步的,所述培养基是液体培养基。
[0017]
进一步的,所述不饱和脂肪酸的加入比例是0.5g/l~1g/l。
[0018]
进一步的,所述不饱和脂肪酸是亚油酸和/或亚麻酸。
[0019]
进一步的,桑黄的培养具体包括:
[0020]
将固体培养的桑黄菌种接种到液体培养基中,进行活化培养,然后按体积百分数10%的接种量接到种子发酵培养基中,进行种子培养,在恒温摇床培养5天得种子液;将种子液按体积百分比为5%的接种量接种于液体发酵培养基中,加入不饱和脂肪酸,使发酵液中不饱和脂肪酸的浓度为0.5g/l~1g/l,恒温摇床培养13天,收集发酵培养物,过滤获得菌丝体。
[0021]
进一步的,所述恒温摇床培养时的转速是150转每分钟,培养温度是26℃。
[0022]
进一步的,所述种子培养基为ypd培养基,配方为:酵母膏10份,蛋白胨20份,葡萄糖20份,充分搅拌直至溶解。
[0023]
进一步的,所述液体发酵培养基的配方是:称取mgso
4 0.5份,(nh4)2so
4 0.2份,葡萄糖20份,cacl
2 0.1份,酵母膏10份,kh2po
4 1份于容器中,加入去离子水,充分搅拌直至溶解后,调节ph值至5.5。
[0024]
与现有技术相比,本发明的有益技术效果:
[0025]
本发明在桑黄发酵培养时以不饱和脂肪酸为激发子,显著的提高了桑黄生物量的积累和硬毛素类多酚产量。
附图说明
[0026]
图1是亚油酸对瓦尼桑黄发酵菌丝生物量的影响实验结果;
[0027]
图2是亚油酸对瓦尼桑黄胞内多酚的影响实验结果;
[0028]
图3是亚油酸对三种多酚化合物含量的影响实验结果;
[0029]
图4是亚麻酸对瓦尼桑黄发酵菌丝生物量的影响实验结果;
[0030]
图5是亚麻酸对瓦尼桑黄胞内多酚的影响实验结果;
[0031]
图6是亚麻酸对三种多酚化合物含量的影响实验结果。
具体实施方式
[0032]
下面结合实施例对本发明进行进一步说明。
[0033]
实施例1
[0034]
1.供试菌株及培养基
[0035]
瓦尼桑黄(sanghuangporus vaninii)菌种保存于石蜡培养基中。桑黄液体培养基:mgso
4 0.5g,(nh4)2so
4 0.2g,葡萄糖20g,cacl
2 0.1g,酵母膏10g,kh2po
4 1g于1l的烧杯中,加入800ml去离子水,充分搅拌直至溶解后,调节ph值至5.5后,定容为1l。固体培养基是在每升液体培养基中加入15g的琼脂粉。
[0036]
2.桑黄的液体发酵
[0037]
将固体培养的瓦尼桑黄切割成小块,转移至发酵培养基中。在恒温摇床中,150转每分钟,26℃条件下培养5天。取出摇瓶,用手提式匀浆器在无菌条件下充分打碎。继续放置于恒温摇床中,150转每分钟,26℃,培养5天。即为母液。可用于后续液体发酵。液体发酵瓦尼桑黄(s.vaninii),共分为三组,分别为培养基中不含有不饱和脂肪酸的对照组、含有0.5g/l及含有1g/l不饱和脂肪酸的实验组。在培养5d、7d、9d、11d和13d时进行取样。
[0038]
3.生物量的测定
[0039]
收集发酵培养物,过滤获得菌丝体,将菌丝体干燥至恒重后进行称量。
[0040]
4.多酚的提取
[0041]
对发酵液进行过滤,收集菌丝体置于离心管中。向离心管中加入1倍菌体体积的甲醇:丙酮=1:1提取液,用闪式提取器将菌体打碎并与提取液充分接触,室温浸泡过夜。取出样品管,转速为6000rmp,离心5分钟,收集上清液。重复三次。收集上清液。利用旋转蒸发仪浓缩样品,并用甲醇溶解。
[0042]
5.多酚含量的测定
[0043]
以没食子酸为标准品,利用folin
‑
ciocalteu法测定多酚含量并绘制标准曲线。样品中多酚含量的测定:利用folin
‑
ciocalteu法测定不同样品中多酚的含量,带入标准曲线方程,计算样品的多酚浓度。
[0044]
6.利用hplc法检测多酚的组成
[0045]
hplc检测条件为:
[0046]
(1)色谱柱:atlantis dc18 3μm 2.1
×
150nm column
[0047]
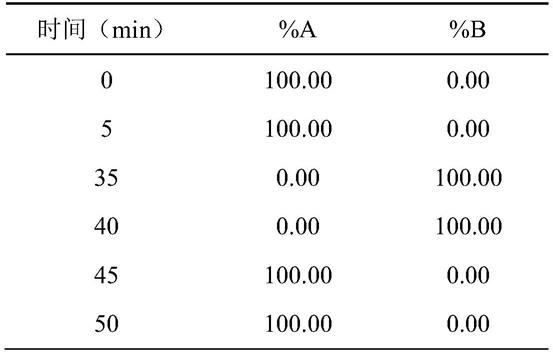
(2)色谱条件:流动相:a:0.01%甲酸加5%乙腈水溶液,b:0.01%甲酸乙腈;流速:0.2ml/min;检测波长:300nm;进样量:2μl;柱温箱:35℃;梯度洗脱程序如下表1:
[0048]
表1 梯度洗脱程序
[0049][0050]
实施例2:亚油酸对桑黄生物量积累和多酚合成的影响
[0051]
1.菌丝体生物量的变化
[0052]
在桑黄液体培养基中添加不同量的亚油酸,使培养基中亚油酸的浓度分别为:0、0.5、1g/l,以不加亚油酸的培养基为对照。0.5g/l和1g/l的亚油酸都能够促进瓦尼桑黄菌丝体生物量的增加,在生长第五天时,0.5g/l亚油酸浓度的菌丝体生长速度最快。随着培养时间的增长,在第七天后,1g/l亚油酸浓度促进效果更加明显,其生物量高于对照组和0.5g/l浓度。直至第13天,亚油酸浓度为1g/l时,桑黄的生物量达到6.9g/l,比对照组提高了53.33%(图1)。
[0053]
2.菌丝体多酚积累的变化
[0054]
在瓦尼桑黄生长的前期,亚油酸对胞内多酚的积累未显示出促进作用。但生长至第7天开始,添加亚油酸的实验组胞内多酚含量逐渐高于对照组(未添加亚油酸),并且0.5g/l浓度的亚油酸促进效果更明显,在第11天时,0.5g/l浓度的亚油酸组的胞内多酚达到了5.37mg/g,相比于对照组的3.61mg/g增加了48.75%(图2)。
[0055]
3.化合物hispidin的积累
[0056]
以hispidin为标准品,利用hplc法检测不同培养条件下多酚组成的区别。从图3中可以看出,第5
‑
7天,添加1g/l亚油酸处理后hispidin含量的增加比较明显,0.5g/l和1g/l浓度在第9天和第13天达到最大值,分别为43.08μg/mg和39.45μg/mg。
[0057]
实施例2亚麻酸对桑黄生物量积累和多酚合成的影响
[0058]
1.对生物量积累的影响
[0059]
在桑黄液体培养基中添加不同量的亚麻酸,使培养基中亚麻酸的浓度分别为:0、0.5、1g/l,以不加亚麻酸的培养基为对照。按照菌丝体的生长情况选取5d、7d、11d、13d这生长时间进行取样,将3组样品取出后通过过滤分离发酵液和菌丝体,充分烘干后,称取菌丝体干重并记录,整理后得到图4。根据图4可以看出,菌丝体生物量处于平稳的增长,相比于不添加亚麻酸的对照组,添加0.5g/l和1g/l亚麻酸后菌丝体生物量增高。并且在第13天时,各浓度下菌丝体的干重都达到了最高,对照组为3.99g/l,0.5g/l亚麻酸实验组为4.76g/l、1g/l亚麻酸实验组为5.16g/l,其中添加1g/l亚麻酸的实验组促生长效果最好,比对照组的干重增加了1.17g/l。
[0060]
2.对多酚积累的变化
[0061]
生长至第5天时,三组样品中0.5g/l实验组的总多酚含量最高。随着生长时间的增
加,第7至14天的数据显示,添加1g/l亚麻酸的实验组促进效果最明显,而0.5g/l亚麻酸刺激后,虽然含量增长少于1g/l的实验组,但相比于对照组,含量仍然升高。最终在第13天时各组均达到最大值,并且此时亚麻酸添加0.5g/l和1g/l这两组的总多酚含量大致相同,相较于此时对照组的含量,增加了0.46mg/g(图5)。
[0062]
3.化合物hispidin的积累
[0063]
图6中显示出第9天开始,添加亚麻酸的实验组hispidin含量高于对照组,添加0.5g/l亚麻酸的实验组在第13天含量最高,达到8.17μg/mg。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1