利用海水促进雨生红球藻细胞生长繁殖的培养基及制备方法与流程
本发明涉及生物技术领域,特别涉及利用海水促进雨生红球藻细胞生长繁殖的培养基及制备方法。
背景技术:
雨生红球藻(haematococcusplavialis)分类上属于绿藻门(chorophata)、绿藻纲(chorophyceae)、团藻目(volvocales)、红球藻科(haemmatococcaceae)、红球藻属(haematococcus,ag),雨生红球藻细胞的形状大多数呈现为广卵形,宽度约为19um-51um,长度约为28um-63um.雨生红球藻是单细胞藻类,用孢子或合子进行生殖内外细胞壁层的主要成分分别是是纤维素和果胶质,自由游动的雨生红球藻细胞大多含有2条鞭毛,含有多个不规则的散布在原生质体内的伸缩泡,由于游动的雨生红球嘉细胞内用于进行光合作用的色素成份含有叶绿素a、叶绿素b、叶黄素和类胡萝卜素,因此细胞呈绿色,雨生红球藻的细胞形态描述为四种,游动细胞(motilecell),指游动阶段除游动孢子以外的细胞形式,细胞呈卵形或椭圆形,动孢子(z0ospore),可以由游动细胞和不动孢子在适宜条件下经过无性繁殖产生。繁殖过程中,由细胞壁演化成的孢子素膨变大,从顶端逐步破裂释放出能自由游动的子细胞。这些从在母细胞内产生起到释放出孢子素为止的具有游动能力的子细胞称为游动孢子,静细胞(non-motilecelly)指不运动阶段除不动孢子以外的细胞形态,在名称上与游动阶段的游动细胞相呼应,静孢子(aplanospore),不动阶段细胞表面上不游动呈静止状态,但是细胞不一定处于静止的休眠状态,实际上,该阶段细胞仍能进行分裂增殖,在母细胞内产生没有鞭毛,发育至冲破细胞壁释放后也不能游动的子细胞。这种由不动细胞经过无性生殖方式产生,到从孢子囊内释放时期的子细胞称为不动孢子,环境适宜时,游动细胞以有丝分裂的方式进行无性繁殖,多数母细胞产生2-4个子细胞。无论母细胞内有2个或是4个子细胞,都能观察到鞭毛的存在并能够自由游动,属于游动孢子,释放出的子细胞游动孢子成为新的游动细胞,不懂细胞发育成孢子母细胞和孢子囊,最终孢子从鹏达的孢子囊壁中释放出来成为有鞭毛的游动孢子并残留下透明外壳,环境不适宜时,游动细胞或者刚释放的游动孢子退去鞭毛,直接转入不动细胞阶段。
就目前的雨生红球藻细胞的培养时,对培养环境如光照强度,光照颜色,营养元素等无法进行准确把控,进而对雨生红球藻细胞的繁殖生长造成抑制,不利于雨生红球藻细胞的繁殖,进而不利于下一工序对虾青素的积累和提取,同时采用干藻接种操作繁琐,不利于雨生红球藻细胞的快速繁殖,减低繁殖速率。
技术实现要素:
有鉴于此,本发明提供了利用海水促进雨生红球藻细胞生长繁殖的培养基制备工艺,解决了雨生红球藻细胞培养环境不适宜同时培养繁殖生产效率低下等问题。
为了实现上述发明目的,本发明提供以下技术方案:
本发明利用海水促进雨生红球藻细胞生长繁殖的培养基的制备方法,其特征在于,包括如下步骤:
步骤1、海水处理:取海水过滤、灭菌,制得处理后的海水;
步骤2:母液制备:取kno3、k2hpo4、edta-na2、vb1、vb12、feso4.7h2o、nahco3mnso4与水混合,杀菌;
步骤3:取培养基、步骤1制得的所述处理后的海水与步骤2制得的母液混合,制得混合培养基。
在本发明的一些具体实施方案中,步骤1中所述过滤采用膜过滤或活性炭过滤。
在本发明的一些具体实施方案中,步骤2中所述母液制备具体为:以100ml为例,称取kno3100mg,k2hpo410mg,edta-na210mg,vb16*10-3mg,vb125*10-5mg,feso4.7h2o2.5mg,nahco3100mg,和mnso40.25mg,用水定容至100ml。
基于上述,本发明还提供了所述的制备方法制得的培养基。
此外,本发明还提供了所述的培养基在利用海水促进雨生红球藻细胞生长繁殖中的应用。
本发明还提供了利用海水促进雨生红球藻细胞生长繁殖的方法,取保存的雨生红球藻藻种活化,湿藻接种于所述的培养基中,培养,检测。
在本发明的一些具体实施方案中,所述湿藻接种的接种量为15%。
在本发明的一些具体实施方案中,所述培养采取的培养方式为通气细胞悬浮培养,所述培养的条件为:光照强度1000~1500lx,光照周期为24h,光质为白光,光照方式为单侧光,培养温度为9~11℃,通空气,初始ph为7.0,培养时间为25d。
在本发明的一些具体实施方案中,所述检测采用卢戈式固定液处理,在560nm波长下测定吸光度值;所述检测还包括采用ph试纸测定ph值;取1ml雨生红球藻的培养液加1*10-3ml卢戈式固定液,静置1min后采用血球计数板和10*40倍镜的显微镜对藻细胞密度进行血球板计数。
本发明提供了一种利用海水促进雨生红球藻细胞生长繁殖的培养基制备工艺。包括但不限于以下有益效果:
1、本发明通过采用湿地接种的方法对雨生红球藻细胞进行接种培养,采用含有旧液的雨生红球藻藻种直接种于新鲜的培养基中,使在接种时更加方便快捷,使在短时间内可对更多的雨生红球藻细胞进行接种,提高接种效率且更易于实验室操作。
2、本发明通过采用海水的加入培养基进行氮饥饿处理,以及对雨生红球藻细胞进行光照,温度,湿度等培养环境的控制,同时在培养时对培养基内的雨生红球藻细胞的形态和密度进行检测为雨水红球藻细胞的繁殖和生长提供更优良的环境,使雨水红球藻细胞更易于大量生长和繁殖,进而提高雨水红球藻细胞的繁殖效率。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
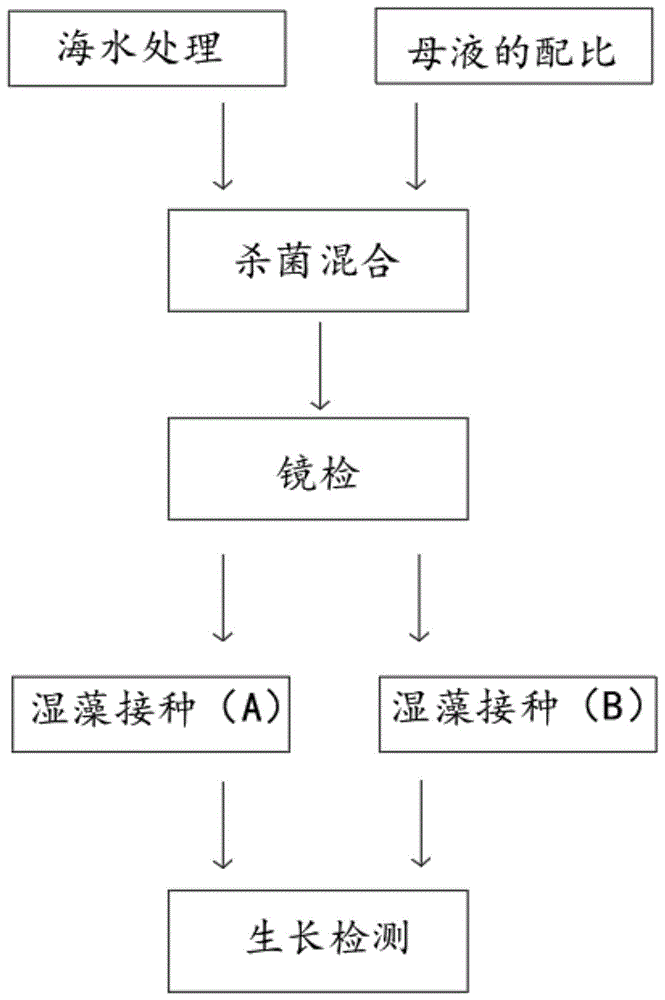
图1示本发明的工艺流程图。
具体实施方式
本发明公开了利用海水促进雨生红球藻细胞生长繁殖的培养基及制备方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明通过以下技术方案予以实现:一种利用海水促进雨生红球藻细胞生长繁殖的培养基制备工艺,包括如下步骤:
所述雨生红球藻细胞在培养基中加入海水和营养母液,采用湿藻接种的方法对雨生红球藻细胞培养并对其生长和繁殖进行观察;
海水处理,所述海水处理用烧杯取200ml海水通过薄膜和活性炭进行过滤,将过滤后的海水置于立式压力蒸汽灭菌器内进行高压灭菌,条件为121℃,30min,取2*1700ml的自来水装入锥形瓶中进行灭菌处理;
母液的配比,所述母液的配比用fa1004型电子天平分别称取固体kno3100mg,k2hpo410mg,edta-na210mg,vb16*10-3mg,vb125*10-5mg,feso4.7h2o2.5mg,nahco3100mg,和mnso40.25mg分别置于小烧杯中完全溶解并冷却到室温后,用容量瓶定容至100ml,将容量瓶中的各组分试剂分装到200ml的锥形瓶中,且用二到三层报纸包扎封口;
杀菌混合,所述杀菌混合将母液的各个组分试剂的锥形瓶置于立式压力蒸汽灭菌器中进行高压蒸汽灭菌,条件为121℃,30min,将杀菌后的母液各个组分与海水以1:3的比例混合,得到母液,将母液与自来水以1:1000的配比通过移液枪枪头取液体至培养基中密封;
镜检,所述镜检时将提前冷藏保存的雨生红球藻藻种取出,放置于室温下静置活化;
湿藻接种(a),所述湿藻接种采用含有旧液的雨生红球藻藻种直接种于新鲜的培养基中,所述湿地接种反应容器为2000ml的锥形瓶,且每瓶培养基的体积为1700ml;
湿藻接种(b),所述湿藻接种量为移入藻种液的体积和原培养基体积的比例,所述湿藻接种接种量为15%,即向新鲜培养基中直接倒入250ml绿色游动藻种;
培养条件,所述培养条件采用led光照箱提供1000-1500lx的光照强度,在gxz-430a光照培养箱光照周期为24h,光质为白光,培养温度为10±1℃,通空气,初始ph为7.0,培养时间为25天;
生长检测,所述生长检测采用显微镜对不定期从培养物中取出的藻悬液进行细胞形态观察,所述生长检测采用卢戈式固定液处理后利于显微镜直接计数法-血球板计数法对培养细胞的细胞密度进行测定,所述生长检测采用722型光栅分光光度计在560nm波长下测定培养液的吸光度值,所述生长检测采用ph试纸对培养物的ph值每天进行测定。
优选的,所述杀菌混合进行立式压力蒸汽灭菌器在进行高压灭菌时vb1和nahco3需要在培养基前放置超净工作台中紫外灭菌20min。
优选的,所述镜检和湿地接种均采用超净工作台中无菌进行。
优选的,所述培养条件采取的培养方式为通气细胞悬浮培养,所述培养条件的光照方式为单侧光,且培养过程中采用jd-3型lxmeter光强计测量锥形瓶外面向光面和背光面的光照强度并计算光照平均值进行光照检测。
优选的,所述生长检测卢戈式固定液配制方法为用fa1004型电子天平城区10gki溶于10-20ml水中,放置于总的试剂瓶在保存,取1ml藻细胞悬液加1*10-3ml卢戈式固定液,静置1min后采用25*16型血球计数板和10*40倍镜的显微镜对培养物的藻细胞密度进行血球板计数。
优选的,所述生长检测在对培养物吸取光值测定前需要将培养物充分摇匀,且测定需要重复测定1-2次。
利用海水促进雨生红球藻细胞生长繁殖的培养基及制备方法
下面结合实施例,进一步阐述本发明:
实施例1
如图1所示,一种利用海水促进雨生红球藻细胞生长繁殖的培养基制备工艺,包括如下步骤:
所述雨生红球藻细胞在培养基中加入海水和营养母液,采用湿藻接种的方法对雨生红球藻细胞培养并对其生长和繁殖进行观察,海水中存在大量盐类物质,在盐胁迫条件下,可在雨生红球藻细胞培养时对虾青素进行高效积累;
海水处理,所述海水处理用烧杯取200ml海水通过薄膜和活性炭进行过滤,将过滤后的海水置于立式压力蒸汽灭菌器内进行高压灭菌,条件为121℃,30min,取2*1700ml的自来水装入锥形瓶中进行灭菌处理;
母液的配比,所述母液的配比用fa1004型电子天平分别称取固体kno3100mg,k2hpo410mg,edta-na210mg,vb16*10-3mg,vb125*10-5mg,feso4.7h2o2.5mg,nahco3100mg,和mnso40.25mg分别置于小烧杯中完全溶解并冷却到室温后,用容量瓶定容至100ml,将容量瓶中的各组分试剂分装到200ml的锥形瓶中,且用二到三层报纸包扎封口;
杀菌混合,所述杀菌混合将母液的各个组分试剂的锥形瓶置于立式压力蒸汽灭菌器中进行高压蒸汽灭菌,条件为121℃,30min,将杀菌后的母液各个组分与海水以1:3的比例混合,得到母液,将母液与自来水以1:1000的配比通过移液枪枪头取液体至培养基中密封;
镜检,所述镜检时将提前冷藏保存的雨生红球藻藻种取出,放置于室温下静置活化,确定藻细胞处于绿色游动时期,该时期的藻细胞活动性强,生长旺盛,接种到新鲜培养基后能较快的适应新环境,利于藻细胞的存活,
湿藻接种(a),所述湿藻接种采用含有旧液的雨生红球藻藻种直接种于新鲜的培养基中,所述湿地接种反应容器为2000ml的锥形瓶,且每瓶培养基的体积为1700ml;
湿藻接种(b),所述湿藻接种量为移入藻种液的体积和原培养基体积的比例,所述湿藻接种接种量为15%,即向新鲜培养基中直接倒入250ml绿色游动藻种;
培养条件,所述培养条件采用led光照箱提供1000-1500lx的光照强度,在gxz-430a光照培养箱光照周期为24h,光质为白光,培养温度为10±1℃,通空气,初始ph为7.0,培养时间为25天,接种后进行雨生红球藻细胞的扩大化培养,培养第一天不通气,不提供额外的光照,给雨生红球藻细胞一定的时间以适应生长环境,培养第二天向锥形瓶中通入空气,通气前用高压蒸汽灭菌过的移液枪枪头在锥形瓶的封口报纸上扎一个大小合适的孔洞,使通气用的橡胶管刚好通过空桶插入锥形瓶中,各项装置组装完毕后可以接通吹气泵的电源进行通气,此时需要控制空气的通入量,以锥形瓶中的空气气泡每秒冒出一到两个为宜,培养三到四天后可以加入大空气的通入量,一锥形瓶中的空气气泡呈连续状且瓶中的藻悬液液体呈翻滚状态为宜,此时若通气量过小,锥形瓶中的雨生红球藻容易聚集成团,沉降到瓶的底部,导致光照强度不均匀,影响雨水红球藻的生长,而且成团的藻细胞不容易被散开,不利于藻细胞的计数和od值的测量,如果通气量过大,藻悬液容易被吹溅到锥形瓶瓶口,造成培养液的污染。
生长检测,所述生长检测采用显微镜对不定期从培养物中取出的藻悬液进行细胞形态观察,所述生长检测采用卢戈式固定液处理后利于显微镜直接计数法-血球板计数法对培养细胞的细胞密度进行测定,所述生长检测采用722型光栅分光光度计在560nm波长下测定培养液的吸光度值,所述生长检测采用ph试纸对培养物的ph值每天进行测定。
所述杀菌混合进行立式压力蒸汽灭菌器在进行高压灭菌时vb1和nahco3需要在培养基前放置超净工作台中紫外灭菌20min,由于vb1和nahco3高温条件下易分解,不能进行高温灭菌,进而需要在在外灭菌处理,培养基分组灭菌时可将后期所需要的灭菌的实验材料一并灭菌,便于后期实验使用,灭菌后的培养基组分母液可在多次使用,所述镜检和湿地接种均采用超净工作台中无菌进行,防止杂藻和杂菌的污染,所述培养条件采取的培养方式为通气细胞悬浮培养,所述培养条件的光照方式为单侧光,且培养过程中采用jd-3型lxmeter光强计测量锥形瓶外面向光面和背光面的光照强度并计算光照平均值进行光照检测,随着培养的进行,锥形瓶中的藻细胞数量会不断增多,藻细胞密度会不断增大,锥形瓶内的实际光照强度会不断小于预设光照强度,由于单侧光的使用,使锥形瓶不同位置的光照强度茶杯过大,因此在培养过程中要及时测量锥形瓶外部的光照强度并以此估算锥形瓶内部的光照强度,通过靠近或远离led灯开增大或减小光照强度,所述生长检测卢戈式固定液配制方法为用fa1004型电子天平城区10gki溶于10-20ml水中,放置于总的试剂瓶在保存,取1ml藻细胞悬液加1*10-3ml卢戈式固定液,静置1min后采用25*16型血球计数板和10*40倍镜的显微镜对培养物的藻细胞密度进行血球板计数,所述生长检测在对培养物吸取光值测定前需要将培养物充分摇匀,且测定需要重复测定1-2次,减少系统误差。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!