含二苯乙烯或二苯甲酮骨架的CA-4衍生物、药物组合物及其制备方法和应用与流程
含二苯乙烯或二苯甲酮骨架的ca-4衍生物、药物组合物及其制备方法和应用
技术领域
1.本发明涉及药物化学技术领域,是一类含二苯乙烯或二苯甲酮基本骨架的ca-4衍生物、药物组合物及其制备方法和在抗肿瘤中的应用。
背景技术:
2.ca-4是从南非灌木柳树中分离得到的顺式二苯乙烯结构的微管蛋白抑制剂,作用于秋水仙碱结合位点,具有非常好的肿瘤细胞毒性,不仅如此,它还具有极强的抗血管生成活性,能够破坏肿瘤组织周围的血管生成,共同发挥抗肿瘤作用。随着肿瘤发生发展的机制逐渐被深入研究,研究者们以ca-4为母体结构,开始进行各个部位的结构修饰和改造。
[0003][0004]
构效关系研究表明,ca-4结构中二苯乙烯的顺式结构和3,4,5-三甲氧基苯基是抗肿瘤活性的必要条件。虽然,ca-4能够识别肿瘤组织和正常组织内皮细胞的差异,选择性抑制肿瘤细胞微管蛋白的聚合,抑制肿瘤血管增生,从而作为一种强效的微管聚合抑制剂发挥抗肿瘤作用。由于ca-4极不稳定,顺式结构见光易异构成活性很低的反式构型,且ca-4的水溶性极差,限制了其临床应用。
技术实现要素:
[0005]
为改善上述技术问题,本发明提供了一种式iii所示的化合物,其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物或它们药学上可接受的盐:
[0006][0007]
其中,所述x选自c(o)、无取代或任选被一个或两个ra取代的乙烯基;y选自无取代或任选被一个、两个或更多个rb取代的亚c
1-3
烷基、亚c
2-3
烯基、-o-r-;r选自无取代或任选被一个、两个或更多个rc取代的亚c
1-2
烷基、亚乙烯基、亚c
6-14
芳基、亚5-14元杂芳基;r1选自oh、无取代或任选被一个、两个或更多个rd取代的芳基、杂芳基;r1选自oh、无取代或任选被一个、两个或更多个rd取代的芳基、杂芳基;
[0008]
每个ra、rb、rc、rd相同或不同,彼此独立地选自h、oh、nh2、卤素、无取代或任选被一个、两个或更多个ra1取代的烷基、烷氧基、环烷基、杂烷基、芳基、杂芳基;
[0009]
每个ra1相同或不同,彼此独立地选自h、oh、nh2、卤素、烷基、烷氧基、环烷基、杂烷基、芳基、杂芳基。
[0010]
根据本发明的实施方案,所述x可以选自c(o)、无取代或任选被一个或两个ra取代的乙烯基;y可以选自无取代或任选被一个、两个或更多个rb取代的亚c
1-2
烷基、亚乙烯基、-o-r-;r可以选自无取代或任选被一个、两个或更多个rc取代的亚c
1-2
烷基、亚乙烯基、亚c
6-14
芳基、亚5-14元杂芳基;r1可以选自oh、无取代或任选被一个、两个或更多个rd取代的c
6-14
芳基、5-14元杂芳基;
[0011]
每个ra、rb、rc、rd可以相同或不同,彼此独立地选自h、oh、nh2、卤素、无取代或任选被一个、两个或更多个ra1取代的c
1-12
烷基、c
1-12
烷氧基、3-12元环烷基、3-12元杂烷基、c
6-14
芳基、5-14元杂芳基;
[0012]
每个ra1可以相同或不同,彼此独立地选自h、oh、nh2、卤素、c
1-12
烷基、c
1-12
烷氧基、3-12元环烷基、3-12元杂烷基、c
6-14
芳基、5-14元杂芳基。
[0013]
根据本发明的实施方案,所述x可以选自c(o)、无取代或任选被一个或两个ra取代的顺式乙烯基;y可以选自无取代或任选被一个、两个或更多个rb取代的亚c
1-2
烷基、亚乙烯基、-o-r-;r可以选自无取代或任选被一个、两个或更多个rc取代的亚c
1-2
烷基、亚乙烯基、亚c
6-10
芳基、亚5-10元杂芳基;r1可以选自oh、无取代或任选被一个、两个或更多个rd取代的c
6-10
芳基、5-10元杂芳基;
[0014]
每个ra、rb、rc、rd可以相同或不同,彼此独立地选自h、oh、nh2、卤素、c
1-8
烷基、c
1-8
烷氧基、3-8元环烷基、3-10元杂烷基、c
6-10
芳基、5-10元杂芳基。
[0015]
根据本发明的实施方案,所述x可以选自c(o)、无取代或任选被一个或两个ra取代的顺式乙烯基;y可以选自无取代或任选被一个、两个或更多个rb取代的亚c
1-2
烷基、亚乙烯基、-o-r-;r可以选自无取代或任选被一个、两个或更多个rc取代的亚c
1-2
烷基、亚乙烯基、亚c
6-10
芳基、亚5-10元杂芳基;r1选自oh、无取代或任选被一个、两个或更多个rd取代的c
6-10
芳基、5-10元杂芳基;
[0016]
每个ra可以相同或不同,彼此独立地选自c
1-8
烷基、c
1-8
烷氧基、3-8元环烷基、c
6-10
芳基、5-10元杂芳基。
[0017]
每个rb可以相同或不同,彼此独立地选自卤素、c
1-8
烷基、c
1-8
烷氧基;
[0018]
每个rc可以相同或不同,彼此独立地选自卤素、c
1-8
烷基、c
1-8
烷氧基;
[0019]
每个rd可以相同或不同,彼此独立地选自oh、nh2、卤素、c
1-8
烷基、c
1-8
烷氧基。
[0020]
根据本发明的实施方案,所述x可以选自c(o)或顺式乙烯基;y选自亚乙烯基、-o-r-;r选自亚c
1-2
烷基、亚c
6-10
芳基、亚5-10元杂芳基、亚c
6-10
芳基-c
1-2
烷基;r1选自oh、c
6-10
芳基、氨基-c
6-10
芳基。
[0021]
根据本发明的实施方案,所述x选自c(o)或顺式乙烯基;y选自亚乙烯基、亚甲氧基、亚丙氧基、亚丁氧基、亚苄基氧基、亚吡啶基氧基;r1选自oh、邻氨基苯基。
[0022]
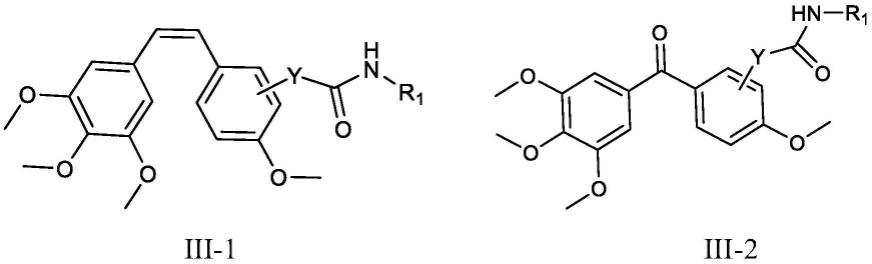
根据本发明的实施方案,式iii化合物具有式iii-1或式iii-2所示的结构:
[0023][0024]
其中,y和r1独立地具有上文所述的定义。
[0025]
根据本发明示例性的实施方案,式iii化合物选自如下结构:
[0026][0027]
本发明还提供式iii所示化合物的制备方法,包括以下步骤:
[0028][0029]
其中,x、y、r和r1独立地具有上文所述的定义;a选自羟基、卤素;x’选自卤素,x
’‑
r-可以选自卤代c
1-2
烷基、卤代芳基、卤代芳基c
1-2
烷基、或乙烯基,例如为溴甲基、溴乙基、乙烯基、4-溴苯基、4-溴甲基苯基、2-(4-溴苯基)异丙基、2-溴-5-吡啶基;r’选自c
1-6
烷基,例如为甲基、乙基或丙基;
[0030]
1)式i所述化合物与化合物a反应得到式ii所示化合物;
[0031]
2)式ii所述化合物与化合物b反应得到式iii所示化合物;
[0032]
根据本发明的实施方案,步骤1)中所述反应可以在碱作用下进行,所述碱可以为无机碱或有机碱,所述无机碱例如为氢氧化钠、氢氧化钾、碳酸钾、碳酸钠、碳酸铯、磷酸钾中的至少一种;所述有机碱例如为三乙胺、二异丙基乙胺、n,n-二甲氨基吡啶中的至少一种;
[0033]
根据本发明的实施方案,步骤1)中所述反应可以在有机溶剂存在下进行,所述有机溶剂可以例如为n,n-二甲基甲酰胺、甲醇、乙醇、二氧六环、四氢呋喃、二氯甲烷中的至少一种;
[0034]
根据本发明的实施方案,步骤1)中所述反应可以在催化剂作用下进行;当所述碱为无机碱时,所述催化剂例如为碘化钾、碘化钠或碘化亚铜;当所述碱为有机碱时,所述催化剂可以为钯催化剂,例如为pd(oac)2;优选地,所述催化剂为碘化亚铜时,反应体系中还可以加入有机配体,例如为2-吡啶甲酸;所述催化剂钯催化剂时,反应体系中还可以加入有机配体,例如为三(邻甲基苯基)磷(p(o-tol)3);
[0035]
根据本发明的实施方案,步骤1)中所述反应的温度为40-130℃例如为60-90℃;所述反应的时间可以为2-24h,例如为6-12h。
[0036]
根据本发明的实施方案,步骤2)中所述反应可以在碱作用下进行,所述碱可以为无机碱或有机碱,所述无机碱例如为氢氧化钠、氢氧化钾、碳酸钾、碳酸钠、碳酸铯、磷酸钾、磷酸钾中的至少一种;所述有机碱例如为三乙胺、二异丙基乙胺、n,n-二甲氨基吡啶中的至少一种;
[0037]
根据本发明的实施方案,步骤2)中所述反应可以为将式ii化合物、碱与化合物b同时加入反应体系中得到式iii所示化合物;或者式ii化合物在碱存在下水解后,再与化合物b反应得到式iii化合物;
[0038]
根据本发明的实施方案,步骤2)中所述反应可以在有机溶剂存在下进行,所述有机溶剂可以例如为n,n-二甲基甲酰胺、甲醇、乙醇、二氧六环、四氢呋喃、二氯甲烷中的至少一种。
[0039]
本发明还提供一种药物组合物,其包含治疗有效量的式iii所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物或它们药学上可接受的盐中的至少一种。
[0040]
根据本发明的实施方案,所述药物组合物还包括一种或多种药学上可接受的辅料。
[0041]
根据本发明的实施方案,所述药物组合物还可以进一步含有一种或多种额外的治疗剂。
[0042]
本发明还提供治疗肿瘤疾病的方法,包括给予患者预防或治疗有效量的式iii所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物或它们药学上可接受的盐中的至少一种。
[0043]
本发明还提供治疗肿瘤疾病的方法,包括给予患者预防或治疗有效量的上述药物组合物。
[0044]
所述肿瘤可以为白血病细胞、乳腺癌细胞、肝癌细胞、肺癌细胞、胃癌细胞和宫颈
癌细胞;优选为u937白血病细胞、mcf7乳腺癌细胞、hepg2肝癌细胞、a549肺癌细胞、mgc-803胃癌细胞和hela宫颈癌细胞。
[0045]
在一些实施方案中,所述患者哺乳动物,优选是人。
[0046]
本发明还提供式iii所示的化合物、其消旋体、立体异构体、互变异构体、同位素标记物、溶剂化物、多晶型物或它们药学上可接受的盐中的至少一种在制备药物中的用途。
[0047]
根据本发明的实施方案,所述药物为抗肿瘤药物,如微管蛋白抑制剂药物。
[0048]
根据本发明的实施方案,所述肿瘤可以为白血病细胞、乳腺癌细胞、肝癌细胞、肺癌细胞、胃癌细胞和宫颈癌细胞;优选为u937白血病细胞、mcf7乳腺癌细胞、hepg2肝癌细胞、a549肺癌细胞、mgc-803胃癌细胞和hela宫颈癌细胞。
[0049]
有益效果
[0050]
本发明提供了一种含二苯乙烯或二苯甲酮骨架的ca-4衍生物及其制备方法和在抗肿瘤中的应用。本发明的化合物对包括但不限于对u937(人白血病细胞)、mcf7(人乳腺癌细胞)、hepg2(人肝癌细胞)、a549(人肺癌细胞)、mgc-803(人胃癌细胞)和hela(人宫颈癌细胞)在内的多种肿瘤有明显的抑制作用,特别是化合物iiie在各个癌细胞系上的ic
50
值均小于0.5μm,在mgc-803上的ic
50
值仅为16nm,可作为进一步开发的候选或者先导化合物,应用于制备抗肿瘤药物。
[0051]
本发明的制备方法有效整合了二苯乙烯骨架、二苯甲酮骨架、异羟肟酸和邻氨基苯基等基团,实验可重复性强,稳定性好,实验反应所需条件较简单,且实验环境温和,产率较好,可在较小投入情况下进行大量生产。
[0052]
术语定义与说明
[0053]
除非另有说明,本技术说明书和权利要求书中记载的基团和术语定义,包括其作为实例的定义、示例性的定义、优选的定义、表格中记载的定义、实施例中具体化合物的定义等,可以彼此之间任意组合和结合。这样的组合和结合后的基团定义及化合物结构,应当被理解为本技术说明书和/或权利要求书记载的范围内。
[0054]
除非另有说明,本说明书和权利要求书记载的数值范围相当于至少记载了其中每一个具体的整数数值。例如,数值范围“1-40”相当于记载了数值范围“1-12”中的每一个整数数值即1、2、3、4、5、6、7、8、9、10、11、12,以及数值范围“13-40”中的每一个整数数值即13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40。此外,当某些数值范围被定义为“数”时,应当理解为记载了该范围的两个端点、该范围内的每一个整数以及该范围内的每一个小数。例如,“0~10的数”应当理解为不仅记载了0、1、2、3、4、5、6、7、8、9和10的每一个整数,还至少记载了其中每一个整数分别与0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9的和。
[0055]
应当理解,本文在描述一个、两个或更多个中,“更多个”应当是指大于2,例如大于等于3的整数,例如3、4、5、6、7、8、9或10。
[0056]
术语“卤素”表示氟、氯、溴和碘。
[0057]
术语“烷基”应理解为表示具有1~40个碳原子,例如1-20个碳原子的直链或支链饱和烃基。“c
1-12
烷基”应理解为表示具有1~12个碳原子的直链或支链饱和一价烃基。例如,“c
1-10
烷基”表示具有1、2、3、4、5、6、7、8、9或10个碳原子的直链和支链烷基,“c
1-8
烷基”表示具有1、2、3、4、5、6、7、或8个碳原子的直链和支链烷基,“c
1-6
烷基”表示具有1、2、3、4、5
或6个碳原子的直链和支链烷基。所述烷基是例如甲基、乙基、丙基、丁基、戊基、己基、异丙基、异丁基、仲丁基、叔丁基、异戊基、2-甲基丁基、1-甲基丁基、1-乙基丙基、1,2-二甲基丙基、新戊基、1,1-二甲基丙基、4-甲基戊基、3-甲基戊基、2-甲基戊基、1-甲基戊基、2-乙基丁基、1-乙基丁基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、2,3-二甲基丁基、1,3-二甲基丁基或1,2-二甲基丁基等或它们的异构体。
[0058]
术语“烯基”应理解为表示直连或支链的烃基,其包含一个或多个双键(例如1-5个双键)并且具有2~40个碳原子(例如2-20个碳原子),优选“c
2-12
烯基”。“c
2-12
烯基”应理解为表示直连或支链的一价烃基,其包含一个或多个双键并且具有2~12个碳原子,优选“c
2-10
烯基”。“c
2-10
烯基”应理解为优选表示直连或支链的一价烃基,其包含一个或多个双键并且具有2、3、4、5、6、7、8、9或10个碳原子,更优选“c
2-8
烯基”。“c
2-10
烯基”应理解为优选表示直连或支链的一价烃基,其包含一个或多个双键并且具有2、3、4、5、6、7或8个碳原子,例如,具有2、3、4、5或6个碳原子(即,c
2-6
烯基),具有2或3个碳原子(即,c
2-3
烯基)。应理解,在所述烯基包含多于一个双键的情况下,所述双键可相互分离或者共轭。所述烯基是例如乙烯基、烯丙基、(e)-2-甲基乙烯基、(z)-2-甲基乙烯基、(e)-丁-2-烯基、(z)-丁-2-烯基、(e)-丁-1-烯基、(z)-丁-1-烯基、戊-4-烯基、(e)-戊-3-烯基、(z)-戊-3-烯基、(e)-戊-2-烯基、(z)-戊-2-烯基、(e)-戊-1-烯基、(z)-戊-1-烯基、己-5-烯基、(e)-己-4-烯基、(z)-己-4-烯基、(e)-己-3-烯基、(z)-己-3-烯基、(e)-己-2-烯基、(z)-己-2-烯基、(e)-己-1-烯基、(z)-己-1-烯基、异丙烯基、2-甲基丙-2-烯基、1-甲基丙-2-烯基、2-甲基丙-1-烯基、(e)-1-甲基丙-1-烯基、(z)-1-甲基丙-1-烯基、3-甲基丁-3-烯基、2-甲基丁-3-烯基、1-甲基丁-3-烯基、3-甲基丁-2-烯基、(e)-2-甲基丁-2-烯基、(z)-2-甲基丁-2-烯基、(e)-1-甲基丁-2-烯基、(z)-1-甲基丁-2-烯基、(e)-3-甲基丁-1-烯基、(z)-3-甲基丁-1-烯基、(e)-2-甲基丁-1-烯基、(z)-2-甲基丁-1-烯基、(e)-1-甲基丁-1-烯基、(z)-1-甲基丁-1-烯基、1,1-二甲基丙-2-烯基、1-乙基丙-1-烯基、1-丙基乙烯基、1-异丙基乙烯基。
[0059]
术语“环烷基”应理解为表示饱和的单环、二环(如稠环、桥环、螺环)烃环或三环烷烃,其具有3~20个碳原子,优选“c
3-12
环烷基”,更优选优选“c
3-8
环烷基”。“c
3-12
环烷基”应理解为表示饱和的一价单环、二环(如稠环、桥环、螺环)烃环或三环烷烃,其具有3~12个碳原子,优选“c
3-10
环烷基”,更优选优选“c
3-8
环烷基”。术语“c
3-10
环烷基”应理解为表示饱和的一价单环、双环(如桥环、螺环)烃环或三环烷烃,其具有3、4、5、6、7、8、9或10个碳原子。所述c
3-10
环烷基可以是单环烃基,如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基或环癸基,或者是双环烃基如龙脑基、吲哚基、六氢吲哚基、四氢萘基、十氢萘基、二环[2.1.1]己基、二环[2.2.1]庚基、二环[2.2.1]庚烯基、6,6-二甲基二环[3.1.1]庚基、2,6,6-三甲基二环[3.1.1]庚基、二环[2.2.2]辛基、2,7-二氮杂螺[3,5]壬烷基、2,6-二氮杂螺[3,4]辛烷基,或者是三环烃基如金刚烷基。
[0060]
除非另有定义,术语“杂环基”是指饱和或不饱和的非芳族的环或环系,其包含一个或多个独立选自n、o和s的杂原子且总成环原子数为3-20(如原子数为3、4、5、6、7、8、9、10等)。“3-12元杂环基”是指饱和的或不饱和的非芳族的环或环系,例如,其是4-、5-、6-或7-元的单环、7-、8-、9-、10-、11-或12-元的二环(如稠环、桥环、螺环)或者三环环系,并且含有至少一个,例如1、2、3、4、5个或更多个选自o、s和n的杂原子,其中n和s还可以任选被氧化成各种氧化状态,以形成氮氧化物、-s(o)-或-s(o)
2-的状态。优选地,所述杂环基可以选自“3-10元杂环基”。术语“3-10元杂环基”意指饱和的或不饱和的非芳族的环或环系,并且含有至少一个选自o、s和n的杂原子。所述杂环基可以通过所述碳原子中的任一个或氮原子(如果存在的话)与分子的其余部分连接。所述杂环基可以包括稠合的或桥连的环以及螺环的环。特别地,所述杂环基可以包括但不限于:4元环,如氮杂环丁烷基、氧杂环丁烷基;5元环,如四氢呋喃基、二氧杂环戊烯基、吡咯烷基、咪唑烷基、吡唑烷基、吡咯啉基;或6元环,如四氢吡喃基、哌啶基、吗啉基、二噻烷基、硫代吗啉基、哌嗪基或三噻烷基;或7元环,如二氮杂环庚烷基。任选地,所述杂环基可以是苯并稠合的。所述杂环基可以是双环的,例如但不限于5,5元环,如六氢环戊并[c]吡咯-2(1h)-基环,或者5,6元双环,如六氢吡咯并[1,2-a]吡嗪-2(1h)-基环。杂环基可以是部分不饱和的,即它可以包含一个或多个双键,例如但不限于二氢呋喃基、二氢吡喃基、2,5-二氢-1h-吡咯基、4h-[1,3,4]噻二嗪基、1,2,3,5-四氢噁唑基或4h-[1,4]噻嗪基,或者,它可以是苯并稠合的,例如但不限于二氢异喹啉基。所述3-12元杂环基与其它基团相连构成本发明的化合物时,可以为3-12元杂环基上的碳原子与其它基团相连,也可以为3-12元杂环基环上杂环原子与其它基团相连。例如当3-12元杂环基选自哌嗪基时,可以为哌嗪基上的氮原子与其它基团相连。或当3-12元杂环基选自哌啶基时,可以为哌啶基环上的氮原子和其对位上的碳原子与其它基团相连。
[0061]
术语“芳基”应理解为优选表示具有6-20个碳原子(例如6、7、8、9、10、11、12、13、14、15、16、17、18、19、20个碳原子)的芳香性或部分芳香性的单环、双环或三环烃环。“c
6-14
芳基”应理解为优选表示具有6、7、8、9、10、11、12、13或14个碳原子的一价芳香性或部分芳香性的单环、双环或三环烃环(“c
6-14
芳基”),特别是具有6个碳原子的环(“c6芳基”),例如苯基;或联苯基,或者是具有9个碳原子的环(“c9芳基”),例如茚满基或茚基,或者是具有10个碳原子的环(“c
10
芳基”),例如四氢化萘基、二氢萘基或萘基,或者是具有13个碳原子的环(“c
13
芳基”),例如芴基,或者是具有14个碳原子的环(“c
14
芳基”),例如蒽基。当所述c
6-14
芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为邻位、对位或间位取代。
[0062]
术语“杂芳基”应理解为包括这样的单环、二环(如稠环、桥环、螺环)或三环芳族环系:其具有5~20个环原子且包含一个或多个(例如1-5个)独立选自n、o和s的杂原子,例如“5-14元杂芳基”。“5-14元杂芳基”应理解为包括这样的一价单环、双环或三环芳族环系:其具有5、6、7、8、9、10、11、12、13或14个环原子,特别是5或6或9或10个碳原子,且其包含1-5个,优选1-3各独立选自n、o和s的杂原子并且,另外在每一种情况下可为苯并稠合的。“杂芳基”还指其中杂芳族环与一个或多个芳基、脂环族或杂环基环稠合的基团,其中所述连接的根基或点在杂芳族环上。当所述5-14元杂芳基与其它基团相连构成本发明的化合物时,可以为5-14元杂芳基环上的碳原子与其它基团相连,也可以为5-14元杂芳基环上的杂原子与其它基团相连。当所述5-14元杂芳基被取代时,其可以为单取代或者多取代。并且,对其取代位点没有限制,例如可以为杂芳基环上与碳原子相连的氢被取代,或者杂芳基环上与杂原子相连的氢被取代。
[0063]
术语“螺环”是指两个环共用1个成环原子的环系。
[0064]
术语“稠环”是指两个环共用2个成环原子的环系。
[0065]
术语“桥环”是指两个环共用3个以上成环原子的环系。
[0066]
除非另有说明,杂环基、杂芳基或亚杂芳基包括其所有可能的异构形式,例如其位
置异构体。因此,对于一些说明性的非限制性实例,可以包括在其1-、2-、3-、4-、5-、6-、7-、8-、9-、10-、11-、12-位等(如果存在)中的1、2个或更多个位置上取代或与其他基团键合的形式,包括吡啶-2-基、亚吡啶-2-基、吡啶-3-基、亚吡啶-3-基、吡啶-4-基和亚吡啶-4-基;噻吩基或亚噻吩基包括噻吩-2-基、亚噻吩-2-基、噻吩-3-基和亚噻吩-3-基;吡唑-1-基、吡唑-3-基、吡唑-4-基、吡唑-5-基。
[0067]
术语“亚*基”表示有两个键被取代的二价基团。
具体实施方式
[0068]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0069]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0070]
本发明实施例的制备步骤概括如下:
[0071]
步骤1:
[0072]
将上文所述的式i化合物溶于dmf中,室温下向体系中加入ki、k2co3,再加入另一原料,然后60℃反应8h,tlc监测反应完全,加40ml水稀释体系,用二氯甲烷(20ml
×
3)萃取。合并有机相,有机相用水洗三遍,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,硅胶柱层析分离纯化,得中间体ii。
[0073]
或将上文所述的式i化合物置于密封管中,加无水dmf搅拌溶解,随后加入et3n、p(o-tol)3和另一原料,置换ar,加入pd(oac)2,再置换ar。然后130℃加热8h,tlc监测反应完全。加30ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,水、饱和食盐水各洗两遍,无水硫酸镁干燥,过滤浓缩,硅胶柱层析分离纯化,得上文所述的式ii化合物。
[0074]
或将上文所述的式ⅰ化合物至于密封管中,加无水dmf搅拌溶解,随后加入k3po4,2-吡啶甲酸和另一原料,置换ar,加入cui,再置换ar。然后110℃加热10h,tlc监测反应完全。加30ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,水、饱和食盐水各洗两遍,无水硫酸镁干燥,过滤浓缩,硅胶柱层析分离纯化,得上文所述的式ⅱ化合物。
[0075]
步骤2:
[0076]
将上文所述的式ii化合物溶于甲醇中,0℃下加入羟胺溶液(10ml/mmol),然后于室温下搅拌6h,tlc监测反应完全,向体系中加1m的盐酸调节ph至酸性,旋蒸除掉甲醇,加20ml水稀释体系,用二氯甲烷(10ml
×
3)萃取,有机相用饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,硅胶柱层析分离纯化,得到上文所述的式iii所示化合物;
[0077]
或将上文所述的式ii化合物溶于thf/h2o(1:1)中,室温下加入koh,60℃加热8h,tlc监测反应完全,待体系冷却,向体系中加1m的盐酸调节ph至酸性,有白色固体析出,将固体过滤,用石油醚洗,干燥后无需进一步纯化,直接溶于dcm中,室温下加入dipea、edci
·
hcl、hobt,搅拌30min,然后加入邻苯二胺搅拌过夜,tlc监测反应完全,向体系中加1m的盐酸调节ph至中性。然后加20ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,硅胶柱层析(pet:ea=1:1)分离纯化,得到上文所述的式iii所示化合物。
[0078]
实施例1:
[0079]
(z)-n-羟基-2-(2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯氧基)乙酰胺(化合物iiia)的制备
[0080][0081]
步骤1:将(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯酚溶于10ml dmf中,室温下向体系中加入ki、k2co3,溴乙酸甲酯,然后60℃反应8h,tlc监测反应完全,加40ml水稀释体系,用二氯甲烷(20ml
×
3)萃取。合并有机相,有机相用水洗三遍,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=4:1)分离纯化,得无色油状物。
[0082]
步骤2:将该油状物溶于4ml meoh中,0℃下加入羟胺溶液(10ml/mmol),然后于室温下搅拌6h,tlc监测反应完全,向体系中加1m的盐酸调节ph至酸性,旋蒸除掉甲醇,加20ml水稀释体系,用二氯甲烷(10ml
×
3)萃取,有机相用饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=1:2)分离纯化,得到化合物iiia。
[0083]
得白色固体;收率48.8%。1h nmr(400mhz,cdcl3)δ9.63(s,1h),6.99(dd,j=8.4,1.5hz,1h),6.84(d,j=1.6hz,1h),6.81(d,j=8.4hz,1h),6.51
–
6.43(m,4h),4.48(s,2h),3.88(s,3h),3.86(s,3h),3.71(s,6h).
13
c nmr(101mhz,cdcl3)δ166.11,153.02,148.85,146.63,132.58,130.44,129.64,128.82,124.39,116.85,111.73,106.02,69.04,60.96,56.02,55.94.
[0084]
实施例2:
[0085]
(e)-n-羟基-3-(2-甲氧基-5-((z)-3,4,5-三甲氧基苯乙烯基)苯基)丙烯酰胺(化合物iiib)的制备
[0086][0087]
步骤1:称取(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)溴苯(121mg,0.32mmol)置于密封管中,加4ml无水dmf搅拌溶解,随后加入et3n(432ul,6e.q.)、p(o-tol)3(68mg,0.4e.q.)和丙烯酸甲酯(377ul,8e.q.)置换ar,加入pd(oac)2(24mg,0.2e.q.),再置换ar。然后130℃加热8h,tlc监测反应完全。加30ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=8:1)分离纯化,得到中间体。
[0088]
步骤2:将步骤1的中间体溶于4ml meoh中,0℃下加入羟胺溶液(10ml/mmol),然后于室温下搅拌6h,tlc监测反应完全,向体系中加1m的盐酸调节ph至酸性,旋蒸除掉甲醇,加20ml水稀释体系,用二氯甲烷(10ml
×
3)萃取,有机相用饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=1:2)分离纯化,得到化合物iiib。得黄色固体;收率36.5%
。1h nmr(400mhz,dmso-d6)δ12.32(s,1h),7.77(d,j=16.1hz,1h),7.59(d,j=2.1hz,1h),7.36
–
7.31(m,1h),7.04(d,j=8.7hz,1h),6.58(s,2h),6.54(d,j=11.4hz,1h),6.52(d,j=11.4hz,1h),6.26(d,j=16.1hz,1h),3.85(s,3h),3.66(s,3h),3.61(s,6h).
[0089]
实施例3:
[0090]
n-羟基-2-(2-甲氧基-5-(3,4,5-三甲氧基苯甲酰基)苯氧基)乙酰胺(化合物iiic)的制备
[0091][0092]
制备方法参考实施例1,区别在于将化合物(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯酚替换为化合物2-甲氧基-5-(3,4,5-三甲氧基苯甲酰基)苯酚。得白色固体;收率45.7%。1h nmr(400mhz,dmso-d6)δ11.18(d,j=41.0hz,1h),10.72(d,j=5.9hz,1h),8.95(d,j=6.0hz,1h),7.08
–
6.74(m,2h),6.67(s,1h),6.51(s,1h),4.40(d,j=11.1hz,2h),3.81(d,j=19.9hz,3h),3.71(dd,j=13.8,6.7hz,9h).
[0093]
实施例4:
[0094]
(z)-n-(2-氨基苯基)-4-((2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯氧基)甲基)苯甲酰胺(化合物iiid)的制备
[0095][0096]
步骤1:将(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯酚溶于10ml dmf中,室温下向体系中加入ki、k2co3,4-(溴甲基)苯甲酸甲酯,然后60℃反应8h,tlc监测反应完全,加40ml水稀释体系,用二氯甲烷(20ml
×
3)萃取。合并有机相,有机相用水洗三遍,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=4:1)分离纯化,得到中间体。
[0097]
步骤2:将得到的中间体直接溶于4ml thf/h2o(1:1)中,室温下加入koh,60℃加热8h,tlc监测反应完全,待体系冷却,向体系中加1m的盐酸调节ph至酸性,有白色固体析出,将固体过滤,用石油醚洗,干燥后溶于4ml dcm中,室温下加入dipea、edci
·
hcl、hobt,搅拌30min,然后加入邻苯二胺搅拌过夜,tlc监测反应完全,向体系中加1m的盐酸调节ph至中性。然后加20ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=1:1)分离纯化,得到化合物iiid。
[0098]
得白色固体;收率57.3%。1h nmr(400mhz,cdcl3)δ8.67(s,1h),7.78(d,j=8.2hz,2h),7.36(d,j=7.6hz,1h),7.21(d,j=8.2hz,2h),7.09(t,j=7.0hz,1h),6.88
–
6.80(m,4h),6.75(s,1h),6.48(d,j=12.0hz,1h),6.38(d,j=12.0hz,1h),6.34(s,2h),5.07(s,2h),3.91(s,3h),3.77(s,3h),3.56(s,6h).
13
c nmr(101mhz,cdcl3)δ152.72,147.50,
140.88,136.36,133.09,129.95,129.74,128.78,127.68,127.13,126.14,125.68,122.78,119.14,117.88,113.87,111.47,105.61,70.13,61.11,56.02,55.69,14.21.
[0099]
实施例5:
[0100]
(e)-n-(2-氨基苯基)-3-(2-甲氧基-5-((z)-3,4,5-三甲氧基苯乙烯基)苯基)丙烯酰胺(化合物iiie)的制备
[0101][0102]
制备方法参考实施例2步骤1和实施例4步骤2。得黄色固体;收率47.2%。1h nmr(400mhz,cdcl3)δ8.14(s,1h),7.85(d,j=15.3hz,1h),7.25(s,2h),7.15(d,j=8.4hz,1h),7.00
–
6.74(m,3h),6.69(d,j=8.6hz,1h),6.43(d,j=15.0hz,4h),6.32(d,j=15.5hz,1h),5.00(s,2h),3.77(s,3h),3.76(s,3h),3.63(s,6h).
13
c nmr(101mhz,cdcl3)δ152.29,128.23,128.07,124.18,120.06,109.68,104.85,59.96,55.01,54.52.
[0103]
实施例6:
[0104]
(e)-n-(2-氨基苯基)-3-(2-甲氧基-5-(3,4,5-三甲氧基苯甲酰基)苯基)丙烯酰胺(化合物iiif)的制备
[0105][0106]
制备方法参考实施例2步骤1和实施例4步骤2,区别在于将实施例2步骤1中化合物(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)溴苯替换为2-甲氧基-5-(3,4,5-三甲氧基苯甲酰基)溴苯。得黄色固体;收率36.4%。1h nmr(400mhz,cdcl3)δ7.81(d,j=15.6hz,1h),7.67(s,1h),7.44(d,j=8.5hz,1h),7.25
–
7.15(m,2h),7.03(d,j=9.4hz,3h),6.93(d,j=9.8hz,1h),6.76(t,j=7.9hz,2h),6.52(d,j=15.6hz,1h),3.93(s,3h),3.90(s,3h),3.84(s,6h).
[0107]
实施例7:
[0108]
(z)-n-羟基-4-((2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯氧基)甲基)苯甲酰胺(化合物iiig)的制备
[0109][0110]
制备方法参考实施例1,区别在于将化合物溴乙酸甲酯替换为4-(溴甲基)苯甲酸甲酯。得黄色固体;收率51.8%。1h nmr(400mhz,cdcl3)δ7.58(d,j=8.2hz,2h),7.16(d,j=
8.1hz,2h),6.85(s,2h),6.71(s,1h),6.46(d,j=12.1hz,1h),6.35(d,j=12.1hz,1h),6.28(s,2h),5.04(s,2h),3.90(s,3h),3.86(s,3h),3.50(s,6h).
13
c nmr(101mhz,cdcl3)δ166.75,152.59,148.81,147.42,141.19,135.95,133.11,130.48,129.99,129.74,128.74,127.16,126.19,122.75,113.78,111.51,105.49,70.02,61.09,56.00,55.62.
[0111]
实施例8:
[0112]
(z)-n-(2-氨基苯基)-6-(2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯氧基)烟酰胺(化合物iiih)的制备
[0113][0114]
步骤1:称取化合物(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯酚(200mg,0.63mmol)置于密封管中,加4ml无水dmf搅拌溶解,随后加入k3po4(268mg,2e.q.)、2-吡啶甲酸(62mg,0.4e.q.)和6-溴烟酸甲酯(163mg,1.2e.q.)置换ar,加入cui(24mg,0.2e.q.),再置换ar。然后110℃加热10h,tlc监测反应结束。加30ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=4:1)分离纯化,得中间体。
[0115]
步骤2:将得到的中间体直接溶于4ml thf/h2o(1:1)中,室温下加入koh,60℃加热8h,tlc监测反应完全,待体系冷却,向体系中加1m的盐酸调节ph至酸性,有白色固体析出,将固体过滤,用石油醚洗,干燥后溶于4ml dcm中,室温下加入dipea、edci
·
hcl、hobt,搅拌30min,然后加入邻苯二胺搅拌过夜,tlc监测反应完全,向体系中加1m的盐酸调节ph至中性。然后加20ml水稀释体系,用二氯甲烷(10ml
×
3)萃取。合并有机相,饱和食盐水洗两遍,无水硫酸镁干燥,过滤浓缩,柱层析(pet:ea=1:1)分离纯化,得到化合物iiih。得白色固体;收率50.6%。1h nmr(400mhz,cdcl3)δ8.58(s,2h),8.17(d,j=8.6hz,1h),7.37(d,j=7.7hz,1h),7.13
–
7.07(m,2h),6.95(d,j=8.5hz,1h),6.89(d,j=8.6hz,1h),6.86
–
6.81(m,3h),6.54(d,j=11.9hz,1h),6.49(d,j=11.9hz,1h),6.43(s,2h),3.82(s,3h),3.75(s,3h),3.72(s,6h).
[0116]
实施例9:
[0117]
(z)-n-羟基-6-(2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯氧基)烟酰胺(化合物iiii)的制备
[0118][0119]
制备方法参考实施例8步骤1和实施例1步骤2。得黄色固体;收率47.3%。1h nmr(400mhz,dmso-d6)δ11.24(s,1h),9.11(s,1h),8.40(d,j=2.1hz,1h),8.09(dd,j=8.6,2.4hz,1h),7.18(dd,j=8.5,2.0hz,1h),7.11(d,j=8.5hz,1h),7.01(d,j=10.0hz,2h),
6.55(d,j=8.5hz,3h),6.49(d,j=12.2hz,1h),3.67(s,3h),3.62(s,6h),3.59(s,3h).
13
c nmr(101mhz,dmso-d6)δ164.35,152.55,146.27,138.60,132.02,129.76,129.29,128.46,126.93,123.51,122.82,112.96,109.86,105.86,59.97,55.73,55.50,14.05.
[0120]
实施例10:
[0121]
(z)-n-(2-氨基苯基)-5-(2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯氧基)戊酰胺(化合物iiij)的制备
[0122][0123]
制备方法参考实施例4,区别在于将4-溴甲基苯甲酸甲酯替换为5-溴戊酸乙酯。黄色油状物;收率39.4%。1h nmr(400mhz,cdcl
3)
δ8.46(s,1h),7.21(d,j=7.7hz,1h),7.06(t,j=7.6hz,1h),6.88(d,j=8.2hz,1h),6.78(dd,j=11.1,7.5hz,4h),6.55(d,j=4.0hz,2h),6.52(d,j=5.2hz,2h),3.84(s,3h),3.82(d,j=6.0hz,2h),3.78(s,3h),3.73(s,6h),2.43(t,j=6.9hz,2h),1.82(dq,j=12.1,6.4hz,5h).
[0124]
实施例11:
[0125]
n-羟基-4-(2-甲氧基-5-(3,4,5-三甲氧基苯甲酰基)苯氧基)丁酰胺(化合物iiik)的制备
[0126][0127]
制备方法参考实施例4,区别在于将(z)-2-甲氧基-5-(3,4,5-三甲氧基苯乙烯基)苯酚替换为2-甲氧基-5-(3,4,5-三甲氧基苯甲酰基)苯酚,溴乙酸甲酯替换为4-溴丁酸乙酯。白色固体;收率38.4%。1h nmr(400mhz,dmso-d6)δ11.17(d,j=45.5hz,1h),10.43(d,j=8.8hz,1h),8.72(d,j=11.4hz,1h),7.05
–
6.82(m,2h),6.68(s,1h),6.53(s,1h),3.91(q,j=6.5hz,2h),3.79(d,j=19.6hz,3h),3.75
–
3.67(m,9h),2.18
–
2.08(m,2h),1.93(q,j=8.0hz,2h).
[0128]
实施例12:
[0129]
采用cck-8法和srb法来测定含二苯乙烯或二苯甲酮骨架的ca-4衍生物对u937(人白血病细胞)、mcf7(人乳腺癌细胞)、hepg2(人肝癌细胞)、a549(人肺癌细胞)、mgc-803(人胃癌细胞)和hela(人宫颈癌细胞)的半数抑制浓度(ic
50
)。
[0130]
srb法
[0131]
先将处于对数生长期的mcf-7、hepg2、mgc-803、hela、a549细胞接种于96孔板中,3000-4000/孔,在37℃,5%co2培养箱过夜孵育使其贴壁,弃去上层培养基,加入不同浓度梯度的含药培养基,培养72h后,弃去上层培养液,每孔轻柔加入100μl10%(w/v)三氯乙酸后于4℃固定30min后弃去,用蒸馏水清洗残留试剂,65℃烘干,每孔加100μl 0.4%srb,室温下摇床染色20min,弃染液,用新配制的1%冰乙酸清洗多余染液,65℃干燥。每孔加150μl 10mm unbuffered trisbase平板振荡5min溶解染料,酶标仪测量560nm波长下处的吸光度
值(optical density,od)。抑制率(%)=(od
对照孔-od
加药孔
)/od
对照孔
×
100%,并计算出抑制率为50%时化合物的浓度。实验重复三次,数据以均值和标准差形式列出。
[0132]
cck-8法
[0133]
收集对数生长期的u937细胞,接种于96孔板中,8000/孔,将含药培养基和细胞悬液共同加入孔内。取三个孔,加入空白培养基,作为空白组。在37℃,5%co2培养箱孵育72h。每孔加10μl cck-8染液,继续孵育3~4h,酶标仪测量450nm波长下的吸光度值,无药物对照组od值控制在2.0左右为宜。增殖抑制率的计算公式:抑制率(%)=od
对照孔-od
加药孔
)/(od
对照孔-od
空白孔
)
×
100%。
[0134]
半数抑制浓度(ic
50
)定义为当50%的肿瘤细胞存活时的药物浓度。根据测定的光密度(od值),制作细胞生长抑制率的标准曲线,在标准曲线上求得其对应的药物浓度。
[0135]
测得的ic
50
见表1所示。
[0136]
表1本发明所列含二苯乙烯和二苯甲酮骨架的ca-4衍生物对肿瘤细胞的抑制ic
50
值(μm)
[0137][0138]a3次平行试验,实验结果取平均值
[0139]
从上述实验可知:本发明的含二苯乙烯和二苯甲酮骨架的ca-4衍生物对u937(人白血病细胞)、mcf7(人乳腺癌细胞)、hepg2(人肝癌细胞)、a549(人肺癌细胞)、mgc-803(人胃癌细胞)和hela(人宫颈癌细胞)有明显的抑制作用,尤其是对mgc-803(人胃癌细胞)的抑制效果更好。因此,本发明的化合物可以应用于制备抗肿瘤药物,并具有优异的活性。
[0140]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1