一种重组酯酶突变体、基因、工程菌及拆分(R,S)-吲哚啉-2-甲酸乙酯的应用
一种重组酯酶突变体、基因、工程菌及拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯的应用
(一)技术领域
1.本发明涉及分子生物学与生物技术领域,具体地说,涉及利用基因突变技术制备一种立体选择性酯酶突变体及其编码基因,含有该编码基因的载体、工程菌及其应用。
(二)
背景技术:
2.培哚普利是血管紧张素(angiotensin)转化酶(ace)抑制剂培哚普利拉的前药酯,除了降低血压的作用外,该药物还能改善内皮功能以及使血管和心脏结构与功能正常化。目前(s)
‑
吲哚啉
‑2‑
羧酸的合成主要以化学法为主。但是化学法使用的手性助剂昂贵且难以回收利用,且反应步骤繁琐,需要高压环境,限制其商业化应用。酶法拆分凭借其反应条件温和、高立体选择性和环境友好的特性,越来越受到青睐。
3.目前,(s)
‑
吲哚啉
‑2‑
羧酸及其甲酯的化学合成主要有四种方法,分别为手性助剂重结晶法、手性助剂不对称氢化法、手性助剂不对称还原法以及手性源合成法。手性助剂重结晶法:重结晶法的原理是使用光学活性化合物作为助剂,将特定的光学异构体选择性地沉淀为盐,与其他光学异构体分离得到纯产品。vincent m等人将(+)
‑
α
‑
甲基苄基胺作为手性助剂,分离得到光学纯度为96%的(s)
‑
吲哚啉
‑2‑
羧酸。而(+)
‑
α
‑
甲基苄基胺价格昂贵,不可回收利用,因此重结晶法难以工业化生产(s)
‑
吲哚啉
‑2‑
羧酸。
4.手性助剂不对称氢化法:该方法是将底物和具有手性配体的金属催化剂加入溶剂中,然后对底物进行光学选择性氢化。kuwano等人以吲哚啉
‑2‑
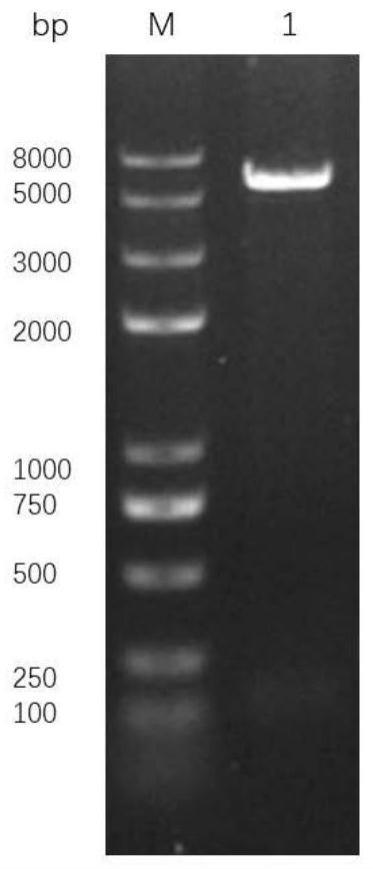
羧酸甲酯为底物,rh(nbd)2sbf6作为催化剂,(r,r)
‑
2,2
‑
双(二苯基膦基)
‑
1,1
‑
双二茂铁作为配体,在含有碳酸铯的异丙醇溶液中(60℃和5.0mpa),制备具有光学纯度为95%的(s)
‑
吲哚啉
‑2‑
羧酸。该方法使用昂贵的手性助剂进行氢化,且手性助剂难以合成。此外,由于上述氢化方法需要昂贵的设备和设施,因此不能用于大规模的生产。
5.手性源合成法:以单一构型的苯丙氨酸为手性源,采用硝基胺化法合成得到(s)
‑
吲哚啉
‑2‑
羧酸。liu等人以l
‑
苯丙氨酸为初始原料,在硝酸脲/硫酸以及碳酸钾的作用下,硝基胺化生成(s)
‑6‑
硝基
‑
吲哚啉
‑2‑
羧酸,然后利用盐酸和催化剂pd/c脱去硝基制备(s)
‑
吲哚啉
‑2‑
羧酸,其收率为42%,光学纯度为99.5%。该方法需要使用昂贵的原材料,且收率较低,反应能耗大。
6.目前,通过酶法拆分获得目的产物已经越来越受欢迎,经过基因工程改造的酶能显著提高对底物的拆分效果。另外,酶法拆分具有反应步骤简单、能耗低、副产物少、无污染等优点。因而,用改造后的工程酶来拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯有望取代化学法实现工业化应用。
(三)
技术实现要素:
7.本发明目的是提供一种高立体选择性重组酯酶突变体、编码基因、含有该基因的重组载体、该重组载体转化得到的重组基因工程菌,及其在生物法拆分(r,s)
‑
吲哚啉
‑2‑
甲
酸乙酯中的应用,解决了用野生型重组酯酶制备(s)
‑
吲哚啉
‑2‑
甲酸过程中ee.值偏低的技术难题。该重组酯酶突变体在转化率达到49%时(理论转化率50%),(s)
‑
吲哚啉
‑2‑
甲酸的e.e.
p
仍保持在98%以上,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的e.e.
s
也达到了97.90%。
8.本发明采用的技术方案是:
9.本发明提供一种立体选择性重组酯酶突变体,所述重组酯酶突变体氨基酸序列如seq id no.1所示。
10.met pro leu asp pro his ile gln ile phe leu asn gln tyr asn glu met pro arg pro ser leu glu asp val thr pro pro gln leu arg glu met glu lys met ser leu thr pro
11.ser lys glu ala val lys lys val tyr asn lys glu ile gln leu asn glu arg thr leu thr ile arg val tyr glu pro glu gly thr gly pro phe pro ala leu val tyr tyr his gly gly gly trp val gln gly ser leu asp thr his asp ser ile cys arg ser tyr ala asn glu thr asn cys ile val val ser val asp tyr arg leu ala pro glu asp lys phe pro ala ala val asn asp ala tyr asp ala leu asp trp ile ala ala his ala ser gln leu asn ile asp ser asn lys ile ala val gly gly asp ser ala gly gly asn leu ala ala val val ser ile leu ala lys gln arg gln gly pro ser ile val his gln leu leu ile tyr pro ser val gly phe lys asn gln his pro ala ser met lys glu asn gly glu gly tyr leu leu ser lys asp leu met asp trp phe arg leu gln tyr leu asn asn lys
12.glu glu glu gln his pro tyr asn ala pro val leu leu glu asp leu ser ser leu pro ser ala thr ile leu thr ala gln tyr asp pro leu arg asp ser gly lys asp tyr ala asp ala leu lys asn his gly val pro val thr tyr glu asn tyr glu thr met ile his gly phe leu gly phe his glu phe val pro leu ala gln gln ala ile asn lys ser ala ala gln leu arg gln val phe asp ser ile
13.因为氨基酸序列具有特殊性,所有含有与seq id no.1所示氨基酸序列的多肽片段及其变体类型,比如保守性变体、生物活性片段或者衍生物,如果该多肽片段或者是多肽变体与上述氨基酸序列的同源性达到90%以上、而且有相同的酶活性,均属于本发明保护范围之列。具体的,所述改变如氨基酸的插入、缺失、替换;或者所替换的氨基酸具有与原氨基酸相似的结构或化学性质,例如用异亮氨酸替换亮氨酸;也或者是非保守性改变,例如用甲硫氨酸替换成甘氨酸。
14.所述蛋白其产生形式可以是天然蛋白、重组蛋白、合成蛋白,或是使用重组技术从原核或真核宿主中合成。依据重组生产使用的宿主不同,本发明的蛋白其形式可以是糖基化的。本发明的蛋白可以含有或不含有起始的甲硫氨酸残基。
15.本发明还涉及所述重组酯酶突变体的编码基因,所述编码基因的核苷酸序列如seq id no.2所示:
16.atgccgctggacccgcacattcagatttttctgaaccagtataacgaaatgccgcgtccgagcctggaagacgtgacccc
17.gccgcagctgcgtgaaatggaaaaaatgagcctgaccccgagcaaagaagcagttaaaaaagtttataataaagaaattc
18.agctgaatgaacgtaccctgaccattcgtgtttatgaaccggaaggtaccggtccgtttccggcactggtttattatcat
19.ggtggtggttgggttcagggtagcctggatacccatgatagcatttgtcgtagctatgcaaatgaaaccaattgtattgt
20.tgttagcgttgattatcgtctggcaccggaagataaatttccggcagcagttaatgatgcatatgatgcactggattgga
21.ttgcagcacatgcaagccagctgaatattgatagcaataaaattgcagttggtggtgatagcgcaggtggtaatctggca
22.gcagttgttagcattctggcaaaacagcgtcagggtccgagcattgttcatcagctgctgatttatccgagcgttggttt
23.taaaaatcagcatccggcaagcatgaaagaaaatggtgaaggttatctgctgagcaaagatctgatggattggtttcgtc
24.tgcagtatctgaataataaagaagaagaacagcatccgtataatgcaccggttctgctggaagatctgagcagcctgccg
25.agcgcaaccattctgaccgcacagtatgatccgctgcgtgatagcggtaaagattatgcagatgcactgaaaaatcatgg
26.tgttccggttacctatgaaaattatgaaaccatgattcatggttttctgggttttcatgaatttgttccgctggcacagc
27.aggcaattaataaaagcgcagcacagctgcgtcaggtttttgatagcatttga
28.本发明重组酯酶突变体编码基因由如下方法得到:以pet
‑
28a
‑
bace(cn201910766521.0)为模板质粒,设计了一对突变引物l86q
‑
f(5
’‑
ggtggtggttgggttcagggtagtctggatac
‑3’
),l86q
‑
r(5
’‑
aacccaaccaccaccatgataataaaccagtgcc
‑3’
),在pcr仪上,进行全质粒扩增。得到的扩增产物取150ng转化到大肠杆菌bl21(de3)中,接着将其涂布在含有50ug/ml卡那霉素的lb平板中,放置在37℃恒温培养箱培养12~16小时。从已培养的平板中挑选阳性单克隆,转接到同样含有50ug/ml卡那霉素的lb液体培养基,于37℃震荡培养16小时。之后从菌体中提取重组质粒,并送去测序,测序正确即为pet
‑
28a(+)
‑
bace(l86q)重组载体,立体选择性重组酯酶突变体基因位于该重组载体内。
29.因为核苷酸序列具有特殊性,所有与seq id no.2所示多核苷酸的变体,只要与该多核苷酸具有超过70%的同源性、且功能相同,均属于本发明保护范围之列。所述多核苷酸的变体是指改变其中的一个或多个核苷酸的多核苷酸序列。
30.本发明另外涉及包含所述重组酯酶突变体编码基因的重组质粒,以及用所述重组质粒转化宿主菌获得的重组基因工程菌;所述重组质粒以pet
‑
28a为基础质粒,宿主菌优选大肠杆菌bl21(de3)。
31.本发明另外涉及所述重组酯酶突变体编码基因在合成重组酯酶突变体中的应用,具体所述的应用是:构建含有所述重组酯酶突变体基因的重组质粒pet
‑
28a
‑
bace(l86q),将所述重组质粒转化到大肠杆菌bl21(de3)中,得到的重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)。重组大肠杆菌经发酵、诱导后,发酵液通过离心作用分离得到含有酯酶突变体的菌体。菌体细胞通过超声破碎处理,离心去除固体碎片,得到的上清液流经ni
‑
nta亲和层析柱,目的蛋白被柱子吸附,杂蛋白流穿,最后通过洗脱液洗脱得到纯化后的重组酯酶突变
体纯酶。
32.本发明另外涉及所述的重组酯酶突变体在拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯中的应用,所述应用是以含有重组酯酶突变体编码基因的工程菌经发酵诱导后得到的湿菌体、冻干菌体或湿菌体超声破碎提取的纯酶为催化剂,加入(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯作为底物,在ph7.5、10
‑
200mm的pb缓冲液中,在反应条件为10
‑
40℃,200
‑
300rpm下进行反应(优选20℃、180rpm下反应60min),反应结束后,反应液分离纯化,得到(s)
‑
吲哚啉
‑2‑
甲酸。所述底物的加入终浓度以缓冲液体积计为1~50g/l(优选20~30g/l);催化剂的加入终浓度以缓冲液体积计为0.0001~20g/l,其中湿菌体为5~20g/l(优选8
‑
15g/l),冻干菌体为1~3g/l,纯酶为0.0001
‑
0.05g/l(优选0.025
‑
0.05g/l)。
33.本发明所述终产物分离纯化方法为:反应结束后,往反应液中加入乙酸乙酯萃取反应液中的酯,然后离心分离水相和有机相,往水相中加入10m naoh水溶液至ph 10.0,充分摇匀后离心取上清,往上清液中加6m hcl调节至ph 2.0,然后负压(0.01
‑
0.03mpa)抽滤,滤渣,干燥(优选60℃干燥30min)后为产物(s)
‑
吲哚啉
‑2‑
甲酸。
34.本发明所述湿菌体和冻干菌体按以下步骤获得:将含有重组酯酶突变体编码基因的工程菌(优选大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q))接种至含50μg/ml卡那霉素的lb液体培养基中,37℃下培养12
‑
16h,获得种子液;按照体积浓度1%的接种量将种子液转接到含50μg/ml卡那霉素的tb液体培养基中,37℃振荡培养至od
600
达到0.6
‑
0.8,加入诱导剂iptg至终浓度为0.2mm,在18℃下诱导发酵16
‑
18h,发酵液经离心(4℃、12000rpm离心10min),取沉淀即为湿菌体。将湿菌体在
‑
20℃冷冻16小时,然后将冰冻好的湿菌体转移至冻干机,
‑
60℃、100pa冻干24h,即为冻干菌体。
35.本发明所述纯酶按以下步骤获得:往每2g湿菌体加入15ml 4℃预冷的pb(ph7.5、20mm)缓冲液重悬细胞,超声破碎(200w,工作3s,间隔3s,10min),将破碎液在4℃下12000rpm离心10min,取上清液通过ni
‑
nta亲和层析柱纯化,收集含有目的蛋白的洗脱液,并加入蔗糖作为保护剂,
‑
60℃、100pa冻干24h后,即为重组酯酶突变体纯酶,所述蔗糖加入量以洗脱液体积计为50g/l。
36.所述ni
‑
nta亲和层析柱纯化具体为:ni
‑
nta亲和层析柱(5ml histrap
tm ff,ge healthcare)用含有20mm咪唑的pb(ph7.5)缓冲液平衡后,将粗酶液以流速2ml/min上样,上样结束后再用含有20mm咪唑的pb(ph7.5)缓冲液洗平基线,最后用含200mm咪唑的pb(ph7.5)缓冲液以流速2ml/min洗脱目的蛋白,当uv280nm值大于200mau时收集含有目的蛋白的洗脱液,当uv280nm值下降至小于200mau停止收集。
37.与现有技术相比,本发明的有益效果主要体现在:本发明对野生型的酯酶bace进行了定点突变,得到了立体选择性提高的突变体。该突变体重组质粒转化至大肠杆菌中,构建成大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)工程菌;该工程菌经超声破碎,过柱纯化得到重组酯酶突变体;利用大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)工程菌或重组酯酶突变体为生物催化剂拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯,得到产物(s)
‑
吲哚啉
‑2‑
甲酸,其转化率达49%,产物的光学纯度达到98%以上。
(四)附图说明
38.图1为线性化pet
‑
28a
‑
bace(l86q)琼脂糖凝胶电泳;泳道m是dna marker,泳道1是
实施例1线性化pet
‑
28a
‑
bace(l86q)片段。
39.图2为构建的重组质粒pet
‑
28a
‑
bace(l86q)。
40.图3为重组酯酶突变体纯化后蛋白质电泳图;泳道m是protein marker,泳道1是实施例2重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)未加iptg培养的湿菌体;泳道2是实施例2重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)加0.2mm iptg诱导培养的湿菌体;泳道3是实施例3重组酯酶bace突变体纯酶液。
41.图4为大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)拆分外消旋吲哚啉
‑2‑
甲酸乙酯产生(s)吲哚啉
‑2‑
甲酸的高压液相色谱图。
(五)具体实施方式
42.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
43.实施例1:pet
‑
28a
‑
bace(l86q)质粒构建
44.重组载体pet
‑
28a
‑
bace的构建参照专利申请cn201910766521.0。
45.1、以重组载体pet
‑
28a
‑
bace为dna为模板,使用带有同源臂的引物l86q
‑
f(5
’‑
ggtggtggttgggttcagggtagtctggatac
‑3’
),l86q
‑
r(5
’‑
aacccaaccaccaccatgataataaaccagtgcc
‑3’
)进行pcr扩增。
46.pcr体系(20μl)如下:
47.上游引物l86q
‑
f和下游l86q
‑
r各0.5μl,重组载体pet
‑
28a
‑
bace 1μl,primestar max premix(2
×
)dna聚合酶10μl,加ddh2o补至20μl。
48.pcr反应条件:预变性98℃,5min;变性98℃,5s;退火65℃,5s;延伸72℃,40s;共35个循环;终延伸72℃5min,降温至4℃保存。取2μl pcr反应液与1μl的上样缓冲液混匀后,点样进行琼脂糖凝胶电泳检测,电泳结果(图1)显示条带单一,且扩增片段大小符合预期,约为6190bp。
49.2、将上述pcr扩增片段(片段两头已包含了15bp的同源片段)用一步克隆试剂盒(clonexpressⅱone step cloning kit,南京诺唯赞生物科技有限公司)按照说明书进行同源重组自连。取2μl的连接产物,转化至大肠杆菌bl21(de3)感受态细胞中,冰上放置30分钟,42℃热激90秒,冰上静置5分钟,往里添加700μl lb培养基,37℃,200rpm复苏1小时。涂布于含50μg/ml卡那霉素的lb平板上,37℃培养16小时,次日挑取阳性克隆接种于含有50μg/ml卡那霉素的lb液体培养基中,37℃培养16小时。收集培养后菌液测序,测序结果正确的阳性克隆,抽提质粒。该质粒即为含酯酶bace突变体的重组质粒pet
‑
28a
‑
bace(l86q),酯酶bace突变体氨基酸序列为seq id no.1所示,编码基因序列为seq id no.2所示,图2为该重组载体图谱。已转入该重组载体的大肠杆菌bl21(de3)便是重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)。
50.同时以重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace作为野生型。
51.每升lb培养基组成:5g酵母粉、10g蛋白胨、10g氯化钠溶解于1l纯净水中,ph自然。
52.实施例2、重组酯酶bace突变体菌体细胞
53.将实施例1构建的重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)接种于含50μg/ml卡那霉素的lb液体培养基中,在37℃下培养16h,此为种子液。种子液以1%(v/v)接种量
接种到含50μg/ml卡那霉素的tb培养基中,37℃下培养2.5小时至od
600
=0.6,再添加终浓度为0.2mm的iptg,18℃诱导16小时,4℃、12000rpm离心10min,收集菌体,即为含重组酯酶bace突变体的菌体细胞。同样条件下,以不添加iptg培养的湿菌体进行蛋白电泳检测,电泳结果如图3所示。
54.同样条件下制备含野生型重组酯酶bace的菌体细胞。
55.每升tb培养基组成:15g酵母粉、20g蛋白胨、8g氯化钠、4g葡萄糖、2.22g磷酸氢二钠、1g磷酸二氢钾溶解于1l纯净水中,ph自然。
56.实施例3:bace(l86q)酶活力测定
57.取实施例2方法制备的重组大肠杆菌bl21(de3)/pet
‑
28a
‑
bace(l86q)湿菌体2g,加入15ml 4℃预冷的pb(ph7.5)缓冲液重悬细胞,超声破碎(200w,工作3s,间隔3s,10min),将破碎液在4℃下12000rpm离心10min,取上清液,即含有重组酯酶bace突变体的粗酶液。
58.粗酶液用ni
‑
nta亲和层析柱纯化,具体为:ni
‑
nta亲和层析柱(5ml histrap
tm ff,ge healthcare)用含有20mm咪唑的pb(ph7.5)缓冲液平衡后,将粗酶液以流速2ml/min上样,上样结束后再用含有20mm咪唑的pb(ph7.5)缓冲液洗平基线,最后用含200mm咪唑的pb(ph7.5)缓冲液以流速2ml/min洗脱目的蛋白,当uv280nm值大于200mau时收集含有目的蛋白的洗脱液,当uv280nm值下降至小于200mau停止收集。洗脱液即为重组酯酶bace突变体纯酶液,采用bradford法检测蛋白浓度为3.20mg/ml,蛋白电泳检测,电泳结果如图3所示,该重组酯酶bace突变体在大肠杆菌中能够高效表达,纯化后纯度达到95%。往5ml含有目的蛋白的洗脱液中加入0.25g蔗糖作为保护剂,放置于
‑
20℃冷冻16小时后,转移至冻干机,
‑
60℃、100pa冻干24h,即为重组酯酶bace突变体纯酶0.016g,于
‑
20℃储存。
59.重组酯酶bace突变体活力测定方法为:总体系1ml:980μl pb(ph7.5)缓冲液和10μl对硝基苯酚丁酸酯(溶解于异丙醇中,浓度为150mm),于40℃金属浴保温5min。之后加入10μl(蛋白浓度1.6μg/ml)的重组酯酶bace突变体纯酶液,并立即计时。反应时间为5min,反应结束后立即加入375μl终止液(氯仿:异戊醇=24:1,v/v)终止反应。反应液在25℃、12000rpm离心30sec,吸取200μl上层液加入到96孔透明酶标板中,并立即在波长为410nm下测定吸光值。同样的反应条件下,加入10μl的pb(ph7.5)缓冲液代替酶液作为对照。根据标准曲线公式y0=146.17x0(y0为对硝基苯酚浓度,单位μm;x0为od
410nm
读数)计算得到生成的对硝基苯酚的量为0.336μmol。在上述测定条件下,以每分钟水解底物产生lμmol的对硝基苯酚所需的酶量定义为1个酶活力单位(u)。重组酯酶bace突变体的酶比活力为4200.7u/mg。
60.实施例4:冻干菌体拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
61.称取实施例2方法制备的含重组酯酶bace突变体的湿菌体1g,放置于
‑
20℃冷冻16小时,然后将冰冻好的湿菌体转移至冻干机,
‑
60℃、100pa冻干24h,即得到含有重组酯酶bace突变体的冻干菌体0.1g。同样条件下制备含野生型重组酯酶bace的冻干菌体。
62.拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),0.001g冻干菌体,加入浓度25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm、60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析。出峰时间为(s)
‑
吲哚啉
‑2‑
甲酸乙酯7.145min,(r)
‑
吲哚啉
‑2‑
甲酸乙酯7.605min,(s)
‑
吲哚啉
‑2‑
甲酸8.467min,(r)
‑
吲哚啉
‑2‑
甲酸10.051min。经过积分求得其峰面积分别为(s)
‑
吲哚啉
‑2‑
甲酸乙酯42902微伏*秒,(r)
‑
吲哚啉
‑2‑
甲酸乙酯3130023微伏*秒,(s)
‑
吲哚啉
‑2‑
甲酸173011微伏*秒,(r)
‑
吲哚啉
‑2‑
甲酸1513微伏*秒。代入标准曲线y1=5.586*10
‑7x1(y1:吲哚啉
‑2‑
甲酸乙酯的浓度,单位mm;x1:吲哚啉
‑2‑
甲酸乙酯的峰面积,单位微伏*秒)和y2=5.789*10
‑7x2(y2:吲哚啉
‑2‑
甲酸的浓度,单位mm;x1:吲哚啉
‑2‑
甲酸的峰面积,单位微伏*秒)分别计算得到(s)
‑
吲哚啉
‑2‑
甲酸乙酯的浓度为0.024mm,(r)
‑
吲哚啉
‑2‑
甲酸乙酯的浓度为1.748mm,(s)
‑
吲哚啉
‑2‑
甲酸的浓度为0.100mm,(r)
‑
吲哚啉
‑2‑
甲酸的浓度为0.000876mm。
63.底物对映体过量(e.e.
s
),产物对映体过量(e.e.
p
),转化率(c),根据以下公式计算。
[0064][0065][0066][0067]
r
s
:(r)
‑
吲哚啉
‑2‑
甲酸乙酯的浓度;s
s
:(s)
‑
吲哚啉
‑2‑
甲酸乙酯的浓度;s
p
:(s)
‑
吲哚啉
‑2‑
甲酸的浓度;r
p
:(s)
‑
吲哚啉
‑2‑
甲酸的浓度。
[0068]
液相结果如图4所示,(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p
为98.26%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s
为97.29%,转化率为49.8%。相同条件下,野生型重组酯酶bace的e.e.
p
只有67.3%,表明重组酯酶bace突变体对于(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映选择性优于野生型重组酯酶bace。
[0069]
液相色谱:仪器型号waters 1525;手性液相色谱柱大赛璐ad
‑
h;流动相正己烷:异丙醇=4.5:1(v:v),流速1ml/min,柱温30℃,检测波长为237nm,进样量10μl。
[0070]
实施例5:冻干菌体拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
[0071]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),0.001g实施例4方法制备的含重组酯酶bace突变体的冻干菌体,加入浓度50g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析(同实施例4)。(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p 98.05%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s 95.23%,转化率49.3%。
[0072]
实施例6:冻干菌体拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
[0073]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),0.002g实施例4方法制备的含重组酯酶bace突变体的冻干菌体,加入浓度25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析(同实施例4)。(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p 98.01%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s 97.79%,转化率49.9%。
[0074]
实施例7:湿菌体拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
[0075]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),0.008g实施例2方法制备的含重组酯酶bace突变体的湿菌体,加入浓度25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析(同实施例4)。(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p 98.22%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s 95.25%,转化率49.2%。
[0076]
实施例8:湿菌体拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
[0077]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),0.015g实施例2方法制备的含重组酯酶bace突变体的湿菌体,加入浓度25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析(同实施例4)。(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p 98.10%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s 97.53%,转化率49.9%。
[0078]
实施例9:纯酶拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
[0079]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),25μg实施例3方法制备的重组酯酶bace突变体纯酶(即将实施例3方法制备的重组酯酶bace突变体纯酶用蒸馏水复溶至蛋白浓度3.2mg/ml,然后向反应液中添加7.81μl),25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析(同实施例4)。结果显示(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p 98.35%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s 97.10%,转化率49.7%。
[0080]
实施例10:纯酶拆分(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯
[0081]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),50μg实施例3方法制备的重组酯酶bace突变体纯酶(即将实施例3方法制备的重组酯酶bace突变体纯酶用蒸馏水复溶至蛋白浓度3.2mg/ml,然后向反应液中添加7.81μl和15.6μl),加入浓度25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。添加50μl 6n盐酸终止反应,再加入1ml乙酸乙酯充分震荡混匀,12000rpm离心,吸取30μl上层有机相,真空旋干,加入1ml的流动相(正己烷/异丙醇=4.5:1,v/v)溶解,溶解液即为样品,进行液相色谱检测分析(同实施例4)。结果显示(s)
‑
吲哚啉
‑2‑
甲酸的对映体过量值e.e.
p 98.11%,(s)
‑
吲哚啉
‑2‑
甲酸乙酯的对映体过量值e.e.
s 97.90%,转化率49.9%。
[0082]
实施例11:终产物分离纯化
[0083]
拆分反应体系为1ml:1ml pb缓冲液(200mm,ph7.5),50μg实施例3方法制备的重组酯酶bace突变体纯酶(即将实施例3方法制备的重组酯酶bace突变体纯酶用蒸馏水复溶至蛋白浓度3.2mg/ml,然后向反应液中添加7.81μl和15.6μl),加入浓度25g/l(r,s)
‑
吲哚啉
‑2‑
甲酸乙酯。反应条件:20℃、180rpm,60min。反应结束后,往反应液中加入1ml乙酸乙酯颠
倒混匀数次,20℃、12000rpm离心5min。取下层水相并往其中加入10m naoh水溶液至ph 10.0,充分摇匀后20℃、12000rpm离心5min取上清,往上清液中滴加6m hcl调节至ph 2.0,然后负压(0.01
‑
0.03mpa)抽滤,滤渣,60℃干燥30min,即产物(s)
‑
吲哚啉
‑2‑
甲酸0.012g。
[0084]
以上所述,仅是本发明的较佳实施例而已,并非对本发明的技术内容作任何形式上的限制。凡是依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1