可卡因酯酶突变体及其应用
1.本发明涉及生物医药技术领域,特别是涉及可卡因酯酶突变体及其应用。
背景技术:
2.可卡因滥用和成瘾是现代社会中严重的医学和社会问题。到目前为止,还没有药物获得批准用于可卡因解毒的治疗。可卡因滥用造成的灾难性医学和社会后果使得抗可卡因药物的开发成为当务之急。在体内,约40%的可卡因被丁酰胆碱酯酶(butyrylcholinesterase,bche)和羧酸酯酶2(carboxyesterase
‑
2,ce
‑
2)快速生物转化为非活性代谢物芽子碱甲酯(eme),而45%的可卡因在肝脏经羧酸酯酶1(carboxyesterase
‑
1,ce
‑
1)水解成有毒代谢物苯甲酰芽子碱(benzoylecgonine,bze)(图1)。bze与可卡因具有相似的生理活性,由于bze体内半衰期较长,被认为是可卡因长期毒性的主要贡献者。此外,bze是环境中成瘾性药物主要残留污染物之一,对生态体系有着重要影响。
3.可卡因滥用的理想治疗方法不仅需要快速消除可卡因本身的毒性,而且更需要去除可卡因有毒代谢产物bze的毒性。基于计算机辅助设计和酶工程相结合的研究策略,科学家们设计和开发出了一系列高效且热稳定的可卡因代谢酶包括人丁酰胆碱酯酶(butyrylcholinesterase,bche)突变体和细菌可卡因酯酶(cocaine esterase,coce)突变体,能够有效消除可卡因的毒性(larsen na,turner jm,stevens j,rosser sj,basran a,lerner ra,bruce nc,wilson ia.crystal structure of a bacterial cocaine esterase.nat struct biol 2002,9(1):17
‑
21.)。在此基础上,进一步降解bze是实现可卡因彻底解毒的关键,因此开发针对bze降解的高效代谢酶对可卡因的彻底解毒治疗具有重要意义。
4.内源bche是唯一被证实能水解bze为无毒的牙子碱(ecgonine,ecg)和苯甲酸。但由于天然bche高度糖基化修饰,高效经济重组表达bche一直是行业难题,后期开发难度大。因此寻找能够经济表达且具有高催化活性的bze代谢酶具有重要的应用价值。
5.coce可以用原核细胞表达系统经济高效地表达,且该重组蛋白在人体内具有良好的安全性(coce t172r/g173q突变体已完成可卡因解毒的临床试验ii期,证实其安全有效。nasser,a.f.,et.al.j.addict.dis.2014,33,289
–
302),因此coce是非常理想的候选bze代谢酶。但天然coce对bze的催化效率太低,亟需大幅度提高才能满足高效去除bze毒性的要求。
技术实现要素:
6.本发明旨在设计获得全新的高活性coce突变体,进一步提高对可卡因有毒代谢物be的催化活性,可用于可卡因中毒的临床治疗,满足临床使用需求。
7.基于酯酶对苯酯水解的催化机理和酯酶经典的催化三联体结构,我们通过rosetta软件搜索发现可卡因酯酶可作为水解bze的候选酶。我们首次发现coce能够催化bze水解生成芽子碱和苯甲酸,其水解bze的催化参数为:k
cat
=301.2min
‑1,k
m
=5153μm。
8.可卡因酯酶突变体,由野生型可卡因酯酶经过突变所得,野生型可卡因酯酶的氨基酸序列如seq id no.1所示,
9.所述可卡因酯酶突变体为以下一种:
10.(1)v116k,
11.(2)t172r/g173q/v116k,
12.(3)t172r/g173q/l196c/i301c/v116k,
13.(4)t172r/g173q/l196c/i301c/v116k/a51l,
14.(5)t172r/g173q/l196c/i301c/v116k/a51y,
15.(6)t172r/g173q/l196c/i301c/v116k/a51v,
16.(7)t172r/g173q/l196c/i301c/v116k/a51f,
17.(8)t172r/g173q/l196c/i301c/v116k/a51w。
18.本发明又提供了所述可卡因酯酶突变体在制备用于治疗可卡因中毒的药物中的应用。
19.本发明又提供了所述可卡因酯酶突变体在制备用于水解苯甲酰苯甲酰芽子碱为芽子碱和苯甲酸的水解剂中的应用。
20.本发明又提供了所述可卡因酯酶突变体在治理水体或土壤中可卡因或苯甲酰芽子碱污染中的应用。
21.本发明还提供了一种用于治疗可卡因中毒的药物,活性成分为所述可卡因酯酶突变体。
22.所述的药物,还包括医学上可接受的助剂。
23.本发明还提供了一种用于治理水体或土壤中可卡因或苯甲酰芽子碱污染的试剂,有效成分为所述可卡因酯酶突变体。
24.本发明还提供了编码所述可卡因酯酶突变体的基因。
25.本发明还提供了包含所述基因的表达载体。
26.本发明还提供了包含所述表达载体的重组表达细胞。
27.本发明还提供了所述基因在治理水体或土壤中可卡因或苯甲酰芽子碱污染中的应用。
28.本发明通过计算机辅助设计得到一系列突变,采用点突变pcr方法构建coce突变体;表达重组蛋白酶并纯化;通过体外和体内酶促反应验证酶活性,筛选高活性突变体。
29.本发明研究发现,将可卡因酯酶第116的v(缬氨酸)突变成k(赖氨酸)后获得的v116k突变体对可卡因有毒代谢物苯甲酰芽子碱的催化效率相对于野生型酶大大提高。在v116k突变的基础上,进一步进行筛选,筛选到的可卡因酯酶突变体对可卡因有毒代谢物苯甲酰芽子碱的催化效率更进一步获得提高。
附图说明
30.图1为可卡因代谢途径。
31.图2为本发明技术路线图。
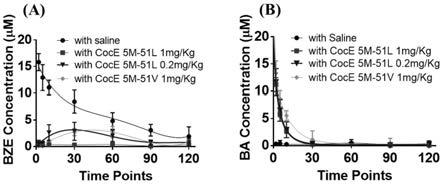
32.图3为高活性coce突变体加速大鼠体内bze的代谢:(a)血液中bez浓度随时间变化曲线;(b)血液中代谢产物ba浓度随时间变化曲线。其中,5m
‑
51l表示t172r/g173q/l196c/
i301c/v116k/a51l;5m
‑
51v表示t172r/g173q/l196c/i301c/v116k/a51v。
具体实施方式
33.本发明整体技术路线如图2所示。
34.实施例1:定点突变
35.采用定点突变的方法获得coce的突变体。
36.首先将野生型coce的cdna(genbank#af173165.1,上海捷瑞生物合成)构建到大肠杆菌表达载体pet
‑
22b(+)(上海捷瑞生物提供,含c端
‑6×
his目的基因插入到ndei和xhoi酶切位点)。以野生型coce质粒为模板,设计突变体的引物通过pcr(kod one mater mix,上海东洋纺)扩增获得突变体的pcr产物,用dpnⅰ(thermo scientific,fd1703)将产物中的dna模板除去后,转化进入感受态细胞(dh5α)中使pcr产物环化,将转化后的感受态细胞菌液涂在含有100μg/ml氨苄青霉素的lb固体培养基上37℃,15hr培养,挑选单克隆并用质粒提取试剂盒提取突变体质粒,通过dna测序确定获得序列正确的突变体质粒。对于有多处突变的,在一处突变后再进行下一轮突变。突变体引物设计如表1所示。
37.表1定点突变所用引物序列
38.39.实施例2:蛋白表达及纯化
40.将构建成功的突变体质粒转化进入大肠杆菌bl21感受态细胞中表达蛋白,将菌液接种至lb液体培养基(含100μg/ml氨苄青霉素)中,在37℃、250rpm摇床上扩大培养至od
600
=0.6
‑
0.8,将菌液冷却至15℃。加入iptg(sigma,367
‑
93
‑
1)至终浓度为1mm,15℃,180rpm诱导蛋白表达15hr。收集菌体,用含150mm nacl的50mm tris
‑
hcl(ph 7.4)缓冲液重悬。用预冷的高压细胞破碎仪(scientz jg
‑
ia,宁波新芝)将大肠杆菌细胞破碎,9000rpm,45min离心后收集上清,将上清和钴介质(takara,talon metal affinity resin)在4℃中旋转混合2hr,使带有6
×
his的蛋白与介质结合。将结合液加入重力柱中,在重力作用下自然流出,用不同浓度咪唑梯度洗脱的方法将目的蛋白纯化出来。收集洗脱组分到30k(millipore)超滤管中,通过离心浓缩替换缓冲液,蛋白保存在solution s溶液(50mm hepes,20%d
‑
山梨醇,1m甘氨酸,ph 7.4)中。通过bradford试剂盒(生工,c503031
‑
1000)测定蛋白浓度。
41.实施例3:酶活性分析
42.首先建立hplc检测底物bze与产物苯甲酸ba的实验方法。bze和ba在230nm处均具有较强的紫外吸收,hplc分析以乙腈和0.1%甲酸为流动相,通过c18液相色谱柱分离bze和ba,以紫外检测器检测bze和ba在230nm波长的吸收,获得bze和ba的线性标准曲线。coce催化bze反应的活性测定,反应温度为25℃,每组三个重复。通过将50μl底物bze溶液与50μl酶溶液(0.1m磷酸盐缓冲液(ph7.4)稀释)来启动酶促反应。反应具体条件如表2所示。
43.表2高活性突变体酶对底物bze体外催化反应条件
[0044][0045][0046]
然后加入50μl 10%高氯酸终止反应,加入50μl的乙腈,将混合物以12000rpm离心
5分钟,然后将上清液稀释至合适的倍数进样100μl。将bze和ba出峰时间、峰面积和标曲曲线进行对比,计算反应样品中bze残留浓度和ba生成浓度。通过计算不同底物浓度下酶催化生成ba的反应速率,使用graphpad prism 8绘制酶反应动力学曲线,进行michaelis
‑
menten动力学分析,即可获得各突变体的k
cat
和k
m
。结果如表3所示。
[0047]
表3高活性突变体酶对底物bze催化动力学参数
[0048][0049]
备注:k
eff
指相应酶对于底物bze的催化效率(k
cat
/k
m
)。
[0050]
rce指突变体酶对bze的催化效率与野生型酶对bze的催化效率的比值。
[0051]
实施例4:动物体内实验
[0052]
实验用雄性sd大鼠(~200g/只)购自浙江省医学科学院实验动物中心,饲养于恒温恒湿的环境。饲养和实验使用均按照《实验动物饲养管理和使用指南》。
[0053]
(1)ba和bze血样标准曲线
[0054]
使用采血针和肝素处理的毛细血管从大鼠股静脉采血。首先取8管来自于同一只大鼠的血液,每管75μl,将每管血液加入到100μl 250μμ对氧磷(paraxon)以抑制内源性代谢酶对bze的影响,
‑
80℃冻存。解冻后加入19.7μl含0、4、10、20、40、60、100、200μμba和be标准品混合液,然后涡旋20s,后加入150μl乙腈,涡旋1min,再加入50μl 10%hclo4,涡旋1min,17000rcf离心15min,转移上清再次离心,取约250μl上清液进hplc分析,进样量为100μl,hplc实验条件与实施例3相同。最终标准样品bze和ba浓度分别为0、0.2、0.5、1、2、3、5、10μμ。
[0055]
(2)coce高活性突变体加速体内bze的代谢
[0056]
每组5只大鼠。首先通过大鼠尾静脉注射0.2或1mg/kg的高活性coce突变体或生理盐水,注射1分钟内尾静脉注射2mg/kg bze。bze注射后分别取0、2、5、10、30、60、90、120min的血样75μl,各加入100μl 250μμ对氧磷,
‑
80℃冻存。解冻后涡旋20s,后加入150μl乙腈,
涡旋1min,再加入50μl 10%hclo4,涡旋1min,17000g离心15min,转移上清再次离心,取上清液约250μl进hplc分析,进样量为100μl。根据标准品的血样标准曲线计算各组大鼠不同时间点血液中ba和bze的浓度,从而获得bze在有无高活性coce突变体存在时的代谢情况。
[0057]
结果如图3所示,结果显示,2mg/kg bze静脉注射大鼠体内,2min时血液中bza浓度高达15.8μm,血液中ba浓度<0.5μm。注射高活性突变体时,大鼠血液中bza浓度快速下降而血液中ba浓度迅速升高,表明大鼠体内有毒的bze被高活性突变体快速清除,代谢成无毒的ba。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1