紫色红曲菌comp52338_c2基因过表达菌株的构建方法及其应用
:
1.本发明涉及一种紫色红曲菌comp52338_c2基因过表达菌株的构建方法,属于生物基因工程领域。
背景技术:
2.红曲菌是一种嗜酸性丝状腐生真菌,在许多亚洲国家特别是东亚地区作为传统食品加工的微生物。它的次级代谢产物主要包括monacolink、红曲色素、桔霉素、麦角固醇、γ
‑
氨基丁酸等。其中关于monacolink、红曲色素、桔霉素的研究较多。monacolin k是红曲菌产生的一种聚酮类次级代谢产物,具有降血压的功效,可以治疗心血管疾病且疗效显著。红曲色素是红曲菌在次级代谢过程中产生的一种由多种聚酮化合物组成的混合物,在食品添加剂,纺织品,化妆品和药品等领域发挥着重要作用。桔霉素是红曲菌产生的一种具有肾毒性、致畸性以及致癌性的物质,严重威胁着红曲产品的安全性,限制了红曲行业的发展。
3.monacolin k,又名“洛伐他丁”,红曲菌发酵液中的monacolin k有两种存在形式,即开环的酸式结构和闭环的内酯式结构。monacolin k能够竞争性抑制胆固醇合成通路中的限速酶hmg
‑
coa还原酶,进而达到抑制机体胆固醇的生物合成的作用。对monacolin k合成途径及相关基因和酶的最初认识是起源于土曲霉的研究,而在红曲菌的研究中起步较晚,且许多细节尚未清楚,因而探究红曲菌中monacolin k生物合成的调控过程是十分必要的。目前实验中主要采用基因工程手段对红曲菌次级代谢产物的生物合成调控进行研究。
4.由于真菌生物合成和代谢调控的复杂性,我们对红曲菌monacolink合成调控机制尚未认识清楚,为了进一步探索红曲菌次生代谢产物合成的调控机制,可以从转录因子方面探索红曲菌的生物学过程,通过转录因子与靶基因的识别,更好的认识monacolink生物合成的基因调控网络。
技术实现要素:
5.本发明所要解决的技术问题是提供紫色红曲菌comp52338_c2基因过表达菌株的构建方法。
6.在申请人前期的研究中,实验室前期利用高通量测序技术对紫色红曲菌m1的转录组进行分析,发现comp52338_c2基因对提高红曲菌monacolin k产量具有积极作用。
7.为解决上述技术问题,本发明采用的技术方案是:
8.利用基因过表达技术对comp52338
‑
c2基因进行过表达,通过电击转化方式将重组质粒导入红曲菌原生质体,并成功筛选出重组菌株。
9.comp52338_c2基因序列如下:
10.ggaagaggtccagagggtgagattgtcacgcaacagctgcatgataagggtgctgtcacggtagctctcctcggagagagagtcaagctcagcgatggcatcgtcaaaggcctgtttggcgaggtggcaggcacggtcgggagagttcaagatctcatagtagaaaacggagaagttgagtgcaagaccaaggcggatggggtgggtgggggtaagatca
gtctgagcaacatcggtagcgttcttgtacgcctcgtgggcagcggtagcagcgaccttgcgcttgtttccagaagcgaattcagcgaggtaacggtggtagtcacccttcatcttgtagtagaagaccttggactcgccagtctcggccttagggatgagggactgatcgaggacctcgagaacatcctggcaaaccttctccagctcgttctcgatcttctggcggtagtcacggatgatggcaacgtgttcctcagagcccttggattcctccttctgctcgatggaggagatgattctccaggaagcacgacgggtaccgacgacgttcttgtacgcgacggaaagaagattacgctcgtcgacggtaagctcgcctccaaggttggcgacttccttcatgtacgtgaccatctcatcgtagcgctcggcctgctcgcagagcctcgcgaggaatgtcttgctggaaggggggaatggatgtcagtactacaagccgtcgcaggactgggactttgatagccgcgaatttcttacttttcacgctcagagctcatcgtgaatagggagaaagggagaaatgaagggagtaaagaggaggtgggaagaggagtgacggaaggtgttcacagaagcagtcaggaatggtgagggagaatgaaagaggaaaaggagacaagacagataccgagatagaagagcagagagagatttgggggaggcggaggagggcagagttggcagacgcgagctagcagccgccattggtggcagcaggcagtgataggccggtgaggtgactggcaacgcttagcgactcgcttgttttcttttctcctctggtttactctggcataaaagaagaggaaattcgacactgatatgatctgtctacctgttctgcttctgttcccttctttctgtcttcgtggtgtcctcttggactgcgtatgcatacacattctcatagtattcggtgaggtcacctgatggccgccccttttacaacggacgacgcacttctatttatttcctcgcgccgtcttgccagctgcagtcgatcaacattgcaaaagcgctgctggttgcgtagactatgcgggtttgatgctgtgtaattgttctctctctgtctgctttcccttgtacctcactgtctgtctcttgagtctgctctgcgacaccctaagtcagatcgtgttgtttcactccgcagctcaaataattaataacgattgaatcaacgattgactgattgaacgaatctcattaatataaagaatgcttcgaggaatcctacttggatcagggttgggacagtcgccagtgatcggtcatcgttgcttgaaccaaccgccaactgggttattacgccgtacagattgcatgagaggttgtccaattgtcgtcattgtcagcctgttcaagaatcgactatgggaatggcaagctgcagaaacagt。
11.利用上述公开的comp52338_c2基因序列,本发明提供一种紫色红曲菌comp52338_c2基因过表达菌株的构建方法,包括下列步骤:
12.(1)菌株培养
13.由北京工商大学食品添加剂工程技术中心保存的紫色红曲菌m1(菌种号:cgmcc.3.0568),将m1菌株在固体培养基(g/l)上活化2代,取菌液接种到种子培养基(g/l)中,30℃、200r/min培养2d,按10%的接种量将种子液接种到发酵养基(g/l)中,30℃、150r/min培养2d,再25℃、150r/min培养13d。
14.(2)comp52338_c2基因过表达菌株的构建
15.设计引物序列如下:
16.c2
‑
f:ggaagaggtccagagggtgag;
17.c2
‑
r:actgtttctgcagcttgcca。
18.利用上述引物进行comp52338_c2目的基因扩增:
19.以pbargpe
‑
hygro(武汉淼灵生物公司)为过表达载体,通过dnaman软件选出该载体上的两个单一酶切位点,通过双酶切将扩增出的comp52338_c2目的基因进行连接,构建过表达pbargpe
‑
hygro
‑
c2重组质粒。将重组质粒转入大肠杆菌dh5α感受态细胞中,并进行重组质粒的提取和验证。
20.(3)过表达质粒转化
21.将红曲霉m1接种于pda培养基平板上,在30℃恒温培养箱中培养4d。在每个培养皿中加入10ml灭菌水,用接种环轻轻刮擦细菌表面以释放孢子,制备孢子悬浮液。将孢子悬液
(200μl)涂在置于pda板上的灭菌玻璃纸盘上,涂布至干燥,在30℃下培养30
‑
40h。将生长在玻璃纸盘上的淡粉色菌丝体用接种环刮除,置于单层mira布上,过滤并用50ml硫酸镁溶液洗涤。过滤灭菌后的菌丝体转移到50ml的溶解酶溶液中,在30℃和60rpm下消化2.5
‑
3h,然后通过单层mira布再次过滤。滤液在4℃下以7000转/分离心5分钟,并丢弃上清液。然后用1.2mol l
‑
1山梨醇溶液过滤样品两次(随后离心,并去除上清液)。原生质体在山梨醇溶液中重新悬浮,并保存在冰上以备将来使用。将红曲霉m1活性细胞悬液(100μl)涂在pda平板上。采用电击转化法,将成功构建的高表达质粒导入红曲原生质体中,根据潮霉素b浓度筛选结果筛选转化子。
22.(4)过表达菌株的筛选和验证
23.将在潮霉素b抗性平板上筛选得到的阳性红曲菌转化子连续传5代,旨在筛选稳定遗传的转化子。对红曲菌阳性转化子中的monacolin k产量进行检测,初步证明过表达菌株构建成功。利用阳性转化子的rna,将其反转录为cdna为模板,用hygro
‑
f、hygro
‑
r引物来扩增潮霉素基因。如果目的菌株能扩增出潮霉素基因,而对照菌株未能扩增出潮霉素基因,则证明过表达质粒在红曲菌中表达,进而证明过表达菌株构建成功。
24.hygro
‑
f、hygro
‑
r引物如下:
25.hygro
‑
f:atgaaaaagcctgaactc
26.hygro
‑
r:tctttgccctcggacg。
27.本发明的有益效果
28.本发明成功克隆出紫色红曲菌m1菌株中的comp52338_c2基因,验证其存在,并成功构建了过表达质粒pbargpe
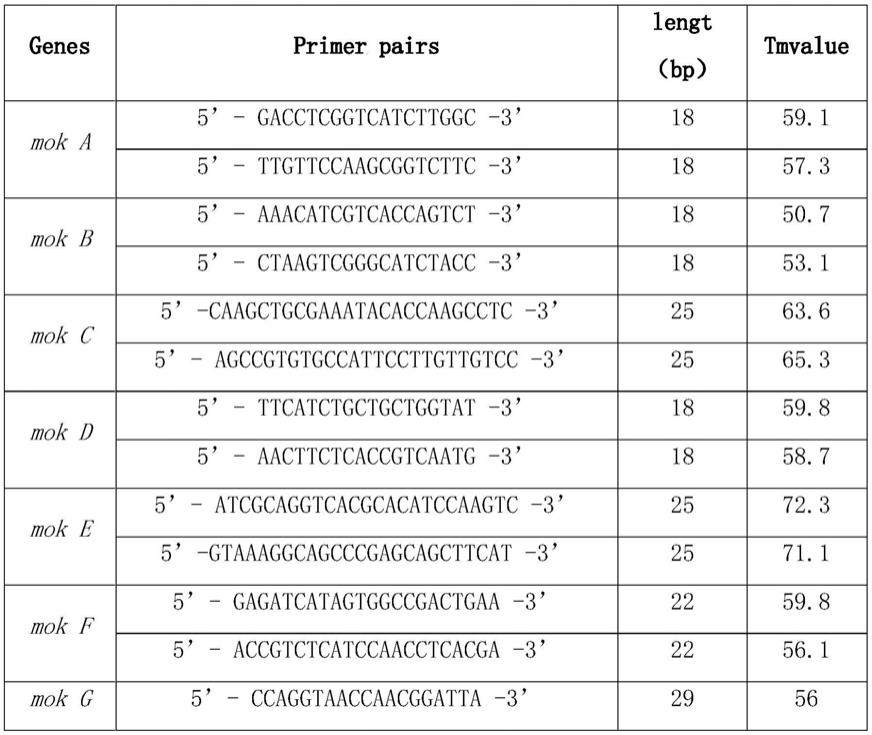
‑
hygro
‑
c2,导入红曲菌m1菌株中,成功构建了过表达工程菌株。结果显示,与野生型m1相比,过表达comp52338_c2菌株第12天monacolin k产量提高了34.64%。
附图说明
29.图1是过表达comp52338_c2菌株和野生型m1菌株的monacolin k产量对比。
30.图2是重组质粒电泳图谱。
31.其中,a是重组质粒pbargpe1
‑
hygro
‑
c2经限制性内切酶消化鉴定为琼脂糖凝胶电泳,m:dl10000 dna标记;lane1:pbargpe1
‑
hygro
‑
c2/quickcutbamhi+quickcut ecorv;lan2:pbargpe1
‑
hygro/quickcut bamhi+quickcut ecorv。
32.c是重组质粒pbargpe1
‑
hygro
‑
c2琼脂糖凝胶电泳,m:超螺旋dna梯状标记;lane1
‑
4:pargpe1
‑
hygro
‑
c2重组质粒;lane5:pbargpe1
‑
hygro
‑
c2重组质粒。
33.e是pcr电泳,m:dl2000 dna标记;lane1:m1株;lane2:c2
‑
6株;c4
‑
9株潮霉素转录组的。
34.图3.潮霉素b对紫色红曲菌m1耐受浓度的筛选。
35.图4过表达菌株monacolin k及其生物量的检测。a.pbargpe1
‑
hygro
‑
c2转化子中monacolin k的含量;c.c2
‑
6菌株的生物量检测;e.c2
‑
6菌株monacolin k的检测;
36.图5为红曲红色素、红曲橙色色素和红曲黄色素的过表达菌株和m1菌株产色素检测结果。图6过表达菌株和m1菌株在不同放大倍数下的扫描电镜照片。a:菌株m1 1000
×
;b:菌株c2
‑
6 10000
×
;c:菌株m1 5000
×
;d:菌株c2
‑
6 5000
×
b。
37.图7
‑
图15分别是mok a,mok b,mok c,mok d,mok e,mok f,mok g,mok h,mok i基因表达量变化。
具体实施方式
38.实施例1
39.本实施例提供一种紫色红曲菌comp52338_c2基因过表达菌株,该菌株可以显著提高monacolin k产量。与野生型m1相比,过表达comp52338_c2菌株第12天monacolin k产量提高了34.64%。具体结果见图1。
40.实施例2
41.本实施例具体提供一种紫色红曲菌comp52338_c2基因过表达菌株的构建方法,并按照下列实验方法进行。
42.具体过程和步骤如下:
43.2.1菌株及培养条件
44.由北京工商大学食品添加剂工程技术中心保存的紫色红曲菌m1(菌种号:cgmcc.3.0568),将m1菌株在固体培养基(g/l)(葡萄糖20g,蛋白胨3g,酵母浸粉4g,麦芽浸粉20g,琼脂20g,kh2po
4 2g,nano
3 2g,mgso4.7h2o 1g)上活化2代,取适量菌液接种到种子培养基(g/l)(葡萄糖30g,豆粕粉15g,蛋白胨10g,甘油70g,kh2po
4 2g,nano
3 2g,mgso4.7h2o 1g)中,30℃、200r/min培养2d,按10%的接种量将种子液接种到发酵养基((g/l):甘油90g,大米粉20g,蛋白胨10g,kh2po
4 2.5g,nano35 g,mgso4.7h2o 1g,znso4.7h2o 2g)中,30℃、150r/min培养2d,再25℃、150r/min培养13d。
45.2.2comp52338基因过表达菌株的构建
46.根据已获得的红曲菌中comp52338_c2的基因序列设计引物,利用primer premier 5.0软件,设计引物。
47.设计引物序列如下:
48.c2
‑
f:ggaagaggtccagagggtgag
49.c2
‑
r:actgtttctgcagcttgcca
50.本实验以pbargpe
‑
hygro(武汉淼灵生物公司)为过表达载体,通过dnaman软件选出该载体上的两个单一酶切位点,通过双酶切将扩增出的comp52338_c2目的基因进行连接,构建过表达pbargpe
‑
hygro
‑
c2重组质粒。将重组质粒转入大肠杆菌dh5α感受态细胞中,并进行重组质粒的提取和验证。
51.2.3过表达质粒转化
52.将红曲霉m1接种于pda培养基平板上,在30℃恒温培养箱中培养4d。在每个培养皿中加入10ml灭菌水,用接种环轻轻刮擦细菌表面以释放孢子,制备孢子悬浮液。将孢子悬液(200μl)涂在置于pda板上的灭菌玻璃纸盘上,涂布至干燥,在30℃下培养30
‑
40h。将生长在玻璃纸盘上的淡粉色菌丝体用接种环刮除,置于单层mira布上,过滤并用50ml硫酸镁溶液洗涤。过滤灭菌后的菌丝体转移到50ml的溶解酶溶液中,在30℃和60rpm下消化2.5
‑
3h,然后通过单层mira布再次过滤。滤液在4℃下以7000转/分离心5分钟,并丢弃上清液。然后用1.2mol l
‑
1山梨醇溶液过滤样品两次(随后离心,并去除上清液)。原生质体在山梨醇溶液中重新悬浮,并保存在冰上以备将来使用。将红曲霉m1活性细胞悬液(100μl)涂在pda平板
上。采用电击转化法,将成功构建的高表达质粒导入红曲原生质体中,根据潮霉素b浓度筛选结果筛选转化子。
53.2.4过表达菌株的筛选和验证
54.将在潮霉素b抗性平板上筛选得到的阳性红曲菌转化子连续传5代,旨在筛选稳定遗传的转化子。对红曲菌阳性转化子中的monacolin k产量进行检测,初步证明过表达菌株构建成功。利用阳性转化子的rna,将其反转录为cdna为模板,用hygro
‑
f、hygro
‑
r引物来扩增潮霉素基因。如果目的菌株能扩增出潮霉素基因,而对照菌株未能扩增出潮霉素基因,则证明过表达质粒在红曲菌中表达,进而证明过表达菌株构建成功。
55.2.5monacolin k的检测
56.发酵液的预处理:取发酵液5ml,加入15ml 75%的甲醇,超声波萃取30min,静置过夜。
57.monacolin k的检测:采用hplc法,色谱柱:inertsilods
‑
3c18(150mm
×
4.6mm
×
5μm),流动相:0.1%磷酸:甲醇=1:3,流速1ml/min,检测器为紫外检测器(pda),检测波长237nm,检测温度30℃,进样量10μl。
58.2.6色价检测
59.发酵液的预处理:取发酵液5ml,加入15ml 70%的乙醇溶液,于恒温水浴锅60℃浸提1h,静置。用分光光度计测定410、448、505nm处吸光值。利用公式:红曲色素色价(u/ml)=吸光值
×
稀释倍数,计算得出。
60.2.7干重测定
61.采用干重法测菌丝体生物量。取5ml发酵液用3层纱布过滤,再用蒸馏水洗涤2
‑
3次,拧干水分,在60℃烘箱中烘干至恒重,即为菌丝体干重。
62.2.8扫描电镜处理
63.培养8d的红曲菌菌体,12000r/min离心5min收集菌体细胞,将细胞重悬(用枪头吹打,吹打时注意不要将细胞吸入枪头造成细胞损失)于2.5%戊二醛溶液(pbs缓冲溶液稀释)固定12h。用0.1m磷酸盐缓冲液(pbs,ph7.2)漂洗细胞两次(两次重悬离心)弃去上清液。依次用不同浓度的乙醇溶液(30%,50%,70%,80%,90%,100%)对细胞进行脱水,每种浓度静置10min,12000r/min离心5min(每种浓度重复两次),弃去上清液。先把菌体重悬于醋酸异戊酯与乙醇(v:v=1:1)中,再重悬与醋酸异戊酯溶液中,以对细胞进行乙醇置换。将细胞重悬于每种溶剂中静置10min,12000r/min离心5min,弃去上清液。加入溶剂六甲基二硅胺(hexamethyl disilazane,hmds),用量没过样品即可,用脱脂棉将离心管口塞上,置于60℃烘箱干燥直至样品成粉末状,留待观察。
64.2.9monacolin k合成相关基因的转录量分析
65.1.菌体的收集及处理
66.分别取不同培养天数的红曲菌发酵液置于2ml离心管中,用无菌水洗涤离心直至上清液不再呈红色,吸除离心管中残余水分。首先进行红曲菌rna的提取,再将其反转录成cdna以用于荧光定量分析。
67.2.引物的设计与合成
68.用olige7.37软件,根据ncbi网站(http://www.ncbi.nlm.nih.gov/nuccore/dq176595.1)的红曲菌合成monacolin k关键基因组序列,选取mok a、mok b、mok c、mok d、
mok e、mok f、mok g、mok h、mok i九段基因组、内参基因gapdh以及c3基因序列,表1为设计得到的rt
‑
qpcr的引物序列,由华大基因科技有限公司制备合成。
69.表1关键基因的引物序列
[0070][0071][0072]
1.荧光定量分析
[0073]
根据天根生化科技(北京)有限公司的superreal荧光定量预混试剂增强版(sybr green)试剂盒说明书设计反应体系并进行扩增。操作方法如下:
[0074]
(1)rt
‑
qpcr反应体系:
[0075]
本研究反应体系如下表2所示。
[0076]
表2荧光定量pcr反应体系
[0077]
组成成分20μl体系
2
×
superreal premix plus10μl正向引物(10μm)0.6μl反向引物(10μm)0.6μlcdna模板1μlrnase
‑
free ddh2o补足至20μl
[0078]
(2)rt
‑
qpcr反应条件:
[0079]
1)95℃for 15min
[0080]
2)95℃for 10sec
[0081]
3)52℃for 20sec
[0082]
4)72℃for 30sec
[0083]
5)goto2,40more times
[0084]
6)melt curve 65℃to 95℃:increment 0.5℃5sec
[0085]
(3)提前设置好反应程序,荧光定量pcr仪中放入样品,开始反应。
[0086]
3结果
[0087]
3.1重组质粒的验证
[0088]
为了验证重组质粒是否构建成功,首先进行双酶切验证,并以原质粒做对照。重组质粒pbargpe1
‑
hygro
‑
c2在经过双酶切后得到两段大小分别在6000bp左右和1700bp左右的清晰条带,与目标条带大小一致(图2a)。再对重组质粒pbargpe1
‑
hygro
‑
c2进行电泳验证,发现长度在7700bp左右,均符合目的基因片段与原质粒长度之和。(图2c)
[0089]
3.2过表达菌株潮霉素基因的pcr验证
[0090]
通过hplc初步筛选出高产monacolin k的转化子后,对c2
‑
6菌株进行潮霉素基因的pcr验证。分别提取红曲菌m1菌株和c2
‑
6菌株的rna,再将其反转录成cdna。以cdna为模板,hygro
‑
f和hygro
‑
r为引物进行扩增潮霉素基因。结果显示,对照菌株红曲菌m1菌株未能扩增出明显条带,而c2
‑
6菌株能扩增出1000bp左右条带,与预期结果一致。(图2e)说明c2
‑
6菌株中成功的导入了过表达质粒,过表达菌株构建成功。
[0091]
3.3重组质粒转化子的筛选
[0092]
选取100μl红曲菌孢子悬液分别涂布于不同浓度梯度的潮霉素b抗性平板上。潮霉素浓度增长的同时,m1菌株的菌落数减少,最终选择潮霉素b的最佳筛选抑制浓度为10μg/ml。在随后的过表达质粒的转化子的筛选过程中,实验发现当潮霉素b浓度为10μg/ml时,加入质粒的红曲菌菌株有菌落生长,而未加入质粒的红曲菌m1菌株则无菌落生长。因此,挑取潮霉素b浓度为10μg/ml抗性板上的菌落,从而成功获得具有潮霉素b抗性的转化子。(图3)将分别获得的11株转化子在具有潮霉素b抗性的平板上传5代,再进行发酵培养。将c2的11株转化子进行发酵培养后,取菌液处理,利用hplc测定monacolin k产量。结果发现在c2的11株菌株中,第6株(编号为c2
‑
6)产量最高,达到131mg/l,(图4a)因此实验选择c2
‑
6作为目标菌株。
[0093]
3.4生物量
[0094]
通过比较c2
‑
6和m1菌株在不同发酵天数下菌丝干重的差异,研究了comp52338_c2基因过表达对红曲霉菌丝生长的影响。结果显示c2
‑
6、c4
‑
9和m1菌株的菌丝体生长趋势相似,差异不显著,见图4c。
[0095]
3.5过表达菌株monacolink产量的检测
[0096]
将c2
‑
6菌株和m1菌株进行摇瓶发酵培养,通过hplc分别检测两种菌株5,8,12,15d时monacolin k产量,结果显示第12d时过表达c2
‑
6菌株与m1菌株相比monacolin k产量提高了34.64%;达到了126.01mg/l,15d时提高了37.87%,产量为194.35mg/l,结果见图4e。
[0097]
3.6过表达菌株红曲色素产量检测
[0098]
通过紫外分光光度计分别检测2,5,8,12,15d的c2
‑
6菌株和m1菌株的红曲红色素、红曲橙色素和红曲黄色素。三种色素的产量变化总体呈现上升趋势,在第15d时产量达到最高。通过对比c2
‑
6和m1菌株发现,c2
‑
6菌株的三种色素产量在发酵后期低于m1菌株。在第12d时,c2
‑
6菌株三种色素的产量与m1菌株相比分别降低了8.23%,8.55%,8.94%。(图5)
[0099]
3.7过表达菌株微观菌体形态的检测
[0100]
扫描电镜观察c2
‑
6和m1菌株菌丝体的形态差异。对比相同倍数下的c2
‑
6菌株和m1菌株的菌丝体,发现c2
‑
6菌株菌丝体凹陷程度、颗粒数及褶皱程度明显高于m1菌株。这说明comp52338_c2基因的过表达可能会改变红曲霉菌丝体的形态,进而影响发酵液中次级代谢产物的产生(图6)。
[0101]
3.8monacolin k生物合成基因转录水平检测
[0102]
利用rt
‑
qpcr技术检测过表达菌株c2
‑
6和野生型菌株中monacolin k生物合成基因簇上mok a
‑
mok i九段基因的表达量。结果如图7所示,mok d基因的表达量在发酵第15天较m1菌株提高了83.91%,在发酵第15天,c2
‑
6菌株的大多数基因的表达量较m1菌株上调,包括mok c,mok d,mok e,mok f和mok h基因等,其中mok c基因表达量提高了73.12%,mok a基因表达量降低了88.28%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1