一种TGase交联改性罗伊氏乳杆菌微胶囊及其制备方法
一种tgase交联改性罗伊氏乳杆菌微胶囊及其制备方法
技术领域
1.本发明属于益生菌微胶囊技术领域,具体涉及一种tgase交联改性罗伊氏乳杆菌微胶囊及其制备方法。
背景技术:
2.罗伊氏乳杆菌(lactobacillus reuteri)作为一种乳酸菌,存在于所有脊椎动物和哺乳动物肠道内,是国际上公认的新型益生乳酸菌,具有很高的理论研究和生产应用价值。但是罗伊氏乳杆菌耐酸性较差、对氧极为敏感、活性保持较困难。在生产加工、贮藏、运输、销售和消费过程中,还会受到其它微生物、储存温度、食品组分(高酸、高盐、添加剂等)和宿主消化系统(胃酸、胆汁)的影响,导致活菌数下降,影响其在肠道中定殖和生理功能的发挥。喷雾干燥微胶囊包埋技术是对乳酸菌的一种保护技术,可在活菌表面形成一层半透性或密封的囊膜,构成微胶囊,并在特定条件下将内部包埋的菌体释放,从而增强乳酸菌对环境的抵抗力,显著提升菌体存活率,使其在肠道中定殖,充分发挥乳酸菌益生功能的作用。
3.水产动物来源的明胶因其形成的凝胶结构松散,强度较弱,对芯材保护能力弱;鱼皮明胶作为一种新型壁材,具有良好的生物相容性、生物降解性和低免疫原性等特性,广泛应用于制备可食性膜和食品表面涂层等方面;相比于其他来源明胶,鱼皮明胶更易发生降解,且具有较低的水蒸气透过率,更适合作为益生菌微胶囊包埋的壁材,有利于于肠道中释放益生菌。由于明胶的乳化性和成膜性,在乳液形成过程中,蛋白质分子在油水界面迅速吸附,形成空间稳定层,喷雾过程中在液滴表面迅速形成热可逆凝胶膜,保护乳酸菌免受高温脱水损伤,并促进微胶囊在此后加工和储存期间的稳定性。谷氨酰胺转氨酶(transglutaminase,tgase) 可催化蛋白质分子中谷氨酰胺残基和赖氨酸残基,形成ε
‑
(γ
‑
谷氨酸)赖氨酸共价键,在分子内或分子间产生交联,会影响明胶薄膜的力学性能如抗拉强度、断裂延伸率,可提高聚合物基体内聚性能,改善阻隔性能和机械阻力如水蒸气透过率等,降低膜的溶解度,提高凝胶强度和成胶性能。。
技术实现要素:
4.针对现有技术中的不足与难题,本发明旨在提供一种tgase交联改性罗伊氏乳杆菌微胶囊及其制备方法。
5.本发明通过以下技术方案予以实现:
6.本发明提供一种罗伊氏乳杆菌,其为罗伊氏乳杆菌(lactobacillus reuteri)ncuf 203.1,于2020年12月10日保存于武汉市中国典型培养物保藏中心,保藏地址为湖北省武汉市武昌区八一路299号武汉大学内,保藏编号为:cctcc no:m 2020890。
7.本发明还提供一种tgase交联改性罗伊氏乳杆菌微胶囊的制备方法,其以罗伊氏乳杆菌浓缩菌液为芯材,以鱼皮明胶与麦芽糊精为壁材,所述壁材经tgase交联改性处理;所述罗伊氏乳杆菌为罗伊氏乳杆菌(lactobacillus reuteri)ncuf 203.1,于2020年12月
10日保存于中国典型培养物保藏中心,保藏地址为湖北省武汉市武昌区八一路299号武汉大学内,保藏编号为:cctcc no:m 2020890。
8.该制备方法具体步骤为:
9.(1)制备壁材溶液:将鱼皮明胶与麦芽糊精按2~5:6~9体积比配置混合溶液,浓度均为10%(w/v),调节溶液ph值为6.0~8.0;
10.(2)tgase交联改性:在步骤(1)制得的溶液中加入tgase,tgase的使用量为10~50 u/g鱼皮明胶,在30~60℃下催化交联改性30~120min,使交联度为4~27%,壁材溶液的乳化性为59.5~64.5m2/g、乳化稳定性为45.52~63.27min,起泡性为115~140%,泡沫稳定性 17.69~32.14%,待反应结束后在100℃的条件下加热5min,进行灭酶;
11.(3)制备改性微胶囊壁材:在经步骤(2)交联改性后的溶液中混合加入大豆卵磷脂和 30~50℃预热的植物油,设置高速分散器转速为10000rpm,将溶液分散2次,每次2min,再设置高压均质机压力为80mpa,均质2次,得到改性微胶囊壁材;
12.(4)制备浓缩菌液:将冷冻保藏的罗伊氏乳杆菌ncuf203.1在mrs平板上划线培养,经过37℃培养48h后,挑单菌落于mrs液体培养基中,并在37℃下培养12h,然后转接到 mrs液体培养基中,培养24h后,通过冷冻高速离心机在4℃、8000rpm下离心5min,弃上清液,以无菌生理盐水洗涤两次,菌体重新悬浮于生理盐水中得到浓缩菌液;
13.(5)喷雾干燥制备微胶囊:将步骤(3)制得的改性微胶囊壁材与步骤(4)制得的浓缩菌液混合均匀,再进行喷雾干燥,喷雾干燥的进风温度为100~140℃、进料流量为6ml/min~12 ml/min和菌壁比为0.2~1;
14.(6)装瓶:干燥结束后,立即将制得的微胶囊收集于无菌密封玻璃瓶中,于4℃储存,经研究表明该微胶囊在4℃下储存时,罗伊氏乳杆菌的死亡速率常数仅为4.0
×
10
‑
4 h
‑1,稳定性较好。
15.进一步地,步骤(2)中交联度为15.45%,壁材溶液的乳化性为64.5m2/g、乳化稳定性为63.27min、起泡性为140%、泡沫稳定性为32.14%。
16.进一步地,步骤(5)中进风温度117℃、进料流量7.8ml/min、菌壁比为0.5,在上述参数条件下,罗伊氏乳杆菌微胶囊包埋活菌数为8.18
±
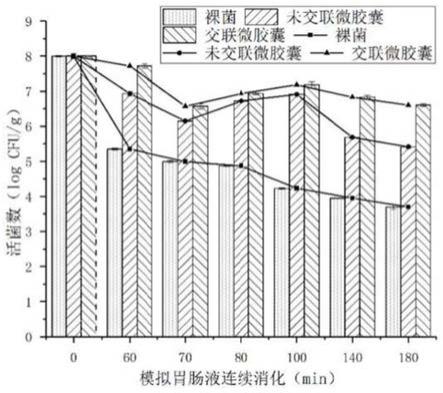
2.50log cfu/g,较未交联的活菌数提高104%。
17.本发明还提供了上述方法制备得到的tgase交联改性罗伊氏乳杆菌微胶囊,胃肠消化性能研究表明,该罗伊氏乳杆菌微胶囊在模拟胃肠消化中活菌存活率较裸菌有显著提高,罗伊氏乳杆菌微胶囊在模拟胃肠消化中活菌数最高为7.18log cfu/g,比裸菌高1.6log cfu/g。
18.与现有技术相比,本发明有益效果包括:
19.(1)本发明以谷氨酰胺转氨酶对鱼皮明胶进行交联改性,提高其成膜性能,复配麦芽糊精制备壁材,采用喷雾干燥法进行壁材包埋罗伊氏乳杆菌微胶囊的制备,为生产提供一种低能耗,活菌存活率高的罗伊氏乳杆菌ncuf 203.1微胶囊产品提供技术指导。
20.(2)本发明采用tgase对鱼皮明胶进行交联改性,使分子内或分子间产生交联,会影响明胶薄膜的力学性能如抗拉强度、断裂延伸率,可提高聚合物基体内聚性能,改善阻隔性能和机械阻力(水蒸气透过率等),降低膜的溶解度,提高凝胶强度和成胶性能。
21.(3)本发明tgase在交联制备壁材时可使游离氨基减少,交联度增加,蛋白质分子
内或分子间的网络结构增强,结构更紧密,不溶的大分子聚合物形成,流动性降低,黏度增加使得气泡向气
‑
液界面扩散,融入明胶分子形成稳定的气泡壁,起泡性增强可以提高乳液的乳化性质和成膜性,减少了芯材向壁材表面的迁移,能更好地包埋芯材从而提高微胶囊囊壁的致密度。
附图说明
22.图1为催化交联时间对tgase交联度的影响;
23.图2为温度和交联度对黏度的影响;
24.图3为交联度对乳化性的影响;
25.图4为交联度对起泡性的影响;
26.图5为罗伊氏乳杆菌的生长曲线;
27.图6为喷雾干燥进风温度对微胶囊活菌数的影响;
28.图7为喷雾干燥进料流量对微胶囊活菌数的影响;
29.图8为喷雾干燥菌壁比对微胶囊活菌数的影响;
30.图9为模拟胃液消化中微胶囊包埋的活菌数随时间的变化;
31.图10为模拟肠液消化中微胶囊包埋的活菌数随时间的变化;
32.图11为模拟胃肠液连续消化过程中微胶囊包埋活菌数随时间的变化;
33.图12为微胶囊加速储存过程中活菌数随时间和温度的变化。
具体实施方式
34.下面结合附图,对本发明作进一步地说明。
35.一种tgase交联改性罗伊氏乳杆菌微胶囊的制备方法,具体包括以下步骤:
36.(1)制备壁材溶液:将鱼皮明胶与麦芽糊精按2~5:6~9体积比配置混合溶液,浓度均为10%(w/v),调节溶液ph值为6.0~8.0;
37.(2)tgase交联改性:在步骤(1)制得的溶液中加入tgase,tgase的使用量为10~50 u/g鱼皮明胶,进行催化交联改性,待反应结束后在100℃的条件下加热5min,进行灭酶;
38.(3)制备改性微胶囊壁材:在经步骤(2)交联改性后的溶液中混合加入大豆卵磷脂和 30~50℃预热的植物油,设置高速分散器转速为10000rpm,将溶液分散2次,每次2min,再设置高压均质机压力为80mpa,均质2次,得到改性微胶囊壁材;
39.(4)制备浓缩菌液:将冷冻保藏的罗伊氏乳杆菌ncuf203.1(菌种保藏号:cctcc no:m 2020890)在mrs平板上划线培养,经过37℃培养48h后,挑单菌落于mrs液体培养基中,并在37℃下培养12h,然后转接到mrs液体培养基中,培养24h后,通过冷冻高速离心机在4℃、8000rpm下离心5min,弃上清液,以无菌生理盐水洗涤两次,菌体重新悬浮于生理盐水中得到浓缩菌液;
40.(5)喷雾干燥制备微胶囊:将步骤(3)制得的改性微胶囊壁材与步骤(4)制得的浓缩菌液混合均匀,再进行喷雾干燥;
41.(6)装瓶:干燥结束后,立即将制得的微胶囊收集于无菌密封玻璃瓶中储存。
42.对步骤(2)tgase交联改性、步骤(5)喷雾干燥制备微胶囊、步骤(6)储存阶段不同参数制作样品,对各项指标进行测定:
43.1、tgase催化的交联度
44.取4ml opa试剂于试管中,加入200μl样品,混合均匀,35℃水浴反应5min后在340 nm下测吸光值。以4ml opa试剂中加入与样品等量的蒸馏水作为空白对照
45.x(%)=(1
‑
a
t
/a0)
×
100
46.式中:a0为交联前壁材溶液的吸光度,a
t
为交联后壁材溶液的吸光度,催化交联时间对 tgase交联度的影响结果如图1所示。
47.2、壁材溶液的黏度
48.取所制备的壁材溶液2ml,用流变仪测定黏度(选用直径为50mm的平板夹具,设定测试间距为1mm,测试温度范围为20~75℃,剪切速率固定为100s
‑1,)测定壁材溶液表观黏度随温度的变化,温度和交联度对黏度的影响如图2所示。
49.3、壁材溶液的乳化性能
50.取10ml壁材溶液于烧杯中,加入0.4ml植物油,用高速分散机在10000rpm条件下分散1min制成乳状液,用移液枪从底部吸取乳状液50μl,立即与3ml 0.1%sds(w)混合,用紫外
‑
可见分光光度计于500nm处测吸光度a0,10min后再测一次a
t
,空白组为3ml 0.1% sds溶液,交联度对乳化性和起泡性的影响如图3和图4所示。
51.乳化性以乳化活力指数eai表示:
[0052][0053]
式中:eai是每克蛋白质的乳化面积(m2/g);n是sds溶液的稀释倍数(100);是体系中油相所占的分数(0.02);c是蛋白质的浓度(0.03g/ml);l是比色池光径(1cm)。
[0054]
乳化稳定性(es)以乳化稳定指数(esi)表示:
[0055]
esi(min)=(a0×
δt)/(a0‑
a
t
)
[0056]
式中:a0是0时刻的吸光值;a
t
是t时刻的吸光值;δt是时间差,本实验为10min。
[0057]
4、罗伊氏乳杆菌的生长曲线
[0058]
以培养时间为横坐标,以罗伊氏乳杆菌数目的对数为纵坐标作图所绘制的曲线称为该菌的生长曲线,罗伊氏乳杆菌的生长曲线如图5所示。
[0059]
5、微胶囊活菌数的测定
[0060]
将不同进风温度、进料流量、菌壁比下进行喷雾干燥后罗伊氏乳杆菌微胶囊粉末,分别准确称取0.05g于4.95ml浓度为0.2m的磷酸盐缓冲液中(ph值为7.0),然后在37℃下保温至微胶囊颗粒全部溶解,最后采用平板计数法测定其中活菌的数量,喷雾干燥进风温度、进料流量、菌壁比对微胶囊活菌数的影响如图6~8所示。
[0061]
6、模拟胃液消化
[0062]
取0.1g微胶囊分散到含9.9ml、37℃预热的模拟胃液的试管中,在37℃、100rpm摇床中孵育,于不同时间段取样,加入碳酸钠溶液调节ph=7.0,终止反应。随后立即加入20ml、 ph=7.0的磷酸盐缓冲液,在37℃、100rpm摇床中孵育至微胶囊充分解聚,涂布平板进行活菌计数,测定其消化情况,模拟胃液消化中微胶囊包埋的活菌数随时间的变化如图9所示。
[0063]
7、模拟肠液消化
[0064]
取0.1g微胶囊分散到含9.9ml、37℃预热的模拟肠液的试管中,在37℃、100rpm摇床中孵育,于不同时间段取样,取消化液涂布平板进行活菌计数,测定其消化情况,模拟肠
液消化中微胶囊包埋的活菌数随时间的变化如图10所示。
[0065]
8、模拟胃肠液连续消化
[0066]
取0.1g微胶囊分散到含9.9ml、37℃预热的模拟胃液的锥形瓶中,于37℃恒温100rpm 摇床中孵育60min后,用0.2m的氢氧化钠溶液调节ph为7.0,快速加入10ml、37℃预热的人工肠液。将此混合溶液在37℃、100rpm条件下继续孵育2h。于不同时间段取样,从锥形瓶中取0.5ml消化液涂布平板进行活菌计数,测定其消化情况,模拟胃肠液连续消化过程中微胶囊包埋活菌数随时间的变化如图11所示。
[0067]
9、微胶囊加速储存
[0068]
微胶囊样品在不同温度条件下储存不同时间,分别采样测定活菌数,同一储存温度条件下罗伊氏乳杆菌冻干样品中活菌数符合一级反应动力学方程:lnn0‑
lnn=kt,其中n0为试验初始活菌数(cfu/ml),n为t时刻活菌数(cfu/ml),k为死亡速率常数(h
‑1),t为取样时间(h)。
[0069]
死亡速率常数k和绝对温度t之间符合arrhenius方程:lnk=
‑
e/rt+lna。其中e
a
为反应的活化能(j/mol),r为理想气体常数(j/(mol
·
k)),t为绝对温度(k)。以lnk对1/t 作图,微胶囊加速储存过程中活菌数随时间和温度的变化如图12所示,得一直线,可以预测 4℃条件保存的死亡速率常数。
[0070]
根据上述性能测试,确定步骤(2)tgase交联改性、步骤(5)喷雾干燥制备微胶囊阶段的各项参数范围,其中,步骤(2)tgase交联改性在30~60℃下催化交联改性30~120min,使交联度为4~27%,壁材溶液的乳化性为59.5~64.5m2/g、乳化稳定性为45.52~63.27min,起泡性为115~140%,泡沫稳定性17.69~32.14%;步骤(5)喷雾干燥的进风温度为100~140℃、进料流量为6ml/min~12ml/min和菌壁比为0.2~1;步骤(6)于4℃储存。
[0071]
下面结合实施例,对本发明进一步说明。
[0072]
实施例1
[0073]
1.罗伊氏乳杆菌微胶囊壁材溶液的制备:按照鱼皮明胶与麦芽糊精溶液(混合比例为3∶7) 混合均匀,调节溶液ph值为7.0。
[0074]
2.tgase交联处理:将谷氨酰胺转氨酶(20u/g鱼皮明胶)加入混合溶液中,40℃水浴 60min。
[0075]
3.灭酶:待反应结束后在100℃的条件下加热5min,进行灭酶。
[0076]
4.壁材溶液的均质:将卵磷脂和40℃预热的植物油加入到先前制备的交联溶液中,设置高速分散器转速为10000rpm,将溶液分散2次,每次2min,设置高压均质机压力为80mpa,均质2次。
[0077]
5.浓缩菌液的制备:将冷冻保藏的罗伊氏乳杆菌,在mrs平板上划线培养,经过37℃培养48h后,挑单菌落于5ml mrs液体培养基中,并在37℃下培养12h,然后转接到100 ml mrs液体培养基中,培养24h后,通过冷冻高速离心机在4℃、8000rpm下离心5min,弃上清液,以无菌生理盐水洗涤两次,菌体重新悬浮于生理盐水中得到浓缩菌液。
[0078]
6.喷雾干燥制备微胶囊:按照一定的菌壁比与浓缩菌液混合均匀,设置进口温度110℃、进料流量9ml/min和菌壁比0.2参数进行喷雾干燥。
[0079]
7.装瓶:干燥结束后,立即将制备得到的微胶囊收集于无菌密封玻璃瓶中,于4℃储存。
[0080]
实施例2
[0081]
1.罗伊氏乳杆菌微胶囊壁材溶液的制备:按照鱼皮明胶与麦芽糊精溶液(混合比例为 3:7)混合均匀,调节溶液ph值为7.0。
[0082]
2.tgase交联处理:将谷氨酰胺转氨酶(20u/g鱼皮明胶)加入混合溶液中,40℃水浴 90min。
[0083]
3.灭酶:待反应结束后在100℃的条件下加热5min,进行灭酶。
[0084]
4.壁材溶液的均质:将卵磷脂和40℃预热的植物油加入到先前制备的交联溶液中,设置高速分散器转速为10000rpm,将溶液分散2次,每次2min,设置高压均质机压力为80mpa,均质2次。
[0085]
5.浓缩菌液的制备:将冷冻保藏的罗伊氏乳杆菌,在mrs平板上划线培养,经过37℃培养48h后,挑单菌落于5ml mrs液体培养基中,并在37℃下培养12h,然后转接到100 ml mrs液体培养基中,培养24h后,通过冷冻高速离心机在4℃、8000rpm下离心5min,弃上清液,以无菌生理盐水洗涤两次,菌体重新悬浮于生理盐水中得到浓缩菌液。
[0086]
6.喷雾干燥制备微胶囊:按照一定的菌壁比与浓缩菌液混合均匀,设置进口温度120℃、进料流量6ml/min和菌壁比0.53参数进行喷雾干燥。
[0087]
7.装瓶:干燥结束后,立即将制备得到的微胶囊收集于无菌密封玻璃瓶中,于4℃储存。
[0088]
实施例3
[0089]
1.罗伊氏乳杆菌微胶囊壁材溶液的制备:按照鱼皮明胶与麦芽糊精溶液(混合比例为 3∶7)混合均匀,调节溶液ph值为7.0。
[0090]
2.tgase交联处理:将谷氨酰胺转氨酶(20u/g鱼皮明胶)加入混合溶液中,40℃水浴 90min。
[0091]
3.灭酶:待反应结束后在100℃的条件下加热5min,进行灭酶。
[0092]
4.壁材溶液的均质:将卵磷脂和40℃预热的植物油加入到先前制备的交联溶液中,设置高速分散器转速为10000rpm,将溶液分散2次,每次2min,设置高压均质机压力为80mpa,均质2次。
[0093]
5.浓缩菌液的制备:将冷冻保藏的罗伊氏乳杆菌,在mrs平板上划线培养,经过37℃培养48h后,挑单菌落于5ml mrs液体培养基中,并在37℃下培养12h,然后转接到100 ml mrs液体培养基中,培养24h后,通过冷冻高速离心机在4℃、8000rpm下离心5min,弃上清液,以无菌生理盐水洗涤两次,菌体重新悬浮于生理盐水中得到浓缩菌液。
[0094]
6.喷雾干燥制备微胶囊:按照一定的菌壁比与浓缩菌液混合均匀,设置进口温度130℃、进料流量12ml/min和菌壁比1参数进行喷雾干燥。
[0095]
7.装瓶:干燥结束后,立即将制备得到的微胶囊收集于无菌密封玻璃瓶中,于4℃储存。
[0096]
以上所述仅表达了本发明的优选实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形、改进及替代,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1