基于DNA功能化纳米材料的电化学传感器及构建方法
基于dna功能化纳米材料的电化学传感器及构建方法
技术领域
1.本发明属于甲基化检测技术领域,尤其涉及一种基于dna功能化纳米材料的电化学传感器及构建方法。
背景技术:
2.目前,常用的检测甲基化的方法主要有限制性内切酶技术检测法,亚硫酸氢盐测序法,和高分辨率熔解曲线法。这些方法操作繁琐、检测时间长且费用高。
3.通过上述分析,现有技术存在的问题及缺陷为:目前甲基化检测方法操作繁琐、检测时间长且费用高。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种基于dna功能化纳米材料的电化学传感器及构建方法。
5.本发明是这样实现的,一种基于dna功能化纳米材料检测甲基化的电化学传感器,所述基于dna功能化纳米材料检测甲基化的电化学传感器由dna功能化纳米材料和g
‑
四链体/hemin模拟酶构建而成。
6.本发明的传感器的构建过程如下图,该生物传感器根据电流信号的变化对甲基化进行定量分析,具有灵敏度高、选择性好、制备简单等优点。
7.本发明的另一目的在于提供一种基于dna功能化纳米材料检测甲基化的电化学传感器构建方法包括:
8.由dna功能化纳米材料和g
‑
四链体/hemin模拟酶生物辅助信号放大方法构建得到基于dna功能化纳米材料检测甲基化的电化学传感器。
9.进一步,所述基于dna功能化纳米材料检测甲基化的电化学传感器的构建方法包括:
10.步骤一,用三条巯基修饰的单链dna与特定dna序列合成dna四面体,通过au
‑
s键将dna四面体固定在金电极表面,进行传感界面探针的高效固定;
11.步骤二,利用重亚硫酸氢盐同时处理含有5
‑
mc目标序列和不含5
‑
mc的核酸序列,令含有5
‑
mc目标序列与线性锁式探针发生环化反应;
12.步骤三,以环化后的核酸序列为模板,dna四面体顶点延伸的单链dna 探针为引物引发rca扩增反应,生成一条富含g碱基的dna长链,与氯化血红素结合后,形成g
‑
四链体/hemin dnazyme模拟酶。
13.步骤四,利用所述g
‑
四链体/hemin dnazyme模拟酶在h2o2存在下催化放大亚甲基蓝产生的电流响应信号。
14.进一步,所述基于dna功能化纳米材料检测甲基化的电化学传感器的构建方法的电化学dna生物传感器构建及分析检测特定序列dna甲基化包括:(1) dna四面体的合成;(2)rca扩增反应;(3)电化学dna生物传感器的检测。
15.进一步,所述电化学dna生物传感器构建及分析检测特定序列dna甲基化包括:具体包括:
16.第一步,利用三条巯基修饰的单链dna与特定dna序列经给一步热变性法合成dna四面体;
17.第二步,dna甲基化目标序列首先用重亚硫酸氢钠处理,胞嘧啶转化为尿嘧啶,但5
‑
mc保持不变;
18.第三步,将mb作为电化学指示剂,通过mb与碱基的特异性相互作用可以吸附到寡核苷酸上,并作为电子介体;在电化学检测过程中,作为良好的电子介体mb产生dpv电化学信号;
19.第四步,将hemin结合到g
‑
四链体获得dnazyme的hemin/g
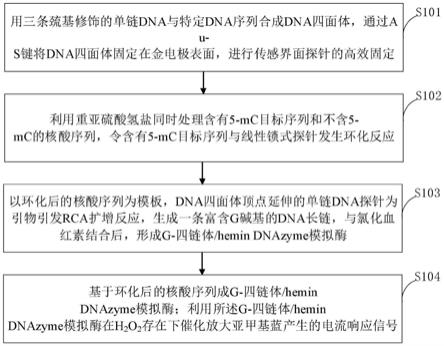
‑
四链体结构,该dnazyme在h2o2催化下放大mb电流响应信号。
20.进一步,所述第二步dna序列间的差异就可以用来检测dna甲基化和 dna未甲基化,线性锁式探针含有两个不同区域,两个互补序列位于5'和3'末端,中间部分为启动rca的特殊区域;当线性锁式探针的两个末端与dna甲基化序列完全杂交时,5'和3'末端紧密接近,在taq dna连接酶存在下产生环状探针。
21.进一步,将dna四面体的单链探针作为信号引物与环化模板结合,在dna 聚合酶存在下引发rca反应,形成倍数增长的富含g碱基重复核酸序列;在 rca反应过程中,没有成环的锁式探针以及过量pcr产物可能会产生检测干扰,用外切核酸酶i和外切核酸酶iii混合液进行酶切反应,有效地除去未连接的锁式探针和其他的pcr产物。
22.进一步,所述第四步通过监测dpv电流的变化,能够间接确定样品中dna 甲基化序列的浓度。
23.本发明的另一目的在于提供一种所述基于dna功能化纳米材料检测甲基化的电化学传感器在甲基化dna的定量分析中的应用。
24.本发明的另一目的在于提供一种试剂盒,所述试剂盒包含所述基于dna功能化纳米材料检测甲基化的电化学传感器。
25.本发明所用的所有dna序列均为现有的,由上海生工生物工程有限公司购买。
26.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明主要利用dna功能化纳米材料和g
‑
四链体/hemin模拟酶生物辅助信号放大技术,构建生物传感器并用于甲基化dna的定量分析。利用本发明的电化学传感器进行定量分析,灵敏度高,信号响应快、特异性高、成本低廉、易于临床实验室推广。
附图说明
27.图1是本发明实施例提供的基于dna功能化纳米材料检测甲基化的电化学传感器构建方法流程图。
28.图2是本发明实施例提供的基于循环伏安法(a)和交流阻抗法(b)电化学生物传感器构建过程表征图。
29.其中,(a)和(b)中的a表示裸ge;,b表示tep/ge,c表示rca/ge,d 表示嵌入hemin后的rca/ge。
30.图3(a)是本发明实施例提供的信号放大策略循环伏安法表征:曲线a,嵌入hemin
后的rca/ge;曲线b,存在hemin和mb分子的rca/ge;曲线c,检测液中含有2mm h2o2。
31.图3(b)是本发明实施例提供的信号放大策略差分伏安脉冲法表征:曲线a,仅存在mb分子的rca/ge;曲线b,hemin和mb分子同时加入后的 rca/ge。
32.图4(a)是本发明实施例提供的10nm的甲基化dna和10nm的未甲基化dna dpv响应图。
33.图4(b)是本发明实施例提供的不同浓度的甲基化dna和未甲基化dnadpv响应图。
34.图5是本发明实施例提供的电化学响应信号与甲基化dna浓度关系曲线图;
35.其中,图5(a)电化学生物传感器对不同浓度的dna甲基化序列的电化学响应图(曲线a
‑
g,甲基化dna的浓度是10
‑8m、10
‑9m、10
‑
10
m、10
‑
11
m、 10
‑
12
m、10
‑
13
m、10
‑
14
m、10
‑
15
m、10
‑
16
m、10
‑
17
m)。
36.图5(b)电化学信号与甲基化dna浓度关系校准曲线。
37.图6是本发明实施例提供的电化学dna生物传感器构建及分析检测特定序列dna甲基化示意图。
具体实施方式
38.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
39.针对现有技术存在的问题,本发明提供了一种基于dna功能化纳米材料检测甲基化的电化学传感器,下面结合附图对本发明作详细的描述。
40.本发明实施例提供的基于dna功能化纳米材料检测甲基化的电化学传感器由dna功能化纳米材料和g
‑
四链体/hemin模拟酶生物构建而成。
41.本发明实施例提供的基于dna功能化纳米材料检测甲基化的电化学传感器构建方法包括:
42.由dna功能化纳米材料和g
‑
四链体/hemin模拟酶生物辅助信号放大方法构建得到基于dna功能化纳米材料检测甲基化的电化学传感器。
43.如图1所示,本发明实施例提供的基于dna功能化纳米材料检测甲基化的电化学传感器构建方法包括:
44.s101,用三条巯基修饰的单链dna与特定dna序列合成dna四面体,通过au
‑
s键将dna四面体固定在金电极表面,进行传感界面探针的高效固定;
45.s102,利用重亚硫酸氢盐同时处理含有5
‑
mc目标序列和不含5
‑
mc的核酸序列,令含有5
‑
mc目标序列与线性锁式探针发生环化反应;
46.s103,以环化后的核酸序列为模板,dna四面体顶点延伸的单链dna探针为引物引发rca扩增反应,生成一条富含g碱基的dna长链,与氯化血红素结合后,形成g
‑
四链体/hemin dnazyme模拟酶;
47.s104,基于环化后的核酸序列成g
‑
四链体/hemin dnazyme模拟酶;利用所述g
‑
四链体/hemin dnazyme模拟酶在h2o2存在下催化放大亚甲基蓝产生的电流响应信号。
48.如图6所示,本发明提供的电化学dna生物传感器构建及分析检测特定序列dna甲基化具体包括:
49.(1)dna四面体的合成;(2)rca扩增反应;(3)电化学dna生物传感器的检测。第一步,利用三条巯基修饰的单链dna与特定dna序列经给一步热变性法合成dna四面体。这种纳米结构通过“金字塔”底部的三个硫醇很容易固定在金电极表面,并且单链探针dna能够有序的、定向的屹立在四面体结构的顶端,减小了探针在电极上的表面效应和方位效应。第二步,dna 甲基化目标序列首先用重亚硫酸氢钠处理,胞嘧啶转化为尿嘧啶,但5
‑
mc保持不变。所以,dna序列间的差异就可以用来检测dna甲基化和dna未甲基化。线性锁式探针含有两个不同区域,两个互补序列位于5'和3'末端,中间部分为启动rca的特殊区域。当线性锁式探针的两个末端与dna甲基化序列完全杂交时,5'和3'末端紧密接近,在taq dna连接酶存在下产生环状探针。然后,将dna四面体的单链探针作为信号引物与环化模板结合,在dna聚合酶存在下引发rca反应,形成倍数增长的富含g碱基重复核酸序列。在 rca反应过程中,没有成环的锁式探针以及过量pcr产物可能会产生检测干扰,所以用外切核酸酶i和外切核酸酶iii混合液进行酶切反应,有效地除去未连接的锁式探针和其他的pcr产物。第三步,将mb作为电化学指示剂,通过mb与碱基的特异性相互作用可以大量吸附到寡核苷酸上,并作为电子介体。在电化学检测过程中,作为良好的电子介体mb可以产生dpv电化学信号。最后,将hemin结合到g
‑
四链体获得dnazyme的hemin/g
‑
四链体结构,该dnazyme可以在h2o2催化下放大mb电流响应信号。通过监测dpv电流的变化,能够间接确定样品中dna甲基化序列的浓度。
50.下面结合具体实施例对本发明的技术方案做进一步说明。
51.实施例:
52.利用三条巯基修饰的单链dna与特定dna序列合成dna四面体,通过 au
‑
s键将dna四面体固定在金电极表面,实现传感界面探针的高效固定。重亚硫酸氢盐同时处理含有5
‑
mc目标序列和不含5
‑
mc的核酸序列后,仅含有 5
‑
mc目标序列与线性锁式探针发生环化反应。以环化后的核酸序列为模板, dna四面体顶点延伸的单链dna探针为引物引发rca扩增反应,生成一条富含g碱基的dna长链,与氯化血红素(hemin)结合后,形成g
‑
四链体/hemindnazyme模拟酶,该酶具有辣根过氧化物酶活性,在h2o2存在下催化放大亚甲基蓝(methylene blue,mb)产生的电流响应信号。
53.在最优实验条件下,该电化学生物传感器dpv电流信号与5
‑
mc目标序列浓度的对数呈现良好的线性相关性,线性范围为10
‑
15
m到10
‑8m,检测限为0.1 fm。
54.本发明电化学生物传感器具有灵敏度高、选择性好、制备简单等优点,并成功应用于甲基化dna回收实验检测。
55.下面结合具实验数据对本发明的积极效果作进一步描述。
56.图2基于循环伏安法(a)和交流阻抗法(b)电化学生物传感器构建过程表征:(a)裸ge;(b)tep/ge;(c)rca/ge;(d)嵌入hemin后的rca/ge
57.图3(a)信号放大策略循环伏安法表征:曲线a,嵌入hemin后的 rca/ge;曲线b,存在hemin和mb分子的rca/ge;曲线c,检测液中含有2mm h2o2;
58.图3(b)信号放大策略差分伏安脉冲法表征:曲线a,仅存在mb分子的rca/ge;曲线b,hemin和mb分子同时加入后的rca/ge。
59.图4(a)10nm的甲基化dna和10nm的未甲基化dna dpv响应;图4(b)不同浓度的甲基化dna和未甲基化dna dpv响应
60.图5电化学响应信号与甲基化dna浓度关系曲线:图5(a)电化学生物传感器对不同浓度的dna甲基化序列的电化学响应(曲线a
‑
g,甲基化dna的浓度是10
‑8m、10
‑9m、10
‑
10
m、10
‑
11
m、10
‑
12
m、10
‑
13
m、10
‑
14
m、10
‑
15
m、10
‑
16
m、10
‑
17
m);图5(b)电化学信号与甲基化dna浓度关系校准曲线。
61.表1本发明检测甲基化dna方法与部分文献研究报道的方法进行比较
[0062][0063][0064]
参考文献:
[0065]
[1]dadmehr,m.hosseini,m.hosseinkhani,s.ganjali,m.r.khoobi,m.behzadi,h.hamedani,m.sheikhnejad,r.dnamethylationdetectionbyanovelfluorimetricnanobiosensorforearlycancerdiagnosis.biosens.bioelectron.,2014,60,35
‑
44.
[0066]
[2]cao,a.p.zhang,c.y.sensitiveandlabel
‑
freednamethylationdetectionbyligation
‑
mediatedhyperbranchedrollingcircleamplification.anal.chem.,2012,84(12),6199
‑
6205.
[0067]
[3]zhu,b.c.booth,m.a.shepherd,p.sheppard,a.travas
‑
sejdic,j.distinguishingcytosinemethylationusingelectrochemical,label
‑
freedetectionofdnahybridizationandds
‑
targets.biosens.bioelectron.,2015,64,74
‑
80.
[0068]
[4]geng,y.wu,j.shao,l.j.yan,f.ju,h.x.sensitivecolorimetricbiosensingformethylationanalysisofp16/cdkn2promoterwithhyperbranchedrollingcircleamplification.biosens.bioelectron.,2014,61,593
‑
597.
[0069]
[5]xu,y.z.gao,x.y.zhang,l.chen,d.p.dai,z.zou,x.y.simultaneousdetectionofdoublegene
‑
specificmethylationlocibasedonhairpinprobestaggedwithelectrochemicalquantumdotsbarcodes.j.electroanalchem.,2016,781,356
‑
362.
[0070]
[6]hu,j.zhang,c.y.singlebaseextensionreaction
‑
basedsurfaceenhancedramanspectroscopyfordnamethylationassay.biosens.bioelectron.,
2012,31,451
‑
457.
[0071]
[7]yin,h.s.sun,b.zhou,y.l.wang,m.xu,z.n.fu,z.l.ai,s.y.anewstrategyformethylateddnadetectionbasedonphotoelectrochemicalimmunosensorusingbi2s3nanorods,methylbondingdomainproteinandanti
‑
histagantibody.biosens.bioelectron.,2014,51,103
‑
108.
[0072]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1