一株葡萄牙柠檬酸杆菌及其在去除氯霉素和溶磷解钾中的应用
1.本发明属于有机污染物微生物修复技术领域,特别涉及一株葡萄牙柠檬酸杆菌及其在去除氯霉素和溶磷解钾中的应用。
背景技术:
2.氯霉素(chloramphenicol,cap)是第一个可人工合成的抗菌抗生素是一类一类广谱抗生素,对革兰氏阳性、阴性菌均有抑制作用,尤其对伤寒、副伤寒杆菌作用更强,其作用机理在于抑制菌体蛋白的合成。因具有良好的抗菌作用和药物代谢动力学特性,而被广泛应用于人类以及动物疾病治疗,特别对各类家禽、家畜、水产品的各种传染性疾病的控制和治疗起重要作用。
3.近年来氯霉素的不合理使用导致土壤中药物残留,以及畜禽抗生素蓄积中毒,对消费者健康构成潜在的威胁。此外,由于抗生素药物的不完全代谢性,其原形化合物或代谢产物通过粪、尿等排泄物进入环境,并且在环境中往往能维持数年活性,对微生物、部分动植物产生不同程度的影响。因此,降低环境中氯霉素的残留量对人体健康、土壤肥效、植物生长、环境微生物多样性和生态安全都具有重要的意义。
4.氯霉素性质稳定,难降解,用单一的物理或化学方法难以将其去除。目前常用的降解氯霉素的方法主要是fenton高级氧化法、光催化还原降解法、微波辐射等物理或化学的方法,但存在处理成本高,反应条件苛刻,能量消耗大,容易形成二次污染等缺点,不容易广泛推广。微生物降解作为抗生素在环境土壤中降解的重要途经,具有处理成本低,环境友好,操作简单等优点。利用环境中的原始菌源筛选出高效氯霉素降解菌是降低甚至是消除环境中氯霉素污染的重要手段,极具广阔的发展前景。
技术实现要素:
5.本发明的首要目的在于克服现有技术的缺点与不足,提供一株葡萄牙柠檬酸杆菌。
6.本发明的另一目的在于提供所述葡萄牙柠檬酸杆菌在去除土壤和/或水体中的氯霉素(chloramphenicol,cap)方面的应用。
7.本发明的又一目的在于提供所述葡萄牙柠檬酸杆菌在溶解不可溶性磷和/或钾化合物方面的应用。
8.本发明的再一目的在于提供所述葡萄牙柠檬酸杆菌在增加土壤中有效磷和/或速效钾方面的应用。
9.本发明的目的通过下述技术方案实现:
10.一株葡萄牙柠檬酸杆菌,名称为葡萄牙柠檬酸杆菌(citrobacter portucalensis)szw2,保藏编号为gdmcc no:61695,该菌株于2021年5月27日保藏于广州市先烈中路100号大院59号楼5楼的广东省微生物菌种保藏中心。
11.所述的葡萄牙柠檬酸杆菌的16s rdna序列由1430个碱基(bp)组成,其核苷酸序列如seq id no.1所示。
12.一种培养所述葡萄牙柠檬酸杆菌的方法,具体步骤为:将所述的葡萄牙柠檬酸杆菌接种于培养基中、于28℃~37℃条件下进行培养。
13.所述的培养基为lb培养基,msm培养基,含氯霉素(cap)的msm培养基,含氯霉素和蛋白胨的msm培养基,nbrip培养基和钾细菌培养基中的一种;优选为lb培养基。
14.所述的含氯霉素的msm培养基中氯霉素的浓度为10mg
·
l
‑1以下;优选为2.5~10mg
·
l
‑1;更优选为10mg
·
l
‑1。
15.所述的含氯霉素和蛋白胨的msm培养基中氯霉素的浓度为10mg
·
l
‑1以下(优选为2.5~10mg
·
l
‑1;更优选为10mg
·
l
‑1),蛋白胨的浓度为10g
·
l
‑1。
16.所述的nbrip培养基的配方如下:葡萄糖10g
·
l
‑1,ca3(po4)
2 5.0g
·
l
‑1,mgcl
2 5g
·
l
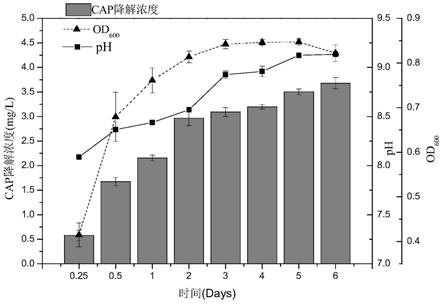
‑1,mgso4·
7h2o 0.25g
·
l
‑1,kcl 0.2g
·
l
‑1,(nh4)2so
4 0.1g
·
l
‑1,调ph至7.2。
17.所述的钾细菌培养基的配方如下:钾长石(k2o
·
al2o3·
6sio2)2.5g
·
l
‑1,na2hpo
4 0.2g
·
l
‑1,mgso4·
7h2o 0.02g
·
l
‑1,nacl 0.2g
·
l
‑1,caco
3 5.0g
·
l
‑1,caso4·
2h2o 0.1g
·
l
‑1,葡萄糖10g
·
l
‑1,ph调至6.8~7.0。
18.所述的培养为在摇床中进行培养,其转速为125~150r
·
min
‑1。
19.所述的培养的温度优选为28~30℃;更优选为30℃。
20.所述的培养的时间为18~48h;优选为18~24h。
21.一种葡萄牙柠檬酸杆菌培养物,将上述葡萄牙柠檬酸杆菌接种于培养基中,于28℃~37℃条件下培养获得。
22.所述的培养基为lb培养基、msm培养基和含蛋白胨的msm培养基中的一种;更优选为lb培养基。
23.所述的含蛋白胨的msm培养基中蛋白胨的浓度优选为10g
·
l
‑1。
24.所述的培养为在摇床中进行培养,其转速为125~150r
·
min
‑1。
25.所述的培养的温度优选为28~30℃;更优选为30℃。
26.所述的培养的时间为18~48h;优选为18~24h。
27.所述的葡萄牙柠檬酸杆菌在去除或降低环境中氯霉素(cap)方面的应用。
28.所述的环境包括土壤环境和水体环境。
29.所述的葡萄牙柠檬酸杆菌在去除或降低环境中氯霉素(cap)方面的应用,为将所述的葡萄牙柠檬酸杆菌加入到含有氯霉素的土壤和/或水体环境中,该菌株可以耐受氯霉素生长,能够对土壤或水体中的氯霉素进行消除。
30.所述的含有氯霉素的水体中的氯霉素的浓度为10mg
·
l
‑1以下。
31.所述的去除的时间为0.25天以上;优选为6天以上。
32.所述的葡萄牙柠檬酸杆菌和/或葡萄牙柠檬酸杆菌培养物在促进植物生长方面的应用。
33.所述的葡萄牙柠檬酸杆菌和葡萄牙柠檬酸杆菌培养物中的至少一种在溶解不可溶性磷和/或钾化合物方面的应用。
34.所述的葡萄牙柠檬酸杆菌和葡萄牙柠檬酸杆菌培养物中的至少一种在溶解不可溶性磷和/或钾化合物方面的应用,为将所述的葡萄牙柠檬酸杆菌接种到含有不可溶性磷
和/或钾化合物的培养基中,于28℃~37℃条件下进行培养,该葡萄牙柠檬酸杆菌能够降低体系ph使不可溶性磷和/或钾化合物溶解;或将所述的葡萄牙柠檬酸杆菌培养物加入到含有不可溶性磷和/或钾化合物的培养基中,使不可溶性磷和/或钾化合物溶解。
35.所述的不可溶性磷化合物包括含磷矿物;优选为磷酸三钙(ca3(po4)2)。
36.所述的含有不可溶性磷化合物的培养基优选为nbrip培养基,其配方如下:葡萄糖10g
·
l
‑1,ca3(po4)
2 5.0g
·
l
‑1,mgcl
2 5g
·
l
‑1,mgso4·
7h2o 0.25g
·
l
‑1,kcl 0.2g
·
l
‑1,(nh4)2so
4 0.1g
·
l
‑1,ph 7.2。
37.所述的不可溶性钾化合物包括含钾矿物;优选为钾长石(k2o
·
al2o3·
6sio2)。
38.所述的含有不可溶性钾化合物的培养基优选为钾细菌培养基,其配方如下:钾长石2.5g
·
l
‑1,na2hpo
4 0.2g
·
l
‑1,mgso4·
7h2o 0.02g
·
l
‑1,nacl 0.2g
·
l
‑1,caco
3 5.0g
·
l
‑1,caso4·
2h2o 0.1g
·
l
‑1,葡萄糖10g
·
l
‑1,ph调至6.8~7.0。
39.所述的葡萄牙柠檬酸杆菌的接种量为体积百分比1~5%;优选为体积百分比2%。
40.所述的培养的温度优选为28~30℃。
41.所述的培养的时间为18h以上;优选为6d以上。
42.所述的葡萄牙柠檬酸杆菌和葡萄牙柠檬酸杆菌培养物中的至少一种在增加土壤中有效磷和/或速效钾(有效钾)方面的应用。
43.所述的葡萄牙柠檬酸杆菌和葡萄牙柠檬酸杆菌培养物中的至少一种在增加土壤中有效磷和/或速效钾方面的应用,为将葡萄牙柠檬酸杆菌加入到土壤中,该葡萄牙柠檬酸杆菌能够降低体系ph,从而溶解土壤中不可溶性的磷和/或钾化合物,以提高土壤中有效磷和/或速效钾含量(进而促进植物生长);或将葡萄牙柠檬酸杆菌培养物加入到土壤中,使土壤中不可溶性的磷和/或钾化合物溶解,以提高土壤中有效磷和/或速效钾含量(进而促进植物生长)。
44.所述的不可溶性磷化合物包括含磷矿物;优选为磷酸三钙(ca3(po4)2)。
45.所述的不可溶性钾化合物包括含钾矿物;优选为钾长石(k2o
·
al2o3·
6sio2)。
46.一种用于溶解不可溶性磷化合物、溶解不可溶性钾化合物、和/或用于去除或降低环境中氯霉素的生物菌剂,含有上述葡萄牙柠檬酸杆菌。
47.所述的环境包括土壤环境和水体环境。
48.本发明中的葡萄牙柠檬酸杆菌szw2在lb平板上生长18~20h后,菌斑呈圆形,边缘呈半透明状,中间隆起呈米黄色;在37℃培养18h后,菌落直径约1~2mm。可在氯霉素浓度为10mg
·
l
‑1的含有10g
·
l
‑1蛋白胨的无机盐液体培养基(msm)中生长良好。
49.本发明相对于现有技术具有如下的优点及效果:
50.(1)本发明中的葡萄牙柠檬酸杆菌szw2可通过共代谢方式对氯霉素进行去除,将菌株szw2接种于氯霉素浓度为10mg
·
l
‑1的含有10g
·
l
‑1蛋白胨的无机盐液体培养基中,30℃,150r
·
min
‑1震荡培养0、0.25、0.5、1、2、3、4、5和6天(d),氯霉素去除效率分别为0,5.79,16.73,21.55,29.66,30.95,31.98,35.04和36.80%,说明菌株szw2具有耐受氯霉素生长和去除氯霉素的性能,可用于土壤和水体中低浓度的氯霉素的去除,以去除或降低氯霉素在环境中的残留。
51.(2)本发明中的葡萄牙柠檬酸杆菌szw2可以分泌有机酸类物质降低体系中ph,从而溶解不可溶性磷和钾类物质,将菌株szw2接种在nbrip或者解钾细菌培养基中震荡培养
6d后测定溶液中有效磷和钾含量,可以看到:加菌szw2溶液中有效磷和钾含量为251.41和7.10mg
·
l
‑1,而空白不加菌溶液中磷和钾含量为4.6和4.7mg
·
l
‑1;其中溶磷量显著高于对照不加菌,而解钾含量较低,说明该菌株szw2可溶解不可溶的磷和钾化合物,具有提高土壤有效磷和钾含量的潜能,可用在促植物生长方面。
附图说明
52.图1是菌株szw2的菌落形态图(培养皿直径9cm)。
53.图2是菌株szw2的系统发育树图。
54.图3是菌株szw2在含10g
·
l
‑1蛋白胨msm培养基中对氯霉素的降解浓度以及菌株生长和ph变化图。
55.图4是菌株szw2的溶磷解钾定量测定结果图;其中,a为有效磷的定量测定结果;b为速效钾的定量测定结果。
具体实施方式
56.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
57.实施例1菌株szw2的筛选、分离纯化以及鉴定
58.一、氯霉素降解菌株szw2筛选方法
59.1.材料准备
60.菌株筛选样品来源:从广东省清远连州市龙坪镇养猪场旁干涸水渠中挖掘得到一条蚯蚓,蚯蚓及周围土样用采样袋密封,4℃带回实验室后立即解刨获得肠道内容物。
61.lb培养基:蛋白胨10.0g,酵母提取粉5.0g,nacl 10.0g,ph 7.0~7.2,蒸馏水定容至1l,固体培养基另加18.0g琼脂粉。121℃灭菌15min。
62.无机盐培养基(msm):将5ml磷酸缓冲溶液(kh2po
4 8.5g
·
l
‑1、k2hpo4·
h2o 21.75g
·
l
‑1、na2hpo4·
12h2o 33.4g
·
l
‑1、nh
4 cl 5.0g
·
l
‑1),3.0ml 22.5g
·
l
‑1的mgso4溶液(mgso4·
7h2o 46.125g
·
l
‑1),1.0ml 0.25g
·
l
‑1的fecl3溶液(fecl3·
6h2o 0.42g
·
l
‑1),1.0ml 36.4g
·
l
‑1的cacl2溶液(cacl2·
2h2o 48.22g
·
l
‑1),1.0ml微量元素溶液(含39.9mg
·
l
‑1mnso4·
h2o,42.8mg
·
l
‑1znso4·
h2o,34.7mg
·
l
‑1(nh4)6mo7o
24
·
4h2o)混匀,调ph至7.0~7.2,用纯水定容至1l,121℃灭菌15min。
63.含有10g
·
l
‑1蛋白胨的msm培养基:胰蛋白胨10.0g加入上述msm培养基溶液中,调ph至7.0~7.2,用纯水定容至1l,121℃灭菌15min。
64.2.实验仪器与设备
65.立式压力蒸汽灭菌锅(bl
‑
50a,上海静科实业有限公司)、便携式ph计(phb
‑
4,上海精密科学有限公司)、离心机(centrifuge 5810r)、电热烘箱(dgg
‑
9070a,上海森信实验仪器有限公司)、数显恒温水浴锅(hh系列,常州国宇仪器制造有限公司)、冰箱(rcd
‑
205ag7,海信电器)、生化培养箱(pyx
‑
208s
‑
a,科力仪器)、超净工作台(sw
‑
cj
‑
1f,苏净安泰空气技术有限公司)、涡旋混合器(xw
‑
80a,上海精科实业有限公司)、mycycler pcr(美国bio
‑
rad
公司)、电泳仪(dyy
‑
6c,北京六一仪器厂)、nano drop核酸蛋白定量检测仪(德国thermo)、凝胶成像系统(美国bio
‑
rad公司)、落地恒温振荡器(hzq
‑
211c)。
66.3.氯霉素降解菌株富集筛选及分离纯化
67.(1)菌株的分离与纯化
68.从广东省清远连州市龙坪镇养猪场旁干涸水渠中挖掘得到一条蚯蚓,带回实验室后马上解刨获得肠道内容物。称取内容物0.2g,加至10ml含0.5mg
·
l
‑1氯霉素(cap)的含有10g
·
l
‑1蛋白胨的msm培养基中驯化培养,驯化2d后以2%(v/v)的接种量转接至含1mg
·
l
‑1cap的含有10g
·
l
‑1蛋白胨的msm培养基驯化,然后依次2%(v/v)转接至cap浓度为2.5、5和10mg
·
l
‑1cap的含有10g
·
l
‑1蛋白胨的msm培养基中分别驯化3d。驯化筛选后,将菌液用培养基稀释至107倍,取稀释液0.2ml涂布于lb固体培养基,30℃培养至菌落形成,再将长出来的单菌落挑选出来,分离并纯化。
69.(2)菌株筛选
70.将步骤(1)中分离纯化得到的菌株接种到lb液体培养基中进行扩大培养20~24h。活化后按2%(v/v)的比例加至含有10mg
·
l
‑1cap的含有10g
·
l
‑1蛋白胨的msm培养基中,150r
·
min
‑
1 30℃避光培养,6天后收集菌液,测定cap浓度。其中测定方法如下:菌液8000r
·
min
‑1离心1min,收集上清过0.22μm有机滤膜,滤液用高效液相色谱方法(hplc)进行测定,筛选得到具有cap降解能力菌株。其中,hplc条件为:液相色谱柱为cnw c18
‑
wp(4.6
×
250mm,5μm),a相为甲醇,b相为乙腈,体积比v
(a)
:v
(b)
=50:50,流速为0.8ml
·
min
‑1,柱温30℃;进样量20μl;紫外检测器检测波长278nm。筛选得到一株能降解cap的菌株(hplc测定cap浓度后,cap浓度显著下降,且空白对照组(ck)的浓度基本不变,以此判定该菌株是否具有降解能力),命名为菌株szw2。
71.二、菌落形态特征观察
72.菌株szw2在lb培养基上生长较快,可在28~37℃生长。菌斑呈圆形,边缘呈半透明状,中间隆起呈米黄色(图1)。可在cap浓度为10mg
·
l
‑1的含有10g
·
l
‑1蛋白胨中生长良好。
73.2.16s rdna扩增
74.以提取的菌株szw2的总dna为模板,采用细菌16s rdna通用引物扩增,正向引物为27f:5'
‑
agagtttgatcctggctcag
‑
3',反向引物为1492r:5'
‑
ggttaccttgttacgactt
‑
3'(stackebrandt et al.,1991)扩增16s rdna基因序列。
75.pcr反应总体系为25μl:上、下游引物各2μl,模板dna 0.5μl,2
×
taq pcr master mix 12.5μl,灭菌超纯水至总体积25μl。
76.pcr反应程序为:95℃预变性3min;95℃变性50s;56℃退火50s;72℃延伸50s,35个循环;最后72℃补充延伸5min。再用1.0%琼脂糖凝胶电泳检测pcr产物(选择dl2000 marker)。凝胶成像系统下观察,其中在marker 1000bp与2000bp条带中间范围出现了明显的条带。
77.3.16s rdna序列的测定
78.将pcr扩增后产物送北京睿博兴科生物技术有限公司(广州分公司)测序,得到的菌株的16s rdna基因序列如下(seq id no.1):
79.tcaagtggtagcgccctcccgaaggttaagctacctacttcttttgcaacccactcccatggtgtgacgggcggtgtgtacaaggcccgggaacgtattcaccgtggcattctgatccacgattactagcgattccgacttcat
ggagtcgagttgcagactccaatccggactacgacatactttatgaggtccgcttgctctcgcgaggtcgcttctctttgtatatgccattgtagcacgtgtgtagccctactcgtaagggccatgatgacttgacgtcatccccaccttcctccagtttatcactggcagtctcctttgagttcccggccgaaccgctggcaacaaaggataagggttgcgctcgttgcgggacttaacccaacatttcacaacacgagctgacgacagccatgcagcacctgtctcagagttcccgaaggcaccaaagcatctctgctaagttctctggatgtcaagagtaggtaaggttcttcgcgttgcatcgaattaaaccacatgctccaccgcttgtgcgggcccccgtcaattcatttgagttttaaccttgcggccgtactccccaggcggtcgacttaacgcgttagctccggaagccacgcctcaagggcacaacctccaagtcgacatcgtttacggcgtggactaccagggtatctaatcctgtttgctccccacgctttcgcacctgagcgtcagtctttgtccagggggccgccttcgccaccggtattcctccagatctctacgcatttcaccgctacacctggaattctacccccctctacaagactctagcctgccagtttcggatgcagttcccaggttgagcccggggatttcacatccgacttgacagaccgcctgcgtgcgctttacgcccagtaattccgattaacgcttgcaccctccgtattaccgcggctgctggcacggagttagccggtgcttcttctgcgagtaacgtcaattgctgcggttattaaccacaacaccttcctcctcgctgaaagtactttacaacccgaaggccttcttcatacacgcggcatggctgcatcaggcttgcgcccattgtgcaatattccccactgctgcctcccgtaggagtctggaccgtgtctcagttccagtgtggctggtcatcctctcagaccagctagggatcgtcgcctaggtgagccgttaccccacctactagctaatcccatctgggcacatccgatggcaagaggcccgaaggtccccctctttggtcttgcgacgttatgcggtattagctaccgtttccagtagttatccccctccatcgggcagtttcccagacattactcacccgtccgccactcgtcacccaaggagcaagctcctctgtgctaccgttcgactgcaggtagtcatccggg。
80.上述序列由1430碱基(bp)组成。
81.将获得的16s rdna基因序列提交至美国国立生物信息中心(ncbi)网页进行blast对比,与lpsn数据库(http://www.bacterio.net/index.html)中相关模式菌株的16s rdna基因进行同源性比对分析,下载同源性较高的模式菌株序列在美国国立生物信息中心(ncbi)网站上对扩增产物序列进行blast比对和同源性分析,采用mega 6.0软件,以neighbour
‑
joining法构建系统发育树。经16s rdna序列进行比较发现,菌株szw2与葡萄牙柠檬酸杆菌(citrobacter portucalensis)有99.23%的同源性(图2)。
82.四、菌株szw2鉴定为一种新功能菌株
83.根据菌株szw2菌落形态特征和分子生物学鉴定结果,将菌株szw2命名为葡萄牙柠檬酸杆菌(citrobacter portucalensis)szw2。该菌株已保存于广东省微生物菌种保藏中心(gdmcc),保藏号为gdmcc no:61695,该菌株于2021年5月27日,保藏单位地址为广州市先烈中路100号大院59号楼5楼。该葡萄牙柠檬酸杆菌(citrobacter portucalensis)具有去除氯霉素的功能,因此,葡萄牙柠檬酸杆菌szw2为一株能够降低溶液中氯霉素含量的新菌株。
84.实施例2菌株szw2去除氯霉素试验
85.将菌株szw2划线与lb平板上30℃培养20h后,挑取单菌落接种于lb液体培养基中,30℃、150rpm的摇床中培养20h后按2%(v/v)的比例接种于氯霉素浓度为10mg
·
l
‑1的含有10g
·
l
‑1蛋白胨的无机盐液体培养基中,30℃、150r
·
min
‑1震荡培养0、0.25、0.5、1、2、3、4、5和6天(d),以不添加菌株szw2为空白对照(ck),设3个重复试验,测定菌株szw2对氯霉素的去除量以及去除效率;其中cap的含量采用hplc进行测定(方法同实施例1)。
86.菌株szw2对氯霉素去除效率分别为0,5.79,16.73,21.55,29.66,30.95,31.98,35.04和36.80%。菌株szw2在含10g
·
l
‑1蛋白胨msm培养基中对氯霉素的去除量,以及菌株
生长和ph变化如图3所示:szw2生长呈现“s型”曲线,在2天(d)时菌体浓度最大为od
600
=0.82;且溶液ph逐渐升高至9.1,并维持在ph 8.9,ph的升高是因为szw2利用蛋白胨(含有大量的氨基基团)为营养物质生长时,会产生大量的胺类化合物,致使溶液ph升高。结果说明菌株szw2具有耐受氯霉素生长和去除氯霉素的性能,可应用于土壤和水体中氯霉素的去除。
87.实施例3菌株szw2的溶磷解钾定性试验
88.菌株溶磷解钾(溶磷解钾细菌(phosphate/potassium solubilizing bacteria),意为将不可溶的磷和钾类物质转变为可溶性的磷和钾)(具体参考文献:rawat,p.,das,s.,shankhdhar,d.,et al.,phosphate
‑
solubilizing microorganisms:mechanism and their role in phosphate solubilization and uptake[j].journal of soil science and plant nutrition.2020,https://doi.org/10.1007/s42729
‑
020
‑
00342
‑
7.)功能试验:
[0089]
将菌株szw2接种于lb液体培养基,于125~150r
·
min
‑1,28~30℃摇床振荡培养18~24h,后2%(v/v)接于nbrip或解钾细菌液体培养基中,设3个重复试验,置于30℃、150r
·
min
‑1摇床中培养6d,测定溶液中有效磷和速效钾的含量(速效钾用火焰光度计测定);其中有效磷和速效钾的含量的检测分别参考书籍(鲍士旦.土壤农化分析.3版,中国农业出版社,2000.)第五章和第六章中的方法进行;
[0090]
nbrip培养基配方:葡萄糖10g
·
l
‑1;ca3(po4)
2 5.0g
·
l
‑1;mgcl
2 5g
·
l
‑1;mgso4·
7h2o 0.25g
·
l
‑1;kcl 0.2g
·
l
‑1;(nh4)2so
4 0.1g
·
l
‑1;ph 7.2;
[0091]
钾细菌培养基:钾长石(k2o
·
al2o3·
6sio2)2.5g
·
l
‑1,na2hpo
4 0.2g
·
l
‑1,mgso4·
7h2o 0.02g
·
l
‑1,nacl 0.2g
·
l
‑1,caco
3 5.0g
·
l
‑1,caso4·
2h2o 0.1g
·
l
‑1,葡萄糖10g
·
l
‑1,ph6.8~7.0。
[0092]
结果如图4所示:可以看到菌株szw2可以降低体系中ph,从而溶解不可溶性磷和钾类物质,加菌szw2溶液中有效磷(phosphorus)和速效钾(potassium)含量为251.41和7.10mg
·
l
‑1,而空白不加菌溶液中磷和钾含量为4.6和4.7mg
·
l
‑1,其中溶磷量(有效磷的含量)显著高于对照不加菌,而解钾含量(速效钾的含量)较低。说明该菌株szw2可溶解不可溶的磷和钾化合物,具有提高土壤有效磷和钾含量的潜能,可用在促植物生长方面。
[0093]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1