一种与绵羊体高相关的分子标记及其应用
1.本发明属于分子标记制备技术领域,具体涉及cap2基因片段作为影响绵羊体高的分子标记及其应用。
背景技术:
2.环化酶相关蛋白(cap)是进化过程中高度保守的蛋白,由474-551个氨基酸残基组成,通过调节肌动蛋白细胞骨架在细胞极性和发育中起重要作用(kosmas et al.,2015)。在哺乳动物中,cap1和cap2是cap的两个同源物(matviw,yu,&young,1992;swiston,hubberstey,yu,&young,1995;yu,swiston,&young,1994)。cap1在胞吞作用和细胞运动中起作用(bertling et al.,2004),并存在于应力纤维和富肌动蛋白区域(peche et al.,2007)。cap1和cap2之间的相似性约为76%,敲除小鼠的cap2基因会导致体重下降和生存率下降(kosmas et al.,2015)。此外,在缺乏cap2的肌原纤维中,钙调节性发展的协同性降低(kosmas et al.,2015)。
3.绵羊是我国著名的多产品种,四级发情,生长快,性成熟早,产仔数高,平均产仔数2.06(x.feng et al.,2018)。绵羊主要分布在中国的江苏、浙江和上海。错义突变发生在编码区,导致翻译缺陷蛋白,并与许多疾病有关(lee et al.,2008)。同义突变在非编码区域并不产生改变的蛋白质,而是改变dna和rna序列,有被视为沉默突变,因此很容易被忽略(sharma et al.)。然而,同义突变可以改变mrna的稳定性、剪接调节位点、mirna结合位点或翻译效率,从而导致蛋白质水平或蛋白质构象的改变(sauna&kimchi-sarfaty,2011)。本发明通过对cap2基因进行测序和分析,探讨其不同基因型与绵羊体高之间的关联,旨在为提高绵羊体高的遗传改良方面提供基因素材,加速我国自主知识产权的快速生长型优质肉羊新品种的培育进程。
技术实现要素:
4.本发明的目的在于克服现有技术的缺陷,提供一种作为与绵羊体高相关的分子标记及其应用。
5.本发明的分子标记从绵羊cap2基因中扩增得到,其具体核苷酸序列如seq id no:1所示。通过扩增绵羊cap2基因的dna序列并测序,寻找cap2基因的多态性位点,从而可以建立绵羊体高相关分子标记的检测方法,并可将该分子标记应用于快速生长型优质肉羊新品种的培育中。
6.具体地,本发明的技术方案如下所述:
7.一方面,本发明提供了一种与绵羊体高相关的分子标记,该分子标记通过对绵羊cap2基因进行扩增而获得,具体的,该分子标记的核苷酸序列如seq id no:1所示,即
8.atccaggatctttttgaaacagtgatttactgattgtttttactgtgccgggtcttcgctgctgctctcacgctttctccaggtgcagcgagctggggctgctctccagctgtggtgctcaggcttctcgctgtggtggcttcacttgctgcagagcacgggctctagactgcgtgagcttcagcagctgcagcacatgggctcagcagttgtgggtcctggt
ctctagaacacaggttcctcaaaagttctggcacatggactcagtggcgcctctgcatgtctttccagatcagggactgaacccaygtctcttgcattagcaggcagattcctcaccactaagccaccgcgggagcctgggcattcaggatctttaattgcatcatgcgagttcttggttgcagcatgtgggatccagtttcctgaccagggatcgaat
9.其中第309位的y表示t或c,由于上述序列在第309位碱基处有一个t/c突变,从而导致了绵羊cap2基因在该位点的t/c多态性。
10.通过基因型与性状关联分析的结果表明,随着测定周期的延长,改突变位点与绵羊体高显著相关。携带cc基因型羊的体高要优于携带tt基因型的羊(p《0.05)。由此可知c等位基因为优势等位基因。表明该突变位点可作为影响绵羊体高的潜在分子标记(p《0.05)。
11.第二方面,本发明提供了一种检测上述分子标记的引物对,任何可特异性扩增本发明分子标记或包含上述多态性位点的片段的引物均适用于对该分子标记进行检测,优选地,所述检测分子标记的引物对的核苷酸序列为:
12.正向引物m-f:ctctagactgcgtgagcttc(seq id no:2);
13.反向引物m-r:actctgtgctcccaattcg(seq id no:3)。
14.此外,本发明的引物对可以为kaspar引物对,优选地,所述kaspar引物对的核苷酸序列为:
15.用于检测allelec的正向引物a1:
16.ccagatcagggactgaacccat(seq id no:4);
17.用于检测allelet的正向引物a2:
18.cagatcagggactgaacccac(seq id no:5);
19.通用反向引物c:
20.tggtgaggaatctgcctgctaatg(seq id no:6)。
21.第三方面,本发明提供了一种检测上述分子标记的试剂盒,所述试剂盒中包含了本发明第二方面的引物对或kaspar引物对。
22.第四方面,本发明提供了一种检测与绵羊体高相关的分子标记的方法,所述分子标记的核苷酸序列如seq id no:1所示,所述方法包括利用本发明的引物对或试剂盒对绵羊cap2基因进行检测,本发明的具体检测方法包括如下步骤:
23.a)使用本发明的引物对、kaspar引物对或包含上述引物对的试剂盒,对绵羊基因组dna进行扩增;
24.b)对步骤a)获得的扩增产物的多态性位点进行鉴定。
25.其中,在步骤b)中,任何snp分型方法均可适用于本发明中分子标记的检测,上述snp分型的方法包括但不限于直接测序法、探针法、基因芯片法、高分辨率溶解曲线法。
26.在本发明的分子标记序列和多态性位点已知的情况下,针对该多态性位点设计相应的探针,以及利用上述snp分型方法对分子标记和多态性位点进行检测均属于本领域中较为常规且成熟的技术,针对该多态性位点设计的探针也可包含于本发明的第三方面的试剂盒中。
27.更为具体的,本发明中利用上述引物对检测与绵羊体高相关分子标记的方法,包括如下步骤:
28.a)以绵羊血液为样品提取基因组dna,利用seq id no:2和seq id no:3所示的引物对绵羊cap2基因进行pcr扩增;
29.b)对上述pcr扩增产物进行测序和序列分析,从而通过多态性位点的碱基类型确定基因型。
30.此外,本发明还涉及利用kaspar引物对检测与绵羊体高相关分子标记的方法,包括如下步骤:
31.a)以绵羊血液为样品提取基因组dna,利用seq id no:4-6所示的引物对进行高通量水浴pcr扩增;
32.b)扩增结束后,利用bmg pherastar仪器检测荧光信号并查看分型结果。
33.第五方面,本发明提供了上述分子标记、引物对或试剂盒的检测方法在绵羊体高检测中的应用,通过在待测绵羊中检测本发明的分子标记,并分析多态性位点的类型,从而可以确定绵羊体高的高低,进而筛选出快速生长型的绵羊。
34.第六方面,本发明提供了上述分子标记、引物对或试剂盒的检测方法在绵羊育种中的应用,通过利用本发明的引物对或试剂盒对cap2基因进行扩增和检测,确定待测样品的基因型,从而可以从中选育出快速生长型绵羊品种。
35.寻找基因的变异位点,通过与性状间的关联分析发现基因与性状间的关系是研究基因功能的一个重要手段,也是进行标记辅助选择的基础。本发明通过对绵羊代表品种湖羊cap2进行pcr扩增和测序,发现在扩增片段的第309位存在一个t/c多态性位点,并通过检测1346只湖羊的多态性和建立的最小二乘模型,确定了一种与湖羊体高相关的分子标记,该分子标记可以用于快速生长型湖羊的选育,为湖羊体高的遗传改良提供了有效的基因工程手段,具有重大的实际应用价值。
36.本发明通过设计kaspar引物对分子标记进行检测,kasp是竞争性等位基因特异性pcr(kompetitive allele specific pcr)的缩写,该技术不需要针对每个snp位点都去合成特异的荧光探针,而是基于自己独特的arm pcr原理,让所有的位点检测最终都使用通用荧光引物扩增,大大降低了试剂的成本,同时还保留了taqman探针金标准的准确性,为本发明的分子标记的检测提供了一种简便、准确、低成本的操作方法。
附图说明
37.图1.本发明中用于作为分子标记的湖羊cap2基因片段的凝胶电泳图。
38.其中,m泳道:dl 2000marker,1-10泳道:cap2基因扩增结果。
39.图2.本发明中湖羊cap2基因g.8588t》c突变位点kaspar snp分型结果。其中,靠近左侧的红色点表示cc基因型,靠近中间的绿色点表示ct基因型,靠近右侧的蓝点表示tt基因型。
具体实施方式
40.下面结合实例详细介绍本发明,本发明的优点将会随着描述而更为清楚。应理解,本发明要求保护的范围不受所述具体实施方式的限制,本发明提供的具体实例仅是范例性的,不对本发明的范围构成任何限制,本领域技术人员参照说明书的描述对本发明的具体实施方式进行修改或者对部分技术特征进行等同替换,这些无需创造性劳动的改进和替换也应落入本发明所附权利要求书的保护范围之内。
41.实例1cap2基因的扩增
42.(1)引物设计
43.以湖羊cap2基因dna(genbank收录号:nc_040260.1)为模板,利用oligo7.0软件设计一对引物m-f和m-r,引物序列如下
44.cap2:
45.m-f:5'-ctctagactgcgtgagcttc-3'(seq id no:2),
46.m-r:5'-actctgtgctcccaattcg-3'(seq id no:3)
47.(2)cap2基因的扩增和测序
48.pcr反应总体积25μl,其中dna模板1μl,2
×
pcr master mix 12.4μl,上游引物0.8μl,下游引物0.8μl,ddh2o 10μl。pcr扩增程序是:94℃预变性3min,94℃变性30s,54.5℃退火30s,72℃延伸30s,循环35次,最后72℃延伸10min。pcr反应产物用1.5%琼脂糖凝胶电泳检测,结果显示得到309bp特异扩增片段(图1)。将扩增得到的pcr片段进行测序,测序的结果显示该扩增片段的具体核苷酸序列如seq id no:1所示,其中在该309bp片段中存在一个多态性位点,即扩增的cap2基因片段在第309bp位点存在t/c多态性。
49.dna序列同源性检索鉴定:
50.通过美国国家生物技术信息中心(ncbi,national center for biotechnology information,http://www.ncbi.nlm.nih.gov)网站的blast(basic local alignment search tool)软件,将测序后获得的dna序列与genbank数据库中公布的已知生理功能基因进行序列同源性比较,以鉴定和获得该dna序列的功能信息。检索结果表明所测序列与湖羊cap2基因dna(genbank收录号:nc_040260.1)的部分序列同源性达99%。
51.实例2基因分型检测方法的建立
52.(1)引物序列设计
53.针对实例1中扩增片段的c/t多态性位点设计kaspar引物对,从而用于所述多态性位点的特异性检测,所述kaspar引物对的核苷酸序列为:
54.用于检测allelec的正向引物a1:
55.ccagatcagggactgaacccat(seq id no:4);
56.用于检测allelet的正向引物a2:
57.cagatcagggactgaacccac(seq id no:5);
58.通用反向引物c:tggtgaggaatctgcctgctaatg(seq id no:6)。
59.以上引物委托北京生工生物工程有限公司合成,将kaspar引物对中各组引物均稀释成10μmol/l,并按照体积比为12:12:30(引物a1:引物a2:引物c)的比例混匀备用。
60.(2)dna质控
61.通过1%琼脂糖电泳和nanodrop2100分别对提取得到的基因组dna的质量进行检测,合格的dna要求:琼脂糖电泳显示dna条带单一,没有明显弥散;nanodrop2100检测a260/280介于1.8-2.0之间(dna样品没有蛋白污染);a260/230介于1.8-2.0之间(dna样品盐离子浓度低);270nm没有明显的光吸收(dna样品没有酚污染)。根据英国lgc公司的kasp检测技术和基因组大小换算出dna用量为10~20ng/每样品,稀释dna浓度成为10~20ng/μl备用。
62.(3)基因分型
63.首先利用k-pette分液工作站将稀释好的待测dna模板(10~20ng/μl)1.5ul和空白对照(no template control,ntc)分别加入384孔反应板中,60℃烘干30min(干燥箱,lgc
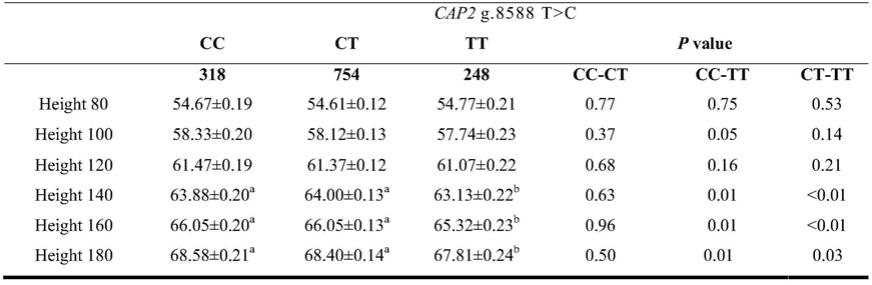
公司),dna变成干粉备用。然后在kraken操作系统下利用meridian加样工作站分别向每个反应孔中加入1
×
master mix(1536微孔板货号part no.kbs-1016-011)与引物混合液,mix分装完毕立即将微孔板依次放在kube热封仪和fusion激光封膜仪上封膜,利用hydrocyler进行高通量水浴pcr扩增。pcr反应在高通量水浴系统hydrocycler中进行,具体程序为:
64.94℃预变性,15分钟;
65.94℃,20秒(变性)—61℃-55℃,1分钟(复性&延伸),以touch down序扩增10个循环,每循环降低0.6℃;
66.94℃,20秒(变性)—55℃,60秒继续扩增26个循环。
67.扩增结束后,利用bmg pherastar仪器检测荧光信号并查看分型情况,具体结果如图2所示,图中每个圆点代表一份待测材料,其中靠近左侧的红色圆点表示该位点是纯合基因型“cc”;靠近右侧的蓝色圆点表示该位点是纯合基因型“tt”;靠近中间的绿色圆点表示该位点是杂合基因型“ct”或“tc”。(4)本发明的分子标记在湖羊体高标记关联分析中的应用
68.试验共检测了1346只湖羊的多态性,确定其基因型,并建立如下所述的最小二乘模型,进行基因型与体高进行关联分析。
69.y
ijkl
=μ+genotypei+pj+fk+m
l
+ε
ijkl
70.其中,y
ijlk
为体高的观察值,μ为总体均数,genotypei为基因型效应,pj为批次效应,fk为父系效应,m
l
为母系效应,ε
ijkl
为随机误差,假定ε
ijkl
相互独立,服从n(0,σ2)分布。
71.基因型检测结果表明在1320个个体中cc基因型有318个,ct基因型有754个个体,tt基因型有248个个体。基因型与性状关联分析的结果如表1所示,结果显示,随着测定周期的延长,cap2 g.8588t》c突变位点与湖羊体高显著相关。携带cc或ct基因型羊的体高要优于携带tt基因型的羊(p《0.05)。由此可知c等位基因为优势等位基因。在育种时选择cc基因型进行保种,繁育时以cc基因型作为种羊,与其它羊进行杂交。尤其是采用cc基因型种公羊精液进行人工受精,可以极大提升繁育效率,得到体高具有优势的羊群。
72.表1湖羊cap2基因多态性与体高关联分析
[0073][0074]
注:height表示体高,单位为cm。height 80表示80天身高,height 100表示100天身高,其他类似。同列数据间角标不同字母表示差异显著(p《0.05),标相同字母表示差异不显著(p》0.05)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1