一种硫脲类化合物及其合成方法、应用
1.本发明属于抗菌化合物技术领域,具体公开一种硫脲类化合物及其合成方法、应用。
背景技术:
2.近年来,随着抗生素在临床上的广泛应用及抗生素滥用等问题的出现,使得微生物耐药性逐年加重。同时,现在使用的抗生素中,除了脂肽外,几乎所有的抗生素都属于20世纪80年代以前发现的类别,20世纪80年代以来取得的大多数进展都是通过对现有抗生素进行结构修饰而实现的,新类抗生素的缺乏,意味着迫切需要筛选新结构的新型抗生素。
技术实现要素:
3.针对以上技术问题,本发明提供了以下技术方案:
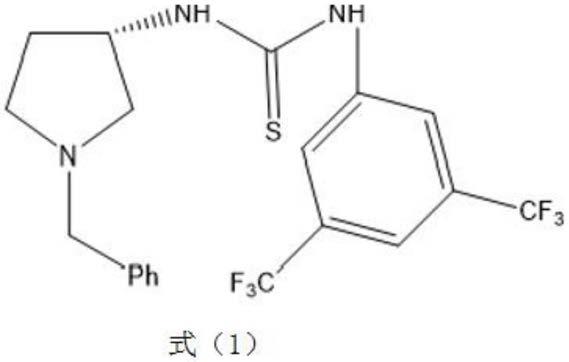
4.本发明提供一种如式(1)所示的硫脲类化合物及其盐,
[0005][0006]
本发明还提供了上述硫脲类化合物在抗菌中的应用。
[0007]
优选地,所述抗菌是抗金黄色葡萄球菌、粪肠球菌、表皮葡萄球菌中的一种或几种。
[0008]
优选地,所述金黄色葡萄球菌为耐甲氧西林金黄色葡萄球菌、金黄色葡萄球菌atcc 29213、耐万古霉素金黄色葡萄球菌中的一种或几种,所述粪肠球菌为粪肠球菌atcc 29212,所述表皮葡萄球菌为耐甲氧西林表皮葡萄球菌。
[0009]
优选地,所述硫脲类化合物的最低抑菌浓度为4μg/ml。
[0010]
本发明还提供了上述硫脲类化合物的合成方法,包括以下步骤:在惰性条件下,将3,5
‑
二三氟甲基异硫氰酸酯滴加至伯胺化合物溶液中,室温搅拌8
‑
12h,反应液依次浓缩、洗涤,所得白色固体即为所述硫脲类化合物。
[0011]
优选地,所述伯胺化合物溶液是将所述伯胺化合物与n,n
‑
二甲基甲酰胺按摩尔比为1:12
‑
15混合后得到。
[0012]
优选地,所述伯胺化合物与所述3,5
‑
二三氟甲基异硫氰酸酯的摩尔比为1:1。
[0013]
优选地,所述伯胺化合物为光学纯伯胺化合物。
[0014]
对比现有技术,本发明的有益效果为:
[0015]
本发明提供的化合物对金黄色葡萄球菌、粪肠球菌及表皮葡萄球菌均具有很好的抑制作用,特别是对s.aureus atcc 29213、s.aureus atcc 43300、lac、mu50、mrse、e.faecalis atcc 29212六种菌株的抑制效果较佳,其最低抑菌浓度为4μg/ml或8μg/ml。
附图说明
[0016]
图1是各组对不同实验菌的杀菌曲线图;
[0017]
图2是实施例3中的菌落电镜扫描图。
具体实施方式
[0018]
下面结合具体实施例对本发明进一步详细说明,应予理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0019]
实施例1
[0020]
一种如式(1)所示的硫脲类化合物及其盐,
[0021][0022]
上述化合物能够抑制金黄色葡萄球菌、粪肠球菌及表皮葡萄球菌的生长。
[0023]
该化合物的合成方法包括以下步骤:
[0024]
在25ml反应管中加入0.5mmol的光学纯伯胺,抽真空并充入氮气保护,加入5ml n,n
‑
二甲基甲酰胺(dmf),再滴加入0.5mmol 3,5
‑
二三氟甲基异硫氰酸酯,加料完毕后室温搅拌8h,将反应液浓缩至干,用10ml蒸馏水洗涤2~3次,得白色固体产物,收率约95%。具体合成路线如下所示:
[0025][0026]
产物结构经1h
‑
nmr、
13
c
‑
nmr等谱图确证,具体谱图数据如下:
[0027]
白色粉末;m.p.126.9
‑
128.3℃;[α]25
d
=
‑
65.6
°
(c=0.25,ch2cl2);
[0028]1h nmr(400mhz,cdcl3)δ:7.79(bs,2h),7.46(bs,1h),7.35
‑
7.28(m,5h),6.50(s,1h),3.67(s,2h),3.09(bs,1h),2.89(bs,1h),2.52(bs,1h),2.37
‑
2.26(m,2h),1.79(br,1h);
[0029]
13
c nmr(100mhz,cdcl3)δ:179.09,155.09,140.88,136.83,132.00(q,j
c
‑
f
=33hz),129.12,128.60,127.75,127.27,124.56,121.85,118.81,115.67,60.64,59.97,52.96,49.62,32.18;
[0030]
19
f nmr(376mhz,cdcl3)δ:
‑
63.05;
[0031]
hrms(esi)m/z calcd.for c
20
h
20
f6n3o
+
[m+h]
+
:432.1505,found 432.1520。
[0032]
实施例2
[0033]
用金黄色葡萄球菌(atcc 29213,购自中国国家细菌耐药性监测中心)、mu50(耐万古霉素金黄色葡萄球菌,购自microbiologics、美国明尼苏达州)、lac(耐甲氧西林金黄色葡萄球菌usa300,购自microbiologics、美国明尼苏达州)及mrse(耐甲氧西林表皮葡萄球菌,从西京医院患者的痰标本中分离)作为实验菌,分别对化合物的抗菌/抑菌活性进行说明。
[0034]
1、实验方法
[0035]
1.1、细菌培养
[0036]
‑
80℃冰箱取上述四个菌株,室温解冻,另取试管,依次加入3ml tsb培养液和30μl菌液放入摇箱中37℃培养8h;
[0037]
转接细菌:试管中加入tsb 3ml,取摇箱中培养8h的上述菌液与tsb培养液的混合液30μl,放入培养箱中培养4h,取出测od值,根据od值将菌液调至浓度为1
×
108cfu/ml,备用。
[0038]
1.2、配制药液及菌液
[0039]
药液:取本发明实施例1提供的化合物,加入dmso溶解,制备成25.6mg/ml的母液,再将该母液用tsb稀释分别制备成4μg/ml及8μg/ml的药液;
[0040]
菌液:取上述浓度为1
×
108cfu/ml的菌液,加入tsb培养液稀释成1
×
106cfu/ml。
[0041]
1.3抗菌实验
[0042]
取48个ep管,分别加入2700μl tsb培养基溶液,按不同实验菌分为4组,每组12个,再向4个组中分别加入300μl浓度为1
×
106cfu/ml的不同实验菌的菌液,得到混合培养液,最终菌液浓度为1
×
105cfu/ml;
[0043]
将4个组每组12个ep管分为空白对照组、阳性对照组、低浓度组及高浓度组4个小组,每小组3个样品(总共48个样品);空白对照组不加任何样液;
[0044]
阳性对照组加样:从3个样品中分别吸取117μl上述混合培养液后,再向3个剩余样品中加入117μl浓度为4μg/ml的利奈唑胺溶液;
[0045]
低浓度组加样:从3个样品中分别吸取117μl上述混合培养液后,再向3个剩余样品中加入117μl浓度为4μg/ml的实施例1提供的化合物溶液;
[0046]
高浓度组加样:从3个样品中分别吸取234μl上述混合培养液后,再向3个剩余样品中加入234μl浓度为8μg/ml的实施例1提供的化合物溶液。
[0047]
涂板:
[0048]
(1)将tsb粉末、琼脂粉及灭菌水按照质量比为3:1:100混合灭菌后分装入768个培
养皿中,冷却凝固,得到装有培养基的培养皿;
[0049]
(2)将上述装有培养基的培养皿平均分为4个组(标记为2h、4h、8h及16h),每组192个;再将每组又平均分为4个小组,每个小组48个培养皿;
[0050]
(3)将上述各组样品液分别稀释成1
×
105cfu/ml、1
×
106cfu/ml、1
×
107cfu/ml及1
×
108cfu/ml 4个浓度,再各取10μl同一浓度的48个样品液分别滴加至上述同一小组的48个培养皿中,滴加完毕后将培养皿倾斜放置,待混合液平稳流下且凝固后将培养皿置于37℃培养箱中培养16h,统计各培养皿中的菌落数(其中,标记为2h、4h、8h及16h的4个组的菌落分别在计时开始后的2h、4h、8h及16h进行计数,即标记为2h的组在计时开始后2h进行计数,标记为4h的组在计时开始后4h进行计数,标记为8h的组在计时开始后8h进行计数,标记为16h的组在计时开始后16h进行计数),并计算每个小组的平均值。
[0051]
1.4结果
[0052]
各小组菌落生长情况如表1及图1所示。
[0053]
表1各小组菌落生长情况(个)
[0054][0055]
结合表1及图1所示,实施例1提供的化合物对四种菌株都具有抑制作用,且高浓度组的抑菌效果优于低浓度组。
[0056]
实施例3
[0057]
电镜扫描
[0058]
1.1菌液制备
[0059]
‑
80℃冰箱取lac菌株(此处仅以lac菌株为例进行说明),室温解冻,另取试管,依次加入3ml tsb培养液和30μl菌液放入摇箱中37℃培养8h;
[0060]
转接细菌:试管中加入tsb 3ml,取摇箱中培养8h的上述菌液与tsb培养液的混合液30μl,放入培养箱中培养4h,取出测od值,根据od值将菌液调至浓度为1
×
108cfu/ml,备用。
[0061]
1.2药液制备
[0062]
称取化合物3mg,加入117μl dmso溶液,配制成25.6mg/ml的化合物溶液ⅰ;再用tsb
稀释成8μg/μl的化合物溶液ⅱ;
[0063]
1.3试样制备
[0064]
取两只试管,每个试管中均加入1800μl tsb和200μl上述浓度为1
×
108cfu/ml的菌液,其中一个试管内不加药作为对照组,另一个试管内加入15.6μl化合物溶液ⅱ,两个试管放入摇箱中37℃振摇6h后取出。
[0065]
另取两个ep管,从两个试管内分别吸取1ml加入ep管中,低温离心(12000r,4℃,2min),弃去上清,然后向每个ep管内加入1ml pbs,重复上面离心步骤,弃去上清,再加入1ml固定液,放4℃冰箱中过夜。送扫描电镜处进行电镜扫描。
[0066]
1.4结果
[0067]
电镜扫描结果如图2所示。
[0068]
由图2可知,本发明实施例1提供的化合物对lac菌株具有明显的抑制作用。
[0069]
实施例4
[0070]
以s.aureus atcc 29213、s.aureus atcc 43300(购自美国atcc)、lac、mu50、mrse、e.faecalis atcc 29212(购自青岛海博生物)、e.coli atcc 25922(购自青岛海博生物)、a.baumannii atcc 19606(购自上海通派生物科技有限公司)、k.pneumoniae atcc 700603(购自上海传秋生物科技有限公司)及p.aeruginosa atcc 27853(购自青岛海博生物)十种菌株为实验菌,用肉汤稀释法对实施例1提供的化合物的最低抑菌浓度(mic)进行测定。
[0071]
1、实验方法
[0072]
1.1、菌液准备
[0073]
‑
80℃冰箱取十个菌株分别放置在试管中,室温解冻,分别加入3ml tsb培养液和30μl菌液放入摇箱中37℃培养8h。
[0074]
转接细菌:试管中加入tsb 3ml,取摇箱中培养8h的上述菌液与tsb培养液的混合液30μl,放入培养箱中培养4h,取出测od值,根据od值将菌液调至浓度为1
×
108cfu/ml,备用。
[0075]
1.2、药液准备
[0076]
药物组:称取实施例1制备的化合物3mg,加入117ul dmso溶液,配制成25.6mg/ml的化合物溶液ⅰ;再吸取该化合物溶液ⅰ40μl加入至960μl mhb(肉汤培养基)中,配制成1.024mg/ml的化合物溶液ⅱ。
[0077]
1.3、测定
[0078]
取两个96孔板(12
×
8),每孔加入100μl mhb,每个孔板第一行为空白对照组,其余各行(两个孔板总共取10行)的第一个孔内加入100μl化合物溶液ⅱ,然后倍比稀释至最后一个孔,得到的个孔浓度分别为512、256、128、64、32、16、8、4、2、1、0.5μg/ml。
[0079]
以上两个孔板中除第一行外,其余每孔均加入100μl浓度为1
×
108的菌液,且10行所加菌液从上到下依次为s.aureus atcc 29213、s.aureus atcc 43300、lac、mu50、mrse、e.faecalis atcc 29212、e.coli atcc 25922、a.baumannii atcc 19606、k.pneumoniae atcc 700603及p.aeruginosa 27853十种菌株的菌液,滴加完毕后再放入37℃恒温培养箱培养过夜,用酶标仪测od值,得到mic结果。
[0080]
1.4、结果
[0081]
化合物溶液对上述十种菌株的mic值如表2所示。
[0082]
表2化合物抗菌结果
[0083]
菌株mic(μg/ml)s.aureus atcc 292134s.aureus atcc 433008lac4mu504mrse4e.faecalis atcc 292124e.coli atcc 25922>256a.baumannii atcc 19606>256k.pneumoniae atcc 700603>256p.aeruginosa atcc 27853>256
[0084]
由表2可以看出,化合物对s.aureus atcc 29213、s.aureus atcc 43300、lac、mu50、mrse、e.faecalis atcc 29212、e.coli atcc 25922六种菌株均具有抗菌活性,对a.baumannii atcc 19606、k.pneumoniae atcc 700603及p.aeruginosa atcc 27853四种菌株无抗菌活性。
[0085]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1