一种人工改造基因、SNA15蛋白及其高效合成纳米银的方法
一种人工改造基因、sna15蛋白及其高效合成纳米银的方法
技术领域
1.本发明涉及基因工程与蛋白质工程,具体涉及一种人工改造基因、sna15蛋白及其高效合成纳米银的方法。
背景技术:
2.银自古以来就被人们用来做抗菌剂,但是随着科技的发展,抗生素的出现导致银在杀菌方面的利用率下降了。但是由于人们对抗生素的滥用导致目前从新药类别的研发到检测细菌对新药产生耐药性的时间正在逐渐缩短,以青霉素为例,目前青霉素三代四代用的居多。
3.纳米银的抑菌机制与抗生素的抑菌机制不同,纳米银在抑菌方面具有广谱性,纳米银的粒径越小,其杀菌性能越强。而一种类型的抗生素只能抑制某一类的细菌,因为纳米银的抑菌是通过直接暴露引起细菌的死亡,由于其特殊的纳米尺寸从而导致细菌发生纳米穿孔,使得纳米银插入到细菌的细胞膜或者细胞壁上,导致其结构被破坏从而致使细菌胞内组分外流,引起细菌死亡。当纳米银进入到细菌的细胞质膜时,会与含巯基的lps结合,削弱其相互作用导致细胞膜的通透性增加,同时纳米银容易与氧结合,促进o2的解离生成ros,粒径越小的纳米银其产生ros的能力越强。入侵到胞内的纳米银会与胞内的dna和蛋白质交联,导致有关氧化损伤修复基因的丢失和氧化损伤蛋白的缺失,并且导致处于自由态的dna分子凝聚,影响细胞的正常分裂及功能的表达。
4.以纳米银作为抗菌剂在净水处理、食品保鲜、水产养殖、农业生产和生物医学应用中起着重要作用,同时纳米银还以纳米银浆的形式被运用到传感器等高新技术领域。随着纳米材料技术的飞速发展,纳米粒子的合成越来越方便,纳米粒子被大量生产,并在日常生活中得到广泛的应用。由于纳米银表面具有等离子体共振增强功能,并且不同形貌,不同粒径的纳米银用不同激发波长会影响纳米银的荧光增强效应。以该蛋白合成的球形银纳米粒子为例,粒径越大,其表面等离子体共振峰越发生红外偏移,表面等离子共振效应逐渐由吸收向散射转变。同时纳米银具有表面增强拉曼散射效应,能够使得待测物质的拉曼信号增强,具备实现单分子检测的特性,可以有效实现利用复合探针对例如癌细胞的靶向sers成像进行检测、对水溶液中有毒有害物质现场检测、肿瘤细胞扩散情况进行检测等方面的应用。正是由于纳米银的表面效应以及量子尺寸导致纳米银在生物医学领域、表面增强拉曼效应,以及微电子领域占有重要地位。例如联合应用外用重组人碱性成纤维细胞生长因子、纳米银抗菌水凝胶敷料能减轻局部肿胀、缓解术后疼痛、促进踝部开放骨折创面恢复,缓解炎症反应及氧化应激反应,有效降低术后切口并发症发生率。纳米银抗菌凝胶可预防放射性皮炎的发生和降低放射性皮炎的严重程度,可减少由于皮肤反应引起的治疗中断,能改善治疗效果。
5.目前存在三种合成纳米银的主要方法:第一种是简单直接的物理方法,但是物理方法对设备要求高,这就带来了高额的成本,对于设备的损耗也较为严重,但是生产得到的纳米银粒径大小可以符合人们的预期,并且生产周期短;第二种是化学合成方法,这种方法
带来的是环境污染加有毒试剂的使用,并且化学还原对导致合成的纳米银颗粒表面吸附刺激性化学物质增加毒性不利于生物医学方向的用途;第三种是绿色环保的生物合成方法,生物法相比其他两种方法具有反应温和,生产成本低,绿色环保无污染,而且在反应过程当中不需要还原剂等添加剂就可以完成纳米银制备的等一系列优点,随着绿色观念、环保观念的普及,利用生物系统合成纳米银粒子的生物法备受关注。生物纳米银在生物分子的保护下稳定性和分散性得到了较大提高,具有良好的生物相容性、特殊的理化性质及优异的抗菌、抗炎作用和较低的生物毒性,在生物医用材料领域内具有独特的优势和举足轻重的地位。从而研究生物合成纳米银粒径的最佳合成条件,深入了解纳米银的合成机制,对于制备更加高效、高产的抗菌银纳米产品意义重大。现有技术中cn110804089提出了一种来源于球形赖氨酸芽孢杆菌的纳米银合成蛋白及其应用,虽然其公开了合成纳米银的蛋白,但是其蛋白合成的纳米银效率较低,并且合成的纳米银分散效果较差,粒径较大,为获得更高效合成纳米银的蛋白而对该蛋白进行改造。
技术实现要素:
6.发明目的:针对现有技术中存在的问题,本发明提供一种经过人工改造后得到编码合成纳米银蛋白的基因,本发明的基因编码的蛋白可以高效合成纳米银,同时基因经原核表达纯化得到的蛋白进行纳米银合成属于非酶催化合成,在以单一非酶催化蛋白合成纳米银领域有重大意义,有利于解析非酶催化蛋白合成纳米银的机理及实现纳米银的可控合成。
7.本发明还提供能够高效合成具有生物活性纳米银的蛋白、载体、工程菌和应用。
8.技术方案:为了实现上述目的,本发明提供一种编码合成纳米银蛋白的基因,所述基因的核苷酸序列如seq id no.1所示。
9.其中,所述基因通过已知纳米银蛋白的核苷酸为模板(cn110804089中seq id no.2;本发明中序列表中seq id no.5),通过对已知核苷酸编码的合成纳米银蛋白结构进行空间模拟,分析各结构域功能和作用,进行蛋白质的结构域重排,筛选获得可以高效进行纳米银合成的结构域,以重排后编码重排蛋白质的基因序列作为模板,通过定点突变获得序列如seq id no 1所示编码高效合成纳米银蛋白的基因。将目的基因与载体进行连接得到重组载体,将重组载体导入原核表达宿主内进行表达纯化。
10.本发明所述基因编码的能够高效合成具有生物活性纳米银的蛋白的氨基酸序列如seq id no.2所示。
11.本发明所述的重组载体,其包括所述的编码合成纳米银蛋白的基因。
12.本发明所述的工程菌,其包括所述的编码合成纳米银蛋白的基因或者所述的合成纳米银蛋白或者重组载体。
13.本发明所述的编码合成纳米银蛋白的基因通过生物法在制备纳米银中的应用。
14.本发明所述的合成纳米银蛋白通过生物法在制备纳米银中的应用。
15.其中,所述应用中以硝酸银为底物浓度14~30mm,合成纳米银的反应温度范围为20~50℃,转速100~250rpm,ph为9~13,反应时间16~24h。
16.其中,所述应用中制备的纳米银为球形纳米银,粒径大小分布于2
‑
25nm。且每次纳米银合成条件可控,合成的纳米银粒径可控,该生物法合成的纳米银表面包裹着的蛋白具
有良好的生物活性。
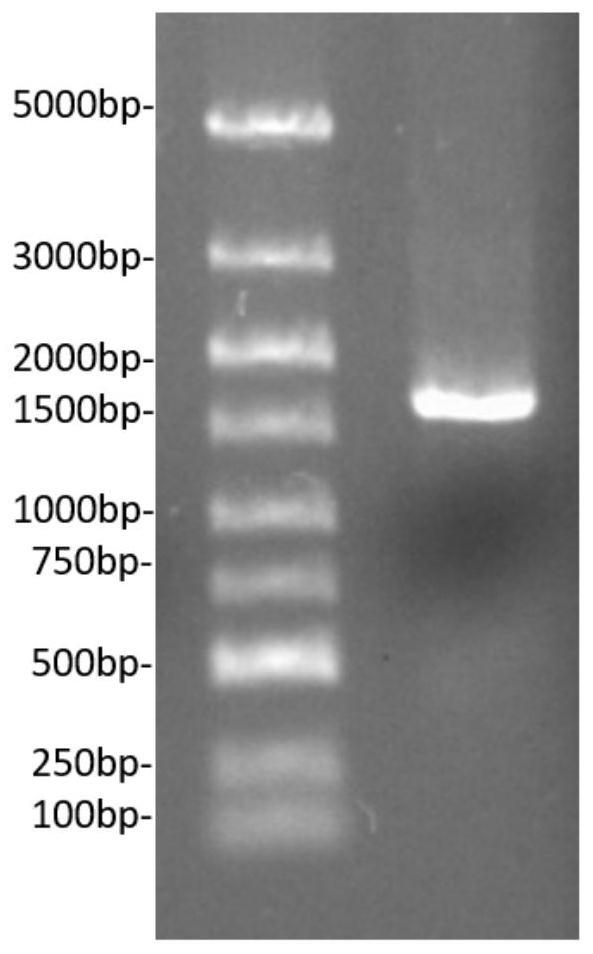
17.进一步地,所述应用中制备的纳米银为球形纳米银,粒径大小分布于2
‑
25nm,其表面包被着参与合成纳米银的蛋白质。经过扫描电镜sem的表征发现粒径小于10nm的纳米银呈现团聚状态,由sem表征结果看团聚状态的纳米银粒径在80nm左右,其原因在于,纳米颗粒的粒径下降,其表面原子比例增加,导致表面配位数不足和高表面能,从而纳米银处于高度活化状态,从而粒径小的纳米银会呈现出团聚状态,将样品经过超声波分散后再进行tem表征,发现大部分合成的纳米银粒径在10nm左右。
18.本发明运用基因工程技术改造编码合成纳米银蛋白的基因。所得到工程基因编码的蛋白能够高效合成纳米银,该蛋白在原核表达系统中表达含量高,并且该蛋白易于从原核表达系统中运用蛋白纯化的方式纯化,该蛋白能够在一定条件下稳定大量合成纳米银。本发明提出经过基因工程和蛋白工程改造后可以大量合成纳米银的蛋白序列以及核酸序列,该蛋白在常温等温和条件下能够通过生物法制备球形纳米银,该生物法合成的纳米银在透射电镜的表征下显示此方法合成的纳米银表面包裹着的该蛋白,体现出该生物法合成的纳米银具有良好的生物活性。同时该生物法合成的纳米银通过抑菌实验证实该纳米银具有广谱抗菌效果且抗菌效果显著。此外,本发明的蛋白每次进行纳米银合成的条件可控,粒径范围可控,且不受到其他因素的影响,只要在ph范围内,不需要特别高的温度,即可合成纳米银,并且经过dls测得纳米银的粒径也在合成范围之内,可以工业化大量制备纳米银颗粒。
19.本发明成功扩增出其相应dna,并且成功构建出重组载体,获得携带该重组载体的原核表达宿主或者工程菌,由于原核表达系统具有培养简单,迅速,经济,适合大规模工业生产工艺等诸多优点,使得生物法中利用单一蛋白制备纳米银具有工业化规模化应用的雏形,具有广泛的应用前景和工业价值。
20.本发明运用基因工程和蛋白质工程的技术人工改造后的蛋白可以将底物硝酸银还原成纳米银,有利于揭示纳米银合成机理,也利于生物合成纳米银的工业化生产及其应用,同时以金黄色葡萄球菌、大肠杆菌、青霉菌、酿酒酵母探究该生物法合成纳米银的抑菌能力。
21.有益效果:与现有技术相比,本发明具有如下优点:
22.1、经过基因工程技术、蛋白质工程技术,人工改造得到的,能够高效合成具有生物活性的纳米银人工序列和人工蛋白,基因通过已知纳米银蛋白的核苷酸序列为模板(cn110804089中seq id no.2)进行空间模拟,分析各结构域功能和作用,筛选获得纳米银高效合成结构域,采用定点突变的技术进行突变,得到一段全新的人工序列。该基因编码的蛋白可以高效合成纳米银,并且可以起到降低小粒径纳米银团聚的作用,在该生物法中作为保护剂和分散剂。最终编码该蛋白的基因命名为sna15其序列如seq id no 1所示。该蛋白命名为sna15protein的氨基酸序列如seq id no.2。本发明首先对蛋白序列采用蛋白质工程技术进行蛋白结构模拟分析后,对蛋白结构域重排,随后运用基因工程技术对其对应的dna序列多个位点进行定点突变,设计pcr反应条件,成功通过pcr定点突变出携带突变位点的dna序列,突变后的序列编码的蛋白可以高效合成纳米银并且在水溶液中分散效果好,故本发明也首次公开了经过人工改造后可高效合成纳米银的sna15 protein氨基酸所对应的核酸序列。
23.2、本发明的sna15 protein,ph范围在11~13,温度范围20~50℃的条件下对纳米银的合成效率较高,合成时间为16~24h,得到的生物纳米银溶液呈褐色,性质稳定,粒径分布在2~25nm,并且合成的纳米银表面包被着蛋白质,具有良好的生物活性和生物学功能。
24.3、本发明经过人工改造的蛋白成功合成了纳米银,发现该改造蛋白的关键功能区域,并成功扩增出其相对应的dna,经过重组载体和原核表达,得到可以大量制备具有高效合成生物纳米银能力的工程菌,该sna15 protein表达量高,是经人工改造之前表达量的10倍以上且蛋白性质稳定,sna15 protein合成的纳米银具有良好的生物活性,粒径可控,合成条件温和,并且sna15 protein蛋白合成纳米银属于非酶催化的纳米银合成,与常规酶催化的纳米银合成不同,不存在酶活中心突变导致无法合成纳米银的情况,目前仍未有该方面的研究。本发明有利于揭示利用单一非酶催化蛋白制备纳米银的合成机制,同时探究该生物法合成的纳米银对金黄色葡萄球菌、大肠杆菌、青霉菌、酿酒酵母的抑菌能力。具有极其广阔的应用前景和工业价值。
附图说明
25.图1为目的基因的琼脂糖凝胶电泳;
26.图2为pet
‑
28a(+)重组质粒双酶切验证琼脂糖凝胶电泳;
27.图3为改造蛋白上清和对照组的sds
‑
page电泳图与原始蛋白经过亲和层析纯化后的sds
‑
page电泳图;其中图3a为重组蛋白的sna15 protein,图3b为改造之前的蛋白(阳性对照);
28.图4为阴离子层析纯化的sds
‑
page电泳图;
29.图5为纳米银合成峰图以及合成颜色;其中图5a为不同蛋白在相同条件下所合成纳米银的特征吸收峰图,图5b为不同蛋白在相同条件下所合成纳米银合成的纳米银溶液的颜色,图5c为重组蛋白的sna15 protein在不同温度下合成纳米银;
30.图6为sem扫描电镜表征图;
31.图7为tem透射电镜表征图;
32.图8为纳米银对金黄色葡萄球菌,大肠杆菌,酿酒酵母,青霉菌的抑菌效果。
具体实施方式
33.下面结合实施例和附图对本发明做进一步的说明。
34.以下实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径获得。
35.实施例1
36.基因克隆、表达载体的构建与验证
37.以已知纳米银蛋白的核苷酸为模板(cn110804089中seq id no.2;本发明中序列表中seq id no.5),通过对已知核苷酸编码的合成纳米银蛋白结构进行空间模拟,分析各结构域功能和作用,进行蛋白质的结构域重排,筛选获得可以高效进行纳米银合成的结构域(筛选方法同实施例2和3),以重排后编码重排蛋白质的基因序列作为模板,设计定点突变引物,引物交由上海杰李生物技术有限公司合成,定点突变序列如下:
38.seq id no.3:f
39.ggaattccatatggatcgaactcgcccaaaagataagaaagtaaaagtgaaaaattcaaaaactttagt
tgtgactttctctaaaacattagattcttcagatggaaac
40.seq id no.4:r
41.ccgctcgagagctacagtaaatccgtcagctgctctcttcgtagtttctggtttgaatacagttgcaaagtcagttttaagattagcaatatgagttgaatcatcttc
42.采用pcr定点突变目的基因。pcr为降落pcr,程序设计如下,98℃预变性5min,98℃变性15s,起初退火温度为65℃,退火15s,一共15个循环。每隔一个循环温度下降1℃,每次退火时间为15s,72℃延伸100s,前一部分变性退火延伸为15个循环。后续程序为98℃变性15s,退火温度为55℃,退火15s,延伸温度72℃,延伸100s,一共30个循环,充分延伸5min,12℃保温。
43.pcr体系为5
×
primestar gxl buffer 10μl,上游引物f1μl,下游引物r1μl,primestar gxl dna polymerase 1μl,模板0.1μl,dntp mixture 4μl,dmso 2.5μl,ddh2o 30.5μl(其中各试剂均购于takara);待pcr程序完成之后,取样1μl进行琼脂糖凝胶电泳,结果如图1所示。通过pcr直接回收的方式得到的目的基因与pet
‑
28a(+)载体都使用限制性内切酶ndeⅰ和xhoⅰ进行双酶切,对双酶切产物进行琼脂糖凝胶电泳,割胶回收,将回收到的酶切产物使用t4 dna连接酶进行连接。将连接产物导入感受态细胞dh5α中进行转化,向转化后的离心管加入700ul无抗lb液体培养基,37℃温和振荡培养60min后,将菌液5000rpm离心2min,每管弃去600ul的上清液,利用剩余培养基悬浮沉淀菌体后,均匀涂布于含kan抗性的筛选平板上,将平板37℃放置过夜培养。于含有kan抗性的平板上挑取阳性转化子,转接到5ml含液体lb培养基(含kan 50ug/ml)中进行过夜培养12h后提取质粒,进行双酶切验证,验证图片如图2所示。将图2质粒送至上海杰李生物技术有限公司进行测序,得到的目的基因的核苷酸序列如seq id no.1所示,长度为1614bp,命名为sna15。
44.实施例2
45.重组蛋白的sna15 protein表达与纯化
46.将实施例1成功构建好的载体质粒转入感受态细胞bl21中,取感受态细胞bl21内导入空质粒进行空载对照,并将模板基因(cn110804089中seq id no.2)按同样的方法构建载体转入感受态细胞bl21中作为阳性对照,大肠杆菌转化步骤相同,转化完成后,分别向转化后的离心管加入700ul无抗lb液体培养基,37℃温和振荡培养50min后,将两管菌液5000rpm离心2min,每管弃去600ul的上清液,利用剩余培养基悬浮沉淀菌体后,均匀涂布于含kan抗性的筛选平板上,将两块平板37℃放置过夜培养。然后从抗性平板上挑取单菌落接种于5ml液体培养基(含kan 50ug/ml)中进行过夜培养,16h后将两管5ml液体培养基(含kan 50ug/ml)培养的大肠杆菌分别转接到800ml液体lb培养基(含kan 50ug/ml)中进行培养,培养条件为37℃,180rpm,培养4h左右。od至0.6时加入终浓度0.05mm的iptg进行诱导,诱导条件为16℃,180rpm诱导16h。在4℃,1.5mpa条件下进行3个循环的破碎,然后用超声破碎仪在冰水浴的条件下,以400w,工作2s,间隔8s为循环超声30min。后以10000rpm,50min,4℃离心取上清,取等量溶液进行sds
‑
page电泳。结果如图3a所示,1:含有重组载体的大肠杆菌上清液;2:未转化的大肠杆菌上清液,由图3可见成功表达的蛋白大小在57.7kda,与蛋白预期大小一致。图3b改造之前的蛋白(阳性对照)大小在120kda,图3b的条带为镍柱纯化后的条带,可以看出其表达量低,并且经纯化发现其性质不稳定,由bbi蛋白质定量试剂(上海生工)溶液测定蛋白浓度发现sna15 protein表达量高,是经人工改造之前表达量的10倍以上,且在
进行蛋白质纯化的过程中发现sna15 protein蛋白性质稳定。将sna15protein的破碎上清经过镍柱亲和层析,目的蛋白质的挂柱、洗杂和洗脱。挂柱前先对柱子进行处理,确保柱子上没有蛋白质,然后用裂解液进行平衡,平衡后再用离心后的上清通过镍柱,反复3遍,使上清中的目的蛋白质都挂在柱子上,然后用裂解buffer配成的20mm咪唑进行洗杂直至用g
‑
250检测流出液时g
‑
250不变蓝,洗杂后用elution buffer洗脱至流出液用g
‑
250检测时不变蓝,至此目的蛋白质被洗脱下来,得到用镍柱亲和层析初步纯化的目的。镍柱亲和层析得到的样品里面会含有核酸和较多的杂蛋白质,为了能够得到更纯、质量更好的样品,需要将得到的样品用离子交换层析做了进一步纯化。采用离子交换层析,将蛋白质的浓缩,因为镍柱洗脱后的蛋白质溶液由于体积太大不能直接上样过离子交换层析,需经过浓缩把大体积浓缩到上样所要求的体积范围内,把镍柱洗脱后的溶液转移至浓缩管中,在4℃,6000rpm条件下浓缩,然后用buffer a稀释。上样前需对蛋白质纯化仪akta进行平衡处理,进行阴离子层析。取不同稀释样品等体积上样量进行sds
‑
page电泳,结果如图4所示。结果显示获得蛋白质样品只有一条单一条带,说明得到纯化后的重组蛋白的sna15 protein纯度较高只有一条单一的条带,其氨基酸序列如seq id no.2所示。
47.实施例3
48.合成纳米银的过程、表征与分析
49.收集实施例2中得到的只有单一条带的目的蛋白,将收集到的纯组分目的蛋白混合,在5ml合成体系中加入14mg硝酸银再加入终浓度为152ug/ml的sna15 protein蛋白溶液,另一管对照加入152ug/ml的纯化的原始蛋白溶液(改造之前模板蛋白,即实施例2的阳性对照),剩下的溶液均用超纯水补齐至5ml,ph调至12,温度30℃,转速250rpm,反应时间16h即可合成纳米银,空白对照组内不加入目的蛋白其他条件与实验组一致,测定其特征吸收峰与合成的纳米银溶液的颜色,图5所示a、b、c分别为sna15 protein合成的纳米银、原始蛋白合成的纳米银(阳性对照)、对照组不添加任何蛋白,图5a可知本发明实施例2制备经过改造的蛋白在420nm处产生吸收峰,而未经改造的蛋白在430nm处产生吸收峰,纳米银的表面等离子共振是由于粒子的表面电子云协同振动产生的,通常在410
‑
440nm内有一吸收峰,一般情况下,粒子越小,吸收峰的位置就越向前偏移,这表明改造后的蛋白合成的纳米银粒径更小,合成效果更好,并且由图5b可见经过改造的蛋白合成的纳米银颜色深浓度更高(其中a为深褐色、b为浅黄色、c为透明)。按上述方法调整不同的反应温度(20
‑
60℃),如图5c中a、b、c、d、e的温度分别为30℃、20℃、40℃、50℃、60℃,相同ph的情况下进行的纳米银合成实验,由图像可知在其在30℃的合成条件最好。此外,将实施例2阴离子层析洗脱的蛋白溶液进一步去除nacl对纳米银合成实验的影响,采用透析的方式梯度透析置换掉nacl,并且将置换的蛋白溶液控制在152ug/ml,以上述相同条件进行纳米银合成得到纳米银溶液。
50.sna15 protein合成的纳米银其表征sem如图6所示,图6可见合成的纳米银在溶液中整体的分散效果好,并未出现大面积的团聚现象,将样品进行超声后再进行tem透射电镜,tem如图7所示,显示纳米银成功合成,粒径大小分布于2
‑
25nm,且透射电镜下面可以看出纳米银表面包裹着蛋白显示该生物法合成的纳米银具有良好的生物活性。
51.实施例4
52.合成纳米银抑菌方面的应用
53.将金黄色葡萄球菌、大肠杆菌培养到对数期,在2瓶固体lb培养基快要凝固的时候
分别加入培养基体积量1%的大肠杆菌、金黄色葡萄球菌摇匀之后倒入一次性平板中,等平板凝固放置牛津杯在制成的固体lb平板上。将培养到对数期的酿酒酵母在1瓶固体ypd培养基快要凝固的时候加入培养基体积量1%酿酒酵母摇匀之后倒入一次性平板中,等平板凝固放置牛津杯在制成的固体ypd平板上。将在茄子瓶pda斜面上培养7天的青霉菌孢子,用30ml无菌水刮下,稀释一倍,稀释后的孢子液取200ul涂布至pda平板上,所有平板均取相同体积的实施例3制备的纳米银溶液100μl加入牛津杯内,其中1
‑
agnps为阴离子层析洗脱蛋白直接进行纳米银合成实验得到的纳米银溶液,2
‑
agnps为阴离子层析洗脱蛋白透析去除nacl对合成实验干扰所合成的纳米银溶液,氨苄青霉素钠以工作浓度100ug/ml加入100μl,sna15 protein蛋白溶液加入100μl。将lb平板都置于37℃下进行培养,ypd平板置于30℃下进行培养,pda平板置于28℃恒温恒湿培养箱进行培养;其中大肠杆菌、金黄色葡萄球菌培养时间为12h,酿酒酵母培养时间为24h,青霉菌培养时间为72h,其结果图8所示,该纳米银具有广谱抗菌能力,对原核生物大肠杆菌,金黄色葡萄球菌,以及真核生物酿酒酵母,青霉菌均有很好的抑制能力,并且去除nacl所得到的纳米银抑菌效果更强。
54.实施例5
55.采用实施例3合成过程,不同之处在于:硝酸银底物浓度为14mm,合成纳米银的反应温度范围为20℃,转速100rpm,ph为9,反应时间24h。
56.实施例6
57.采用实施例3合成过程,不同之处在于:硝酸银为底物浓度30mm,合成纳米银的反应温度范围为50℃,转速250rpm,ph为13,反应时间16h。
58.在上述条件下,均可以成功合成出纳米银,而且每次合成条件都很稳定。
59.综上,本发明制备的纳米银形状规则为球形纳米银,其中,该合成纳米银反应为非酶催化的纳米银合成反应,该纳米银粒径范围为2
‑
25nm,合成粒径范围可控,并且所合成的纳米银表面包被着蛋白。这说明该纳米银具有良好的生物活性,并且经过国内外文献的报道,纳米银可以用来抵抗肿瘤,有优秀的抗肿瘤作用,有望被运用到肿瘤的治疗当中,例如对于肺癌细胞,乳腺癌细胞的抑制。但是这种具有生物活性的纳米银对正常巨噬细胞毒性很低,有望开发出新的抗癌制剂,同时纳米银拥有优秀的抗菌性能,且具有广谱性,在食品保鲜,水产养殖等诸多领域具有广泛的前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1