草莓斑驳病毒样本保存的方法
1.本发明涉及草莓斑驳病毒样本保存的方法,特别涉及一种草莓斑驳病毒感染的草莓叶片样本的保存方法。
背景技术:
2.草莓是蔷薇科(rosaceae)草莓属(fragaria)多年生宿根草本植物。草莓病毒在世界各草莓栽培区广泛分布,由于草莓生产主要依靠匍匐茎进行无性繁殖,而病毒可随无性繁殖材料和传毒介体传播扩散,严重影响草莓的产量和品质,这也成为了草莓生产中最主要的威胁。
3.草莓斑驳病毒(strawberry mottle virus,smov)是伴生豇豆病毒科(secoviridae)温州蜜柑矮缩病毒属(sadwavirus)未确定种病毒,是一种常见的可以侵染草莓的潜隐性rna病毒。病毒粒子形状为球形,通常存在于植株叶片的表层、韧皮部以及薄壁细胞里。1938年第1次在英格兰凤梨草莓上发现smov,且存在范畴广。在世界各地凡有草莓栽培的地方均有smov的分布。
4.在病毒分子生物学的研究过程中,实验材料的质量好坏是获得高质量rna的前提和保障,它要求在提取rna之前,样品材料不受机械损伤、不被氧化褐变、rna不被内源核酸酶所降解。目前一般采用
‑
20℃、液氮法进行样品的保存,但受限条件较多,且采样区域不定,在现场不能及时进行病毒rt
‑
pcr检测,面临着如何节约资源和远距离采样保存的问题。rt
‑
pcr是检测植物病毒过程中应用最为广泛的方法之一,且灵敏度高操作较简便。在应用rt
‑
pcr技术检测草莓叶片中的smov时发现,所提取出的rna容易降解,若样品保存不当pcr检测效果大大降低。所以病样材料保存质量的高低是开展其分子生物学实验的基础。不同的干燥保存条件适用植物、部位、情况不同。以往的保存方式大多以压干、硅胶干燥、微波干燥、烘干和自然晾干为主,效果也不尽相同。
技术实现要素:
5.本发明探究了草莓叶片不同干燥保存条件对草莓斑驳病毒(strawberry mottle virus,smov)pcr检测效果的影响,筛选出可提高草莓斑驳病毒pcr检测效果的草莓叶片干燥保存条件,便于生产中检测样本的保存和运输,提高检测效率。
6.基于上述研究,本发明的目的是提供一种草莓斑驳病毒感染的草莓叶片样本的保存方法,是将草莓斑驳病毒感染的新鲜草莓叶片样本在cao干燥条件下保存。
7.其中所述cao干燥条件为在放置了cao的密闭容器内。
8.保存温度为室温(16
‑
25℃)即可。
9.cao的添加量为0.5g/0.1
‑
10g新鲜草莓叶片样本,如0.5g/0.2g新鲜草莓叶片样本。
10.含有smov的草莓叶片在cao干燥保存条件下pcr检测效果最好。
11.cao干燥保存含有smov的草莓叶片pcr检测效果最好,该研究结果可以为为高效的
保存草莓叶片中的smov提供参考,提高检测效果。
12.本文主要对已经过rt
‑
pcr验证的新鲜smov阳性草莓叶片使用不同干燥保存条件,包括自然风干保存、硅胶干燥保存和cao干燥保存,通过与其他常见保存条件比较来探究最适宜含有smov的草莓叶片样品干燥保存条件,以达到最好的pcr检测效果。
附图说明
13.图1为smov阳性草莓叶片各干燥保存下不同天数rna浓度(ng/ul);
14.图2为smov阳性草莓叶片各干燥保存下不同天数cdna浓度(ng/ul);
15.图3为不同干燥保存条件下1d、3d、7d后检测rna完整性琼脂糖凝胶电泳,其中,a、b、c分别为不同干燥条件下1d、3d、7d rna琼脂糖凝胶。m:dna marker bm2000+1
‑
3:自然风干4
‑
6:硅胶干燥7
‑
9:cao干燥10:阴性对照。
16.图4为不同干燥保存条件下1d、3d、7d后pcr扩增效果图,其中,a、b、c分别为不同干燥条件下1d、3d、7drna琼脂糖凝胶。m:dna marker bm2000+1
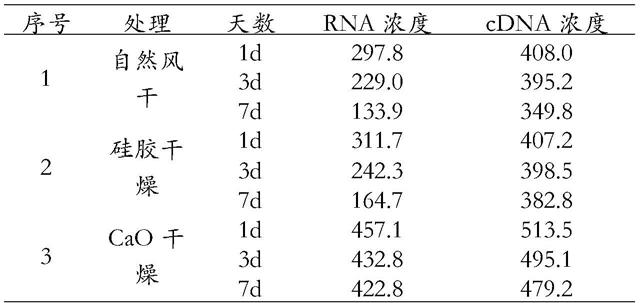
‑
3:自然风干4
‑
6:硅胶干燥7
‑
9:cao干燥10:阴性对照11:阳性对照。
17.图5为六种不同保存条件下5d、10d、15d、20d、30d后pcr扩增效果图,其中a、b、c、d、e分别为六种不同保存条件下5d、10d、15d、20d、30d pcr琼脂糖凝胶。1:自然风干2:烘箱干燥3:cao干燥4:4℃5:
‑
20℃6:
‑
80℃7:阴性对照8:阳性对照
具体实施方式
18.下述实施例中的方法,如无特别说明,均为常规方法。
19.下述实施例中的百分含量,如无特别说明,均为质量百分含量。
20.实施例1、含有smov的草莓叶片的保存方法优化
21.在长期的病毒研究过程中,发明人发现对于含有smov的草莓叶片样本的不同保存方法,对病毒完整性有很大的影响,以致于影响了后期研究检测效率。基于此,本发明探究了草莓叶片不同干燥保存条件对草莓斑驳病毒(strawberry mottle virus,smov)pcr检测效果的影响,筛选出可提高草莓斑驳病毒pcr检测效果的草莓叶片干燥保存条件,便于生产中检测样本的保存和运输,提高检测效率。
22.以经过rt
‑
pcr检测含有smov的草莓叶片为试验材料,设置六种不同的干燥保存条件,包括自然风干保存、硅胶干燥保存、cao干燥保存、以及不同温度低温保存。采用试剂盒提取草莓叶片总rna,通过特异性rt
‑
pcr检测smov,比较草莓叶片不同干燥保存条件对草莓斑驳病毒pcr检测效果的影响。
23.一、新鲜smov阳性草莓叶片的保存
24.材料为经rt
‑
pcr检测感染smov的草莓叶片,采于北京市昌平区草莓种植棚内。将采集的smov阳性草莓叶片平均分为9份,每份0.2g,每3份为一个处理,处理时间分别为1d,3d,7d。
25.处理1将叶片在25℃室温下自然风干保存;
26.处理2将叶片在含有0.5g硅胶颗粒的密闭容器中25℃室温保存;
27.处理3将叶片放入下部铺有0.5g cao粉末的密闭容器中25℃室温保存;
28.从以上3种方法中选取效果最好的干燥方法与其他5种最常见保存方式进行比较。
每份0.2g,处理时间分别为5d,10d,15d,20d,30d。
29.处理1将叶片在25℃室温下自然晾干保存;
30.处理2将叶片在烘箱中50℃干燥2min后25℃室温保存;
31.处理3将叶片放入下部铺有0.5g cao粉末的密闭容器中25℃室温保存;
32.处理4将叶片存放入4℃冰箱中保存;
33.处理5将叶片存放入
‑
20℃冰箱中保存;
34.处理6将叶片存放入
‑
80℃冰箱中保存。
35.二、检测病毒保存质量
36.1、rna质量检测方法
37.1)总rna提取方法
38.使用easy spin植物rna快速提取试剂盒(北京艾德莱生物科技有限公司)提取。
39.2)紫外分光光度法测定rna浓度
40.使用thermo nanodrope 2000微量紫外分光光度计测定每份样品总rna浓度,记录三次重复的平均值。
41.取三次重复的rna浓度数据平均值,第1天自然风干保存、硅胶干燥保存、cao干燥保存下rna浓度分别为297.8ng/ul、311.7ng/ul、457.1ng/ul,第3天自然风干保存、硅胶干燥保存、cao干燥保存下rna浓度分别为229ng/ul、242.3ng/ul、432.8ng/ul,第7天时自然风干保存、硅胶干燥保存、cao干燥保存下rna浓度分别为133.9ng/ul、164.7ng/ul、422.8ng/ul(表1)。cao干燥处理下rna浓度都明显高于另外两种干燥保存方式,且随着保存天数的增加rna浓度变化不大(图1)。
42.表1草莓叶片不同干燥保存条件下总rna和smov cdna浓度
[0043][0044]
3)琼脂糖凝胶电泳检测rna完整性
[0045]
将总rna稀释4倍,取5ul进行1%琼脂糖凝胶电泳,电压5v/cm,电泳后在凝胶成像系统检测。
[0046]
3种干燥保存方法叶片总rna质量见图3。不同处理其总rna完整性存在差异。草莓叶片经过cao干燥保存后随着天数增加总rna完整性较好,28s、18s和5s rrna 3条条带清晰,且28s rrna比18s rrna条带亮,表明rna浓度较高,与紫外分光光度法的结果相一致。而自然风干保存、硅胶干燥保存随着天数增加其总rna质量较差,条带亮度不一,说明总rna已经开始有不同程度的降解。
[0047]
2、cdna质量检测方法
[0048]
1)反转录
[0049]
取11ul depc水、1ul反向引物(smov6732r:5
′‑
caggttactctagtacgtcaccac
‑3′
)(序列表中序列1)、2ul dntp、1.5ul rna,混匀后,65℃水浴5min,冰浴5min。之后分别加入4ul m
‑
mlv buffer,0.5ul m
‑
mlvrt、0.5ul recombinant rnase inhibitor,涡旋离心后42℃ 1h、72℃ 15min,得到cdna。
[0050]
2)紫外分光光度法测定cdna浓度
[0051]
使用thermo nanodrope 2000微量紫外分光光度计测定cdna浓度,记录三次重复的平均值。
[0052]
取三次重复实验的cdna浓度数据平均值,第一天自然风干保存、硅胶干燥保存、cao干燥保存下cdna浓度分别为408ng/ul、407.2ng/ul、513.5ng/ul,第三天自然风干保存、硅胶干燥保存、cao干燥保存下rna浓度分别为395.2ng/ul、398.5ng/ul、495.1ng/ul,第七天时自然风干保存、硅胶干燥保存、cao干燥保存下rna浓度分别为349.8ng/ul、382.8ng/ul、479.2ng/ul(表1)。cao干燥处理下cdna浓度都明显高于另外两种干燥保存方式,且随着保存天数的增加cdna浓度变化不大(图2)。
[0053]
3)pcr检测
[0054]
pcr体系:2xtaq pcr mix 12.5ul、正向引物(smov6126f:5
′‑
ggtttgaaggaatagggttgttg
‑3′
)与反向引物(smov6732r)各0.5ul、cdna 2ul、加dd h2o水至25ul。
[0055]
扩增程序为94℃5min;94℃ 30s,58℃ 40s,72℃ 1min,35个循环;72℃5min。
[0056]
取5ul pcr产物进行1%琼脂糖凝胶电泳,紫外凝胶成像检测。
[0057]
草莓叶片经过3种不同干燥保存处理后提取总rna并进行特异性反转录,获得cdna,取1ulcdna进行smov的特异性pcr检测。结果如图4所示。结果表明,经cao干燥处理后的9份草莓叶片样品cdna都得到了扩增产物且扩增条带明亮整齐。经自然风干和硅胶干燥保存后的草莓叶片样品中,随着保存时间增加,扩增条带亮度逐渐变暗甚至消失。可以看出cao干燥保存草莓叶片对smov的pcr检测效果最好。
[0058]
上述试验证实,cao保存为其中最好的干燥保存方法。为了将它与几种最常见的叶片保存方式进行比较,进行了这6种不同处理下smov的rt
‑
pcr检测分析,结果见图5。
[0059]
由此可见,随着时间的推移,即使到了30天,cao干燥保存后的叶片依旧能扩增出最明亮清晰的目的条带。而其它几种方法扩增条带较暗淡,扩增产物量少甚至逐渐消失。因此,cao干燥保存效果最佳,且稳定。
[0060]
研究结果表明,cao干燥草莓叶片是最理想的方法,pcr扩增smov效果最好。长距离的野外采样时可采用cao干燥保存样品,这样可在不影响调查的情况下提高保存效果并降低保存成本。
[0061]
pcr扩增是分子生物学研究的基本手段,灵敏度高且方便快捷。由于rna病毒极易降解,且草莓植株中病毒含量极低,采集样品后在现场不能及时进行病毒rt
‑
pcr检测,有时样品送检过程的时间较长,这些都涉及到短期保存问题。可见保存带毒植物材料不易。若采集草莓叶片后若保存方法不当,新鲜材料在旅途中可能枯萎、腐烂,特别是一些离体草莓叶片材料中的rna病毒极易受rna酶的作用导致降解,无法获得高质量的病毒rna。因此,病毒资源的有效保存技术能够为研究提供基本的材料,具有十分重要的意义[22]。课题组在多年的草莓病毒检测中发现smov的检测效率低,无法长期高质量保存离体带毒叶片。因此找
到一种简单快捷的草莓叶片样品保存方法对于后续病毒检测工作的进行也非常重要。
[0062]
草莓成熟叶片中含有大量的多糖、蛋白质、多酚和色素等物质,相比于其他植物通过试剂盒提取草莓叶片rna的效果更好。对于cao干燥的效果高于晾干和硅胶干燥,原因可能是由于密闭环境下cao可以和草莓叶片呼吸作用释放出的水分相结合,达到脱水效果,没有水分的存在rna酶无法水解叶片中的rna,从而抑制叶片中rna的降解。
[0063]
该研究结果可以为提高草莓斑驳病毒pcr检测效果提供参考,对病毒资源的长期有效保存具有十分重要的意义。
[0064]
以上说明对本发明而言只是说明性的,而非限制性的,本领域普通技术人员理解,在不脱离所附权利要求所限定的精神和范围的情况下,可做出许多修改、变化或等效,但都将落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1