人食管鳞状细胞癌的分子标记物组及其应用
32.seq id no.2:下游引物:5
’‑
ttgcggcagcatttcatctg-3’33.vwa2
34.seq id no.3:上游引物:5
’‑
ctgcacactgtcccttctaca-3’35.seq id no.4:下游引物:5
’‑
ggtagccgtccagtccttct-3’36.sfrp1
37.seq id no.5:上游引物:5
’‑
tggcccgagatgcttaagtg-3
‘
38.seq id no.6:下游引物:5
’‑
cctcagtgcaaactcgctgg-3’39.lgr6
40.seq id no.7:上游引物:5
’‑
tgggaagaccaaggttgacac-3’41.seq id no.8:下游引物:5
’‑
agagagacgcagctcctccaa-3’42.xcl1
43.seq id no.9:上游引物:5
’‑
tgctctctcactgcatacattg-3’44.seq id no.10:下游引物:5
’‑
tggtgtaggtcttgattctgct-3’。
45.本发明还涉及一种用于治疗食管鳞状细胞癌(escc)的药物,
46.所述的食管鳞状细胞癌(escc)的亚型为nk细胞表面标记物高表达亚型;
47.所述的药物为封闭xcl1、xcl2、cd160的药物;优选的,所述的药物为lcl-161,其结构如下式所示:
[0048][0049]
优选的,所述的药物还包括:必要的药用辅料。
[0050]
本发明的有益效果在于,
[0051]
(1)我们对未经治疗的escc患者中匹配正常组织的肿瘤进行了全面的基因组学和深度转录组学分析,这些患者在手术切除后进行了四年以上的随访。
[0052]
(2)我们探索了转录组亚型和不同的免疫微环境,并发现了新的肿瘤内在免疫逃逸机制。随后合并这些数据以提供一组可靠的预后生物标志物。
[0053]
(3)我们的研究拓宽了escc分子和组织学多样性的知识,并为escc的治疗提供了新的潜在治疗靶点。
附图说明
[0054]
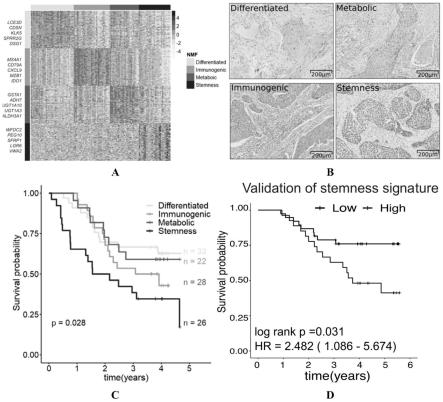
图1、escc的转录组分型及鉴定,
[0055]
1a,120例的食管鳞癌的全基因组表达数据nmf聚类分型结果;
[0056]
1b,各个分型样本具有不同的细胞学特征;
[0057]
1c、各个亚型的生存分析结果;
[0058]
1d、细胞干型特征基因表达高的分组生存差。
[0059]
图2、escc的免疫细胞标记物分型及关联分析,
[0060]
2a、免疫分析分型结果;
[0061]
2b、c3分型中的样本中xcl1和xcl2基因的表达量显著高于其他两个分型;
[0062]
2c、b细胞和nk细胞水平高和食管癌的预后不良相关;
[0063]
2d、本地样本集(china)和tcga样本集中,以nk细胞标记物区分的escc患者的预后情况,都显示出了显著差异;
[0064]
2e、c3免疫型中,stemness转录组基因型占比最高;
[0065]
2f、c3免疫型的患者样本中,xcl1、xcl2和cd160等nk细胞标记基因和细胞干型代表基因lgr6表达呈现显著正相关;
[0066]
2g、对肿瘤标本进行lgr6、xcl1和cd160的共表达进行免疫组化分析。
[0067]
图3、xcl1基因的表达与食管鳞癌的药物敏感性分析
[0068]
3a、xcl1表达中位值可以把食管鳞癌细胞系分成两类;
[0069]
3b、xcl1高表达细胞系对5-氟尿嘧啶不敏感;
[0070]
3c、在xcl1低表达细胞系中过表达xcl1后,对5-氟尿嘧啶敏感度显著降低;
[0071]
3d、对xcl1高表达细胞系药物的活性筛选结果。
具体实施方式
[0072]
实施例1、食管鳞状细胞癌(escc)全转录组分析及分型、预后分析及验证
[0073]
收集120例食管鳞癌的手术标本(郑州大学第一附属医院伦理委员会伦理审查编号:2019-ky-51),进行全转录组测序,确保每个样本产出5gb以上的数据量(碱基数目),将测序数据采用salmon软件进行转录本数据回帖人类基因组37版本转录组并对每个基因进行计数定量。
[0074]
将每个样本的基因定量数据合并为一个矩阵,只保留个体间平均绝对偏差最大的1,500个基因,进行非负矩阵分解(nmf)聚类分析,最优的聚类分析结果由最大态相关系数和在三个数据集的验证情况决定。特征基因选择采取当前分型和其他样本进行对比,采用limma软件进行差异基因分析,找出在该分型中高表达基因,要求差异倍数在1以上。将每个分型的差异基因进行基因富集分析(gsea)获取和该亚型最相关的(p《0.001)基因集。
[0075]
结果如图1a所示,对120例的食管鳞癌的全基因组表达数据nmf聚类分型分为四个亚型,根据每个亚型的基因富集分析得到相关基因集将四个亚型分别命名为:
[0076]
分化型(differentiated),代表基因为lce3d、cdsn、klk5、sprr2g和dsg1等;
[0077]
免疫型(immunogenic),代表基因为ms4a1、cd79a、cxcl9、mzb1和ido1等;
[0078]
代谢型(metabolic),代表基因为gsta1、adh7、ugt1a3和aldh3a1等;和
[0079]
细胞干型(stemness),代表基因为wfdc2、peg10、sfrp1、lgr6和vwa2等。
[0080]
苏木精-伊红(he)染色玻片可以发现各个分型样本具有不同的细胞学特征(图1b)。
[0081]
为考察不同亚型间的预后价值,对120例病人进行随访跟踪,最终获取109例病人的随访信息,结合年龄、性别、抽烟、饮酒、肿瘤分期和分级等临床病理特征进行kaplan-meier曲线分析和cox多因素分析确定各个分析间是否具有生存差异。生存分析结果如图1c所示,结果表明各个亚型间的预后存在明显差异,尤其是细胞干型的病人长期生存期最短。
[0082]
为了验证细胞干型亚型的预后价值,选取wfdc2、vwa2、sfrp1和lgr6四个代表基因和gapdh作为参考基因设计qrtpcr引物(引物的序列结构)。对另外一个样本集65个样本进行基因表达定量,每个样本的每个基因进行三次pcr反应,基因ct值为三次实验的平均值(qrtpcr结果的原始ct数据见表2)。求取每个基因和gapdh表达ct值的差值计算-delta ct值作为每个基因的表达量,将四个基因的表达量进行加和代表一个样本的细胞干型数值,根据细胞干型数值将样本分为高低两组,进行kaplan-meier曲线分析和cox多因素生存分析决定其和生存的关系。
[0083]
表1、细胞干型分型代表基因的q-pcr表达量数据和对照基因的引物列表
[0084]
基因上游引物序列下游引物序列wfdc25
’‑
ctgcccaatgataaggagggt-3
’5’‑
ttgcggcagcatttcatctg-3’vwa25
’‑
ctgcacactgtcccttctaca-3
’5’‑
ggtagccgtccagtccttct-3’sfrp15
’‑
tggcccgagatgcttaagtg-3
‘5’‑
cctcagtgcaaactcgctgg-3’lgr65
’‑
tgggaagaccaaggttgacac-3
’5’‑
agagagacgcagctcctccaa-3’gapdh5
’‑
gactgtggatggcccctccgg-3
’5‘‑
aggtggaggagtgggtgtcgc-3’[0085]
我们在不同的样本集对细胞干型特征基因进行rtpcr表达定量分析其预后相关性,发现细胞干型基因表达高的分组生存差(图1d),具有显著统计差异。
[0086]
表2、65例样本的干型分型代表基因的q-pcr表达量数据
[0087]
[0088]
[0089][0090]
实施例2、食管鳞状细胞癌(escc)免疫分型及解析
[0091]
有很多不同的基因标记(gene signatures)被用来进行肿瘤微环境和免疫细胞解析,但其表现差异十分显著,我们选取了timer、mcp-count、danaher、xcell、davoli、rooney等6种不同的方法来评估同样来自实施例1的食管鳞癌队列(120例样本)的的免疫微环境,通过和免疫组化结果相关性分析确定食管鳞癌免疫细胞类型,然后利用一致性聚类方法对食管鳞癌进行免疫微环境聚类,相关参数设置为聚集层次聚类和皮尔逊相关距离和50次重抽样。在综合比较各个软件对食管鳞癌免疫细胞预测能力后我们确定了danaher为主、结合davoli的cd4+t细胞的预测解析方法,最终确定了13种相关的免疫细胞类型。利用这三种免疫细胞对食管鳞癌进行聚类分析,120例本地食管鳞癌样本可分为三个免疫亚型:c1(热免疫型)、c2(免疫中间型)和c3(冷免疫型),免疫分析分型结果如图2a所示。最佳的聚类分型结果由共识矩阵和聚类追踪图(tracking plot)共同决定(以转录组数据为基础)。免疫细胞聚类采用皮尔逊相关性和均值聚类法决定。该免疫分型结果同时使用mcp-counter的免疫细胞特征分析进行验证。
[0092]
xcl1和xcl2是nk细胞的标记基因,通过wilcox秩和检验(wilcoxon rank-sum test)我们比较了xcl1和xcl2在确定的3个免疫亚型间的分布差异,以确定其是否和免疫亚型聚类结果一致。结果如图2b所示,可见,c3分型中的样本中,xcl1和xcl2基因的表达量显著高于其他两个分型。这提示我们,可以进一步用免疫细胞标记物的水平对escc患者的预后进行进一步分析。
[0093]
各个免疫细胞的对预后价值我们通过采取kaplan-meier曲线分析和cox多因素分析确定各个分析间是否具有生存差异,每个细胞的风险比和95%的置信区间和p value都进行了统计并将细胞按照风险比从小到大进行排序。结果如图2c所示,b细胞和nk细胞水平高和食管癌的预后不良相关,cd8+t细胞水平越高食管癌患者预后越好,进一步的,nk细胞水平高于2.02是食管癌的不良预后标记。
[0094]
为明确nk细胞是否在不同的数据集得到验证,我们采用同样的方法对来自于实施例1的120例本地样本和来自于tcga的数据(90例)中的免疫细胞标记物进行了解析(对tcga
数据的处理中,按照0.658为界值将nk细胞水平分为高和低两组),然后使用kaplan-meier曲线分析进行了其生存预测价值,结果如图2d所示,结果显示,在实施例1的本地样本集(china)和tcga样本集中,以nk细胞标记物区分的escc患者的预后情况,都显示出了显著差异。
[0095]
为了考察基于基因表达特征分型和免疫分型之间有没有关联性,我们将两个分型结果放在一起进行比较,考察每个免疫亚型的样本中分化型、免疫型、代谢型和细胞干型样本的分布情况,并进行统计分析。得出的结论是c3免疫型中,stemness转录组基因型占比最高(图2e)。
[0096]
lgr6是实施例1确定的细胞干型的代表基因,我们通过计算其表达水平和nk细胞特征基因表达的皮尔逊相关性和进行拟合直线作图,结果如图2f所示,可见在c3免疫型的患者样本中,xcl1、xcl2和cd160等nk细胞标记基因和细胞干型代表基因lgr6表达呈现显著正相关。
[0097]
最后,进一步利用连续切片对肿瘤标本进行lgr6、xcl1和cd160的共表达进行免疫组化分析,结果如图2g所示,xcl1和lgr6的免疫组化结果显示,xcl1多分布在肿瘤细胞而非免疫细胞,cd160在免疫细胞和肿瘤细胞中都一定的表达分布。
[0098]
上述结果显示,细胞干型的escc患者的免疫分型相对一致,都属于nk细胞标记物高表达的免疫分型(c3亚型),预后分析结果也显示出两种分型同样有较差的预后结果。
[0099]
实施例3、不同分型的escc亚型的药物敏感性差异
[0100]
从ccle数据库下载22个食管鳞癌的细胞系rna-seq基因表达数据,根据xcl1表达水平按照中位值进行分组进行差异基因分析,并对细胞干型食管鳞癌标记lgr6表达水平和xcl1表达水平进行相关性分析。结果显示,根据xcl1表达中位值可以把食管鳞癌细胞系分为11个低表达组细胞系和11个高表达组细胞系(图3a),表达水平差异显著(t test p值小于0.05)的基因共有97个,采用这97个差异基因进行差异层次聚类结果表明xcl1高表达细胞系和低表达细胞系可以利用该97个差异完美的聚集为两个亚群,而且皮尔逊相关性分析表明xcl1表达水平和lgr6呈现为显著正相关(r:0.59)(图3b)。
[0101]
选取本实验室留存的xcl1高表达细胞系kyese-30、kyse-140、kyse-510、kyse-520和xcl1低表达细胞系kyse-180、kyse-270、kyse450、kyse-70、kyse-150、kyse410共10个细胞系进行了5-氟尿嘧啶药物杀伤实验。具体实验过程如下:
[0102]
(1)细胞准备:用胰酶消化对数期细胞,使用10%dmd重悬,终浓度为4.4x104cells/ml,按照4000细胞每孔的浓度加入到96孔板,上、右、下边孔加入100μl pbs,左边孔加入10%dmem作为空白对照。
[0103]
(2)培养24小时后,用10%dmem稀释药物至10
×
浓度,按药物浓度由高到低将10μl药物加入96孔板中,最右侧细胞孔为阴性对照,不加药。
[0104]
(3)在37℃培养箱5%co2浓度环境下培养72小时。避光条件下,将mts与pms按20:1混匀,然后加入pbs以外所有孔内20μl,放入37℃,co2培养箱中继续培养3h;
[0105]
(4)在反应时间内mts与pms形成稳定溶液,用酶标仪在490nm波长处读出各孔的od值;
[0106]
(5)根据细胞活力,采用graphpad prism 5计算半抑制浓度(ic50)。
[0107]
进一步的,我们利用xcl1低表达细胞系kyse-150构建xcl1过表达细胞系然后再进
行同样的药物杀伤实验。过表达细胞系构建过程如下:
[0108]
(1)使用genewiz合成人源xcl1cdna并克隆到慢病毒载体;
[0109]
(2)分别将1x105个细胞加入到24孔板,使用moi(感染复数)=50感染克隆xcl1慢病毒或未克隆xcl1慢病毒,培养72小时后使用嘌呤霉素(puromycin)进行细胞筛选,xcl1的表达量通过qrtpcr进行定量确定,设计引物如下:
[0110]
上游引物:5
’‑
tgctctctcactgcatacattg-3’[0111]
下游引物:5
‘‑
tggtgtaggtcttgattctgct-3’[0112]
获得了过表达xcl1的kyse-150细胞系之后,重复上述杀伤实验。
[0113]
结果显示,5-氟尿嘧啶药物敏感性实验结果表明xcl1高表达细胞系对5-氟尿嘧啶不敏感(图3c),同样的结论在过表达xcl1的kyse-150细胞系中也得到了验证(图3d)。
[0114]
最后,我们进一步对gdsc(genomics of drug sensitivity in cancer,https://www.cancerrxgene.org)的367个药物杀伤敏感性进行了xcl1高表达和低表达组的对比分析,部分活性差异较大的药物的活性筛选结果如图3e所示,表明xcl1高表达食管鳞癌对lcl-161(结构式如下式所示)更敏感。
[0115][0116]
最后需要说明的是,以上实施例仅用于本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1