能够仅使用二氧化碳和甲酸生长的重组微生物及使用所述重组微生物产生有用物质的方法与流程
8,2020)。然而,存在的局限性在于细胞生长水平非常低。
6.因此,在先前的研究中(韩国专利号10-2000755),诸位发明人设计并且验证了用于将作为c1化合物的甲酸转化为由若干个碳构成的有用化合物的新型代谢途径,并且对使用所述代谢途径且仅使用二氧化碳和甲酸作为碳源生长的微生物的开发进行了另外的研究。结果是,诸位发明人发现,可以通过使大肠杆菌的基因组中缺失编码酶磷酸核糖甘氨酰胺甲酰基转移酶的基因、增强糖异生的代谢流、并且引入衍生自念珠菌属(candida)微生物的甲酸脱氢酶和衍生自拟南芥属(arabidopsis)植物的甲酸脱氢酶的突变基因,仅使用二氧化碳和甲酸作为碳源使微生物生长。此外,诸位发明人已经发现,通过以下方式微生物可以生长至足够高的细胞密度以适用于有用化学物质的产生:调节表达重构的四氢叶酸代谢循环的基因、表达衍生自念珠菌属微生物的甲酸脱氢酶和衍生自拟南芥属植物的甲酸脱氢酶突变体的基因的表达水平,通过改变培养温度条件来有效调节微生物能量供应所需膜蛋白的表达水平,开发根据微生物的生长增加曝气的培养工艺,并且开发将培养基中甲酸的浓度维持在最佳水平的培养工艺。基于这些发现,已经完成了本发明。
7.[相关技术文献]
[0008]
[专利文献]
[0009]
[专利文献1]
[0010]
(专利文献1)pct/us2008/083056
[0011]
(专利文献2)us 2003/0124687
[0012]
(专利文献3)us 2013/0196359
[0013]
(专利文献4)kr 10-2000755
[0014]
[非专利文献]
[0015]
(非专利文献1)kumar等人,nat.comm,2819,2013
[0016]
(非专利文献2)christopher等人,angew.chem.int.ed.49:50,9777-9780,2010
[0017]
(非专利文献3)studt等人,nat.chem,6,320-324,2014
[0018]
(非专利文献4)schwander等人,science,354:6314.900-904,2016
[0019]
(非专利文献5)gleizer,s.等人cell 179,1255-1263,2019
[0020]
(非专利文献6)kim,s.等人nat.chem.biol.1-8,2020
技术实现要素:
[0021]
因此,已经鉴于上述问题完成了本发明,并且本发明的一个目的是提供具有改善的从甲酸和二氧化碳合成有用物质(包括c3化合物)的效率的重组微生物。
[0022]
本发明的另一个目的是提供使用重组微生物从甲酸和二氧化碳产生有用物质(包括c3化合物)的方法。
[0023]
根据本发明的一方面,以上和其他目的可以通过提供重组微生物来实现,在所述重组微生物中编码甘氨酸切割系统转录阻遏物、丙酮酸甲酸裂解酶、或磷酸甘油酸脱氢酶的基因从具有甲酸同化途径的宿主微生物中被减弱或缺失,编码参与甘氨酸切割系统反应的酶的基因在具有所述甲酸同化途径的宿主微生物中增强地表达,并且编码甲酸-四氢叶酸连接酶、次甲基四氢叶酸环化水解酶、或亚甲基-四氢叶酸脱氢酶的基因被引入具有所述甲酸同化途径的宿主微生物中。
[0024]
根据本发明的另一方面,提供了一种产生c3化合物的方法,所述方法包括(a)用甲酸和二氧化碳作为碳源培养重组微生物以产生c3化合物的步骤,以及(b)收集所产生的c3化合物的步骤。
[0025]
根据本发明的另一方面,提供了一种用于产生使用丙酮酸作为中间产物的有用化合物的方法,所述方法包括:(a)用甲酸和二氧化碳作为碳源培养重组微生物以产生具有丙酮酸作为中间产物的有用物质的步骤;以及(b)回收所产生的有用物质的步骤。
附图说明
[0026]
从以下具体实施方式结合附图将更清楚地理解本发明的上述和其他目的、特征和其他优点,在所述附图中:
[0027]
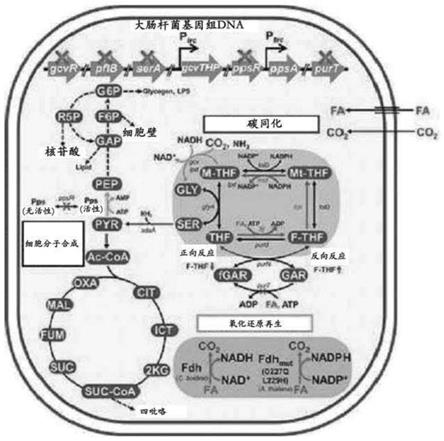
图1示出了重组微生物的同化二氧化碳和甲酸的核心代谢途径,以及其中参与的基因、酶和代谢物;
[0028]
图2是通过将参与二氧化碳和甲酸的同化的基因引入质粒所产生的质粒图谱,所述质粒中插入有衍生自念珠菌属(candida)和拟南芥属(arabidopsis)的甲酸脱氢酶和衍生自拟南芥属的甲酸脱氢酶的突变体;
[0029]
图3是示出所产生的dh5αfc1至dh5αfc5菌株当仅用二氧化碳和甲酸培养时的细胞生长的图;
[0030]
图4是示出dh5αfc5菌株的cfu随时间的变化量的图;
[0031]
图5是根据培养条件的优化比较细胞生长的图;
[0032]
图6示出了所产生的质粒的图谱,所述质粒根据质粒类型具有不同质粒拷贝数和基因表达水平变化;
[0033]
图7是示出仅用二氧化碳和甲酸培养的dh5αfc5、fc7和fc8菌株的每一种的细胞生长的图;
[0034]
图8是示出仅使用二氧化碳和甲酸的烧瓶培养时dh5αfc8菌株的细胞生长的图;
[0035]
图9是示出dh5αfc8菌株在32℃培养时与37℃相比cyoa、cyob、cyda、和cydb的相对表达水平的图;
[0036]
图10是示出在仅使用二氧化碳和甲酸的发酵罐培养中dh5αfc8菌株的细胞生长的图;
[0037]
图11是示出在仅使用二氧化碳和甲酸的发酵罐培养中dh5αfc8菌株的细胞生长的图;
[0038]
图12是示出在仅使用二氧化碳和甲酸的发酵罐培养中dh5αfc8菌株的细胞生长的图;以及
[0039]
图13是示出在引入了甲酸同化代谢途径的曼氏杆菌属(mannheimia)菌株(lpk7_ftf)和野生型曼氏杆菌属菌株(lpk7)中,在丝氨酸中检测到的源自甲酸的
13
c碳的图。
具体实施方式
[0040]
除非另外定义,否则本文所用的所有技术和科学术语都具有与由本发明所涉及领域的技术人员所理解的含义相同的含义。通常,本文所用的命名法是本领域中熟知的,并且是通常使用的。
[0041]
本发明基于以下发现:可以通过进一步改善诸位发明人设想的具有能够从甲酸和二氧化碳合成c3化合物的新型循环代谢途径的重组微生物(韩国专利号10-2000755)来明显提高二氧化碳和甲酸转化为丙酮酸的速率;特别地,可以制造能够仅使用二氧化碳和甲酸而不用另外供应葡萄糖(常规被提供用于使重组微生物生长)而生长的重组微生物;以及与相关技术相比通过改善发酵工艺(其中重组微生物也可以合成丙酮酸)可以明显改善c3化合物合成效率。
[0042]
在一方面,本发明涉及一种重组微生物,其中编码甘氨酸切割系统转录阻遏物、丙酮酸甲酸裂解酶、或磷酸甘油酸脱氢酶的基因从具有甲酸同化途径的宿主微生物中被减弱或缺失,
[0043]
编码参与甘氨酸切割系统反应的酶的基因在具有所述甲酸同化途径的宿主微生物中增强地表达,并且
[0044]
编码甲酸-四氢叶酸连接酶、次甲基四氢叶酸环化水解酶、或亚甲基-四氢叶酸脱氢酶的基因被引入具有所述甲酸同化途径的宿主微生物中。
[0045]
根据本发明,甲酸碳同化途径是用于在微生物中将二氧化碳和甲酸同化为具有三个碳原子的丙酮酸的循环途径。参与大肠杆菌的甲酸同化途径的基因、辅酶和能量载体在图1中示出。
[0046]
根据本发明,甲酸同化途径可以与中心碳同化途径组合,以合成具有三个或更多个碳原子的碳化合物。宿主微生物:i)固有地具有中心碳同化途径;或i)具有引入其中的中心碳同化途径。
[0047]
根据本发明,宿主微生物选自埃希氏杆菌属(scherichia)、曼氏杆菌属、红杆菌属(rhodobacter)和甲基杆菌属(methylobacterium),但是不限于此。
[0048]
根据本发明,可以通过将天然启动子用强启动子取代来增强编码参与所述甘氨酸切割系统反应的酶的基因的表达,但是本发明不限于此。
[0049]
根据本发明,所述强启动子选自trc启动子、tac启动子、t7启动子、lac启动子和trp启动子,但是不限于此。
[0050]
根据本发明,所述甲酸-四氢叶酸连接酶、所述次甲基四氢叶酸环化水解酶和所述亚乙基-四氢叶酸脱氢酶衍生自扭脱甲基杆菌(methylobacterium extorquens),但是本发明不限于此。编码甲酸-四氢叶酸连接酶的基因具有seq id no:1的核苷酸序列,编码次甲基四氢叶酸环化水解酶的基因具有seq id no:2的核苷酸序列,以及编码亚甲基-四氢叶酸脱氢酶的基因具有seq id no:3的核苷酸序列,但是本发明不限于此。
[0051]
根据本发明,编码磷酸烯醇丙酮酸合酶调节蛋白或磷酸核糖甘氨酰胺甲酰基转移酶的基因可以在重组微生物中可被进一步减弱或缺失,在重组微生物中编码磷酸烯醇丙酮酸合酶或h
+-易位nad(p)转氢酶的基因的表达可被进一步增强,以及编码甲酸脱氢酶和/或其突变体的基因可被进一步引入重组微生物中。
[0052]
根据本发明,通过将天然启动子用强启动子取代来增强编码磷酸烯醇丙酮酸合酶(ppsa)和h
+-易位nad(p)转氢酶(pntab)的基因的表达,并且所述强启动子选自trc启动子、tac启动子、t7启动子、lac启动子和trp启动子,但是本发明不限于此。
[0053]
根据本发明,编码选自甲酸-四氢叶酸连接酶、次甲基四氢叶酸环化水解酶、亚甲基-四氢叶酸脱氢酶、甲酸脱氢酶、和甲酸脱氢酶突变体中的一种或多种的基因通过克隆到
含有具有1至12个拷贝的复制起点的载体中(优选地,通过克隆到包括具有1至5个拷贝的复制起点的载体中)而被引入,但是本发明不限于此。
[0054]
根据本发明,所述甲酸脱氢酶可以衍生自博伊丁假丝酵母(candida boidinii),并且编码所述甲酸脱氢酶突变体的基因可以衍生自拟南芥(arabidopsis thaliana),但是本发明不限于此。
[0055]
根据本发明,编码所述甲酸脱氢酶的基因由seq id no:18的核苷酸序列表示,并且编码所述甲酸脱氢酶突变体的基因由seq id no:21的核苷酸序列表示,但是本发明不限于此。
[0056]
根据本发明的一个方面,将天然启动子用强启动子替代,以便增强编码参与重组微生物中的甘氨酸切割系统反应的酶的基因,并且使编码甘氨酸切割系统转录阻遏物的基因缺失,以便抑制甘氨酸切割系统。此外,使编码丙酮酸甲酸裂解酶的基因缺失,以防止丙酮酸向甲酸的不必要转化,并且改善丙酮酸形成流。此外,编码d-3-磷酸甘油酸脱氢酶的基因是在含有葡萄糖的m9基本培养基中生长所必需的基因。当缺失此基因时,可以仅通过c1化合物同化途径产生5,10-ch
2-thf,所述5,10-ch
2-thf是代谢物(诸如嘌呤和甲硫氨酸)的生物合成所必需的。出于这个原因,随着c1化合物同化途径的代谢流增强,有助于菌株的生长。因此,使编码d-3-磷酸甘油酸脱氢酶的基因缺失。
[0057]
根据本发明的重组微生物能够仅使用甲酸和二氧化碳作为碳源产生c3化合物。
[0058]
根据本发明的重组微生物还能够仅使用甲酸和二氧化碳作为碳源生长。
[0059]
本发明的基因可以在编码区中以多种方式改变(只要从编码区表达的蛋白质的氨基酸序列没有改变即可),并且可以被自由改变或修饰(只要基因的表达在编码区以外的区域中不受影响即可),并且此类改变或修饰的基因也落入本发明的范围内。
[0060]
因此,本发明还包括具有与所述基因基本上相同的核苷酸序列的多核苷酸以及所述基因的片段。术语“基本上相同的多核苷酸”意指编码具有与在本发明中使用的酶的功能相同的功能的酶的基因,而不考虑序列的同源性。术语“基因片段”也意指编码具有与在本发明中使用的酶的功能相同的功能的酶的基因,而不考虑片段的长度。
[0061]
此外,蛋白质(其是本发明基因的表达产物)的氨基酸序列可以从诸如各种微生物等生物资源获得,只要不影响相应的酶的效价和活性即可,并且这些生物资源也落入本发明的范围内。
[0062]
因此,本发明还包括具有与所述蛋白质基本上相同的氨基酸序列的多肽和所述多肽的片段。术语“基本上相同的多肽”意指具有与在本发明中使用的蛋白质的功能相同的功能的蛋白质,而不考虑氨基酸序列的同源性。术语“多肽片段”也意指具有与在本发明中使用的蛋白质的功能相同的功能的蛋白质,而不考虑片段的长度。
[0063]
如本文所用,术语“载体”意指含有与调控序列可操作地连接的能够在合适的宿主中表达dna的dna序列的dna产物,并且可以是质粒、噬菌体颗粒或简单的潜在基因组插入物。一旦将载体转化到合适的宿主中,它可以独立于宿主的基因组复制和起作用,或者在一些情况下可以与所述宿主基因组整合。由于质粒是最常用的载体类型,因此所述术语“质粒”和“载体”有时在本发明的说明书中可互换使用。为了本发明的目的,优选使用质粒载体。可用于此目的的典型质粒载体包括(a)有效进行复制的复制起点,以便每个宿主细胞包括若干个到数百个质粒载体,(b)用于筛选由质粒载体转化的宿主细胞的抗生素抗性基因,
和(c)插入外源dna片段的限制性酶切位点。即使不存在适当的限制酶切割位点,载体和外源dna也可以根据常规方法使用合成的寡核苷酸衔接子或接头容易地连接。连接后,应将所述载体转化到合适的宿主细胞中。使用氯化钙或电穿孔方法可以容易地进行转化(neumann等人,embo j.,1:841,1982)。
[0064]
根据本发明,“基因被减弱(或失活)”意指与野生型相比,所述基因的表达被减弱,或者与野生型相比,由所述基因编码的蛋白质的功能或活性被减弱。
[0065]
根据本发明,本领域熟知的表达载体可以用作增强或过表达基因的载体。
[0066]
当一个核苷酸序列与另一个核苷酸序列基于功能关系对齐时,可以称二者是“可操作地连接的”。这可以是以如下方式连接的一个或多个基因和一个或多个调节序列,所述连接方式使得当合适的分子(例如,转录激活因子蛋白)与一个或多个调节序列连接时实现基因表达。例如,当作为参与多肽分泌的前蛋白表达时,前序列或分泌前导序列的dna与所述多肽的dna可操作地连接;当启动子或增强子影响序列的转录时,其与编码序列可操作地连接;当核糖体结合位点影响序列的转录时,其与编码序列可操作地连接;或者当被定位以促进翻译时,核糖体结合位点与编码序列可操作地连接。通常,“可操作地连接”是指所述连接的dna序列与其接触,或指分泌前导序列与其接触并存在于阅读框中。然而,增强子不需要接触。这些序列通过在便利的限制性酶切位点处的连接(联接)进行联接。当不存在这样的位点时,使用根据常规方法的合成的寡核苷酸衔接子或接头。如本领域熟知的,为了提高转基因在宿主细胞中的表达水平,基因应当与在所选择的表达宿主中发挥作用的转录/翻译表达调控序列可操作地连接。优选地,表达调控序列和相应的基因包含在含有细菌选择标记物和复制起点的一种重组载体中。当宿主细胞是真核细胞时,重组载体还应在真核表达宿主中包括有用的表达标记物。
[0067]
用上述重组载体转化的宿主细胞构成本发明的另一个方面。如本文所用,术语“转化”意指将dna引入宿主中并使dna可使用染色体外因子或染色体整合进行复制。
[0068]
应当理解,并非所有载体在表达本发明的dna序列时都起相同作用。同样,并非所有宿主对同一表达系统都同样地起作用。然而,本领域技术人员将能够在没有过多的实验负担和不脱离本发明的范围的情况下从各种载体、表达调控序列和宿主中进行适当的选择。例如,对载体的选择应该在考虑宿主的情况下进行,因为所述载体应该在其中复制。还应当考虑载体的复制次数、控制复制次数的能力以及由相应的载体编码的其他蛋白质的表达,诸如抗生素标记物的表达。
[0069]
此外,在本发明中引入的基因可以引入宿主细胞的基因组中并可以作为染色体因子存在。对于本领域技术人员而言清楚的是,甚至将基因插入宿主细胞的基因组中也与将重组载体引入宿主细胞中具有相同的效果。
[0070]
同时,在本发明中发现,在培养重组微生物的步骤中,可以通过调节iptg的剂量、培养温度、曝气以及甲酸浓度和ph条件将重组微生物的生长提高到7-11倍。
[0071]
在另一方面,本发明涉及一种产生c3化合物的方法,所述方法包括:(a)用甲酸和二氧化碳作为碳源培养重组微生物以产生c3化合物的步骤,以及(b)收集所产生的c3化合物的步骤。
[0072]
根据本发明,在培养重组微生物的步骤中添加0.02至0.08mm iptg,优选0.04至0.06mm iptg,最优选0.05mm iptg。与使用1mm iptg的相关技术相比,此举使用明显降低的
iptg剂量诱导基因表达。这可以增强微生物的生长,同时精细控制使用二氧化碳和甲酸进行的丙酮酸合成代谢途径。
[0073]
根据本发明,可以将所述重组微生物在31℃至33℃,优选在32℃下培养,但是不限于此。在上述温度条件下,细胞色素bo3泛醇氧化酶(cyo)和细胞色素bd-i泛醇氧化酶(cyd)最有效地将还原力转化为细胞能量,即atp。
[0074]
根据本发明,在培养步骤期间,将甲酸维持在2至3g/l的浓度,并且将ph维持在6.6至7.0,但是本发明不限于此。此外,在本发明中,可以将重组微生物最初以450至550rpm的搅拌速度培养,并且然后可以在搅拌速度增加至700至800rpm的最终速度时培养,但是本发明不限于此。通过供应这样的甲酸浓度、ph和曝气,根据本发明的重组微生物的生长速率明显改善。
[0075]
在另一方面,本发明涉及一种用于产生使用丙酮酸作为中间产物的有用化合物的方法,所述方法包括:(a)用甲酸和二氧化碳作为碳源培养重组微生物以产生具有丙酮酸作为中间产物的有用物质的步骤;以及(b)回收所产生的有用物质的步骤。
[0076]
根据本发明,所述有用物质选自丁醇、异丁醇、己醇、庚醇、辛醇、壬醇、癸醇、叔丁醇、1-戊醇、2-戊醇、3-戊醇、2-甲基-1-丁醇、3-甲基-1-丁醇、2-甲基-2-丁醇、异丁醇、腐胺、l-鸟氨酸、精氨酸、多环芳烃(pah)、聚乳酸、聚乳酸共乙醇酸、聚异戊酸酯、聚羟基丁酸酯(phb)、4-羟基丁酸酯、生物柴油、汽油、烯烃、5-氨基戊酸、γ-亚氨基丁酸、3-羟基丙酸、3-氨基丙酸、丙烯酸、1,3-二氨基丙烷、己内酰胺、苏氨酸、缬氨酸、异亮氨酸、富马酸、苹果酸、琥珀酸、神经酰胺、虾青素、水飞蓟素、番茄红素、叶黄素和视黄醇,但是不限于此。
[0077]
重组微生物及使用根据本发明的重组微生物产生c3化合物的方法具有以下特征。
[0078]
首先,通过改善代谢工程化菌株,根据本发明的重组微生物提高了将二氧化碳和甲酸转化为丙酮酸的速率。例如,从诸位发明人首先开发的能够使用二氧化碳和甲酸合成丙酮酸的重组微生物中进一步缺失pflb基因和sera基因,以开发能够以提高的速率从二氧化碳和甲酸合成丙酮酸的菌株(dh5αrg5)。此菌株以与从葡萄糖合成丙酮酸的速率的12.9%相对应的速率从二氧化碳和甲酸合成丙酮酸,与由诸位发明人开发的能够从二氧化碳和甲酸合成丙酮酸的常规重组微生物相比所述速率增加至70%。
[0079]
根据本发明的重组微生物可以仅使用二氧化碳和甲酸生长。诸位发明人先前开发的重组微生物能够使用二氧化碳和甲酸产生丙酮酸,但是需要单独供应葡萄糖用于重组微生物的生长。然而,通过以下方式根据本发明的重组微生物可以在不供应葡萄糖的情况下仅使用二氧化碳和甲酸生长:从具有提高的从二氧化碳和甲酸合成丙酮酸的速率的重组微生物(dh5αrg5)的基因组中缺失ppsr基因和purt基因,、将ppsa基因的天然启动子用强trc启动子取代、并且通过质粒进一步引入衍生自博伊丁假丝酵母的甲酸脱氢酶基因和衍生自拟南芥的甲酸脱氢酶的突变基因。
[0080]
根据本发明,为了进一步提高重组微生物(dh5αfc5)的生长速率,开发了其中进一步调整所引入的质粒的拷贝数的重组微生物(dh5αfc8)。结果是,重组微生物dh5αfc8的生长速率提高到重组微生物dh5αfc5的1.14倍。根据本发明,为了进一步提高重组微生物(dh5αfc8)的生长速率,开发了其中pntab基因的天然启动子被强trc启动子替代的重组微生物(dh5αfc9)。结果是,与重组微生物dh5αfc8的生长速率相比,重组微生物dh5αfc9的生长速率是其两倍。
[0081]
根据本发明,确定了能够使重组微生物的生长最大化的培养条件和发酵条件。培养条件和发酵条件提供了最大生长极限,od
600
=7.38-11.1,这是文献中先前报道的仅使用二氧化碳和甲酸生长的大肠杆菌的最大生长极限od
600
(约1)的7-11倍(kim,s.等人nat.chem.biol.1-8,2020),这是通过减少用于基因表达的iptg的剂量、降低培养温度、改善曝气、和控制甲酸浓度和ph来实现的。
[0082]
实施例
[0083]
在下文中,将参考以下实施例更详细地描述本发明。然而,对于本领域技术人员而言将明显的是,以下实施例仅提供用于说明本发明,并且不应当解释为限制本发明的范围。
[0084]
实施例1:通过建立二氧化碳和甲酸同化途径和代谢工程策略,改善从二氧化碳和甲酸形成丙酮酸的代谢流
[0085]
为了改善二氧化碳和甲酸同化代谢途径中的碳同化代谢流,将含有参与二氧化碳和甲酸同化途径的基因ftl、fch、和mtd的质粒引入重组大肠杆菌菌株中,在所述大肠杆菌菌株中使大肠杆菌的gcvr、pflb和sera基因缺失,并且将gcvt启动子用强trc启动子替代以开发从二氧化碳和甲酸合成总丙酮酸的12.9%的重组菌株。
[0086]
具体地,通过以下方式制备质粒产生所需的外源基因片段:使用作为模板的具有相应的基因的微生物的基因组dna和使用设计用于扩增基因的引物进行pcr,然后收集并纯化扩增后的基因片段,并且相应的基因和引物序列在下表1和2中示出。
[0087]
[表1]
[0088][0089][0090]
[表2]
[0091][0092]
产生了包含编码上述酶的基因的质粒,以构建二氧化碳和甲酸同化途径。
[0093]
[表3]
[0094][0095]
使用通常用于组装基因片段的gibson组装方法(gibson等人,nat.methods,6:5,343-345,2009)从质粒骨架基因片段和扩增的基因片段产生质粒,并且产生的每个质粒包括一个或多个在上述表中列出的外源基因。
[0096]
将通过上述方法产生的重组质粒转化到大肠杆菌中以产生重组大肠杆菌。在本发明中使用的大肠杆菌是大肠杆菌dh5α(invitrogen,usa),并且使用本领域常用的化学转化方法转化到大肠杆菌中。
[0097]
此外,将天然启动子用强trc启动子替代,以便增强编码重组微生物中参与甘氨酸切割系统反应的酶的gcvthp基因(gcvt,ncbi基因id:947390;gcvh,ncbi基因id:947393;gcvp,ncbi基因id:947394),并且使抑制甘氨酸切割系统的基因gcvr缺失。此外,使编码丙酮酸甲酸裂解酶的基因pflb缺失,以防止丙酮酸向甲酸的不必要转化,并且改善丙酮酸形成流。此外,编码d-3-磷酸甘油酸脱氢酶的基因sera是在含有葡萄糖的m9基本培养基中生长所必需的基因。当缺失此基因时,可以仅通过c1化合物同化途径产生5,10-ch
2-thf,所述5,10-ch
2-thf是代谢物(诸如嘌呤和甲硫氨酸)的生物合成所必需的。因此,随着c1化合物同化途径的代谢流增强,有助于菌株的生长。出于这个原因,使基因sera缺失。以下给出增强的基因和缺失的基因。
[0098]
[表4]
[0099][0100]
[表5]
[0101][0102]
将p100thf质粒引入所产生的菌株中以产生以下菌株。
[0103]
[表6]
[0104]
dh5αrg5具有p100thf的dh5α_gtps
[0105]
对作为实验组的重组大肠杆菌(dh5αrg5)和作为对照组的野生型大肠杆菌(dh5αwt)进行碳同位素分析以鉴定在所产生的重组大肠杆菌(dh5αrg5)中针对二氧化碳和甲酸同化的增加的代谢流。
[0106]
[表7]
[0107]
成分含量(g/l)na2hpo43.6kh2po43nacl0.5nh4cl1mgso40.24cacl20.011葡萄糖5甲酸钠
13
c2.76叶酸0.01
碳酸氢钠
13
c3.4feso40.00455niso40.00464钼酸钠0.00618硫胺素0.01
[0108]
将对照和实验大肠杆菌在含有用
13
c碳同位素标记的甲酸盐和碳酸氢盐离子的m9培养基(参见上表7中所示的组成)中培养,然后分析大肠杆菌细胞样品。在强酸性且高温的条件下水解构成大肠杆菌的所有蛋白质后,使用气相色谱/质谱使用大肠杆菌细胞样品分析构成大肠杆菌的氨基酸的质量数(zamboni等人,nat.protocols,4:6,878-892,2009)。
[0109]
同位素分析结果显示,dh5αrg5菌株将对于通过用二氧化碳和甲酸同化形成丙酮酸的代谢流增加至关于丙酮酸形成的总代谢流的12.9%。
[0110]
实施例2:通过改善代谢工程化菌株,开发能够仅使用二氧化碳和甲酸生长的重组微生物
[0111]
使ppsr和purt基因从实施例1中产生的重组大肠杆菌菌株的基因组中缺失,将ppsa基因的启动子用强trc启动子替代以产生重组大肠杆菌菌株(dh5αako1),并且将通过将fdh基因和fdhmut基因添加到实施例1中产生的质粒而产生的质粒(p100fa2)引入重组大肠杆菌菌株(dh5αako1)中以产生能够仅使用二氧化碳和甲酸生长的大肠杆菌(dh5αfc5)。
[0112]
[表8]
[0113][0114][0115]
[表9]
[0116][0117]
为了使细胞在没有葡萄糖的情况下仅使用二氧化碳和甲酸生长,不间断地供应能量和还原(氧化还原)力是必需的。出于此目的,需要用于产生nadh和nadph同时将甲酸转化为二氧化碳的代谢途径。因此,将编码使用nad+的甲酸脱氢酶的从博伊丁假丝酵母衍生的fdh基因和编码使用nadp+的甲酸脱氢酶的从拟南芥衍生的fdh基因的突变体fdh
mut
引入p100thf质粒中以构建p100fa2质粒。
[0118]
[表10]
[0119][0120]
[表11]
[0121][0122]
[表12]
[0123][0124]
[表13]
[0125][0126][0127]
[表14]
[0128][0129]
当仅向m9基本培养基(表15)中添加二氧化碳和甲酸时,通过将p100fa2质粒引入dh5αako1菌株中而产生的dh5αfc5菌株在培养150小时后从0.051的初始光密度生长至高达0.285的光密度。相比之下,阴性对照组(dh5a fc1、fc2、fc3)没有展现菌株生长。
[0130]
[表15]
[0131]
成分含量(g/l)na2hpo46.8kh2po43nacl0.5nh4cl2mgso40.8nahco34.2iptg0.24
edta0.05硫胺素0.002微量金属溶液5ml甲酸钠4.43
[0132]
[表16]
[0133][0134]
此外,确定菌落形成单位(cfu)的数量,以便测量由细胞分裂引起的细胞数量的增加。结果显示,初始cfu是4.8x 107cfu/ml(od
600
为0.051),50小时后cfu增加至14.1x 107cfu/ml(od
600
为0.2),并且然后在150小时后cfu逐渐降低至5.2x 107cfu/ml(od
600
为0.285)(图3和4)。
[0135]
实施例3:通过优化培养环境和基因表达水平来改善生长速率
[0136]
优化实施例2中产生的dh5αfc5菌株的培养条件,并且产生与上述质粒相比拷贝数减少的质粒以构建当仅添加二氧化碳和甲酸时迅速生长的dh5αfc8菌株。此外,观察到当将37℃的常规培养温度降低至32℃(以增加cyo表达水平并且降低cyd表达水平)时,dh5αfc8菌株仅使用二氧化碳和甲酸从0.018生长至高达3.59的光密度。
[0137]
实施例3-1:能够仅使用二氧化碳和甲酸生长的重组菌株的培养条件的优化
[0138]
优化实施例2中产生的dh5αfc5菌株的培养条件。为了将iptg(一种用于促进基因表达的诱导剂)的浓度从1mm的常规浓度降低到0.05mm,将常规培养条件(将30ml的培养溶液添加到100ml挡板烧瓶中)改变为新的培养条件(将50ml的培养溶液添加到300ml挡板烧瓶中)以增强曝气。培养结果显示,最终细胞密度增加到在常规培养条件的情况下的2.16倍(图5)。
[0139]
实施例3-2:通过基因表达优化,能够仅使用二氧化碳和甲酸生长的重组菌株的生长改善
[0140]
优化基因表达水平以实现足够高的细胞浓度,因为超过实际所需表达水平的细胞过度表达会对细胞生长产生负面影响,这是由于在仅使用二氧化碳和甲酸生长时受限制的营养供应。将具有10至12个质粒拷贝的p15a复制起点和具有1至5个质粒拷贝的psc101复制起点分别引入到p100fa1质粒中以构建以下质粒(图6)。
[0141]
[表17]
[0142][0143][0144]
使用含有氯霉素抗性基因、p15a复制起点和bba_23100合成启动子的pacyc184质粒作为模板;和含有氯霉素抗性基因、psc101复制起点和合成启动子bba_23100的pjh518质粒;以及seq id no:24至seq id no:27的引物进行pcr,并且收集并且纯化扩增的基因片段以产生用作用于产生重组质粒的质粒骨架的基因片段。
[0145]
[seq id no:24]:5'-tgctgaaaataagtcgtcctggatccactagttctagagcgg-3'
[0146]
[seq id no:25]:5'-actatttacgaaagtctcgggcttatcgataccgtcgacctcg-3'
[0147]
[seq id no:26]:5'-tgctgaaaataagtcgtcctgcacctcgctaacggattcaccac-3'
[0148]
[seq id no:27]:5'-actatttacgaaagtctcgggaattacaacttatatcgtatggggc-3'
[0149]
将质粒p184fa引入dh5αako1菌株中以产生dh5αfc7菌株,并且将质粒p518fa引入dh5αfc7菌株中以产生dh5αfc8菌株。当在实施例3-1中开发的最佳培养条件下培养所述两种菌株时,dh5αfc8菌株从0.06的初始光密度生长至高达0.607的光密度持续200小时,这相当于dh5αfc5的情况下的1.14倍,并且dh5αfc8菌株展现出最高的生长速率(图7)。
[0150]
[表18]
[0151]
菌株名称基因类型dh5αfc7具有p184fa的ako1dh5αfc8具有p518fa的ako1
[0152]
实施例3-3:通过优化细胞色素bo3泛醇氧化酶(cyo)和细胞色素bd-i泛醇氧化酶(cyd)的表达水平,改善能够仅使用二氧化碳和甲酸生长的重组菌株的生长
[0153]
细胞色素bo3泛醇氧化酶(cyo)(ncbi基因id:945080、945615、946897、944918)和细胞色素bd-i泛醇氧化酶(cyd)(ncbi基因id:945341、945347)是位于大肠杆菌内膜的酶,并且将还原力转化为atp(其是细胞能量)。相关技术(gadgil,m.,kapur,v.&hu,ws biotechnol.prog.21,689-699,2005)报道了当在低于37℃的温度下培养大肠杆菌时,cyo的表达水平升高并且cyd的表达水平降低。在所述两种酶中,与cyd相比,cyo更有效地将还原力转化为atp。出于这个原因,在30℃、32℃和33℃下培养fc8菌株,以便提高cyo的表达水平并且降低cyd的表达水平。作为在32℃下培养的结果,大肠杆菌在791.5小时内从0.018的初始光密度生长至高达3.59(图8),cyo的表达水平升高,并且cyd的表达水平降低(图9)。将用于cyo表达的mrna的量与用于cyd表达的mrna的量通过使用实时定量pcr的rna相对定量进行比较来确定表达水平的变化。用于mrna相对定量的引物在下表19中示出。
[0154]
[表19]
[0155][0156]
实施例4:针对能够仅使用二氧化碳和甲酸生长的重组菌株优化的发酵工艺的开发
[0157]
通过开发针对能够仅使用二氧化碳和甲酸生长的重组菌株优化的发酵工艺改善重组菌株的生长。为了将培养基的甲酸浓度和ph维持在预定水平,使用恒ph模式自动供应30%的甲酸溶液以在培养期间将培养基中的甲酸浓度(2-3g/l)和ph(6.8)维持在最佳水平。此外,为了改善曝气,每当光密度增加1时,将搅拌速度从500rpm的初始搅拌速度以50rpm增加至高达750rpm的最终搅拌速度。在优化的发酵工艺中,在450小时后,dh5αfc8菌株从1.02的初始光密度生长至7.38的光密度(图10)。此外,进行了一项另外的发酵工艺。在优化的发酵工艺中,在577小时后,dh5αfc8菌株从0.91的初始光密度生长至高达11.1的光密度(图11)。
[0158]
实施例5:通过将优化的发酵工艺应用于能够仅使用二氧化碳和甲酸生长的重组菌株来开发能够以更高速率生长的重组菌株
[0159]
在实施例4中开发的优化的发酵工艺中,在450小时后,dh5αfc8菌株从1.02的初始光密度生长至高达7.38的光密度,并且在577小时后,从0.91的初始光密度生长至高达11.1的光密度(图10和11)。在dh5αfc8基因组上将pntab基因的启动子用强trc启动子替代以产生重组大肠杆菌菌株(dh5αfc9)。在实施例4中开发的优化的发酵工艺中,在206小时后,dh5αfc9菌株从1.01的初始光密度生长至高达10.2的光密度。这指示在相同时间(206小时)内,当与dh5αfc8菌株(其从0.91的初始光密度生长至高达约5的光密度)相比时,dh5αfc9菌株以约2倍的速率生长(图12)。
[0160]
[表20]
[0161]
[0162][0163]
实施例6:将甲酸同化代谢途径引入曼氏杆菌属的微生物中并且验证甲酸同化能力
[0164]
已经发现,即使在具有中心碳代谢途径的宿主微生物以及大肠杆菌中,也通过本发明开发的甲酸同化代谢途径进行甲酸同化。在此实施例中,将甲酸同化代谢途径引入曼氏杆菌属的微生物中,并且通过碳同位素分析来鉴定是否进行了甲酸同化。
[0165]
首先,将含有参与甲酸同化途径的基因ftl、fch、和mtd的质粒引入曼氏杆菌属的微生物中以产生包括甲酸同化途径的重组微生物。具体地,使用实施例1中制备的具有相应基因作为模板的p100thf质粒,并且使用设计用于扩增相应基因的引物,通过pcr制备质粒产生所需的外源基因片段,然后收集和纯化扩增的基因片段。引物序列在下表21中示出。
[0166]
[表21]
[0167][0168][0169]
产生了包含编码上述酶的基因的质粒,以构建甲酸同化途径。
[0170]
[表22]
[0171][0172]
使用通常用于组装基因片段的gibson组装方法(gibson等人,nat.methods,6:5,343-345,2009)从质粒骨架基因片段和扩增的基因片段产生质粒,并且因此产生的每个质粒包括一个或多个上述表中列出的外源基因。
[0173]
将通过上述方法产生的重组质粒转化到曼氏杆菌属中以产生重组曼氏杆菌属。本发明中使用的曼氏杆菌属是产琥珀酸曼氏杆菌属(mannheimia succiniciproducens)lpk7,并且使用本领域中常用的电穿孔进行向曼氏杆菌属中的转化。
[0174]
对于甲酸同化能力分析,在补充有2g/l的甘氨酸和4.43g/l的
13
c-标记的甲酸的脑心浸液(bhi)培养基中培养引入了甲酸同化代谢途径的重组曼氏杆菌属菌株(lpk7_ftf)和引入了空载体的阴性对照菌株(lpk7),并且然后测量生物质中所含丝氨酸中所含的碳同位素的比率。当通过甲酸同化途径进行甲酸同化时,甲酸衍生的碳通过图1所示的甲酸同化代谢途径定位于丝氨酸的碳1处。测量结果显示,在引入了甲酸同化代谢途径的lpk7_ftf菌株中,在生物质中所含的总丝氨酸的约19.5%中检测到源自甲酸的
13
c碳,但是在阴性对照菌株的丝氨酸中根本没有检测到
13
c碳(图13)。
[0175]
[表23]
[0176]
此实施例中使用的基因序列
[0177]
[0178]
[0179]
[0180]
[0181]
[0182][0183]
实用性
[0184]
本发明提供了一种重组微生物,所述重组微生物使用二氧化碳(自然界中含量丰富)和甲酸(具有低毒性、在反应动力学方面适于同化反应、并且可以从二氧化碳容易且迅速地合成)以与相关技术相比明显提高的速率合成丙酮酸(其是c3有机化合物),并且特别地,所述重组微生物即使在不含有葡萄糖仅使用二氧化碳和甲酸作为碳源的培养基中也可以以明显提高的速率生长。因此,根据本发明的重组微生物具有以经济有效的方式合成丙酮酸和合成使用丙酮酸作为中间产物的多种高附加值化合物的优点。
[0185]
尽管已经详细地描述了本发明的具体配置,但是本领域技术人员将理解,此详细描述是出于说明目的作为优选实施方案提供的,而不应当解释为限制本发明的范围。因此,本发明的实质范围由提交的所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1