一种抗EphA2全人源双价重组抗体scFv-Fc
一种抗epha2全人源双价重组抗体scfv
‑
fc
技术领域
1.本发明涉及抗体工程技术领域,具体涉及一种抗epha2全人源双价重组抗体scfv
‑
fc。
背景技术:
2.eph受体是受体酪氨酸激酶(rtk)家族中最大的亚群之一,根据其胞外结构域分为a和b两大类,迄今已鉴定出14个eph受体和8个ephrin配体。这些分子通过影响细胞相关信号通路,在肿瘤的形成及进展过程中扮演着重要的角色。促红细胞生成素生成肝细胞a2(epha2)是eph受体重要的成员。在人类基因组中,epha2基因定位于染色体1p36.1这一肿瘤遗传位点上。与其他eph受体不同,epha2广泛表达在人类上皮来源的多种组织或细胞系中,且在正常情况下其表达含量低。大量临床研究证据表明,epha2在肝细胞癌、非小细胞型肺癌、前列腺癌、乳腺癌、大肠癌、胃癌、宫颈癌、皮肤黑色素瘤等多种上皮源性恶性肿瘤中高表达。高表达的epha2促进了肿瘤细胞的生长并增加了其侵袭性,与肿瘤患者的预后不良及生存期降低显著相关。epha2在多类型恶性肿瘤中的表达模式、定位和功能的重要性使其成为有吸引力的治疗靶点,同时,epha2也是向肿瘤组织输送药物,毒素以及显像剂的重要靶点。
3.放射性核素药物治疗是一种基于特异性肿瘤靶点,恶性组织的治疗方式。单克隆抗体在传染病、炎症和肿瘤治疗中是最为普遍采用的分子靶向探针,其具有高特异性、高亲和力,无需进一步修饰便能够在复杂和动态的生物分子背景下识别与癌症相关的单个分子表型,被广泛用于核素成像以及放射性核素药物治疗。然而,开发基于抗体靶向的放射性药物,其首要困难是对抗体载体的选择。抗体载体的亲和力,免疫原性,清除率以及半衰期长短往往成为限制放免治疗作用的主要因素。一般来说,具有中等大小和清除率的抗体片段(diabodies、minibodies以及分子量在50~110kda的scfv
‑
fcs)可能比全长igg更适合作为核标记载体,因为它们对实体肿瘤的穿透能力更高。此外,全长igg抗体的药代动力学缓慢,放射性药物在体循环中长时间滞留可能会对骨髓和其他非靶组织以及非靶细胞造成剂量限制毒性,且其较大的分子量也可能会加重机体循环负担。
4.单链抗体(single chain antibody fragment,scfv),是由抗体重链可变区(vh)和轻链可变区(vl)通过15~20个氨基酸的短肽(linker)连接而成的抗体。scfv能较好地保留其对抗原的亲和活性,并具有分子量小、穿透力强和抗原性弱等特点。scfv抗体比完整抗体具有更好的细胞穿透性。然而,单价结合的单链抗体分子量小、亲和力较低,并且体内半衰期短。
5.众所周知,igg类抗体是血液中含量最丰富的免疫球蛋白,也是治疗性抗体的主要形式。全长igg分子量约为150kda,在人体中其血药清除半衰期(t1/2)为21天。当全长igg作为放射性核素的载体时,缓慢的血液清除增加了其在放免治疗期间对正常组织的辐射剂量。同时,其较大的分子量也降低了对肿瘤组织的穿透性。这些因素限制了全长igg放射免疫治疗的潜力。与此对比,基于igg形式的另一抗体片段scfv
‑
fc在肿瘤摄取方面与全长igg
相似,有着较好的肿瘤靶向性。不仅如此,scfv
‑
fc分子量比全长igg小,同时保留了单价抗体scfv易于穿透肿瘤的特点,但相比于scfv的单价结合,scfv
‑
fc这一重组双价分子亲和力显著增强,并且降低了聚集倾向,增加了血清半衰期。同时,添加的fc段可恢复fc区的免疫效应功能,使这一双价重组抗体在放射性免疫治疗中不仅可作为良好的放射性核素载体,还可以发挥治疗性抗体作用,能够获得更好的治疗效果。除此之外,scfv
‑
fc不仅能作为良好的抗体载体结构,在新冠肺炎(covid
‑
19)的快速诊断、筛查中也有重要应用。hye
‑
yeon kim等人利用噬菌体展示技术制备了scfv
‑
fc融合抗体,用于特异性检测sars
‑
cov
‑
2核衣壳蛋白(np)。研究发现,这些scfv
‑
fc抗体与sars
‑
cov
‑
2np抗原特异性结合,亲和力高,但不与其他冠状病毒np结合。这一基于scfv
‑
fc抗体结构的新冠肺炎生物传感器可以在20min内检测到sars
‑
cov
‑
2病毒,并将其与sars
‑
cov等同类冠状病毒区分开。这一检测方法是对新冠病毒快速筛查方法的有力补充。基于以上研究,scfv
‑
fc这一双价融合抗体有着重要的临床应用前景。
6.epha2是一种重要的致癌蛋白和新兴的药物靶点。基于epha2的靶向治疗已经出现在多种恶性肿瘤的不同阶段的临床试验中。其中,抗体因其高度的特异性、亲和力、稳定性以及与细胞表面蛋白的多种作用机制使其成为epha2靶向治疗药物的首选。针对epha2受体的一系列抗体已经在临床前进行了研究。kelly carles
‑
kinch等人生产了一种以epha2为靶点的单克隆抗体,他们进一步研究表明该epha2单克隆抗体通过诱导epha2蛋白的自磷酸化和降解,对恶性肿瘤细胞的生长以及远处转移有明显的抑制作用。在另一项研究中,epha2抗体也展现出了强大的治疗潜力。atsushi sakamoto等人制备了3株抗epha2单克隆抗体。在对黑色素瘤细胞系的研究中发现,这些epha2单克隆抗体能够明显的抑制细胞迁移、侵袭等细胞转移行为。同时,研究人员将epha2单克隆抗体与免疫毒素进行偶联后发现,偶联后的epha2单抗具有强烈的生长抑制和细胞毒性,在对黑色素瘤这一侵袭性肿瘤的治疗上有极高的治疗前景。以上研究表明,基于epha2靶点的抗体研究在改善肿瘤治疗方式、提高肿瘤治疗效果方面是极其重要的。
7.近30年来,抗体的发展经历了鼠源性抗体、嵌合抗体、人源化抗体以及全人源抗体的几个阶段。其中,鼠源性抗体的主要限制是外源蛋白的免疫原性,会激活人体免疫系统,产生人类抗鼠抗体(hama)反应,引发免疫损伤。尽管嵌合抗体和人源化抗体优化了抗体来源,但仍旧无法完全消除鼠源性单抗的免疫原性所导致不良反应及疗效丧失。相比之下,全人源抗体完全由人类基因编码而成,其免疫原性小,临床效果好,是免疫治疗抗体和核标记靶向抗体研究的主要方向。基于噬菌体展示技术,针对epha2这一肿瘤靶点进行全人源scfv
‑
fc重组抗体的筛选,为恶性肿瘤免疫治疗和靶向放射性核素治疗提供高亲和力、高特异性以及低免疫原性抗体,具有重要的临床意义与治疗前景。
技术实现要素:
8.本发明申请人通过全人源噬菌体展示技术,构建了一个大容量噬菌体单链抗体文库。经过三轮亲和富集筛选,得到了240株能与epha2蛋白特异性结合的scfv。经过dna指纹图谱鉴定、酶联免疫吸附试验(elisa)以及基因测序比较,筛选出了3个序列不同且能和pc
‑
3、hepg2、a549肿瘤细胞上epha2受体特异性结合的scfv。利用分子生物学技术,将scfv与sp
‑
fc/pcdna3.1载体进行连接并在293f真核细胞中进行表达,收集表达上清并进行纯化。
在细胞和组织水平,通过流式细胞技术、免疫组织化学技术等实验方法证实,纯化后的双价重组抗体scfv
‑
fc可以特异性的结合epha2抗原,具有高的亲和力,并对肿瘤细胞生长具有抑制作用。基于此,本发明要求保护如下技术方案:
9.一种抗epha2全人源单链抗体,所述单链抗体为scfv14或者scfv77或者scfv179;
10.scfv14的重链可变区氨基酸序列如seq id no.1所示,轻链可变区氨基酸序列如seq id no.2所示;
11.scfv77的重链可变区氨基酸序列如seq id no.3所示,轻链可变区氨基酸序列如seq id no.4所示;
12.scfv179的重链可变区氨基酸序列如seq id no.5所示,轻链可变区氨基酸序列如seq id no.6所示。
13.在上述技术方案中,所述单链抗体的重链可变区与轻链可变区由连接肽linker连接,所述连接肽linker的氨基酸序列为(gly4ser)3。
14.一种抗epha2全人源双价重组抗体,所述重组抗体为scfv14
‑
fc或者scfv77
‑
fc或者scfv179
‑
fc;所述重组抗体包含上述的单链抗体和人抗体恒定区fc段氨基酸序列。
15.所述scfv14
‑
fc的氨基酸序列如seq id no.7所示;
16.所述scfv77
‑
fc的氨基酸序列如seq id no.8所示;
17.所述scfv179
‑
fc的氨基酸序列如seq id no.9所示。
18.本发明还保护一种编码上述的抗epha2全人源双价重组抗体的多核苷酸分子。
19.本发明还保护一种包含上述的多核苷酸分子的重组dna表达载体。
20.本发明还保护上述的抗epha2全人源单链抗体,或者上述的抗epha2全人源双价重组抗体,在制备抗肿瘤药物中的用途。
21.在上述的用途技术方案中,所述药物为抗肿瘤免疫治疗药物。
22.所述肿瘤为脑低级别胶质瘤、胰腺癌、多形成性胶质细胞瘤、肾透明细胞癌、前列腺癌、肝细胞癌、肺腺癌。
23.优选地,所述肿瘤为前列腺癌、肝细胞癌、肺腺癌。
24.不同类型的噬菌体抗体文库筛选到的抗体其亲和力是不同的。根据抗体文库的来源不同,可以将抗体文库简单的分为免疫文库和非免疫文库。免疫文库是从病人或免疫动物的b细胞(igg)中分离的抗体v基因构建,通常被用于医学研究以获得针对一个特定靶抗原的抗体。而非免疫文库则是由未免疫供者的b细胞(igm)中的抗体v基因构建,与抗原的结合不具备特异性。有研究表明,从非免疫文库中筛选的抗体缺乏体内重排与突变,亲和力较低。除此之外,在非免疫文库中抗体筛选的背景高,针对特定靶抗原的抗体丰度低,需要较大的库容量才能筛选到亲和力较高的抗体,大大加大了筛选难度。与非免疫文库不同,免疫文库中含有大量针对特定靶抗原的抗体,其筛选背景大大降低。同时从免疫文库中筛选到的抗体已经过宿主体内的亲和力成熟过程,具有较高的亲和力;并且筛选来自肿瘤病人的高亲和力抗体,抗体本身在患者体内可能就具备抗肿瘤的能力,更容易筛选到治疗性的抗体。在本研究中,从200例恶性肿瘤患者的pbmc中提取mrna,构建scfv噬菌体免疫文库。肿瘤种类涉及肺癌、子宫颈癌、卵巢癌、宫颈癌、鼻咽癌、食管癌、结直肠癌、胃癌。肿瘤类型多样,丰富的肿瘤类型避免了单一肿瘤类型抗体基因的偏倚,确保了scfv基因的多样性。
25.高亲和力抗体的获得是一个多因素影响的复杂过程,噬菌体抗体文库的来源只是
影响亲和力高低的原因之一。值得注意的是,抗体亲和力的体外筛选也是其中的关键影响因素。在对scfv进行同源重组形成双价抗体scfv
‑
fc之前,我们对初次获得的39株较高亲和力的scfv进行小量表达并与epha2蛋白进行结合,通过elisa检测其与目标蛋白的结合情况。实验结果显示,83%的scfv呈结合阳性。从elisa结合阳性中进一步筛选出高亲和力的scfvs分别与pc
‑
3、hepg2、a549进行细胞elisa,以检测scfv与肿瘤细胞表面抗原的结合情况。综合三次细胞elisa实验结果,选出高亲和力的scfv进行同源重组。通过广泛的elisa筛选确保了最终获得的针对epha2靶抗原的scfv具有较高的结合活性和特异性。同时,我们从富集筛选前以及富集筛选后的免疫文库中随机挑取单克隆菌落进行bstnⅰdna指纹图谱鉴定,结果显示构建的噬菌体免疫文库具有多样性。经过三轮亲和筛选,针对epha2靶抗原的scfv其特异性逐渐增强,亲和力不断增高。
26.我们通过噬菌体展示技术筛选出了3株高亲和力的全人源epha2双价重组抗体scfv
‑
fc,筛选的重组抗体具备抑制肿瘤生长的能力,为肿瘤的免疫治疗及放射性免疫治疗药物提供了良好的抗体。
27.本发明的有益效果是:
28.本发明构建的全人源噬菌体展示文库在特异性抗体筛选方面具有极高的应用前景,筛选到的抗epha2全人源双价重组抗体scfv
‑
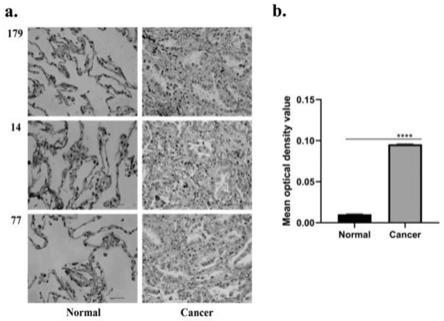
fc,其亲和力高,免疫原性低,稳定性好,并具备抑制肿瘤生长的能力,适合作为免疫治疗的药物或靶向放射性核素药物的载体,有望用于体内靶向杀伤肿瘤细胞,以期获得良好的放免治疗效果,市场应用前景大。
附图说明
29.图1为epha2基因在肿瘤细胞中的表达、epha2基因的表达与tcga肿瘤的生存预后的关系,其中,图a为使用人类蛋白质图谱数据库分析epha2基因在每个细胞系中的表达水平结果,图b、c为使用gepia2工具分析tcga数据库中不同肿瘤的epha2基因表达与总生存期(b)和无病生存期(c)之间的关系得到的生存图和kaplan
‑
meier曲线显示。
30.图2为scfv噬菌体文库的构建和免疫文库的多样性分析,其中,(a)扩增条带为vh基因文库,(b)扩增条带为vκ基因文库,(c)扩增条带为vλ基因文库,(d)通过重叠延伸pcr扩增的vh
‑
vκ基因文库、vh
‑
vλ基因文库,(e)指纹图谱分析筛选前抗体文库多样性,(f)指纹图谱分析第一轮噬菌体展示筛选后的抗体文库多样性,(g)指纹图谱分析第二轮噬菌体展示筛选后的抗体文库多样性,(h)指纹图谱分析第三轮噬菌体展示筛选后的抗体文库多样性。
31.图3为筛选高亲和力抗epha2 scfv,(a)噬菌体elisa确定最初筛选的39种scfv抗体与抗原epha2的结合活性,(b)噬菌体细胞elisa确定28株scfv与pc
‑
3细胞上的epha2受体结合,(c)噬菌体细胞elisa法确定28株scfv与hepg2细胞上的epha2受体的结合,(d)噬菌体细胞elisa法确定28株scfv与a549细胞上的epha2受体的结合。
32.图4为scfv与sp
‑
fc/pcdna3.1的连接,其中,(a)scfv
‑
fc179的凝胶电泳结果,泳道1
‑
3是扩增的scfv目标带;(b)scfv
‑
fc14的凝胶电泳结果,泳道1
‑
4是扩增的scfv目标条带;(c)scfv
‑
fc77的凝胶电泳结果,泳道1
‑
5是扩增的scfv目标条带;(d)epha2
‑
scfv
‑
fc重组蛋白的sds
‑
page结果,m为蛋白分子量标准,泳道1为空白对照;2为scfv
‑
fc 179的预纯化条带,3为重组蛋白scfv
‑
fc 179的纯化蛋白条带;4为scfv
‑
fc 14的预纯化条带,5为scfv
‑
fc 14的纯化蛋白条带;6为scfv
‑
fc 77的预纯化带,7为scfv
‑
fc 77的纯化蛋白条带;(e)scfv
‑
against il
‑
33.applied biochemistry and biotechnology,2012,167:498
‑
509],进行pcr扩增抗体vh、vl(vλ和vκ)片段编码区。pcr反应条件:94℃预变性2min,94℃变性30s,55℃退火30s,72℃延伸30s,30个循环后,72℃孵育10min。pcr产物经1.5%琼脂糖凝胶电泳纯化后回收备用。将不同病人的vh或vldna进行混合,已进行下一步vh和vl的连接。
47.1.4全人源epha2
‑
scfv抗体库的构建
48.以纯化的vh和vl为模板,经重叠pcr合成scfv片段。采用经典的接头(gly4ser)3(序列为seq id no.10:ggggsggggsggggsggggs)作为重链可变区与轻链可变区之间的连接物,经重叠延伸pcr拼接后形成vh
‑
linker
‑
vl的scfv基因片段,其中含有sfiⅰ和notⅰ限制性酶切位点。
49.重叠延伸第一轮pcr:不加引物,94℃2min;然后94℃1min,68℃1min,20个循环;最后72℃作用7min。以第一轮pcr产物为模板,进行第二轮pcr,上游引物v
h
fvf,下游引物vλfvr或vκfvr[序列参见qing yuan,2012,construction of human nonimmune library and selection of scfvs against il
‑
33.applied biochemistry and biotechnology,2012,167:498
‑
509],进行第二轮pcr。反应条件:94℃2min,然后94℃1min,55℃1min,72℃1min,30个循环,72℃10min。pcr产物经1.5%琼脂糖凝胶电泳以胶回收的方式回收扩增产物,保存于
‑
20℃。引物序列为:
[0050]
v
h
fvf:5
′‑
atcgacgctactgcggcccagccggcccaggt
‑3′
(seq id no.11),
[0051]
vλfvr:5
′‑
acggctgcgtcagagtgcggccgcacgttt
‑3′
(seq id no.12),
[0052]
vκfvr:5
′‑
acggctgcgtcagagtgcggccgcacc
‑3′
(seq id no.13)。
[0053]
将v
h
‑
linker
‑
vκ,v
h
‑
linker
‑
vλ混合成scfv文库基因及pcantab 5e载体质粒分别用sfiⅰ和notⅰ限制性酶进行酶切,酶切产物分别经胶回收后在16℃下用t4 dna连接酶构建scfv
‑
基因iii融合文库。连接产物转化tg1感受态细胞,将转化产物加入含有100μg/ml氨苄青霉素和2.0%葡萄糖的lb固体培养基(即lbag固体培养基)上,随机挑取文库中的20个单克隆菌落进行pcr鉴定。pcr产物经bstnⅰ酶切后进行dna指纹图谱分析,以评估scfv的多样性。将平板上的所有单克隆菌落刮下并悬浮在含20%甘油的lbag液体培养基中,分装保存于
‑
80℃。
[0054]
1.5噬菌体扩增
[0055]
取150μl
‑
80℃保存的文库菌液接种在40ml lbag液体培养基中,37℃,250rpm,震荡孵育使菌液的od
600
值达到0.2左右。4000rpm,室温离心15min,收集菌体沉淀并用40ml含100μg/ml氨苄青霉素,不含葡萄糖的lb液体培养基(lba液体培养基)重悬。加入终浓度为3
×
109pfu/ml m13k07辅助噬菌体于lba液体培养基中,37℃静置感染15min。然后放置于水平摇床,37℃,200rpm,震荡培养2h。加入卡那霉素至终浓度为20μg/ml,32℃孵育过夜。8000rpm,4℃,离心20min,弃上清,加入终量1/5的聚乙二醇
‑
氯化钠(20%peg,2.5m nacl)重悬菌体沉淀。冰浴静置1h,4℃,10000rpm离心20min,弃上清,用1x pbs缓冲溶液重悬菌体沉淀。
[0056]
1.6 epha2
‑
scfv亲和力筛选
[0057]
采用液相筛选的方法对scfv进行亲和力筛选。将纯化的epha2蛋白按照sulfonhs
‑
lc
‑
biotinylation(thermo science)手册进行生物素化。扩增的scfv文库噬菌体用封闭缓冲液(含3%牛血清白蛋白(bsa))室温孵育1h。将孵育后的文库噬菌体加入到
1.5ml离心管中,加入链霉亲和素包被的dynabeads m
‑
280(invitrogen),室温孵育1h,去除磁珠,收集上清,以去除文库噬菌体中与磁珠非特异性结合的成分。在处理后的文库噬菌体中加入2μg生物素化epha2蛋白,室温孵育2h。用链霉亲和素包被的磁珠dynabeads m
‑
280捕获结合噬菌体抗原复合物,pbst洗涤5~10次。用0.1m glycine
‑
hcl(ph=2.2)洗脱噬菌体,洗脱后用1m tris中和至ph为7.0。用洗脱后中和的噬菌体感染对数生长期的tg1,涂板lbag,收获菌落进行下一轮筛选。
[0058]
如上进行再一次扩增。在第二轮和第三轮亲和筛选中,使用1μg生物素化的epha2蛋白。同时分别从三轮富集亲和筛选文库中随机选取多个单克隆菌落进行pcr扩增,并将扩增产物产物经bstnⅰ酶切后形成dna指纹图谱,用来评估富集亲和筛选后scfv文库的多样性。
[0059]
1.7 epha2
‑
scfv小量表达
[0060]
随机从经过三轮筛选的单链文库中挑取菌落,37℃,200rpm,使菌液生长至od
600
值为0.2左右,4500rpm,室温离心10min,弃上清。加入lba液体培养基重悬菌体沉淀,加入m13k07辅助噬菌体至终浓度为3
×
109pfu/ml,静置感染15min,37℃,200rpm,震荡培养2h。加入卡那霉素使其终浓度为20μg/ml。水平摇床,32℃,200rpm培养过夜。培养完成后,8000rpm,4℃,离心10min。取上清于离心管中,加入终量为1/5的聚乙二醇
‑
氯化钠(20%peg,2.5m nacl),冰浴1h。冰浴结束后,10,000rpm,4℃,离心20min。弃上清,用pbs重悬菌体沉淀并置于4℃保存。
[0061]
1.8噬菌体elisa
[0062]
将纯化的epha2蛋白用包被缓冲液(0.1m nahco3/na2co3)稀释至3μg/ml,4℃包被过夜。弃包被缓冲液,用洗涤缓冲液pbst(0.05%tween
‑
20加入pbs)洗涤3次,每次5min。弃掉洗涤缓冲液,用elisa封闭缓冲液(pbst含5%脱脂奶粉),37℃封闭1h。封闭结束,洗涤缓冲液洗涤3次,每次5min。elisa封闭缓冲液与噬菌体小量表达上清等比例加入每孔中,37℃孵育1h。孵育结束,洗涤缓冲液洗涤孔板3次,每次5min。用抗m13辣根过氧化物酶(hrp)偶联的二抗(anti
‑
m13
‑
hrp)检测结合的噬菌体抗体。anti
‑
m13
‑
hrp用封闭缓冲液1﹕5000稀释,37℃孵育1h。洗涤缓冲液洗涤4次,每次5min,并拍干孔板中残留的液体。四甲基联苯胺液体底物(tmb)避光孵育15min,加入50μl 2m h2so4终止反应,在od
450
处进行读数。
[0063]
1.9噬菌体细胞elisa
[0064]
选取前列腺癌细胞株pc
‑
3,肝细胞癌细胞株hepg2,肺腺癌细胞株a549,通过human proteinatlas数据库(http://www.proteinatlas.org)分析各细胞系中epha2基因的表达情况。
[0065]
如图1所示,pc
‑
3、hepg2、a549分别在男性生殖系统肿瘤、肝胆肿瘤以及肺癌细胞系中相对于其他细胞株表达epha2的程度更为突出。针对以上三种细胞株展开噬菌体细胞elisa实验,以筛选与肿瘤细胞高结合的epha2
‑
scfv。
[0066]
用胰酶消化细胞并用完全培养基(含10%胎牛血清的gibco1640培养基)调整细胞密度为1.0
×
105个/ml,以每孔100μl铺于96孔板,在含5%co2的培养箱中培养24~48h,使96孔板中各孔细胞密度达到80%~90%。弃去孔板中的培养基,1
×
pbs洗板2次,每次5min。待孔板干燥后,每孔加入80μl固定液(由pbs配制的0.25%戊二醛溶液),固定10min。弃固定液,1
×
pbs洗板3次,每次5min。弃1
×
pbs,用elisa封闭缓冲液在37℃封闭1h。封闭结束,洗
涤缓冲液1
×
pbst洗涤3次,每次5min。封闭缓冲液与噬菌体小量表达上清1:1加入每孔中,37℃孵育1h。孵育结束,洗涤缓冲液1
×
pbst洗涤孔板3次,每次5min。用anti
‑
m13
‑
hrp检测结合的噬菌体抗体,anti
‑
m13
‑
hrp用洗涤缓冲液1﹕5000稀释,37℃孵育1h。洗涤缓冲液1
×
pbst洗涤4次,每次5min,拍干孔板中残留的液体。tmb避光孵育15min,加入50μl 2mh2so4终止反应,在od
450
处进行读数。
[0067]
1.10 epha2双价重组抗体scfv
‑
fc的同源重组及表达
[0068]
以人igg
‑
fc(可结晶片段)为基础,将筛选出来的具有良好结合活性和特异性的epha2
‑
scfv采用pcr进行扩增,其中,scfv14、scfv77、scfv179的扩增引物分别为scfv14f,scfv14r;scfv77f,scfv77r;scfv179f,scfv179r,回收pcr产物,同源重组与sp
‑
fc/pcdna3.1重组载体(其结构已在中国专利zl 201910738442.9,发明名称“全人源抗cd20重组抗体”中公开)进行连接,将epha2
‑
scfv重组为双价epha2
‑
scfv
‑
fc。重组产物转化大肠杆菌top10感受态细胞,以pcdna3.1载体上游引物t7和scfv特异性下游引物(scfv14r,scfv77r,scfv179r)进行菌落pcr以验证是否出现scfv目的条带。经基因测序验证scfv与重组载体是否同源重组。将同源重组后的pcdna3.1/sp
‑
scfv
‑
fc用质粒提取试剂盒(天根生化科技有限公司)提取质粒,并用pei进行转染,在293f真核细胞中表达epha2
‑
scfv
‑
fc融合蛋白。表达第7天,10,000rpm,离心10min,收取表达上清,用蛋白a亲和层析柱从上清液中分离纯化抗体。引物序列如下:
[0069]
pcdna3.1载体上游引物t7:5
’‑
taatacgactcactatagggaga
‑3’
(seq id no.14),
[0070]
scfv14f:5
’‑
cagctacaggcacccacgcc caggtgcagctacagcagt
‑3’
(seq id no.15),
[0071]
scfv14r:5
’‑
gggcatgtatgggtcttatc tttgatctccaccttggtcc
‑3’
(seq id no.16),
[0072]
scfv77f:5
’‑
cagctacaggcacccacgcc caggtccagcttgtacagtct
‑3’
(seq id no.17),
[0073]
scfv77r:5
’‑
gggcatgtatgggtcttatc taggacggtcaccttggtcc3’(seq id no.18),
[0074]
scfv179f:5
’‑
cagctacaggcacccacgcc caggtgcagctggtggagtc
‑3’
(seq id no.19),
[0075]
scfv179r:5
’‑
gggcatgtatgggtcttatc taggacggtcaccttggtcc
‑3’
(seq id no.20)。
[0076]
1.11 epha2融合蛋白的纯化
[0077]
每个抗epha2表达上清与蛋白a树脂(重悬于1
×
pbs中)在4℃下结合过夜。将结合好的融合蛋白加入到经过柱平衡的重力柱中,洗涤缓冲液1
×
pbs洗涤5次,用洗脱缓冲液(0.1m gly
‑
hcl,ph 3.0)洗脱融合蛋白scfv
‑
fc,然后立即用1m tris
‑
hcl(ph 8.0)进行中和,使最终ph变为7.0。收集融合蛋白并用预冷的1
×
pbs透析换液,4℃过夜。
[0078]
1.12流式细胞荧光分选技术
[0079]
用胰酶消化pc
‑
3、a549细胞并计数,使每管细胞总量达到2
×
105。1000rpm,室温离心5min,弃上清,用1
×
pbs重悬细胞。向每管加入已纯化的双价重组抗体scfv
‑
fc,使其终浓度分别为20μg/ml、10μg/ml、5μg/ml、2.5μg/ml、1.25μg/ml,空白对照组为1
×
pbs,4℃孵育1h。孵育结束后,1000rpm,室温离心5min,弃去完全培养基。每管加入500μl 1
×
pbs重悬细胞,1000rpm,室温离心5min,弃上清。重复2次以去除未与肿瘤细胞表面epha2抗原结合的重
组抗体scfv
‑
fc。避光加入1﹕500稀释的alex fluo
‑
488anti
‑
human
‑
igg荧光抗体,4℃孵育1h。1000rpm,室温离心5min,弃上清。用1
×
pbs清洗细胞2遍。最后用100μl 1
×
pbs重悬细胞,收集细胞悬液于流式管中,用流式细胞仪进行检测。
[0080]
1.13免疫组织化学技术
[0081]
将肺腺癌组织和癌旁组织固定后经脱水、包埋、切片处理,将脱蜡后的切片置于双氧水(含3%甲醇)中,室温作用10min后用1
×
pbs洗涤,将组织切片浸入0.01m柠檬酸盐缓冲溶液(ph 6.0)中加热至沸腾,冷却后用pbs洗涤。滴加封闭液(山羊血清)室温作用20min。滴加已纯化的双价重组抗体epha2
‑
scfv
‑
fc作为一抗,4℃孵育过夜。滴加goat
‑
anti
‑
human
‑
igg
‑
hrp作为二抗,37℃孵育90min,孵育结束后用1
×
pbs洗涤。用dab显色试剂盒(北京中杉金桥生物技术有限公司)进行显色,苏木精轻度复染后用中性树胶进行封片。
[0082]
1.14 cck8细胞增值实验
[0083]
取生长状态良好的a549细胞(对数生长期),经胰酶消化制成细胞悬液,以每孔6
×
104/ml的密度取100ul均匀铺于96孔细胞培养板中,于37℃、5%co2的培养箱中培养24h。用gibco1640培养基稀释抗体,稀释后的抗体终浓度分别为0ug/ml、1.25μg/ml、5μg/ml、10ug/ml、每孔各加100ul,阴性对照组不加抗体只加等量的培养基,每个浓度做三组复孔,空白对照组分为加抗体组和不加抗体组。缓慢加入抗体并做好标记后,将96孔板放入培养箱进行72h培养。培养过后,向每孔加入1μl cck8试剂混匀。培养箱培养1h后取出96孔板,使用酶标仪测定od
450
nm处的吸光值,计算细胞存活率和对肿瘤细胞的抑制率。
[0084]
2.结果
[0085]
2.1 epha2显著影响肿瘤的生存及预后
[0086]
根据epha2的表达水平将肿瘤病例分为高表达组和低表达组,利用tcga数据集研究epha2的表达与不同肿瘤患者预后的相关性。
[0087]
如图1所示,epha2的高表达与tcga项目中gbm(p=0.034)、lgg(p=3.8e
‑
07)、luad(p=0.032)、paad(p=0.0074)肿瘤的预后不良有关。无病生存分析数据(图1)显示,在tcga数据中lgg(p=0.0035)、paad(p=0.011),epha2的高表达与预后不良有关。此外,epha2基因低表达与kirc(p=0.049)、thca(p=0.029)的os预后不良以及kirc(p=0.015)的dfs预后不良有关。以上数据表明epha2基因的表达水平显著影响肿瘤患者的预后,epha2是肿瘤治疗的重要靶点。
[0088]
2.2人scfv噬菌体展示文库的构建
[0089]
从200名肿瘤病人的外周血中分离pbmc并提取mrna合成第一链cdna,合成的cdna在凝胶上呈0.1~8kb的涂片,其大小,强度和产量令人满意(数据未显示)。以第一链cdna为模板,分别扩增出重链基因(vh)和轻链基因(vl)的可变区。vl包括vλ和vκ基因,扩增出的vh,vλ和vκ基因谱带的大小约为400bp(图2a
‑
2c,m是dl 2,000bp的dna marker)。将纯化后的vh,vl(vλ和vκ)的扩增产物通过重叠延伸pcr获得vh
‑
linker
‑
vl基因库(约800bp)(图2d),成功构建了全人源scfv dna文库。
[0090]
将scfv文库中的dna与噬菌体载体pcantab5e连接并转化大肠杆菌tg1,随机挑选20个单克隆菌落,经pcr鉴定scfv插入片段。结果表明,所有的单克隆菌落均插入了全长scfv基因,通过bstnⅰ酶切scfv的dna,dna指纹图谱显示每个scfv是不同的(图2e),构建的人scfv噬菌体展示文库具有多样性,抗体文库中的基因序列是丰富的。
[0091]
2.3 epha2
‑
scfv的筛选及亲和力鉴定
[0092]
采用液相筛选的方法,将生物素化的epha2蛋白加入到扩增的scfv文库中,用链霉亲和素包被的dynabeads m
‑
280(invitgen)捕获结合噬菌体抗体抗原复合物。经过三轮富集筛选,丰富了针对靶抗原的抗体克隆。每轮亲和筛选后,随机选取多个单克隆菌落,通过bstnⅰ酶切scfv的dna,dna指纹图谱显示,经过三轮富集亲和筛选,针对epha2靶抗原的scfv的多样性逐渐下降(图2f
‑
h),特异性逐渐增强,亲和力不断增高。
[0093]
三轮富集亲和筛选后,随机选取240个单克隆菌落进行表达,使用elisa方法检测小量表达的scfv与靶抗原epha2的结合活性,根据od
450
处的结果来保存菌株。将保存的菌株再次进行elisa实验,检测保存菌株是否稳定表达scfv(图3a),以筛选与靶抗原epha2有高结合活性并稳定的scfv。结果显示约83%呈elisa阳性反应,阳性反应的od值为阴性值的2倍。
[0094]
分别用固定液固定肿瘤细胞pc
‑
3、hepg2、a549,根据噬菌体elisa试验结果,将经过多轮筛选的与靶抗原epha2高结合的scfv作为一抗,anti
‑
m13
‑
hrp作为二抗进行细胞elisa试验,检测筛选的抗epha2的scfv与肿瘤细胞表面抗原的结合活性,如图所示(图3b~3d),筛选的28株抗epha2的scfv都能与3种肿瘤细胞表面epha2抗原结合,od
450
处数值高于阴性对照孔。
[0095]
2.4 epha2
‑
scfv
‑
fc的同源重组及表达
[0096]
将经过多轮亲和力选择的抗epha2的scfv,根据其波长450nm处od值的大小,选取od值较高的scfv进行基因测序并添加fc段以形成双价重组抗体。将筛选的3株scfv(scfv14、scfv77和scfv179)与重组载体进行连接并将重组产物转化大肠杆菌top10感受态细胞,以pcdna3.1载体上游引物t7和scfv特异性下游引物为引物对,进行菌落pcr扩增,结果验证出现scfv目的条带,条带大小约为800bp(图4a~4c,m是dl 2000bp的dna marker),后经基因测序验证,3株scfv与重组载体成功同源重组。
[0097]
scfv14的重链可变区氨基酸序列如seq id no.1所示,轻链可变区氨基酸序列如seq id no.2所示;scfv77的重链可变区氨基酸序列如seq id no.3所示,轻链可变区氨基酸序列如seq id no.4所示;scfv179的重链可变区氨基酸序列如seq id no.5所示,轻链可变区氨基酸序列如seq id no.6所示。
[0098]
将构建好的pcdna3.1/sp
‑
scfv
‑
fc表达载体瞬时共转染293f真核细胞,在表达第7天收取表达上清,采用蛋白a树脂对收取的表达上清进行纯化,并将纯化前后的表达上清进行sds
‑
page验证(图4d),结果显示,目的蛋白纯化效果较好,其分子大小约为50kd。
[0099]
2.5 epha2双价重组抗体scfv
‑
fc的亲和力鉴定
[0100]
(1)双价重组抗体scfv
‑
fc与肿瘤细胞表面抗原的结合活性
[0101]
前列腺癌细胞pc
‑
3和肺腺癌细胞a549属于高表达epha2受体的肿瘤细胞,我们通过噬菌体抗体库筛选到结合epha2受体胞外区的scfv。使用分子生物学技术方法,添加fc段将scfv构建为双价重组抗体,利用流式细胞术检测重组抗体结合epha2受体的能力。将重组抗体与肿瘤细胞在4℃下共孵育1h。其重组抗体的终浓度分别为20μg/ml、10μg/ml、2.5μg/ml、1.25μg/ml,分别与pc
‑
3、a549细胞进行反应,流式细胞仪检测其结合情况(图5a~5b)。
[0102]
与pc
‑
3细胞的结合显示,179号重组抗体(scfv179
‑
fc)与77号重组抗体(scfv77
‑
fc)1.25μg/ml及以上浓度结合率均超过99%,14号重组抗体(scfv14
‑
fc)2.5μg/ml及以上
浓度结合率超过86%。与a549细胞的结合显示,77号重组抗体1.25μg/ml及以上浓度结合率超过99%,179号重组抗体2.5μg/ml及以上浓度结合率超过93%,14号重组抗体2.5μg/ml及以上浓度结合率超过81%。以上结果表明,我们构建的3种双价重组抗体都能有效结合pc
‑
3、a549细胞上epha2受体。并且平均荧光强度与抗体浓度呈正相关(图5c~5d)。
[0103]
scfv14
‑
fc的氨基酸序列如seq id no.7所示;scfv77
‑
fc的氨基酸序列如seq id no.8所示;scfv179
‑
fc的氨基酸序列如seq id no.9所示;scfv14
‑
fc、scfv77
‑
fc、scfv179
‑
fc的核苷酸编码序列依次如seq id no.21、seq id no.22、seq id no.23所示。
[0104]
(2)双价重组抗体scfv
‑
fc与肿瘤组织表面抗原的结合
[0105]
免疫组化结果表明,3种纯化的双价重组抗体scfv
‑
fc都能有效结合癌组织表面的epha2抗原,结合效果良好。纯化的双价重组抗体scfv
‑
fc有着较高的亲和力和结合活性。同时,我们用image
‑
pro plus6.0分析软件对不同样本进行了半定量分析,以整张图片面积(像素值2048
×
1536)作为测量面积,分别算出肺腺癌组织以及癌旁组织阳性表达的平均光密度值。结果表明,epha2在肺腺癌癌组织中高表达,且癌组织与癌旁组织表达差异显著(图6)。
[0106]
2.6抗epha2抗体对肺癌细胞a549增殖的抑制作用
[0107]
生长状态良好的a549细胞,分别加入0μg/ml、1.25μg/ml、5μg/ml、10μg/ml的抗epha2scfv
‑
fc抗体培养72h后研究结果显示:分别1.25μg/ml、5μg/ml、10μg/ml scfv
‑
fc抗体后,scfv179
‑
fc对a549细胞生长的抑制率为14%,55%和76%;scfv77
‑
fc抗体对a549细胞生长的抑制率为3%,17%和74%;scfv14
‑
fc抗体对a549细胞生长的抑制率为74%,74%和77%,与未加入抗体的阴性对照相对比,三株抗体在10μg/ml浓度下可显著均能显著抑制肿瘤细胞a549的生长(图7)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1