Pgk1作为靶点在制备或筛选治疗胃肠道疾病药物中的应用
pgk1作为靶点在制备或筛选治疗胃肠道疾病药物中的应用
技术领域
1.本发明属于生物医药领域,具体涉及一种pgk1作为靶点在制备或筛选治疗胃肠道疾病药物中的应用。
技术背景
2.胃肠道疾病是人类最常见的疾病之一,涵盖食管、胃、小肠、结肠和直肠等,常见的主要症状包括节律性、周期性上腹痛,腹泻,饥饿性腹痛,反酸,发烧,黑便血便,消化道出血和肠梗阻等。其中最常见的包括吞咽障碍、胃溃疡、十二指肠溃疡、复合型溃疡、胃轻瘫、胃排空延迟、肠易激综合征(ibs)和炎症性肠病(ibd)。溃疡的形成有多种因素,例如胃酸分泌过多、幽门螺杆菌感染和胃粘膜保护作用减弱等因素是引起消化性溃疡的主要环节。胃排空延缓和胆汁反流、胃肠肽的作用、遗传因素、药物因素、环境因素和精神因素等,都和消化性溃疡的发生有关。目前认为胃溃疡的形成因素较多着重于胃粘膜屏障的削弱和胃泌素分泌的增加,而十二直肠溃疡的形成因素则较多着重于壁细胞总体积的增大。此外,过度饮酒、进食无规律、长期精神紧张和长期服用非甾体抗炎药(如阿司匹林)、糖皮质激素、氯吡格雷等药物等外源性因素均与胃溃疡和十二指肠溃疡等的形成有关。炎症性肠病可由细菌、真菌、病毒、寄生虫、原虫等生物引起,亦可由变态反应及理化因子引起。根据病因不同,可分为特异性炎性病变和非特异性炎性病变,前者指感染性结肠炎、缺血性结肠炎和伪膜性结肠炎等,后者主要包括溃疡性结肠炎(ulcerative colitis,uc)与结肠克罗恩病(crohn’s disease,cd);临床表现主要有体重减少、里急后重、腹泻、腹痛、甚至血便。其中,溃疡性结肠炎病变局限于大肠粘膜及粘膜下层,疾病通常先累及直肠,逐渐向全结肠蔓延。而目前主要治疗胃肠道疾病的西药类型有促胃肠动力药、解痉药、止吐药、消化性溃疡药物、胃黏膜保护剂、助消化药、微生态制剂等。其中治疗消化性溃疡的药物主要包括质子泵抑制剂、h2
‑
受体拮抗剂、铋制剂和前列腺素类等,虽能改善缓解症状,但很难彻底治愈,易反复发作。结肠炎的发病机制尚未完全阐明,临床治疗常用的药物包括氨基水杨酸类制剂、糖皮质激素和免疫抑制剂等,短期使用可控制结肠炎的症状,但治愈率极低,长时间使用可诱发多种不良反应,且停药可复发等问题,严重者可引起癌变。因此,开发出一种治疗胃肠道疾病的新药物是目前亟需解决的技术问题。
3.磷酸甘油酸激酶1(phosphoglycerate kinase 1,pgk1)是糖酵解途径中的关键代谢酶,能够催化1,3
‑
二磷酸甘油酸(1,3
‑
bpg)转化为3
‑
磷酸甘油酸(3
‑
pg),并产生糖酵解途径中的第一个atp,因而在细胞能量代谢中发挥着重要功能。pgk1在多种癌细胞中有高水平的表达,最近的研究表明,pgk1与肿瘤的发生和发展密切相关;pgk1在多个位点上发生磷酸化和乙酰化,在特定条件下会发生线粒体和细胞核的易位,进而抑制三羧酸(tca)循环代谢,直接或间接地增强糖酵解活性,同时增强癌细胞的warburg效应,促进癌细胞的增殖和生长。但是,目前并没有任何文献公开能够将上述pgk1基因所转录的蛋白应用于治疗胃肠道疾病。
4.并且,喹唑啉衍生物主要用于治疗心脑血管疾病,脑血管疾病包括脑血栓、脑缺
血、脑梗塞等,心血管疾病包括心肌梗塞、心肌缺血、心肌损伤、冠心病、心绞痛、心力衰竭等。被用于治疗和/或预防败血症及其并发症,以及用于激活新靶标;也被用于制备治疗和/或预防高血糖、脑血栓及其并发症。但是,目前并没有任何文献公开将所述的喹唑啉衍生物用于治疗胃肠道疾病。
5.本发明在研究过程中意外的发现,pgk1、表达pgk1的重组质粒或重组菌、激活pgk1表达的药物能够有效的抑制细胞死亡、增强改善黏膜完整度、促进组织形态改善,对消化性溃疡和炎症性肠病的疗效显著,具有良好的临床应用前景。
技术实现要素:
6.针对上述技术问题,本发明的首要目的是提供一种pgk1作为靶点在制备或筛选治疗胃肠道疾病药物中的应用,并提供了用于治疗胃肠道疾病的药物。具体包括以下方面:
7.第一方面,本发明提供了一种pgk1作为靶点在筛选用于预防或治疗胃肠道疾病药物中的应用,所述药物以pgk1为靶点,促进pgk1的表达。
8.优选地,所述pgk1的氨基酸序列如seq id no.1所示。
9.优选地,所述胃肠道疾病包括消化性溃疡、炎症性肠病。
10.优选地,所述消化性溃疡包括胃溃疡、十二指肠溃疡、球后溃疡、幽门管溃疡、复合溃疡、对吻溃疡;所述炎症性肠病包括结肠炎、溃疡性结肠炎、克罗恩病。
11.优选地,所述消化性溃疡为胃溃疡,所述炎症性肠病为溃疡性结肠炎。
12.第二方面,本发明提供了一种pgk1蛋白,或表达pgk1蛋白的重组质粒,或表达pgk1蛋白的重组益生菌、或促进pgk1蛋白表达的化合物在制备预防或治疗胃肠道疾病药物中的应用。
13.优选地,所述表达pgk1蛋白的重组质粒是将编码pgk1蛋白的基因接入表达载体获得
14.优选地,所述表达载体包括但不局限于pet
‑
28a、pezz18、pta1529、piniii
‑
ompa、pub110、pe194、pucx05
‑
bgab、pht304、pmk3、ppic9、ppic9k、phil
‑
s1、ppiczα、pyam75p、pnz8149
‑
usp45。
15.优选地,所述表达载体为pet
‑
28a,所述表达pgk1蛋白的重组质粒为pet
‑
28a
‑
pgk1,所述pet
‑
28a
‑
pgk1的基因序列如seq id no.3所示。
16.优选地,所述表达pgk1蛋白的重组益生菌是将表达pgk1蛋白的重组质粒转化益生菌获得,或将编码pgk1蛋白的基因整合至益生菌获得。
17.优选地,所述益生菌包括但不局限于大肠埃希菌(escherichia coli)nissle 1917、益生芽孢杆菌、乳球菌、丁酸杆菌、乳杆菌、双歧杆菌、放线菌、巴斯德毕赤酵母。
18.优选地,所述益生菌为(escherichia coli)nissle 1917。
19.优选地,所述促进pgk1蛋白表达的化合物包括下式(ⅰ)所示的喹唑啉衍生物,或其药学可接受的盐,或其互变异构体,或其内消旋体,或其外消旋体,或其对映异构体,或其非对映异构体,或其溶剂合物,或其酯,或其前药,或其为活性成分的药物组合物,
[0020][0021]
其中:
[0022]
r1和r2分别选自氢、氨基、羟基、c1‑6直链烷基、c1‑6取代烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c1‑6烷基酰基、芳基酰基、c6‑
10
芳基、c5‑6环烷基,或r1和r2与其连接的氮原子一起形成5元环或6元环;所述取代烷基包括1
‑
3个羟基和/或卤素取代烷基;
[0023]
r3和r4分别选自氢、卤素、c1‑6烷基、c1‑6卤代烷基、c2‑6烯基、c2‑6炔基、腈基、硝基、氨基、羟基、c1‑6烷氧基、c1‑6烷酰基氧基、c1‑6烷酰基氨基、c1‑6烷酰基氨基、芳基酰基氨基、饱和或不饱和的5元碳环基或杂环基、饱和或不饱和的6元碳环基或杂环基、饱和或不饱和的5元碳环基氧基或杂环基氧基、饱和或不饱和的6元碳环基氧基或杂环基氧基、c1‑6烷基酰基;或者r3和r4与其连接的环原子一起形成5元或6元碳环/杂环;
[0024]
r5和r6分别选自氢、卤素、腈基、硝基、氨基、羟基、c1‑6烷基、c1‑6烷氧基、c1‑6烷酰基氨基、c1‑6卤代烷基、c2‑6烯基、c2‑6炔基、c1‑6烷酰基氨基、c1‑6烷酰基氨基、芳基酰基氨基、饱和或不饱和的5元碳环基或杂环基、饱和或不饱和的6元碳环基或杂环基、饱和或不饱和的5元碳环基氧基或杂环基氧基、饱和或不饱和的6元碳环基氧基或杂环基氧基、c1‑6烷基酰基;
[0025]
r7选自氢、羟基、硝基、c1‑6烷基、c1‑6卤代烷基、c1‑6烷氧基取代烷基、c3‑6环烷基、螺环烷基、桥环烷基、取代或未取代的苯基或杂环基,其中所述取代的苯基或杂环基的取代基包括c1‑6烷基、c1‑6烷氧基、c1‑6卤代烷基、硝基、氨基、腈基、卤素、c1‑6硫醚或其氧化产物砜、亚砜。
[0026]
优选地,所述的r7选自c1‑6烷基、c1‑6卤代烷基、c1‑6烷氧基取代烷基、c3‑6环烷基、螺环烷基、桥环烷基、取代或未取代的苯基或杂环基,其中所述取代的苯基或杂环基的取代基包括c1‑6烷基、c1‑6烷氧基、c1‑6卤代烷基、硝基、氨基、腈基、卤素、c1‑6硫醚或其氧化产物砜、亚砜。
[0027]
优选地,所述的喹唑啉衍生物包括哌唑嗪、特拉唑嗪、多沙唑嗪、阿呋唑嗪和曲马唑嗪。
[0028]
优选地,所述的喹唑啉衍生物为特拉唑嗪。
[0029]
优选地,所述胃肠道疾病包括消化性溃疡、炎症性肠病。
[0030]
优选地,所述消化性溃疡包括胃溃疡、十二指肠溃疡、球后溃疡、幽门管溃疡、复合溃疡、对吻溃疡;所述炎症性肠病包括结肠炎、溃疡性结肠炎、克罗恩病。
[0031]
优选地,所述消化性溃疡为胃溃疡,所述炎症性肠病为溃疡性结肠炎。
[0032]
优选地,pgk1蛋白,或表达pgk1蛋白的重组质粒,或表达pgk1蛋白的重组益生菌、或促进pgk1蛋白表达的化合物加入药学上可接受的载体制成片剂、注射剂、混悬剂、胶囊
剂、颗粒剂中的任一种。
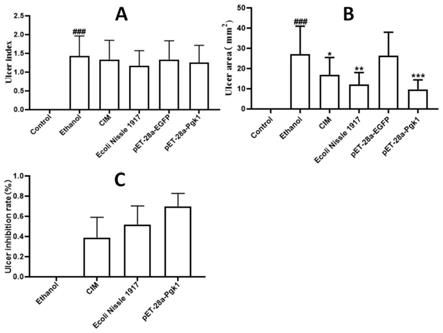
[0033]
本发明的有益效果是:
①
本发明通过构建pgk1基因重组质粒pet
‑
28a
‑
pgk1,并将其转入到益生菌中获得重组益生菌,所述重组益生菌能够有效抑制细胞死亡、增强改善黏膜完整度、促进组织形态改善,显著的减少结肠炎小鼠的体重下降百分率、降低疾病活动改善、减轻结肠组织病理损伤、改善结肠缩短情况,对消化性溃疡和炎症性肠病的疗效显著;
②
本发明所述的喹唑啉衍生物能够激活pgk1的表达,且能够有效抑制细胞死亡、增强改善黏膜完整度、促进组织形态改善,显著的减少结肠炎小鼠的体重下降百分率、降低疾病活动改善、减轻结肠组织病理损伤、改善结肠缩短情况,对消化性溃疡和炎症性肠病的疗效显著,比现有临床药物活性高20
‑
80倍,可以在临床上推广应用;
③
本发明发现以pgk1为靶点,可用于制备或筛选治疗胃肠道疾病药物;
④
本发明还改变了蛋白药物常规的用药方式(肌注或静注),以口服给药的方式将蛋白药物应用于胃肠道疾病的治疗,解决了本领域长期未解决的技术问题,取得了显著的效果。
附图说明
[0034]
图1重组质粒转化dh5α菌株pcr反应结果显示图;
[0035]
图2重组质粒转化(escherichia coli)nissle 1917耐受菌pcr反应结果显示图;
[0036]
图3重组益生菌对胃溃疡小鼠胃粘膜损伤平面图;
[0037]
图4表达pgk1蛋白的重组益生菌对胃溃疡小鼠溃疡指数、溃疡面积和溃疡抑制率的影响,其中,
###
p<0.001vs.control组;
*
p<0.05、
**
p<0.01和
***
p<0.001vs.ethanol组;
[0038]
图5表达pgk1蛋白的重组益生菌对溃疡性结肠炎小鼠结肠损伤示意图;
[0039]
图6表达pgk1蛋白的重组益生菌对溃疡性结肠炎dai评分和结肠长度的影响,其中
###
p<0.001vs.空白对照组;
**
p<0.01和
***
p<0.001vs.dss模型组;
[0040]
图7特拉唑嗪对ges
‑
1细胞存活率的影响,其中,
###
p<0.001vs.control组;
***
p<0.001vs.ethanol组;
[0041]
图8特拉唑嗪对ges
‑
1细胞pgk1活性的影响,其中,
#
p<0.05vs.control组;
*
p<0.05vs.ethanol组;
[0042]
图9特拉唑嗪对胃溃疡小鼠的影响,其中,
###
p<0.001vs.control组;
**
p<0.01和
***
p<0.001vs.ethanol组;
[0043]
图10特拉唑嗪对caco
‑
2细胞的细胞毒和细胞活力分析,其中,
###
p<0.001vs.control组;
*
p<0.05和
**
p<0.01vs.h2o2组;
[0044]
图11特拉唑嗪对caco
‑
2细胞pgk1活性的影响,其中,
##
p<0.01vs.control组;
*
p<0.05vs.h2o2组;
[0045]
图12特拉唑嗪对结肠炎小鼠体重和dai评分的影响,其中,
###
p<0.001vs.control组;
*
p<0.05和
**
p<0.01vs.dss组;
[0046]
图13特拉唑嗪对结肠炎小鼠结肠和结肠长度的影响,其中,
###
p<0.001vs.control组;
*
p<0.05vs.dss组。
具体实施方式
[0047]
为了使本发明的目的、技术方案及优点更加清楚明白,以下实施例,对本发明进行
进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。下述实施例中的实验方法若无特别说明,均为常规方法。下述实施例中所用的试剂材料等,如无特殊说明,均为市售购买。
[0048]
以下列实施例中所述的大肠杆菌菌种(escherichia coli)dh5α购自北京全式金生物技术有限公司;大肠杆菌菌种(escherichia coli)nissle 1917购自德国(商标名为mutaflor);重组质粒pet
‑
28a
‑
egfp购自淼灵质粒平台;无水乙醇购自天津大茂化学试剂公司;β
‑
乳糖(β
‑
lactose,含70%的β
‑
乳糖和30%的α
‑
乳糖)购自麦克林生物科技有限公司;所用pcr引物购自生工生物工程(上海)股份有限公司;所述细菌质粒dna提取试剂盒购自axygen公司;所述primestar hs(premix,2x)、t4 dna ligase购自takara公司;所述dna内切酶bamhi、ecorii购自北京neb公司;
[0049]
所述lb(luria
‑
bertani)液体培养基配方为:1%胰蛋白胨、0.5%酵母提取物、0.5%nacl;所述lb固体培养基配方为:1%胰蛋白胨、0.5%酵母提取物、0.5%nacl、2%琼脂。
[0050]
以下实施例所述的km小鼠是指昆明小鼠;实验动物km小鼠由中国农业科学院兰州兽医研究所提供,许可证号为scxk(甘)
‑
2020
‑
0002,适应性饲养一周,给予动物饮食并自由饮用蒸馏水,然后分组进行实验。
[0051]
在本发明中,烷基是指具有特定碳原子数的直链和支链的饱和及不饱和烷基或者脂肪基;所述的烷氧基是指具有指定碳原子数的饱和及不饱和烷基
‑
o
‑
基团;所述的羧酸酯基取代烷基是指具有指定碳原子数的饱和及不饱和烷基
‑
cooch
x(x=0
‑
3)
‑
基团;所述的硫醚是指具有指定碳原子数的饱和及不饱和烷基
‑
s
‑
基团;所述的氧化产物砜是指具有特定碳原子数的饱和及不饱和烷基基团;所述的氧化产物亚砜是指具有特定碳原子数的饱和及不饱和烷基基团;所述的“卤素”或“卤代”是指作为取代基的氟、氯、溴或碘,当卤原子作为取代基的时候,其在同一个碳原子上取代的数目可以是一个、两个或三个;所述的芳基包括苯基、取代苯基(此处取代苯基包括下述一个、两个或三个基团:c1‑6饱和及不饱和烷基,c1‑6饱和及不饱和烷氧基,苯氧基,腈基,硝基,氨基或卤素等);本发明使用的术语“杂环”表示稳定的5
‑
至7
‑
元杂环,这些杂环可以是饱和的或不饱和的,并由碳原子和任选自n,o和s的1至4个杂原子组成,其中的氮和硫杂原子可被选择性地氧化,且氮杂原子可被选择性季铵化,优选6元杂环,例如吡啶、哌啶、吡嗪、哌嗪、吗啉或硫吗啉等。
[0052]
以下实施例中所述的ges
‑
1细胞为人胃粘膜细胞,用于模拟体外胃溃疡细胞模型,购自武汉普诺赛生物科技有限公司;所述的caco
‑
2细胞为人结直肠腺癌细胞,用于模拟体外结肠炎细胞模型,购自武汉普诺赛生物科技有限公司;所述的西咪替丁片(cimetidine,cim),也称甲氰咪胍,购自上海信谊天平药业有限公司;是一种组胺h2受体阻抗剂,主要用于抑制胃酸的分泌,能明显抑制基础和夜间胃酸分泌,也能抑制由组胺、分肽胃泌素、胰岛素和食物等刺激引起的胃酸分泌,并使其酸度降低,对因化学刺激引起的腐蚀性胃炎有预防和保护作用,对应激性胃溃疡和上消化道出血也有明显疗效。因此,实施例2和实施例4中将西咪替丁作为阳性药物使用;所述的葡聚糖硫酸钠用于小鼠结肠炎的造模,所述葡聚糖硫酸钠(dextran sulfate sodium,dss),mw:40000,购自阿拉丁生物科技有限公司;所述的柳氮磺吡啶肠溶片(salazosulfapyridine,sasp)购自上海信谊天平药业有限公司,适应症为:(1)溃疡性结肠炎治疗轻至中度的溃疡性结肠炎;在重度溃疡性结肠炎中可作为辅助疗
法。亦可用于溃疡性结肠炎缓解期的维持治疗;(2)crohn’s病用于治疗活动期的克隆病,特别是那些累及结肠的患者;(3)类风湿性关节炎对水杨酸类或其他非甾体抗炎药疗效不显著的类风湿性关节炎和幼年类风湿性关节炎(多关节型);因此实施例3和实施例5中将柳氮磺吡啶肠溶片作为阳性药物使用。
[0053]
以下实施例中所述的数据处理方式为:采用spss23.0软件进行统计学分析,数据以(x
±
s)表示,组间比较采用单因素方差分析(one
‑
way anova)和lsd
‑
t法进行两两比较。p<0.05认为具有统计学意义。
[0054]
实施例1表达pgk1的重组质粒和表达pgk1的重组益生菌的制备
[0055]
1.引物合成
[0056]
根据基因pgk1的核苷酸序列seq id no.2所示,与pet
‑
28a质粒图谱比较,设计特异引物,并在引物中插入限制性内切酶酶切位点bamhi和ecori,具体信息见表
‑
1,引物由上海生工生物工程股份有限公司合成;用无菌去离子水将引物溶解,配成浓度为10μmol/l。
[0057]
表1引物信息及合成
[0058][0059]
2.重组质粒的构建
[0060]
pet
‑
28a
‑
pgk1质粒由金唯智生物科技有限公司合成。
[0061]
3.用重组质粒转化(escherichia coli)dh5α菌
[0062]
‑
80℃冰箱中取出dh5α感受态细胞,在冰盒上放置10
‑
20分钟,使其融化;取出50μl感受态细胞加入5μl质粒,用手指轻轻拨打几次混匀,将混合物在冰上放置25min;42℃热激45s后,迅速放回冰上静置2min,加0.5ml室温的lb液体培养基(不含抗生素),37℃、200rpm振摇培养1h,取200μl上述菌液涂布于含有15μg/ml卡那霉素的平板上,待菌液完全被培养基吸收后倒置培养皿,在37℃条件下培养12h。
[0063]
4.热激转化成功菌落验证
[0064]
挑取单克隆,在含有15μg/ml的卡那霉素的液体培养基中扩增培养,进行pcr验证、酶切验证。验证结果如图1所示,目标条带分子量大小为1254bp,验证结果正确(图中箭头所指位置为目标条带)。
[0065]
5.提取重组质粒dna
[0066]
将成功转入重组质粒的菌株转接至lb培养基中放大培养,培养条件为:转速200rpm,温度为37℃。用axygen公司的质粒小提试剂盒提取质粒。
[0067]
6.制作大肠埃希菌(escherichia coli)nissle 1917化学感受态细胞
[0068]
从
‑
80℃冰箱中取出保种的大肠埃希菌(escherichia coli)nissle 1917(mutaflor)菌株,用灭菌的枪头挑取少量保菌液,在lb固体培养基上划线处理,并于37℃培养箱中过夜培养:从lb固体培养基上挑取湿润,圆滑的单菌落,放入lb培养液中,37℃培养12h;当菌液od 600值为0.3
‑
0.5时,将菌液转移到冰上预冷的已灭菌离心管中,冰浴30min,在4℃条件下,1520g离心10min;弃去上清,用500μl预冷的cacl2溶液(已过滤除菌)轻轻悬浮细胞,4℃条件下,1520g离心10min;重复上一步骤一次;弃去上清,加入500μl预冷的
cacl2溶液(已过滤除菌),小心悬浮细胞,即制成了感受态细胞悬液;制备好的感受态细胞悬液直接用于转化实验。未用完的感受态细胞加入等体积的已灭菌的20%甘油,混匀后分装于1.5ml离心管中(每管100μl),置于
‑
80℃冰箱保存。
[0069]
7.将重组质粒转入大肠埃希菌(escherichia coli)nissle 1917菌株
[0070]
从
‑
80℃冰箱中取出(escherichia coli)nissle 1917化学感受态细胞中,在冰盒上放置10
‑
20分钟,使其融化。从中取出50μl感受态细胞加入5μl质粒,用手指轻轻拨打几次混匀,将混合物在冰上放置25min;在42℃热激45s后,迅速放回冰上静置2min,加0.5ml室温的lb液体培养基(不含抗生素),37℃,200rpm振摇培养1h,取200μl上述菌液涂布于含有15μg/ml卡那霉素的平板上,待菌液完全被培养基吸收后倒置培养皿,在37℃条件下培养12h。
[0071]
8.热激转化成功菌落验证
[0072]
挑取单克隆,在含有15μg/ml的卡那霉素的液体培养基中扩增培养,之后进行pcr验证、酶切验证。实验结果如图2所示,验证正确得到表达pgk1的重组大肠埃希菌(escherichia coli)nissle 1917益生菌。
[0073]
需要说明的是,本发明所述方法并不是对表达pgk1重组益生菌构建的唯一限定方法,通过常规的技术手段,构建任一表达pgk1的重组质粒,并通过常规的转化操作,将所述的表达pgk1的重组质粒转化大肠埃希菌(escherichia coli)nissle 1917菌株或其他益生菌,均能够筛选获得表达pgk1的重组益生菌。
[0074]
实施例2表达pgk1的重组益生菌对胃溃疡小鼠的治疗效果
[0075]
1.km小鼠酒精性胃溃疡模型的制备
[0076]
48只km雄性小鼠(20
‑
25g),饲养于兰州大学实验动物房,小鼠适应性饲养一周后,随机分为6组,每组8只,分组情况及给药量如所示:
[0077]
空白对照组:灌胃给予0.25ml,11.1mg/ml(m/v)的β
‑
乳糖溶液;乙醇对照组:灌胃给予0.25ml的无水乙醇;阳性对照组:西咪替丁,80mg/kg/day,灌胃给药;(escherichia coli)nissle 1917组:灌胃0.25ml的(escherichia coli)nissle 1917原菌;pet
‑
28a
‑
egfp组:灌胃0.25ml含重组质粒pet
‑
28a
‑
egfp的重组大肠埃希菌(escherichia coli))nissle 1917益生菌;pet
‑
28a
‑
pgk1组:灌胃0.25ml表达pgk1的重组大肠埃希菌(escherichia coli)nissle 1917益生菌。
[0078]
上述各组小鼠预给药5天(细菌数量为1
×
109cfu,均由11.1mg/ml的β
‑
乳糖溶液进行配制),造模前2h再给药一次,2h后灌胃无水乙醇,刺激2h后结束实验,分离血清和胃组织测定各项指标。
[0079]
2.溃疡面积、溃疡指数与抑制率检测
[0080]
将胃取出,沿胃大弯剪开,冲洗干净内容物,观察胃粘膜溃疡情况,用直尺测量溃疡的横径与纵径,两者乘积为溃疡面积(mm2),如公式1所示;然后计算整个胃组织的溃疡面积,从而计算溃疡抑制率(%),见公式2。同时以各组鼠溃疡点数之和的均值作为溃疡指数(愈合记0分、表浅性黏膜糜烂记1分、深陷性溃疡或透壁性坏死记2分、穿孔或穿透性溃疡记3分)
[0081]
溃疡面积(mm2)=溃疡最大长径*垂直于最大长径的最大宽径
ꢀꢀꢀ
(1)
[0082]
[0083]
3.实验结果
[0084]
上述各组小鼠处死后,迅速取其胃组织,观察其形态改变及溃疡损伤情况,并对其溃疡面积和溃疡指数进行统计分析,实验结果如图3和图4所示。由图3可知,空白对照组小鼠胃组织宏观形态正常,未出现明显出血性病变,而乙醇模型组小鼠胃组织出血性病变明显,溃疡最为严重,表明乙醇胃溃疡模型制备成功;与乙醇模型组相比,阴性对照pet
‑
28a
‑
egfp治疗组未表现出明显的溃疡保护作用;(escherichia coli)nissle 1917原菌对照组能改善胃粘膜的损伤程度,减少溃疡面积(p<0.01),溃疡抑制率达51.91%;临床用药西咪替丁的溃疡抑制率为46.67%;表达pgk1的重组大肠埃希菌(escherichia coli)nissle 1917益生菌的溃疡抑制率高达70.00%,显著高于原菌(escherichia coli)nissle 1917和西咪替丁的溃疡抑制率。上述结果表明,本发明所述表达pgk1的重组益生菌具有显著的胃溃疡预防保护作用,且对胃溃疡的保护作用更强,说明pgk1蛋白具有显著的预防或治疗胃溃疡的作用;进一步表明pgk1基因为筛选预防或治疗胃溃疡的新靶标,为胃溃疡的治疗提供新策略。
[0085]
实施例3表达pgk1的重组益生菌对溃疡性结肠炎小鼠的治疗效果
[0086]
1.实验分组和灌胃给药剂量:
[0087]
将48只8周龄雄性km小鼠按体重随机均分为6组分组和给药剂量如下:
[0088]
正常对照组(control,口服给予等体积11.1mg/ml的β
‑
乳糖溶液);dss模型对照组(dss,口服给予等体积11.1mg/ml的β
‑
乳糖溶液);阳性药组(sasp,口服给予柳氮磺吡啶,80mg/kg/day);(escherichia coli)nissle 1917组:灌胃0.25ml的(escherichia coli)nissle 1917原菌;pet
‑
28a
‑
egfp组:灌胃0.25ml含重组质粒pet
‑
28a
‑
egfp的重组大肠埃希菌(escherichia coli)nissle 1917益生菌;pet
‑
28a
‑
pgk1组:灌胃0.25ml表达pgk1的重组大肠埃希菌(escherichia coli)nissle 1917益生菌。上述给药组均由11.1mg/mlβ
‑
乳糖溶液进行配制。
[0089]
2.溃疡性结肠炎模型的制备
[0090]
配制4%的dss蒸馏水溶液,dss模型对照组小鼠自由饮用dss水溶液造模、dss+各细菌治疗组小鼠自由饮用dss水溶液造模同时给予0.25ml的菌液,细菌密度为1
×
109cfu;dss+sasp组小鼠自由饮用dss水溶液造模同时给予80mg/kg/day的sasp;空白对照组小鼠自由饮用蒸馏水,所有小鼠保持常规饲料喂养,出现血性腹泻或血性便时将含dss的水溶液换成常规饮用水,继续给予药物治疗,第八天末次给药2h后,分离血清及结肠组织备用。
[0091]
3.溃疡性结肠炎检测指标
[0092]
疾病活动指数(dai)评分:参照文献方法,对各组小鼠体重质量下降率、粪便性状及大便隐血情况进行评分。
[0093]
dai=(体重质量下降+粪便性状+大便隐血)/3
[0094]
结肠损伤评价:各组小鼠处死后,分离小鼠结肠,从回肠和结肠结合处剪断回肠,再在结肠近肛门处剪断,分离结肠外的筋膜,使结肠完全伸展开,用直尺测量小鼠结肠自回结肠处至肛门的长度,并拍照记录。
[0095]
4.结果分析
[0096]
重组益生菌对结肠炎小鼠结肠形态及结肠长度的影响结果:上述各组小鼠处死后,迅速摘除其结肠组织,观察其形态改变,同时测量其长度,对各组数据进行统计分析,实
验结果如图5和图6中b所示。与空白对照组相比,dss模型组结肠长度显著的缩短(p<0.001),表明dss模型是制备成功的;与dss模型对照组相比,原菌(escherichia coli)nissle 1917和阴性对照pet
‑
28a
‑
egfp能轻微改善结肠水肿及缩短情况,但无显著性差异;同时pet
‑
28a
‑
egfp的效果与原菌没有差别,表明转入目的基因egfp对溃疡性结肠炎无治疗作用;表达pgk1的重组大肠埃希菌(escherichia coli)nissle 1917益生菌能显著的改善结肠水肿及缩短情况,且具有统计学差异(p<0.001),即pgk1蛋白具有预防或治疗溃疡性结肠炎的作用;且pgk1基因可作为筛选预防或治疗溃疡性结肠炎的新靶标。
[0097]
重组益生菌对溃疡性结肠炎小鼠疾病活动指数的影响结果:上述小鼠在实验过程中,对其体重、粪便粘稠度、便血及隐血情况进行监测,数据统计用spss23.0软件进行单因素方差分析。结果如图6中a可知,与空白对照组相比,dss模型组dai评分呈显著的上升趋势(p<0.001),表明dss模型制备成功;与模型对照组相比,柳氮磺吡啶给药组、(escherichia coli)nissle 1917给药组、pet
‑
28a
‑
egfp给药组和pet
‑
28a
‑
pgk1给药组均能显著的降低dai评分(p<0.05),初步表明(escherichia coli)nissle 1917耐受菌和表达pgk1的重组益生菌对溃疡性结肠炎具有治疗作用。
[0098]
以上所述dai评分、结肠形态及结肠长度测定表明,表达pgk1蛋白的重组益生菌对dss诱导的溃疡性结肠炎有治疗作用,无明显的毒副作用,即pgk1蛋白具有预防和/或治疗溃疡性结肠炎的作用;且pgk1基因可作为筛选预防或治疗溃疡性结肠炎的新靶标。
[0099]
综合实施例2和实施例3结果可知,表达pgk1蛋白的重组益生菌能够显著抑制胃溃疡及溃疡结肠炎,可用于胃肠道疾病的治疗。
[0100]
实施例4特拉唑嗪对胃溃疡小鼠的治疗效果
[0101]
实验材料及来源:ges
‑
1细胞购自武汉普诺赛生物科技有限公司;rmpi 1640培养基、胰酶、双抗、胎牛血清均购自bi生物科技有限公司;pgk1抗体购自武汉博士德公司;特拉唑嗪(terazosin,tz,hplc≥98%),购自阿拉丁生物科技有限公司;无水乙醇,天津大茂化学试剂公司;西咪替丁胶囊(cimetidine capsules,cim)购自特一药业集团股份有限公司。
[0102]
实验动物:8周龄spf级昆明(kunming,km)雄性小鼠,体重为18~22g,实验前未使用任何药物,购自中国农业科学院兰州兽医研究所。实验动物于温度为24~26℃,12h/12h的白昼规律交替的环境中适应饲养一周,给予动物饮食并自由饮用蒸馏水,然后分组进行实验。
[0103]
1.体外细胞模型
[0104]
mtt法检测细胞活力分析:使ges
‑
1细胞在rmpi 1640培养基中培养,该培养基含10%的胎牛血清和1%的双抗。为了诱导细胞死亡模型,本实验以无水乙醇为诱导剂建立ges
‑
1细胞死亡模型,具体方法为:取对数生长期的ges
‑
1细胞,以1
×
104/孔的细胞密度种植与96孔板,待细胞贴壁后,设立空白组、空白+tz(100nmol/l)组、空白+tz(10nmol/l)、乙醇模型组(0.5mmol/l)、乙醇+tz(100nmol/l)组和乙醇+tz(10nmol/l),加特拉唑嗪药物干预24h后,换成含0.5mmol/l乙醇的培养基刺激24h,用mtt法检测细胞活力,计算其存活率。
[0105]
特拉唑嗪对pgk1活性的影响:取对数生长期的ges
‑
1细胞,以1
×
106/孔的细胞密度铺于6cm2细胞培养皿,待细胞贴壁后,设立空白组、空白+tz(10nmol/l)组、乙醇模型组(0.5mmol/l)、和乙醇+tz(10nmol/l),加特拉唑嗪药物干预24h后,换成含0.5mmol/l乙醇的培养基刺激24h后,冰上裂解蛋白进行sds
‑
page蛋白质印迹分析。
[0106]
2.体内动物模型
[0107]
km小鼠酒精性胃溃疡模型的制备:40只km雄性小鼠(20
‑
25g),饲养于甘肃中医药大学实验动物房,小鼠适应性饲养一周后,随机分为4组,每组10只小鼠,分组情况及给药量如表2所示;
[0108]
表2 km雄性小鼠实验分组及各组的给药剂量
[0109]
组别给药剂量空白对照组0.3ml/只灌胃生理盐水乙醇模型组0.3ml/只灌胃无水乙醇西咪替丁阳性组80mg/kg/day西咪替丁灌胃给药,2h后0.3ml/只灌胃无水乙醇tz给药组1mg/kg/day tz灌胃给药,2h后0.3ml/只灌胃无水乙醇
[0110]
上述各组小鼠刺激2h后结束实验,分离血清和胃组织测定各项指标。
[0111]
溃疡面积、溃疡指数与抑制率:将胃取出,沿胃大弯剪开,冲洗干净内容物,观察胃粘膜溃疡情况,用直尺测量溃疡的横径与纵径,两者乘积为溃疡面积(mm2),如公式1所示;然后计算整个胃组织的溃疡面积,从而计算溃疡抑制率(%),见公式2。同时以各组鼠溃疡点数之和的均值作为溃疡指数(愈合记0分、表浅性黏膜糜烂记1分、深陷性溃疡或透壁性坏死记2分、穿孔或穿透性溃疡记3分)
[0112]
溃疡面积(mm2)=溃疡最大长径*垂直于最大长径的最大宽径
ꢀꢀꢀ
(1)
[0113][0114]
3.实验结果
[0115]
特拉唑嗪细胞活性分析用mtt法进行测定,实验结果如图7所示,与空白组相比,空白+tz(100nm)组和空白+tz(10nm)组无明显差异,表明特拉唑嗪在10nmol/l和100nmol/l的浓度下对ges
‑
1细胞既无毒性作用,也不会促进细胞增殖;与空白组相比,ethanol组细胞存活率显著降低(p<0.001),表明乙醇致细胞死亡模型建立成功;与ethanol组相比,ethanol+tz(100nm)组和ethanol+tz(10nm)能显著的提高细胞存活率,表明特拉唑能够抑制乙醇引起的细胞死亡(p<0.001)。
[0116]
特拉唑嗪对pgk1活性的影响如图8所示,特拉唑嗪能够显著上调pgk1蛋白的表达水平(p<0.05),表明特拉唑嗪能够激活pgk1。
[0117]
特拉唑嗪对胃溃疡小鼠胃组织形态、溃疡指数、溃疡面积及溃疡抑制率实验结果如图9所示。正常组小鼠胃组织宏观形态正常,未出现明显出血性病变,而乙醇模型组小鼠胃组织出血性病变明显,溃疡最为严重,表明乙醇胃溃疡模型制备成功;与乙醇模型组相比,特拉唑嗪和西咪替丁各给药组均能显著的改善胃粘膜的损伤程度,减少溃疡面积,且特拉唑嗪的溃疡抑制率(81.57%)高于临床用药西咪替丁(cim)的溃疡抑制率(69.91%)。
[0118]
以上所述溃疡指数、溃疡面积、溃疡抑制率和wb结果测定表明,激活表达pgk1蛋白的特拉唑嗪对酒精性胃溃疡具有预防作用,无明显的毒副作用,即pgk1蛋白具有预防和/或治疗胃溃疡的作用;且pgk1基因可作为筛选预防和/或治疗胃溃疡的新靶标。
[0119]
实施例5特拉唑嗪对结肠炎小鼠的治疗效果
[0120]
实验材料及来源:caco
‑
2细胞购自武汉普诺赛生命科技有限公司;rmpi 1640培养基、胰酶、双抗、胎牛血清均购自bi生物科技有限公司;pgk1抗体购自武汉博士德公司;特拉
唑嗪(terazosin,tz,hplc≥98%),购自阿拉丁生物科技有限公司;柳氮磺吡啶(salazosulfapyridine,sasp)肠溶片购自上海信谊天平药业有限公司;葡聚糖硫酸钠(dextran sulfate sodium,dss),mw:40000,购自阿拉丁生物科技有限公司。
[0121]
实验动物:8周龄spf级昆明(kunming,km)雄性小鼠体重为18~22g,实验前未使用任何药物,购自中国农业科学院兰州兽医研究所。实验动物于温度为24~26℃,12h/12h的白昼规律交替的环境中适应饲养一周,给予动物饮食并自由饮用蒸馏水,然后分组进行实验。
[0122]
1.体外细胞模型
[0123]
特拉唑嗪细胞毒分析:取对数生长期的caco
‑
2细胞,以1
×
104/孔的细胞密度种植于96孔板,待细胞贴壁后,设立空白组、空白+tz(1μmol/l)组、空白+tz(100nmol/l)组和空白+tz(10nmol/l),不同浓度的特拉唑嗪作用于细胞24h后,用mtt法检测细胞毒。
[0124]
特拉唑嗪细胞活力分析:取对数生长期的caco
‑
2细胞,以1
×
104/孔的细胞密度种植于96孔板,待细胞贴壁后,设立空白组、h2o2(500μmol/l)组、h2o2+tz(1μmol/l)h2o2+tz(100nmol/l)组和空白+tz(10nmol/l),不同浓度的特拉唑嗪作用于细胞24h后,,用含500μmol/l h2o2的培养基刺激细胞24h后,用mtt法检测细胞活力。
[0125]
特拉唑嗪对pgk1活性的影响:取对数生长期的caco
‑
细胞,以1
×
106/孔的细胞密度铺于6cm2细胞培养皿,待细胞贴壁后,设立空白组、空白+tz(10nmol/l)组、h2o2模型组(0.5mmol/l)、和h2o2+tz(10nmol/l),加特拉唑嗪药物干预24h后,换成含500μmol/l h2o2的培养基刺激24h后,冰上裂解蛋白进行sds
‑
page蛋白质印迹分析。
[0126]
2.体内动物模型
[0127]
取km雄性小鼠30只,随机分为5组,每组6只,组别及给药如表3所示。
[0128]
表3 km雄性小鼠实验分组及各组的给药剂量
[0129]
组别给药剂量空白对照组(control)蒸馏水自由饮用空白对照组+tz组蒸馏水自由饮用+4mg/kg/day tzdss模型对照组4%m/v dss自由饮用阳性对照组(dss+sasp)4%m/v dss自由饮用+80mg/kg/day saspdss+tz组4%m/v dss自由饮用+4mg/kg/day tz
[0130]
配制4%的dss蒸馏水溶液,dss模型对照组小鼠自由饮用dss水溶液造模、dss+tz组小鼠自由饮用dss水溶液造模同时给予4mg/kg/day的特拉唑嗪;dss+sasp组小鼠自由饮用dss水溶液造模同时给予80mg/kg/day的sasp;空白对照组小鼠自由饮用蒸馏水,空白对照组+tz组小鼠自由饮用蒸馏水的同时给予4mg/kg/day的特拉唑嗪,所有小鼠保持常规饲料喂养,连续造模7天。第七天末次给药2h后,分离血清及结肠组织备用。
[0131]
溃疡性结肠炎临床指标检测:
[0132]
体重降低情况:按每只鼠降低体重的百分比(%)计算,无体重减轻为0分,体重减轻1%
‑
5%记为1分,体重减轻6%
‑
10%为2分,体重减轻11%
‑
15%记为3分,体重减轻大于15%为4分。
[0133]
大便粘稠度:正常大便评分记为0分,松散便记为2分、腹泻记为4分。
[0134]
便血及隐血情况:正常大便评分记为0分,隐血出血记为1分(按隐血检测结果进行
判断),肉眼可见血便为3分。
[0135]
体重降低情况、大便粘稠度以及便血及隐血情况三项的均值即为dai。以上三项均值即为dai。
[0136]
结肠长度的测量:处死小鼠后分离小鼠结肠,从回肠和结肠结合处剪断回肠,再在结肠近肛门处剪断,分离结肠外的筋膜,使结肠完全伸展开,用直尺测量小鼠结肠自回结肠处至肛门的长度,并拍照记录。
[0137]
3.实验结果
[0138]
mtt测定特拉唑嗪的细胞毒实验结果如图10中a所示。与空白组相比,空白+tz(1μm)组、空白+tz(100nm)组和空白+tz(10nm)组无明显差异,表明特拉唑嗪在1μmol/l、100nmol/l和10nmol/l的浓度下对caco
‑
2细胞既无毒性作用,也不会促进细胞增殖;
[0139]
特拉唑嗪的细胞活力分析结果如图10中b所示,与空白组相比,h2o2组细胞存活率显著降低(p<0.01),表明h2o2致细胞死亡模型建立成功;与h2o2模型组相比,h2o2+tz(1μmol/l)、h2o2+tz(100nmol/l)组和空白+tz(10nmol/l)组均能显著的提高细胞存活率,表明特拉唑能够抑制h2o2氧化压力引起的细胞死亡(p<0.05)。
[0140]
特拉唑嗪对pgk1活性的影响如图11所示,特拉唑嗪能够显著上调pgk1蛋白的表达水平(p<0.05),表明特拉唑嗪能够激活pgk1。
[0141]
特拉唑嗪对结肠炎小鼠体重和疾病活动指数的影响如图12所示。与空白对照组相比,空白对照+tz给药组在体重指标和dai评分指标中均显示无统计学差异,表明特拉唑嗪对正常小鼠无毒副作用;与空白对照组相比,dss模型组体重大幅度降低,dai评分呈显著的上升趋势(p<0.001),表明dss模型是制备成功的;与dss模型对照组相比,各给药组均能显著的改善体重减低和dai评分(p<0.05和p<0.01),且特拉唑嗪的疗效强于临床用药柳氮磺吡啶的疗效。
[0142]
特拉唑嗪对结肠炎小鼠结肠形态及结肠长度的影响如图13所示。与空白对照组相比,空白对照+tz给药组小鼠结肠长度无明显的变化,表明喹唑啉衍生物特拉唑嗪对正常小鼠无毒副作用;与空白对照组相比,dss模型组结肠长度显著的缩短(p<0.001),表明dss模型是制备成功的;与dss模型对照组相比,各给药组均能显著的改善结肠水肿及缩短情况,并具有显著性差异(p<0.05),且喹唑啉衍生物特拉唑嗪的疗效强于临床用药柳氮磺吡啶的疗效。
[0143]
以上所述体重差异、dai评分、结肠形态及结肠长度测定和wb结果测定表明,激活表达pgk1蛋白的特拉唑嗪对溃疡性结肠炎具有治疗作用,无明显的毒副作用,即pgk1蛋白具有预防和/或治疗结肠炎的作用;且pgk1基因可作为筛选预防和/或治疗结肠炎的新靶标。
[0144]
综合实施例4和实施例5结果可知,促进pgk1蛋白表达的药物能够显著抑制胃溃疡及溃疡结肠炎,可用于胃肠道疾病的治疗。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1