一种小球藻提取物的制备方法及其应用
1.本发明属于生物技术领域,具体涉及一种小球藻提取物的制备方法及其应用。
背景技术:
2.小球藻(chlorella sp.)属于绿藻属、绿球菌属、卵囊科、小球藻属,是一种常见的单细胞海藻。小球藻能适应不同的生长环境,人工培养也很容易,它不仅能利用光能自养,还可以异养培养。小球藻富含多种有用成分,在不同的环境中生长,其代谢途径也会有所变化,因此积累的产物也不一样。小球藻由于其广泛的生态分布,易于培养和快速生长,是单细胞蛋白的良好来源。是生物技术研究的好材料,营养丰富。小球藻具有重要的经济价值和巨大的应用开发潜力。
3.海藻活性物质的提取工艺主要包括物理提取工艺、化学提取工艺和生物提取工艺三种。目前最常用的是超声波破碎提取法,利用超声波的空化、粉碎、搅拌等操作下破坏植物细胞,使有机溶剂渗透到其中,以便植物中有效成分溶于有机溶剂,另一方面将大分子活性物质降解成可溶且容易吸收的有效小分子物质,然后通过分离和提纯获得所需成分。
4.在提取的过程中需要对小球藻进行科学培养,然而现有的小球藻培养条件不适宜,导致提取的纯度不高,且提取手段繁琐,提取麻烦。
技术实现要素:
5.本发明的目的在于提供一种小球藻提取物的制备方法及其应用,以解决上述背景技术中提出的问题。
6.为实现上述目的,本发明提供如下技术方案:一种小球藻提取物的制备方法,按照先后顺序包括以下步骤:
7.s1:小球藻的培养:无菌条件下,将小球藻接种bg11培养基进行活化培养,培养48
‑
72h;
8.s2:将上述培养的小球藻按照1:5比例接种到无磷bg11培养基进行活化培养,培养至od650nm=0.6,藻液进行不断扩培转接至15l;
9.s3:将上述藻液放入到透析袋中,将透析袋里的藻液进行离心合并上层清液,然后使用等体积ea萃取,旋转蒸发仪蒸发浓缩ea提取液,直到变干,称得提取物的质量,最后用10ml甲醇溶出,
‑
4℃保存待用,得到小球藻提取物溶液。
10.优选的是,在步骤s1中,培养的具体步骤为将小球藻10ml母种按照1:5比例接种bg11培养基进行活化培养,培养至od650nm=0.6,藻液进行不断扩培转接至15l。
11.上述任一方案中优选的是,在步骤s1、s2中,培养条件均为温度25℃,光照2000lux,时间设置12hr昼/12hr夜,每日摇动三角锥形瓶2次。
12.上述任一方案中优选的是,在步骤s2中,所述无磷bg11培养基为不加入磷源的bg11培养基。
13.上述任一方案中优选的是,在步骤s3中,使用ea萃取的次数为3
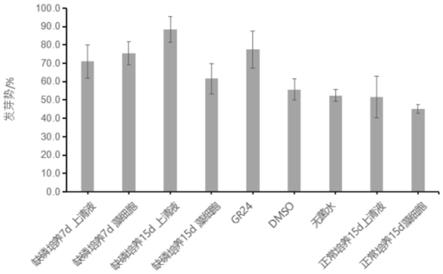
‑
5次,收集每次ea
萃取液,合并所有的ea萃取液。
14.上述任一方案中优选的是,在步骤s4中,所述小球藻提取物配置的浓度分别为10
‑5g/l、10
‑7g/l、10
‑
11
g/l和10
‑
15
g/l。
15.一种小球藻提取物用于促进种子萌发的应用。
16.本发明的技术效果和优点:该小球藻提取物的制备方法在提取前对小球藻进行培养,且采用简单的提取步骤,提取方便,且提取物能够对种子萌发有很好的的促进作用,提高种子的发芽率、发芽势、发芽指数,提前结束发芽周期,促进种子萌发过程中胚根的伸长,全面改善种子萌发情况。
附图说明
17.图1为浓度为10
‑7g/l不同的小球藻提取物对拟南芥种子发芽势的影响;
18.图2为浓度为10
‑
11
g/l不同的小球藻提取物对拟南芥种子发芽势的影响;
19.图3为浓度为10
‑
15
g/l不同的小球藻提取物对拟南芥种子发芽势的影响;
20.图4为浓度为10
‑7g/l不同的小球藻提取物对狗尾草种子发芽势的影响;
21.图5为浓度为10
‑
11
g/l不同的小球藻提取物对狗尾草种子发芽势的影响;
22.图6为浓度为10
‑
15
g/l不同的小球藻提取物对狗尾草种子发芽势的影响。
具体实施方式
23.下面结合附图对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
24.实施例1:
25.一种小球藻提取物的制备方法,按照先后顺序包括以下步骤:
26.s1:小球藻的培养:无菌条件下,将小球藻接种bg11培养基进行活化培养,培养48
‑
72h;
27.s2:将上述培养的小球藻按照1:5比例接种到无磷bg11培养基进行活化培养,培养至od650nm=0.6,藻液进行不断扩培转接至15l;
28.s3:将上述藻液放入到透析袋中,将透析袋里的藻液进行离心合并上层清液,然后使用等体积ea萃取,旋转蒸发仪蒸发浓缩ea提取液,直到变干,称得提取物的质量,最后用10ml甲醇溶出,
‑
4℃保存待用,得到小球藻提取物溶液。
29.具体的,在步骤s1中,培养的具体步骤为将小球藻10ml母种按照1:5比例接种bg11培养基进行活化培养,培养至od650nm=0.6,藻液进行不断扩培转接至15l。
30.具体的,在步骤s1、s2中,培养条件均为温度25℃,光照2000lux,时间设置12hr昼/12hr夜,每日摇动三角锥形瓶2次。
31.具体的,在步骤s2中,所述无磷bg11培养基为不加入磷源的bg11培养基。
32.具体的,在步骤s3中,使用ea萃取的次数为3
‑
5次,收集每次ea萃取液,合并所有的ea萃取液。
33.具体的,在步骤s4中,所述小球藻提取物配置的浓度分别为10
‑5g/l、10
‑7g/l、10
‑
11
g/l和10
‑
15
g/l。
34.在第7天、15天分别取出缺磷培养的小球藻,将透析袋里的藻液进行离心合并上层清液,藻细胞沉淀用超声破碎细胞方便胞内物质溶出,将上清液和藻细胞分别使用等体积ea萃取3次,合并各自的ea萃取液,旋转蒸发仪蒸发浓缩ea提取液,直到变干,称得提取物的质量,最后用10ml甲醇溶出,
‑
4℃保存待用;如此得到不同的缺磷下的小球藻提取物溶液,备用。
35.实施例2:拟南芥种子萌发实验
36.1、样品溶液的配置
37.提取物溶液配置:
38.称取缺磷培养7天上清液提取物1.1mg(按照5
‑
deoxystrigol的分子量330.37,含量为30%进行的估算)用无菌水定容到100ml容量瓶中(相当于10
‑5g/l),再吸取1ml,定容到100ml,相当于10
‑7g/l,此时取出1ml继续配置10
‑
11
g/l的溶液,将剩余的10
‑7g/l提取物溶液用无菌过滤器进行过滤后置于容器备用(编号21
‑
1)。
39.将1ml10
‑7g/l溶液继续稀释定容(方法同10
‑7g/l,需定容2次),得到10
‑
11
g/l溶液,此时取出1ml继续配置10
‑
15
g/l的溶液,将剩余的10
‑
11
g/l提取物溶液用无菌过滤器进行过滤后置于容器备用(编号21
‑
2)。
40.将1ml10
‑
11
g/l溶液继续稀释定容(方法同10
‑7g/l,需定容2次),得到10
‑
15
g/l溶液,将10
‑
15
g/l提取物溶液用无菌过滤器进行过滤后置于容器备用(编号21
‑
3)。
41.其余提取物溶液配置方法与缺磷培养7天的上清液提取物一致。
42.对照组溶液配置:
43.gr24溶液配制:称取提取物0.298mg(分子量298.25)用无菌水定容到100ml容量瓶中(相当于10
‑5g/l),同样配置3种浓度(10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l),方法同上。
44.dmso溶液配制:称取提取物0.078g(分子量78.13)用无菌水定容到100ml容量瓶中(相当于10
‑3g/l),同样配置3种浓度(10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l),方法同上。
45.2、仪器灭菌
46.所用液体和器具灭菌:
47.无菌水的制备:取纯净水适量,放入三角瓶中,棉塞,报纸包装,然后放入灭菌锅中灭菌,烘干后放凉,操作台中使用。
48.无菌培养皿与滤纸的制备:取滤纸放入培养皿中(每个皿2张滤纸),然后将培养皿报纸包装,灭菌锅中灭菌,烘干后放凉,操作台中使用。
49.针头式过滤器:将针头式过滤器放入灭菌锅中灭菌,烘干后放凉,操作台中使用。
50.3、超净台的使用准备
51.使用前20min用75%酒精擦拭工作台面,将实验所需的物品放于台面中间工作区的两侧,使用的移液器吸头、试管、培养皿等需事先灭菌,开启紫外灯对工作区域进行照射灭菌。操作时将照明灯打开,关掉紫外杀菌灯,先用75%酒精擦洗双手,点燃酒精灯,打开的瓶口过火焰,镊子、接种环使用前应经过火焰烧灼。
52.4、种子灭菌
53.1.取一定量拟南芥种子,倒入1.5ml离心管中,加入无菌水,充分涡旋震荡1min,高速顺势离心1min,将上清液以及漂浮的种子去掉。(无菌环境中操作)
54.2.向1.5ml离心管中加入70%的乙醇(用70%乙醇消毒时,时间不宜过长,因为拟
南芥种子的种皮薄,乙醇极易渗入,杀伤种子。所以先加300ul无菌水,再加入700ul无菌的无水乙醇)(无菌环境中操作),涡旋震荡1min,高速顺势离心15s,用移液枪小心的移除上清(无菌环境中操作)。
55.3.加入无菌水洗涤(无菌环境中操作),涡旋震荡15s,高速顺势离心15s,无菌环境下用移液枪小心的移除上清。此过程重复三次。
56.4.向离心管中加入1%(v/v)次氯酸钠溶液(无菌环境中操作,现配现用),在涡旋仪上,涡旋15min,在无菌的环境中去除上清。
57.5.加入无菌水洗涤(无菌环境中操作),涡旋震荡15s,高速顺势离心15s,在无菌的环境中用移液枪小心的移除上清。此过程重复三次。三次洗涤后,加入500ul无菌水,将种子倾倒在无菌滤纸上。
58.5、培养及的制备
59.称取培养基定容至250ml,倒入500ml锥形瓶,配好后,灭菌锅中灭菌(121℃,20min),放凉到40
‑
50℃左右,倒平板,厚度5mm以下,倒好,放在无菌台中铺平,要求必须铺满整个平板。等待其冷却凝固备用。
60.待培养基凝固,分别取用提取液涂布,每种提取液涂布各2个皿,涂布均匀,对照组分别用2ml无菌水、2mldmso溶液和2mlgr24溶液涂布,各2各。
61.6、种子接种及培养
62.等待种子稍干后摆放整齐,用接种环点入无菌的培养基(培养基)上,每个培养皿30粒,用保鲜膜封好培养皿,防止细菌进入。将封好的接种了拟南芥种子的培养皿放入4℃的培养箱中春化2天,将春化后的种子平板放入22℃
‑
23℃的培养室中光照培养,进行种子萌发实验。
63.7、种子萌发计数
64.种子计数时间为12h,24h,36h,48h,60h(从开始培养计时),观察萌发以胚根长出露白算萌发。直至发芽数没有明显变化结束计数。
65.8、计算发芽率和发芽势
[0066][0067][0068]
分别用10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l不同的小球藻提取液溶液处理的拟南芥种子发芽率对比分别如表1、表2、表3,
[0069]
表1:10
‑7g/l溶液处理的拟南芥种子发芽率
[0070][0071][0072]
表2:10
‑
11
g/l溶液处理的拟南芥种子发芽率
[0073][0074]
表3:10
‑7g/l溶液处理的拟南芥种子发芽率
[0075][0076]
通过上表1、2、3可以得到小球藻提取液物溶液对种子的发芽率有很大的提高。
[0077]
用浓度为10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的小球藻提取物液溶液处理的拟南芥种子发芽势分别如图1、图2、图3,小球藻提取物能提高拟南芥种子的发芽势。
[0078]
发芽率和发芽势都提高了,因此小球藻提取物能够提高种子的萌发。
[0079]
实施例3:狗尾草种子萌发实验
[0080]
1、实验前期制备
[0081]
取纯净水适量,放入1000ml三角瓶中,用棉塞、牛皮纸包装,放入灭菌锅中,在121℃下灭菌20分钟,结束后取出,冷却。
[0082]
将三片滤纸分别放入统一规格的培养皿中,然后将培养皿用牛皮纸包装,放入灭菌锅中,在121℃下灭菌20分钟,结束后取出,放入鼓风干燥箱中,把培养皿烘干。
[0083]
将小烧杯、容量瓶用牛皮纸包装,将锥形瓶用棉塞、牛皮纸包装,放入灭菌锅中,在121℃下灭菌20分钟,结束后取出,放入鼓风干燥箱中,把玻璃器皿烘干。
[0084]
每次使用超净台前,用酒精棉球擦拭台面,把与实验相关的器材放入,打开紫外灯进行杀菌,一般照射30min。紫外杀菌结束前,要先打开风机,再关紫外灯,打开照明灯,戴上乳胶手套,玻璃挡板尽量打开空隙小一点,手进入超净工作台,点燃酒精灯,
[0085]
用酒精棉球擦拭双手,等酒精蒸发结束,开始实验。
[0086]
2、小球藻提取物的稀释
[0087]
实验组提取物的稀释:称取小球藻提取物1.1mg(按照5
‑
deoxystrigol的分子量330.37,含量为30%进行的估算),用dmso进行有机溶解,用无菌水把溶解后的小球藻提取液定容到100ml容量瓶(相当于10
‑5g/l),再吸取1ml10
‑5g/l的溶液,定容到100ml,相当于10
‑7g/l的溶液,此时取出1ml10
‑7g/l的溶液继续配置10
‑
11
g/l的溶液,将剩余10
‑7g/l的提取物溶液置于容器,标记后备用。将1ml的10
‑7g/l溶液继续稀释定容(方法同10
‑7g/l的稀释方
法,需定容2次),得到10
‑
11
g/l的溶液,此时取出1ml继续配置10
‑
15
g/l的溶液,将剩余10
‑
11
g/l的提取物溶液置于容器,标记后备用。将1ml的10
‑
11
g/l溶液继续稀释定容(方法同10
‑
7g/l的稀释方法,需定容2次),得到10
‑
15
g/l的溶液,将10
‑
15
g/l的提取物溶液置于容器,标记后备用。
[0088]
小球藻提取物稀释的方法如上,配置出7天缺磷培养的上清液和藻细胞提取物、15天缺磷培养的上清液和藻细胞提取物的10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的3种浓度的溶液。
[0089]
对照组溶液的稀释:以gr24溶液为例,称取gr240.298mg(分子量298.25),用
[0090]
dmso进行有机溶解,用无菌水把溶解后的gr24溶液定容到100ml容量瓶(相当于10
‑5g/l),再吸取1ml10
‑5g/l的溶液,定容到100ml容量瓶,相当于10
‑7g/l的溶液,
[0091]
此时取出1ml继续配置10
‑
11
g/l的溶液,将剩余的10
‑7g/l的gr24溶液置于容器,标记后备用。
[0092]
接下来溶液稀释步骤与实验组提取物的稀释10
‑
11
g/l、10
‑
15
g/l的2种浓度方法一致,得到gr24溶液10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的3种浓度的溶液。
[0093]
dmso溶液配制:称取提取物0.078g(分子量78.13),用无菌水定容到100ml容8量瓶(相当于10
‑3g/l),再吸取1ml10
‑3g/l的溶液,定容到100ml容量瓶,相当于10
‑5g/l的溶液,再吸取1ml10
‑5g/l的溶液,定容到100ml容量瓶,相当于10
‑7g/l的dmso溶液置于容器,标记后备用。
[0094]
接下来溶液稀释步骤与实验组提取物的稀释10
‑
11
g/l、10
‑
15
g/l的2种浓度方法一致,得到dmso溶液10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的3种浓度的溶液。
[0095]
15天正常培养的上清液和藻细胞提取物的溶液稀释实验步骤与实验组提取物10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的3种浓度方法一致,得到15天正常培养的上清液提取物和藻细胞提取物的10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的3种浓度的溶液。
[0096]
3、溶液的灭菌
[0097]
稀释结束后,打开其中一瓶溶液,吸取需要过滤的溶液10ml,实验中使用的是5ml的注射器,再换上无菌过滤器,把它打到已灭菌的小烧杯中,进行过滤,上述步骤共重复三次,为了确保溶液是无菌溶液,最后注入已灭菌的15ml的离心管中,做上标记。
[0098]
其他需要灭菌的溶液按上述步骤进行过滤灭菌。
[0099]
4、狗尾草种子的处理
[0100]
取合适的狗尾草种子,倒入5ml离心管中,加入无菌水(无菌环境中操作),充分涡旋震荡1min,高速顺势离心1min,将上清以及漂浮的种子去掉(无菌环境中操作),把不饱满的种子先剔除,留下饱满的种子来进行萌发实验。
[0101]
向离心管中加入70%的乙醇(无菌环境中操作,先加300ul无菌水,再加入700ul无菌的无水乙醇),涡旋震荡1min,高速顺势离心15s,用移液枪小心地移除上清(无菌环境中操作)。此过程重复一次。
[0102]
加入无菌水洗涤(无菌环境中操作),涡旋震荡15s,高速顺势离心15s,用移液枪
[0103]
小心地移除上清(无菌环境中操作)。此过程重复两次。
[0104]
向离心管中加入1%(v/v)次氯酸钠溶液(无菌环境中操作,现配现用,先加入990ul无菌水,再加入10ul无菌的次氯酸钠溶液),在涡旋仪上,涡旋10min,去除上清(无菌环境中操作)。
[0105]
加入无菌水洗涤(无菌环境中操作),涡旋震荡15s,高速顺势离心15s,用移液枪小心的移除上清(无菌环境中操作)。此过程重复三次。
[0106]
经过无菌水洗涤后,再加入500ul无菌水到离心管中,将狗尾草种子倾倒在无菌滤纸上,待水稍干后摆放整齐,将三层无菌滤纸放入无菌培养皿中。
[0107]
5、狗尾草种子的接种
[0108]
先使用3ml不同浓度的溶液(实验组分别是7天缺磷培养的上清液和藻细胞提取物、15天缺磷培养的上清液\和藻细胞提取物4种类型溶液,每组做2个;对照组分别是无菌水、dmso溶液和gr24溶液、15天正常培养的上清液和藻细胞提取物5种类型溶液)浸润滤纸,然后将30颗经过表面消毒的种子均匀铺在滤纸上,盖上培养皿盖,用保鲜膜进行包装,防止水分蒸发太快,影响种子萌发。
[0109]
接种结束后,将统一规格的培养皿放入22℃恒温培养箱中催芽,萌发期间及时补充无菌水,以保证种子萌发所需水,但不能超过3ml。
[0110]
6、狗尾草种子的观察记录
[0111]
接种结束后,每天定时观察狗尾草种子萌发情况,统计每个培养皿中正常发芽的种子粒数,记录种子发芽数,以露白为2mm作为标准判断种子是否萌发的标准。
[0112]
7、计算发芽率和发芽势
[0113][0114][0115]
分别用10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l不同的小球藻提取液溶液处理的拟南芥种子发芽率对比分别如表4、表5、表6,
[0116]
表4:浓度为10
‑7g/l的小球藻提取物对狗尾草种子发芽率的影响
[0117][0118]
表5:浓度为10
‑
11
g/l的小球藻提取物对狗尾草种子发芽率的影响
[0119][0120]
表6:浓度为10
‑
15
g/l的小球藻提取物对狗尾草种子发芽率的影响
[0121][0122]
通过上表4、5、6可以得到小球藻提取液物溶液对种子的发芽率有很大的提高。
[0123]
用浓度为10
‑7g/l、10
‑
11
g/l、10
‑
15
g/l的小球藻提取物液溶液处理的狗尾草种子发芽势分别如图4、图5、图6,小球藻提取物能提高狗尾草种子的发芽势。
[0124]
发芽率和发芽势都提高了,因此小球藻提取物能够提高种子的萌发。
[0125]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1