一种基于烷基化多肽的核酸递送系统及制备方法与应用
1.本发明属于生物医药领域,具体涉及一种以烷基化多肽为载体的核酸递送系统及制备方法与应用。
背景技术:
2.近年来,随着对疾病基因相关机制的不断深入研究,以寡核苷酸、质粒dna、sirna或者mrna等为代表的核酸类药物目前已被证明能够用于多种疾病的治疗,引发了全球的广泛关注,其中一些核酸类药物已获得批准上市,用于临床治疗。然而,核酸在体液和细胞内运输所面临的一系列障碍,如容易在血液中快速降解、肝肾清除速度快、细胞摄取效率低以及难以从细胞内涵体逃逸等问题,极大阻碍了核酸类药物的临床应用。
3.目前,大多数临床研究及上市的核酸类药物所使用的基因传递系统都是病毒类载体。尽管病毒载体在基因治疗领域取得了一定进展,但仍存在许多局限性,包括致癌性、免疫原性、广泛的趋向性、有限的载药量(loading capacity)和大规模生产较困难等问题。研究表明,非病毒载体也能传递相对分子质量更大的遗传物质,如聚合物类(polymer)、脂质类(liposome或lnp)以及肽类小分子等,且通常比病毒载体更易合成,便于大规模生产;基于日益先进和成熟的生物纳米技术,其还可被设计用于执行某些特定功能,如实现靶向、成像示踪、与光热疗联合应用等。然而,相对于病毒载体而言,非病毒载体的转染效率较低,最终表达蛋白的效果不佳;另外,聚合物类和脂质类载体合成步骤复杂、价格昂贵、生物相容性较差。迄今为止仅有少量基于非病毒载体的核酸类药物能获批用于临床,其中包括patisiran、fomivirsen、inotersen等。
4.作为一种重要的生物小分子,多肽在基因递送应用方面具有许多独特的优势:成熟的固相合成方法能提供结构明确、分布单一的高纯度多肽分子;可以由20种性质各异的氨基酸组成性质丰富的一级序列;可获得β
‑
折叠、α
‑
螺旋等具有重要生物学活性的二级结构;易于改性或与其他具有组织靶向功能的序列或分子偶联。另外,多肽可以通过非共价相互作用(包括疏水相互作用、静电相互作用、分子间氢键、π
‑
π堆积相互作用等)按照一定次序组装成稳定的纳米结构。通过合理调控多肽分子结构以及给予合适的外界刺激,多肽可通过多重非共价键作用自发地组装形成具有特定形态和功能的组装体。目前已报道的多肽递送载体大体可分为两类:一类是模拟、改造穿膜肽(cell penetrating peptide)序列的多肽,透膜效果好;另一类是将靶向性多肽、穿膜肽与其他载体混合使用。作为生物同源的新一代生物材料,多肽具有优越的生物、化学活性,在药物/基因控制释放、细胞培养、组织工程支架材料以及生物矿化等领域有着巨大的应用前景。其中,两亲性多肽分子具有类似天然磷脂分子的特性,有着更为丰富的分子结构设计、且能够组装形成具有特殊生物学功能的组装体结构。因此,可以通过合理设计多肽的氨基酸序列,与核酸分子通过静电相互作用形成稳定的纳米复合物或纳米颗粒,能够实现对核酸类药物的递送及其在细胞内的稳定释放,提升核酸药物的活性。
5.目前,尚未有采用以seq id no.1所示的阳离子多肽片段和疏水片段组成烷基化
多肽用于核酸药物高效转染到多种癌细胞或免疫细胞中的报道。
技术实现要素:
6.本发明的目的是克服现有技术的不足,提供一种烷基化多肽。
7.本发明的第二个目的是提供一种稳定性好、生物毒性低、安全有效的基于烷基化多肽的核酸递送系统。
8.本发明的第三个目的是提供一种基于烷基化多肽的核酸递送系统的制备方法。
9.本发明的第四个目的是提供一种基于烷基化多肽的核酸递送系统在制备抗癌药物中的应用。
10.本发明的技术方案概述如下:
11.一种烷基化多肽,所述烷基化多肽包括阳离子多肽片段和疏水片段,所述阳离子多肽片段具有α
‑
螺旋二级结构;所述疏水片段为棕榈酸、月桂酸、肉豆蔻酸和硬脂酸中任一个的脂质部分;所述阳离子多肽片段的氨基酸序列由seq id no.1所示;所述阳离子多肽片段的n
‑
端和疏水片段连接。
12.一种基于烷基化多肽的核酸递送系统的制备方法,包括如下步骤:将上述一种烷基化多肽,溶于无核酸酶水(depc水)中得到浓度为0.1
‑
1.0mg/ml烷基化多肽溶液,加入到核酸溶液中,在室温下通过静电复合组装,得到基于烷基化多肽的核酸递送系统。
13.核酸优选为寡核苷酸、质粒dna、sirna或mrna。
14.烷基化多肽溶液中的质子化氮与核酸溶液中的磷酸基团的摩尔比(n/p)大于等于10;
15.组装的时间至少30分钟。
16.上述方法制备的一种基于烷基化多肽的核酸递送系统。
17.上述一种基于烷基化多肽的核酸递送系统在制备抗癌药物中的应用。
18.本发明的优点:
19.本发明提供的烷基化多肽能够以不同的n/p比例,通过简单混合的方式与核酸分子(mrna、质粒dna、sirna或寡聚核苷酸等)形成大小合适、结构稳定的球状结构的基于烷基化多肽的核酸递送系统,可以实现核酸分子的跨膜递送。
20.本发明的烷基化多肽,与现有市场上的脂质体以及聚合物转染试剂相比,简化了包裹核酸药物的制备过程;并具有毒性较低、生物相容性好,并且成本低廉等优点。
附图说明
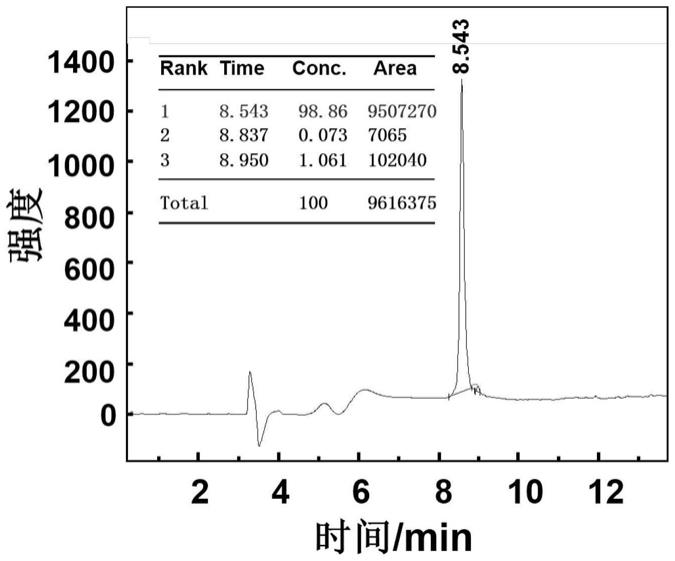
21.图1为实施例1中制备的一种烷基化多肽的液相色谱图。
22.图2为实施例1中制备的一种烷基化多肽的质谱图。
23.图3为实施例1中制备的一种烷基化多肽的圆二色光谱图。
24.图4为实施例2制备的一种基于烷基化多肽的核酸递送系统1的粒径分布图。
25.图5为实施例2制备的一种基于烷基化多肽的核酸递送系统1的透射电子显微镜(tem)图。
26.图6为实施例2制备的一种基于烷基化多肽的核酸递送系统1的核酸凝胶电泳图。
27.图7为实施例2制备的一种基于烷基化多肽的核酸递送系统1在hek 293t和dc2.4
细胞中转染后的倒置荧光显微镜明场图和egfp荧光场图。
28.图8为实施例2制备的一种基于烷基化多肽的核酸递送系统1在hek 293t和dc2.4细胞中转染后的流式细胞图。
29.图9为实施例1制备的一种烷基化多肽的细胞毒性分析图。
30.图10为实施例3制备的一种基于烷基化多肽的核酸递送系统2在hela细胞中转染的倒置荧光显微镜明场图和egfp荧光场图。
31.图11为实施例4制备的一种基于烷基化多肽的核酸递送系统3在hela细胞中转染的倒置荧光显微镜的明场图、egfp荧光场图和二者合并图。
具体实施方式
32.下面通过具体实施例对本发明作进一步的说明。但本发明所保护范围不限于此。对本发明内容所做的等同替换,或相应的改进,仍属于本发明的保护范围之内。
33.实施例1
34.一种烷基化多肽,烷基化多肽包括阳离子多肽片段和疏水片段,阳离子多肽片段具有α
‑
螺旋二级结构(图3),并且对ph敏感;疏水片段为棕榈酸的脂质部分;阳离子多肽片段的氨基酸序列由seq id no.1所示;所述阳离子多肽片段的n
‑
端和疏水片段连接。
35.本实施例烷基化多肽的分子式:
36.c
16
‑
trp
‑
glu
‑
ala
‑
arg
‑
leu
‑
ala
‑
arg
‑
ala
‑
leu
‑
ala
‑
arg
‑
his
‑
leu
‑
ala
‑
arg
‑
ala
‑
leu
‑
arg
‑
ala
‑
cys
‑
glu
‑
ala,(其中的阳离子多肽片段的氨基酸序列由seq id no.1所示,人工合成)。
37.seq id no.1是委托吉尔生化(上海)有限公司生产制备。
38.分别使用美国agilent公司的1200型液相色谱仪和美国布鲁克道尔顿公司的miorotof
‑
qii型液相色谱
‑
高分辨四极杆飞行时间串联质谱联用仪测试烷基化多肽的纯度,图1中显示烷基化多肽纯度为98.86%,图2中显示相对分子质量与理论相对分子质量吻合,表明所合成的烷基化多肽满足实验要求。使用jasco公司的jasco
‑
810型圆二色谱仪测定烷基化多肽的圆二色谱,样品池光程0.1mm,波长范围185
‑
350nm,扫描速度100nm/min,带宽1nm,测试温度25℃。图3中189nm处的正峰以及208nm处的负峰,表明烷基化多肽呈现α
‑
螺旋的结构。
39.采用cck8法分析实施例1制备的烷基化多肽的细胞毒性,结果表明该多肽具有良好的生物相容性,见图9。
40.实施例2
41.一种基于烷基化多肽的核酸递送系统1的制备方法,包括如下步骤:将实施例1制备的一种烷基化多肽0.5mg,溶于1ml无核酸酶水(depc水)中,用枪头吹吸使其分散均匀,得到浓度为0.5mg/ml烷基化多肽溶液;
42.加入到1μg/μl核酸溶液1中,使配制烷基化多肽溶液中的质子化氮与核酸溶液1中的磷酸基团的摩尔比(n/p)等于15。在室温下通过静电复合组装30min,得到基于烷基化多肽的核酸递送系统1。
43.核酸溶液1:720个碱基的单链egfp mrna(seq id no.2,增强型绿色荧光蛋白信使rna),购自美国trilink biotechnologies公司;egfp mrna购买时为1μg/μl溶液,人工合
成。
44.基于烷基化多肽的核酸递送系统1的表征:
45.利用马尔文纳米粒度仪(malvern zetasizer nano zs)对基于烷基化多肽的核酸递送系统1的粒径进行表征。流体力学半径的测量值显示基于烷基化多肽的核酸递送系统1的粒径在106nm左右,相比单纯烷基化多肽组装体的粒径(340nm)明显减小,适合细胞摄取(图4)。
46.利用场发射透射电子显微jem
‑
2100f原位观察形成基于烷基化多肽的核酸递送系统1的形貌。使用移液枪吸取10μl组装的基于烷基化多肽的核酸递送系统1,滴在300目铜网(碳膜载网)表面,静置2min,然后用滤纸除去铜网表面粘附的基于烷基化多肽的核酸递送系统1,在25℃下自然干燥。用1%的磷钨酸水溶液(ph=6.5)负染处理后,在加速电压为80kv的透射电子显微镜下观察,从图5中可以看到基于烷基化多肽的核酸递送系统1的粒径与光散射测得的结果基本一致,直径大小在100nm左右。
47.使用核酸凝胶电泳仪探究烷基化多肽与核酸溶液1的结合能力。称取0.8g琼脂糖置于三角瓶中,加入40ml的1
×
tae缓冲液,用微波炉加热至完全溶解,配制2%的凝胶溶液。待液体冷却至50℃左右,加入5μl溴化乙锭(etbr,eb),充分混合后倒入插好梳子的模具制胶。当凝胶完全凝固后,小心取下琼脂糖凝胶并放入电泳槽中,使槽中的tae缓冲液刚好没过胶面,然后向30μl基于烷基化多肽的核酸递送系统1中加入6μl的6
×
loading buffer,混合均匀后加入到凝胶的样品孔中,并加入5μl marker作为对照。凝胶电泳仪在125v的电压运行25min,取出凝胶后在紫外光照射下对凝胶进行可视化成像,结果发现烷基化多肽在n/p≥8时可以完全包裹核酸(图6)。
48.分别用0.1
‑
1.0mg/ml中的烷基化多肽溶液,如0.1mg/ml、0.4mg/ml、0.6mg/ml、1.0mg/ml的烷基化多肽溶液替代本实施例中的0.5mg/ml的烷基化多肽溶液,其它同本实施例,分别可以得到相应的基于烷基化多肽的核酸递送系统。
49.本发明的阳离子多肽片段带正电荷,能够与带负电荷的核酸分子发生静电相互作用,形成一种基于烷基化多肽的核酸递送系统;
50.一种烷基化多肽具有α
‑
螺旋二级结构,起到稳定基于烷基化多肽的核酸递送系统结构的作用;所述疏水片段为12
‑
18个碳原子的长链脂肪酸的脂质部分,其能促进组装体与细胞膜融合,提高细胞内吞效率。
51.实施例3
52.实施例2制备的一种基于烷基化多肽的核酸递送系统1在制备抗癌药物中的应用
53.(1)hek 293t细胞培养基的配制:
54.先向50ml离心管中加入45ml dmem高糖培养基,然后加入5ml澳洲胎牛血清和500μl双抗(青霉素和链霉素),混合均匀后得到hek 293t细胞培养基;
55.(2)dc2.4细胞培养基的配制:
56.先向50ml离心管中加入45ml rpmi
‑
1640培养基,然后加入5ml澳洲胎牛血清和500μl双抗(青霉素和链霉素),混合均匀后得到dc2.4细胞培养基;
57.(3)将hek 293t细胞、dc2.4细胞置于5%co2、37℃的细胞培养箱中培养。将处于对数生长期的hek 293t细胞和dc2.4细胞分别用hek 293t细胞培养基和dc2.4细胞培养基重悬,按5
×
104个/孔的细胞密度接种到12孔板内,在5%co2、37℃的细胞培养箱中过夜,待细
胞密度约为70%
‑
80%时才能进行转染。转染前,吸去培养基,用pbs(ph=7.4)洗两次,然后每孔加入900μl的opti
‑
mem培养基。
58.(4)基于烷基化多肽的核酸递送系统1转染方法如下:将n/p=15的基于烷基化多肽的核酸递送系统1加入depc水稀释到终体积为100μl,在室温下静置30min后加入到含900μl opti
‑
mem培养基的培养孔中,轻轻摇动细胞培养板,使基于烷基化多肽的核酸递送系统1与孔中的培养基充分混合。4h后将opti
‑
mem培养基更换为对应的hek 293t细胞培养基和dc2.4细胞培养基,继续培养24h,用倒置荧光显微镜观察实验结果,并用流式细胞仪定量检测荧光强度。
59.由于倒置荧光显微镜的荧光场视野中出现大面积绿色荧光表达,说明该烷基化多肽可以保护、释放egfp mrna,并在细胞质基质中表达绿色荧光蛋白,见图7。流式细胞结果显示相较于裸露的mrna,基于烷基化多肽的核酸递送系统1转染的细胞平均荧光强度明显增强,说明烷基化多肽的递送mrna药物的潜力,见图8。
60.实施例4
61.一种烷基化多肽,烷基化多肽包括阳离子多肽片段和疏水片段,阳离子多肽片段具有α
‑
螺旋二级结构,并且对ph敏感;疏水片段为月桂酸的脂质部分;阳离子多肽片段的氨基酸序列由seq id no.1所示;所述阳离子多肽片段的n
‑
端和疏水片段连接。
62.实施例5
63.一种基于烷基化多肽的核酸递送系统2的制备方法,包括如下步骤:将实施例4制备的一种烷基化多肽0.5mg,溶于1ml无核酸酶水中,用枪头吹吸使其分散均匀,得到浓度为0.5mg/ml烷基化多肽溶液;加入到500ng/μl核酸溶液2中,使配制烷基化多肽溶液中的质子化氮与核酸溶液2中的磷酸基团的摩尔比(n/p)等于10。在室温下通过静电复合组装30min,得到基于烷基化多肽的核酸递送系统2。
64.核酸溶液2(质粒dna溶液):pegfp
‑
n1质粒(seq id no.3,绿色荧光蛋白基因质粒)购自于美国clontech公司;pegfp
‑
n1质粒购买时为500ng/μl溶液(质粒),来源于大肠埃希氏菌(escherichia coli)dh
‑
5α。
65.分别用0.1
‑
1.0mg/ml中的烷基化多肽溶液,如0.1mg/ml、0.4mg/ml、0.6mg/ml、1.0mg/ml的烷基化多肽溶液替代本实施例中的0.5mg/ml的烷基化多肽溶液,其它同本实施例,分别可以得到相应的基于烷基化多肽的核酸递送系统。
66.实施例6
67.实施例5制备的一种基于烷基化多肽的核酸递送系统2在制备抗癌药物中的应用
68.(1)hela细胞培养基的配制:先向50ml离心管中加入45ml dmem高糖培养基,然后加入5ml澳洲胎牛血清和500μl双抗(青霉素和链霉素),混合均匀后得到hela细胞培养基;
69.(2)将hela细胞置于5%co2、37℃的细胞培养箱中培养。将处于对数生长期的hela细胞用hela细胞培养基重悬,按5
×
104个/孔的细胞密度接种到12孔板内,在5%co2、37℃的细胞培养箱中过夜,待细胞密度约为70%
‑
80%时再进行转染。转染前,吸去培养基,用pbs(ph=7.4)洗两次,然后每孔加入900μl的opti
‑
mem培养基。
70.(3)基于烷基化多肽的核酸递送系统2转染方法如下:将n/p=10的基于烷基化多肽的核酸递送系统2加入depc水稀释到终体积为100μl,在室温下静置30min后加入到含900μlopti
‑
mem培养基的培养孔中,轻轻摇动细胞培养板,使基于烷基化多肽的核酸递送系统2
与孔中的培养基充分混合。4h后将opti
‑
mem培养基更换为hela细胞培养基,继续培养24h,用倒置荧光显微镜观察实验结果。
71.由于倒置荧光显微镜的荧光场视野中出现大面积绿色荧光表达,说明该烷基化多肽可以保护、释放pegfp
‑
n1质粒,并在细胞质基质中表达绿色荧光蛋白,见图10。
72.实施例7
73.一种烷基化多肽,烷基化多肽包括阳离子多肽片段和疏水片段,阳离子多肽片段具有α
‑
螺旋二级结构,并且对ph敏感;疏水片段为硬脂酸的脂质部分;阳离子多肽片段的氨基酸序列由seq id no.1所示;所述阳离子多肽片段的n
‑
端和疏水片段连接。
74.实验证明,用肉豆蔻酸中的脂质部分替代本实施例硬脂酸的脂质部分,其它同本实施例,得到相应的一种烷基化多肽。
75.实施例8
76.一种基于烷基化多肽的核酸递送系统3的制备方法,包括如下步骤:将实施例7制备的一种烷基化多肽0.5mg,溶于1ml无核酸酶水(depc水)中,用枪头吹吸使其分散均匀,得到浓度为0.5mg/ml烷基化多肽溶液;加入到1μg/μl核酸溶液3中,使配制烷基化多肽溶液中的质子化氮与核酸溶液中的磷酸基团的摩尔比(n/p)等于10。在室温下通过静电复合组装30min,得到基于烷基化多肽的核酸递送系统3。
77.核酸溶液3:fam(羧基荧光素)标记的小干扰rna(sirna,seq id no.4(人工合成)和seq id no.5(人工合成))(购自于上海吉玛制药技术有限公司),以depc水为溶剂,配成浓度为1μg/μl的溶液。具体步骤为:将1od的sirna在4000转/分钟的转速下离心1分钟,缓慢打开后加入33ul的depc水振荡溶解,得到1μg/μl溶液备用。
78.分别用0.1
‑
1.0mg/ml中的烷基化多肽溶液,如0.1mg/ml、0.4mg/ml、0.6mg/ml、1.0mg/ml的烷基化多肽溶液替代本实施例中的0.5mg/ml的烷基化多肽溶液,其它同本实施例,分别可以得到相应的基于烷基化多肽的核酸递送系统。
79.实施例9
80.实施例8制备的一种基于烷基化多肽的核酸递送系统3在制备抗癌药物中的应用
81.(1)hela细胞培养基的配制同实施例6的步骤(1);
82.(2)将hela细胞置于5%co2、37℃的细胞培养箱中培养。将处于对数生长期的hela细胞用hela细胞培养基重悬,按5
×
104个/孔的细胞密度接种到12孔板内,在5%co2、37℃的细胞培养箱中过夜,待细胞密度约为70%
‑
80%时再进行转染。转染前,吸去培养基,用pbs(ph=7.4)洗两次,然后每孔加入900μl的opti
‑
mem培养基。
83.(3)基于烷基化多肽的核酸递送系统3转染方法如下:将n/p=10的基于烷基化多肽的核酸递送系统3加入depc水稀释到终体积为100μl,在室温下静置30min后加入到含900μl opti
‑
mem培养基的培养孔中,轻轻摇动细胞培养板,使基于烷基化多肽的核酸递送系统3与孔中的培养基充分混合。4h后将opti
‑
mem培养基更换为hela细胞培养基,继续培养24h,用倒置荧光显微镜观察实验结果,见图11。
84.由于倒置荧光显微镜的荧光场视野中出现大面积羧基荧光素荧光,说明烷基化多肽可以有效将sirna递送至细胞内,见图11。
85.本发明的基于烷基化多肽的核酸递送系统不仅能够将核酸递送到hek 293t细胞(人源胚胎肾上皮细胞)、hela细胞(人宫颈癌细胞)并实现其表达,还能实现较难转染的免
疫细胞dc2.4细胞(小鼠骨髓来源树突状细胞)、raw 264.7细胞(小鼠单核巨噬细胞)的递送。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1