一种抗菌肽CCM7WC及其制备方法与应用与流程
一种抗菌肽ccm7wc及其制备方法与应用
技术领域
1.本发明涉及一种抗菌肽ccm7wc及其制备方法与应用,属于生物医学技术领域。
背景技术:
2.近年来传统抗生素的大规模滥用导致越来越严重的病原微生物耐药问题,给人类健康带来巨大的威胁。临床上应对耐药微生物感染的措施是使用对耐药微生物尚未使用过的新的或者替代性的抗生素,因此这就需要持续开发新的抗微生物药物。
3.抗菌肽是生物体基因编码的一种天然小分子多肽,是生物体免疫系统的一种重要分子,对细菌、真菌、病毒甚至原虫均具有直接的杀灭作用。抗菌肽具有分子量小、结构简单、抗菌活性强、杀菌机制独特、毒性低和不易引起耐药性等优点,因此自发现之日起就被认为是具有极大开发潜力的新一代抗生素。到目前为止,已从不同生物体中发现超过2600多种不同的抗菌肽,而且其数目还在增加。但是,有些天然抗菌肽还存在抗菌活性低、细胞毒性高、稳定性差等问题。
技术实现要素:
4.为解决上述技术问题,本发明根据绿海龟抗菌肽的氨基酸序列,利用分子改造方法设计改造体ccm7wc,该改造体具有广谱高效抗菌活性、低细胞毒性和高稳定性,此外具有分子量小、结构简单、制备方法简单等有益特点。
5.本发明的第一个目的是提供一种抗菌肽ccm7wc,所述抗菌肽ccm7wc是对氨基酸序列如seq id no.1所示的绿海龟抗菌肽cm
‑
cath2进行改造获得。
6.进一步地,所述的改造包括剪切去除氨基酸序列如seq id no.1所示的绿海龟抗菌肽cm
‑
cath2的末端14个氨基酸。
7.进一步地,所述的改造还包括将抗菌肽中第一位精氨酸、第二位精氨酸、第五位苯丙氨酸、第八位苯丙氨酸和第九位苯丙氨酸替换为色氨酸。
8.进一步地,所述的改造还包括在抗菌肽的两端分别加一个半胱氨酸。
9.进一步地,所述的抗菌肽ccm7wc的氨基酸序列如seq id no.4所示。
10.进一步地,所述的抗菌肽ccm7wc为α螺旋结构的多肽。
11.进一步地,所述的抗菌肽ccm7wc的分子量2803.37da。
12.进一步地,所述的抗菌肽ccm7wc的等电点11.57。
13.本发明的第二个目的是提供所述的抗菌肽ccm7wc的制备方法,所述方法包括采用多肽固相合成法合成抗菌肽ccm7wc的全序列,以及采用hplc反相柱层析脱盐。
14.本发明的第三个目的是提供所述的抗菌肽ccm7wc在制备抗菌药物或组合物、抑制细菌生长药物或组合物、抗炎药物或组合物、防腐剂、动物饲料添加剂或化妆品添加剂中的应用。
15.本发明的有益效果是:
16.本发明根据绿海龟抗菌肽的氨基酸序列,利用分子改造方法设计改造体ccm7wc,
该改造体具有广谱高效抗菌活性、低细胞毒性和高稳定性,此外具有分子量小、结构简单、制备方法简单等有益特点。
具体实施方式
17.下面结合具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
18.实施例1:
19.绿海龟改造体抗菌肽c
‑
cm6的化学合成
20.绿海龟抗菌肽cm
‑
cath2是基因编码的一种多肽,含有33个氨基酸残基,分子量4089.9da,等电点12.96。绿海龟抗菌肽cm
‑
cath2全序列为:arg
1 arg
2 ser
3 arg
4 phe
5 gly6arg
7 phe
8 phe
9 lys
10 lys
11 val
12 arg
13 lys
14 gln
15 leu
16 gly
17 arg
18 val
19 lys
20 arg
21 his
22 ser
23
arg
24 ile
25 thr
26 val
27 gly
28 gly
29 arg
30 met
31 arg
32 phe
33
(seq id no.1)。由于cm
‑
cath具有分子量大、免疫原性和毒性高、稳定性差的特点,因此根据其氨基酸序列,我们首先利用序列剪切的方法对其进行缩短获得片段arg
1 arg
2 ser
3 arg
4 phe
5 gly
6 arg
7 phe
8 phe
9 lys
10 lys
11
val
12 arg
13 lys
14 gln
15 leu
16 gly
17 arg
18 val
19
(seq id no.2)。为了降低其毒性,我们进一步利用trp替换其两亲性α螺旋结构疏水侧的arg1、arg2、phe5、phe8和phe9,得到改造体trp1trp
2 ser
3 arg
4 trp
5 gly
6 arg
7 trp
8 trp
9 lys
10 lys
11 val
12 arg
13 lys
14 gln
15 leu
16 gly
17 arg
18 val
19
(seq id no.3)。为了提高其稳定性,我们进一步在其序列两侧加上两个cys,使其环化,最终得到改造体抗菌肽ccm7wc,其氨基酸序列为:cys
1 trp
2 trp
3 ser
4 arg
5 trp
6 gly
7 arg8trp
9 trp
10 lys
11 lys
12 val
13 arg
14 lys
15 gln
16 leu
17 gly
18 arg
19 val
20 cys
21
(seq id no.4)(cys1和cys
21
之间形成二硫键),并利用多肽固相合成的方法对其进行了化学合成,具体制备方法如下:
[0021]ⅰ、ccm7wc的制备方法:根据上述ccm7wc的氨基酸序列,用自动多肽合成仪(433a,applied biosystems)合成其全序列,利用hplc反相柱层析脱盐。
[0022]ⅱ、分子量测定采用基质辅助激光解析电离飞行时间质谱(maldi
‑
tof)。
[0023]ⅲ、纯化的ccm7wc用高效液相色谱hplc方法鉴定其纯度,分子量测定采用基质辅助激光解析电离飞行时间质谱(maldi
‑
tof),等电聚焦电泳测定等电点,用自动氨基酸测序仪测定氨基酸序列结构。
[0024]
测定结果为:
[0025]
ccm7wc是绿海龟抗菌肽cm
‑
cath2的一种改造体。ccm7wc是一种α螺旋结构的多肽,含有21个氨基酸残基,分子量2803.37da,等电点11.57。ccm7wc全序列为:cys1trp
2 trp
3 ser
4 arg
5 trp
6 gly
7 arg
8 trp
9 trp
10 lys
11 lys
12 val
13 arg
14 lys
15 gln
16 leu
17 gly
18 arg
19
val
20 cys
21
(cys1和cys
21
之间形成二硫键)。与母本肽cm
‑
cath2相比,改造肽ccm7wc的序列缩短,分子量大大降低,免疫原性和合成成本也相应大大降低。
[0026]
实施例2:
[0027]
ccm7wc药理实验:
[0028]
1.ccm7wc抗菌活性测定:
[0029]
(1)分别挑取保存于斜面上的试验菌株均匀涂布于mh固体培养基(北京索莱宝科技有限公司)平板上,将经过灭菌的0.5cm直径的滤纸片置于培养基表面,滴加溶解于灭菌
去离子水的2mg/ml的抗菌肽c
‑
cm6样品溶液10μl,于37℃倒置培养18-20小时,观察抑菌圈形成与否。若样品具有抗菌活性,则会在滤纸片周围形成清晰透明的抑菌圈,抑菌圈越大表明样品抗菌活性越强。
[0030]
(2)抗菌肽ccm7wc最小抑菌浓度(minimum inhibitory concentration)测定(2倍稀释法):
[0031]
选择上步实验中具有抑菌圈的菌株进行mic测定实验。试验菌株接种到mh液体培养基(北京索莱宝科技有限公司)中,37℃振荡培养到对数生长期,而后用新鲜mh液体培养基将培养至对数生长期的培养液稀释到2
×
105cfu/ml待用。
[0032]
在无菌96孔板各孔中预先加入100μl mh液体培养基,然后在第一孔中加入100μl用mh液体培养基稀释到一定浓度的经0.22μm孔滤膜过滤的的抗菌肽ccm7wc样品溶液,混匀后取100μl加入第2孔,依次倍比稀释,自第9孔吸出100μl弃去,第10孔为对照孔。
[0033]
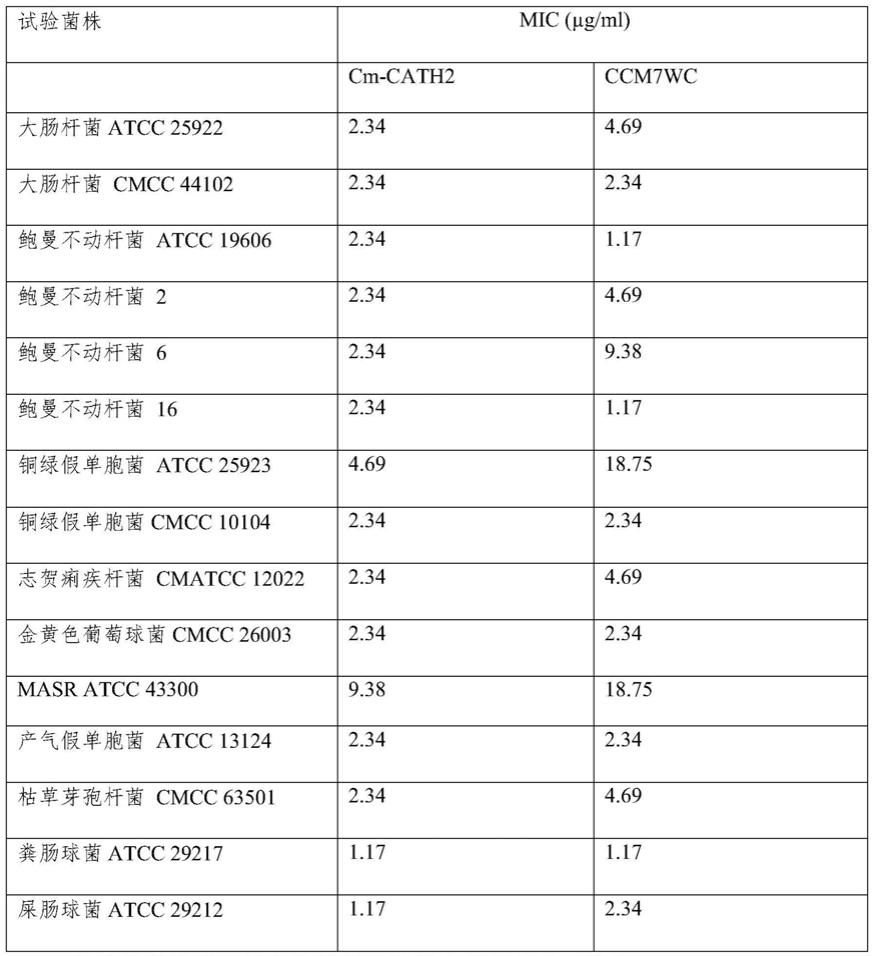
将上述各管混匀后放置37℃缓慢振荡培养18小时,于600nm波长处测定光吸收。最小抑菌浓度为看不见细菌生长的最低样品浓度。结果如表1所示。
[0034]
由表1可见,抗菌肽ccm7wc对革兰氏阳性细菌、革兰氏阴性细菌和真菌均表现出很强的抗菌活性,其中包括大量临床分离致病菌,mic值处于1.17
‑
18.75μg/ml的范围。其抗菌活性与母本肽cm
‑
cath2相当。
[0035]
表1抗菌肽ccm7wc和母本肽cm
‑
cath的抗菌活性
[0036][0037]
mic:最小抑菌浓度,以上结果为三次独立重复实验平均值。
[0038]
2.ccm7wc溶血活性测定:
[0039]
将采集的人血与阿氏液混合抗凝,生理盐水洗涤2次并重悬成107‑
108cell/ml的悬浮液。上述稀释好的红细胞悬液与溶解于生理盐水的ccm7wc样品混合,37℃保温30min,再于1000rpm离心5min,上清液于540nm测吸收值。阴性对照使用生理盐水,阳性对照使用10%triton x
‑
100,溶血百分比按以下公式计算:溶血百分比h%=a
样品
‑
a
阴性对照
/a
阳性对照
×
100%。结果表明多肽浓度为200μg/ml,ccm7wc的溶血百分比为7.78%。说明ccm7wc具有较低的溶血活性,不易引起哺乳动物红细胞破裂溶解。尤其在抗菌活性范围内,安全性高。与ccm7wc相比,母本肽cm
‑
cath2在200μg/ml浓度下的溶血百分比为19.12%,表明改造体ccm7wc的溶血活性低于母本肽cm
‑
cath2,更适于进一步药物开发。
[0040]
3.ccm7wc细胞毒性测定:
[0041]
用含有10%的胎牛血清以及双抗(青霉素和链霉素各100u/ml)的dmem(gibco公司,美国)培养基培养小鼠成纤维细胞l929,人肝癌细胞hepg2和人前列腺癌细胞pc3。待细
胞长满后去除培养液,用hanks缓冲液(gibco公司,美国)洗涤三次,用0.25%的胰酶消化细胞,使细胞脱落下来,用dmem培养基重悬细胞。96孔板中每孔加入100μl细胞悬液(大约2
×
104个细胞),待细胞贴壁后,加入溶解于dmem培养基的不同浓度的ccm7wc样品,在37℃,5%二氧化碳条件下培养48个小时。培养结束后96孔板每孔加入20μl 5mg/ml的mtt溶液(用hanks缓冲液配制),继续培养4小时。吸出孔中液体,每孔加入150μl二甲基亚砜,充分混匀,用酶标仪检测490nm波长的光吸收。细胞死亡率按以下公式计算:细胞死亡率%=a
阴性对照
‑
a
样品
/a
阴性对照
×
100%。结果如表2所示,在浓度为200μg/ml时,ccm7wc对hepg2、pc3和l929三种细胞的诱导死亡率分别为26.85%、19.78%和21.2%,说明ccm7wc对真核细胞具有较低的毒性。与ccm7wc相比,母本肽cm
‑
cath2在200μg/ml浓度下对hepg2、pc3和l929三种细胞的诱导死亡率分别为65.8%、58.7%和54.87%,表明改造体ccm7wc的细胞毒性显著低于母本肽cm
‑
cath2,更适于进一步药物开发。
[0042]
表2抗菌肽ccm7wc和母本肽cm
‑
cath的细胞毒性
[0043][0044]
4.ccm7wc稳定性测定:
[0045]
取健康人的血清,与ccm7wc以1:3的体积比混合,将混合物放于37℃培养箱中孵育10小时,于不同时间点取样品利用上述2倍稀释法检测其对大肠杆菌atcc25922的最小抑菌浓度值,以此确定ccm7wc对人血清中蛋白酶降解的抵抗性。
[0046]
结果如表3所示,ccm7wc对人血清中蛋白酶的降解具有很强的抵抗性,在两者混合10小时后,其mic值升高仍不大,说明ccm7wc在体内具有很好的稳定性。与ccm7wc相比,母本肽cm
‑
cath2在与人血清混合后其mic升高迅速,说明其稳定性较差。
[0047]
表3抗菌肽ccm7wc和母本肽cm
‑
cath血清稳定性
[0048][0049]
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1