一种糖肽或药学上可接受的盐及其制备方法与应用
1.本发明属于生物医药和材料技术领域,尤其涉及一种糖肽或药学上可接受的盐及其制备方法与应用。
背景技术:
2.蛋白聚糖(proteoglycan)是人体内一系列结构高度复杂的生物大分子,主要分布于细胞外基质内和细胞膜表面。细胞外基质中的蛋白聚糖储存、激活多种影响细胞生长、分化的生长因子、酶等。细胞膜表面的蛋白聚糖则作为受体传导信号,控制细胞与细胞外基质、细胞与细胞之间的相互作用。在组织修复、癌症发展(侵袭、转移、生长)等过程中,蛋白聚糖均发挥重要的生理学功能。这些作用源于蛋白聚糖上不同结构糖胺聚糖与蛋白质之间可调的相互作用。通过对这些相互作用过程的认识,可以构建具备特殊生物活性的含糖材料,模拟蛋白聚糖功能。利用含糖材料增强特定蛋白质功能,可加速组织修复,而通过抑制蛋白质活性或与特定蛋白聚糖的作用竞争,则能够抑制癌症的发展。尽管一些研究采用硫酸化壳聚糖、含糖高分子等模拟糖胺聚糖或蛋白聚糖活性,制备为纳米粒或者水凝胶,包载并释放小分子化学药或者生长因子等生物药,获得了良好的治疗效果。但是这些天然、半天然或合成型高分子材料的化学结构复杂,制备可重复性相对较低,难以保证每批次材料均具有相同且稳定的化学结构,对效果的重现性产生一定影响,临床转化难度较高。这些问题成为阻碍含糖活性材料在癌症治疗或组织工程临床转化应用的瓶颈。
3.人体组织缺损的修复和功能重建一直是临床上极具挑战的课题。这是因为部分组织或器官自身修复功能有限,如骨骼、大面积皮肤、血管、神经等。组织移植又受替代物供体不稳定、排斥反应、并发症高发、术后易感染等问题限制。近年来,利用生长因子与水凝胶支架相结合的组织工程策略是临床治疗和转化的重点。水凝胶能够提供类似细胞外基质的环境,还可以包载促进细胞生长、诱导干细胞分化的生长因子及其它类型药物,加速创伤组织的修复与重建。
4.生长因子是一类调节细胞生长、分化的水溶性蛋白质或多肽,对于细胞生理过程具有极为重要的调控作用。例如,血管内皮生长因子(vascular endothelial growth factor,vegf)和成纤维细胞生长因子(fibroblast growth factors,fgfs)可刺激血管分化、血管新生和组织修复;骨形态发生蛋白(bone morphogenetic protein,bmp)可诱导新骨和软骨的形成与生长。在bmp家族中,人重组bmp
‑
2和bmp
‑
7已经被美国fda批准,在临床上成功应用于脊椎融合、颈椎前路手术等,可显著提高骨修复速度。但是,生长因子类药物本身价格昂贵、半衰期短、易变性失活,而且直接注射后易流失,难以保存在组织缺损部位。这导致药物使用剂量偏高,不仅成本居高不下,也带来了临床应用的高风险,如组织水肿、排斥、异位增生等问题。
5.多肽水凝胶是受到广泛研究关注的一类材料,其生物相容性好,能为细胞的生长提供适宜的环境,并且在体内可降解。通过分子间的氢键、亲疏水作用、π
‑
π堆积等物理作用力驱动,多肽能够自组装形成三维结构的水凝胶。由于物理作用相对共价化学键较弱,这类
水凝胶的储能模量一般较低,具备在外力作用下的溶胶
‑
凝胶转变特性,表现为良好的触变性,能作为可注射水凝胶应用。可注射水凝胶在成胶前或受外力作用下为低粘度水溶液,在注射给药或外力作用消除后,在原位快速成胶定型。采用多肽构建的可注射水凝胶不仅方便药物的包载、给药、局部药物浓度维持,还能够为形状复杂的伤口、组织缺损提供微创治疗,避免手术造成的感染及二次损伤。多肽水凝胶对于药物的局部递送和原位组织修复具有广阔的应用前景和价值。不过,目前应用的大多数多肽水凝胶支架仅能包载和释放生长因子,难以提高其稳定性和生物活性,是临床应用亟待解决的问题。
技术实现要素:
6.针对上述问题,本发明受蛋白聚糖结构和功能启发,设计了具备生物活性的糖肽分子,其包含硫酸化修饰的糖单元和多肽两个部分,兼具两者的理化性质和生物学功能。糖肽中的多肽部分驱动分子自组装,使糖肽在低浓度条件下形成纳米粒,随浓度增高逐渐形成纳米棒、纳米纤维等,在高浓度下纳米纤维聚集形成三维水凝胶。糖肽自组装后,糖单元部分可提供模拟蛋白聚糖的活性功能,特异性结合原先与蛋白聚糖亲和的生长因子、酶等蛋白质或多肽、提高其稳定性和活性功能。由该糖肽得到的纳米粒能够抑制肿瘤细胞生长,也能包载小分子药物用于癌症治疗。由该糖肽制备得到的水凝胶可用于生长因子类药物的包载和制剂制备,提高药物稳定性和生物活性,具备可注射性,可在给药部位快速形成原位凝胶,加速组织重建。
7.为解决上述技术问题,本发明提供了一种糖肽或药学上可接受的盐及其制备方法与应用。
8.一种糖肽或其药学上可接受的盐,所述糖肽化学结构通式为式(1)
‑
(24)所示:
9.[0010][0011]
其中,n=2
‑
16的整数,r1为h或硫酸基;
[0012]
r2为h、乙酰基或硫酸基;
[0013]
r3为h、乙酰基、1
‑
萘乙酰基、2
‑
萘乙酰基、芴甲氧羰基、胆固醇甲酰基、月桂酰基、肉豆蔻酰基、棕榈酰基、硬脂酰基或油酰基;
[0014]
r4选自h、ch3、ch2c6h5、ch(ch3)2、ch2ch(ch3)2、ch(ch3)ch2ch3、ch2c6h4oh、ch2c8h6n、(ch2)2sch3、ch2cooh、(ch2)2cooh、ch2c3h3n2、(ch2)4nh2、ch2conh2、(ch2)2conh2、ch2oh、ch2sh、(ch2)3nhc(nh)nh2和ch(oh)ch3中的一种或多种。
[0015]
在本发明的一个实施例中,所述糖肽化学结构通式为式(1)
‑
(4)和(9)
‑
(16)时,采用以下方法制备所述糖肽:在反应溶剂中,将糖衍生物与多肽在催化剂作用下反应得到所述糖肽;所述反应溶剂为水、dmf、dmac、nmp和dmso中的一种或几种。
[0016]
在本发明的一个实施例中,所述多肽的化学结构为:
[0017][0018]
其中,n为2
‑
16的整数,r3为h、乙酰基(ac)、1
‑
萘乙酰基(1
‑
nap)、2
‑
萘乙酰基(2
‑
nap)、芴甲氧羰基(fmoc)、胆固醇甲酰基(chol)、月桂酰基(c
11
h
23
co
–
)、肉豆蔻酰基(c
13
h
27
co
–
)、棕榈酰基(c
15
h
31
co
–
)、硬脂酰基(c
17
h
35
co
–
)或油酰基(c
17
h
33
co
–
);
[0019]
r4选自h、ch3、ch2c6h5、ch(ch3)2、ch2ch(ch3)2、ch(ch3)ch2ch3、ch2c6h4oh、ch2c8h6n、(ch2)2sch3、ch2cooh、(ch2)2cooh、ch2c3h3n2、(ch2)4nh2、ch2conh2、(ch2)2conh2、ch2oh、ch2sh、(ch2)3nhc(nh)nh2和ch(oh)ch3中的一种或多种。
[0020]
在本发明的一个实施例中,所述催化剂为cucl、cubr、cui或cuso4与抗坏血酸钠。
[0021]
在本发明的一个实施例中,所述催化剂为cucl、cubr或cui时,催化剂用量为糖衍生物的0.05
‑
0.3摩尔当量。
[0022]
在本发明的一个实施例中,所述催化剂为cuso4与抗坏血酸钠时,cuso4用量为糖衍生物的0.05
‑
0.3摩尔当量,抗坏血酸钠用量为糖衍生物的0.1
‑
1摩尔当量。
[0023]
在本发明的一个实施例中,所述糖衍生物与多肽和催化剂摩尔比为1:0.8
‑
1.2:0.05
‑
0.3。
[0024]
在本发明的一个实施例中,所述糖肽化学结构通式为式(5)
‑
(8)和(17)
‑
(24)时,采用以下方法制备所述糖肽:在反应溶剂中,将多肽、缩合剂和糖衍生物在催化剂作用下反应得到所述糖肽;所述反应溶剂为水、dmf、dmac、nmp和dmso中的一种或多种。
[0025]
在本发明的一个实施例中,反应前进行预处理:将多肽溶解于溶剂中,加入缩合剂,混合活化0.5
‑
24小时,再加入糖衍生物和催化剂反应。
[0026]
在本发明的一个实施例中,所述多肽的化学结构为:
[0027][0028]
其中,r3为h、乙酰基(ac)、1
‑
萘乙酰基(1
‑
nap)、2
‑
萘乙酰基(2
‑
nap)、芴甲氧羰基(fmoc)、胆固醇甲酰基(chol)、月桂酰基(c
11
h
23
co
–
)、肉豆蔻酰基(c
13
h
27
co
–
)、棕榈酰基(c
15
h
31
co
–
)、硬脂酰基(c
17
h
35
co
–
)或油酰基(c
17
h
33
co
–
);
[0029]
r4选自h、ch3、ch2c6h5、ch(ch3)2、ch2ch(ch3)2、ch(ch3)ch2ch3、ch2c6h4oh、ch2c8h6n、(ch2)2sch3、ch2cooh、(ch2)2cooh、ch2c3h3n2、(ch2)4nh2、ch2conh2、(ch2)2conh2、ch2oh、ch2sh、(ch2)3nhc(nh)nh2和ch(oh)ch3中的一种或多种。
[0030]
在本发明的一个实施例中,所述缩合剂为hatu、hbtu、hctu、tatu、tbtu、edc和pybop中的一种或多种。
[0031]
在本发明的一个实施例中,所述催化剂为n,n
‑
二异丙基乙胺(diea)和/或三乙胺(tea)。
[0032]
在本发明的一个实施例中,所述多肽、缩合剂、催化剂与糖衍生物的摩尔比为1
‑
2:1
‑
5:1
‑
5:1。
[0033]
所述的糖肽在制备治疗肿瘤药物和/或肿瘤转移药物中的应用。
[0034]
一种糖肽纳米粒,所述糖肽纳米粒包括所述糖肽或其药学上可接受的盐。
[0035]
进一步的,所述糖肽纳米粒的制备方法为:
[0036]
方法一,具体制备方法为:将糖肽溶解于水、生理盐水、磷酸盐缓冲液、tris缓冲液、hepes缓冲液或细胞培养液等水溶液中至浓度为0.1
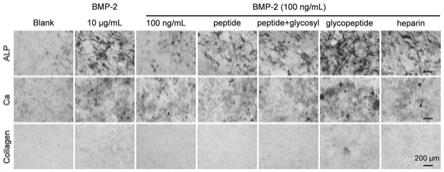
‑
2000mg/l,即可形成纳米粒以及其它不同结构与形貌的纳米结构材料。
[0037]
进一步的,糖肽浓度为0.1
‑
100mg/l。
[0038]
方法二,具体制备方法为:将糖肽溶解于有机溶剂中(dmf、dmso、乙醇和四氢呋喃中至少一种),然后在搅拌下加入到水、生理盐水、磷酸盐缓冲液、tris缓冲液、hepes缓冲液或细胞培养液等水溶液中,使糖肽终浓度为0.1
‑
2000mg/l,之后超滤并用水洗涤,去除有机溶剂,即可得到糖肽纳米粒。进一步的,糖肽浓度为0.1
‑
100mg/l。
[0039]
在本发明的一个实施例中,所述糖肽纳米粒在小分子载体中的应用。
[0040]
一种糖肽水凝胶,所述糖肽水凝胶包括所述糖肽或其药学上可接受的盐。
[0041]
糖肽水凝胶的制备方法:
[0042]
方法一,具体方法如下:将糖肽分散于水、生理盐水、磷酸盐缓冲液、tris缓冲液、hepes缓冲液或细胞培养液等水溶液中,终浓度为2
‑
20mg/ml,加热至50
‑
80℃,待糖肽完全溶解后,静置于室温冷却形成糖肽水凝胶。
[0043]
进一步的,糖肽水溶液的终浓度为5
‑
10mg/ml。
[0044]
方法二,具体制备方法为:将糖肽分散于水、生理盐水、磷酸盐缓冲液、tris缓冲液、hepes缓冲液或细胞培养液等水溶液中,终浓度为2
‑
20mg//ml,调节溶液ph至6.5
‑
8.5,待糖肽溶解后,静置于室温形成水凝胶。
[0045]
进一步的,糖肽水溶液的终浓度为5
‑
10mg/ml。
[0046]
方法三,具体制备方法为:将糖肽溶解于有机溶剂中(dmf、dmso、乙和四氢呋喃中至少一种),然后加入到水、生理盐水、磷酸盐缓冲液、tris缓冲液、hepes缓冲液或细胞培养液等水溶液中,糖肽终浓度为2
‑
20mg/ml时即可直接形成水凝胶。
[0047]
进一步的,糖肽水溶液的浓度为5
‑
10mg/ml。
[0048]
三种方法制备得到的糖肽水凝胶进行比较发现:第一种方法制备的水凝胶透明度偏低、强度适中,适合加热后溶解性可提高的糖肽分子;第二种方法制备的水凝胶透明度适中、强度偏低,适合直接溶解性好的糖肽分子;第三种方法制备的水凝胶透明度高、强度高,适合各类糖肽分子,尤其是水溶性较差的糖肽分子。
[0049]
在本发明的一个实施例中,所述糖肽水凝胶是可注射的。
[0050]
所述的糖肽水凝胶在药物载体中的应用。
[0051]
在本发明的一个实施例中,所述药物为蛋白质或多肽类药物。
[0052]
在本发明的一个实施例中,所述药物为生长因子类药物。
[0053]
在本发明的一个实施例中,所述生长因子类药物为骨形态发生蛋白(bmp)、血管内皮生长因子(vegf)或成纤维生长因子(fgf)。
[0054]
进一步的,骨形态发生蛋白为bmp
‑
2、bmp
‑
7、bmp
‑
3、bmp
‑
4、bmp
‑
5、bmp
‑
6、bmp
‑
8a、bmp
‑
8b、bmp
‑
9、bmp
‑
10、bmp
‑
11或bmp
‑
15。
[0055]
进一步的,血管内皮生长因子为vegf
‑
a、vegf
‑
b、vegf
‑
c、vegf
‑
d、vegf
‑
e或胎盘生
长因子(pgf)。
[0056]
进一步的,成纤维生长因子为fgf1、fgf2(bfgf)、fgf3、fgf4、fgf5、fgf6、fgf7、fgf8、fgf9、fgf10、fgf15、fgf19、fgf21或fgf23。
[0057]
在本发明的一个实施例中,通过所述糖肽制备载生长因子的可注射水凝胶,具体制备方法为:
[0058]
向糖肽溶液或已形成的水凝胶中加入生长因子类药物,并使得生长因子的终浓度达到0.05
‑
10μg/ml,搅拌均匀,在4℃静置4
‑
24小时,即形成载药可注射水凝胶,并用于修复治疗。
[0059]
所述糖肽用作激素类、抗病毒类、抗炎类药物的凝胶制剂辅料。
[0060]
本发明的上述技术方案相比现有技术具有以下优点:
[0061]
本发明所制备得到的糖肽,可在水溶液中自组装,在低浓度形成纳米粒,随浓度升高逐渐形成纳米纤维,进而聚集为三维网络并形成水凝胶。该体系糖肽的化学结构相对简单,可稳定、重复制备。糖肽在自组装后,具有仿蛋白聚糖的结构和功能,能够与多种细胞内或细胞外的蛋白质通过糖
‑
蛋白质相互作用结合,显示出生物活性。糖肽纳米粒可以进入癌细胞,起抑制癌细胞生长、促癌细胞凋亡的作用。糖肽纳米粒也能够作为载体包载抗癌药物,增强癌症治疗效果。糖肽水凝胶能够维持或增强生长因子等蛋白质的构象,提高其稳定性和活性最高可达100倍,降低生长因子用量。糖肽水凝胶形成过程温和,其具备良好的流变学性能,能够以注射或涂抹等形式给药。糖肽水凝胶生物安全性优异,可为细胞提供类似细胞外基质的适宜生长环境,促进细胞黏附、分化、生长和增殖,结合生长因子后可促进组织修复和重建。
附图说明
[0062]
为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中:
[0063]
图1为三种不同方法制备的糖肽水凝胶。
[0064]
图2为本发明实施例1的糖肽在不同浓度条件下形成的纳米粒、纳米棒、纳米纤维及水凝胶三维网络的透射电镜照片。
[0065]
图3为本发明实施例1的糖肽水凝胶的流变学性能;(a)应变扫描和(b)频率扫描。
[0066]
图4为本发明实施例1的糖肽水凝胶在1%和300%应力交替变化条件下的流变学性能,表明其具有良好的触变性和可注射性。
[0067]
图5为圆二色谱图,表明本发明实施例1的糖肽水凝胶可以增强生长因子的构象;(a)bmp
‑
2(b)糖肽水凝胶(c)复合bmp
‑
2糖肽水凝胶。
[0068]
图6为本发明实施例1的糖肽在不同浓度下的细胞相容性(mtt法)。
[0069]
图7为本发明测试例细胞培养中,细胞在本发明实施例1的糖肽水凝胶中三维培养生长3天后的细胞激光共聚焦图。
[0070]
图8为本发明测试例细胞成骨分化评价中细胞在不同条件下生长7天后碱性磷酸酶(alp)、矿化、胶原分泌情况图。表明本发明实施例1的糖肽水凝胶复合bmp
‑
2后能够提高其活性,降低用量,并且获得良好的细胞向成骨分化结果。
[0071]
图9为本发明实施例1
‑
实施例3与对比例1中所得糖肽化合物的红外吸收光谱。
[0072]
图10为本发明实施例1中所得糖肽纳米粒及对应糖衍生物对四种癌细胞的抑制作用;(a)
‑
(d)糖肽纳米粒(e)
‑
(h)糖衍生物。
具体实施方式
[0073]
下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
[0074]
实施例1
[0075][0076]
糖肽制备:在dmf溶剂中,n2保护及室温条件下,将合成得到的1
‑
o
‑
叠氮乙基
‑
3,4,6
‑
o
‑
硫酸基
‑
n
‑
乙酰氨基葡萄糖(530.5mg,1mmol)和多肽n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
苯丙氨酰
‑
丙炔胺(571.7mg,1mmol),在cuso4(16.0mg,0.1mmol)和抗坏血酸钠(39.6mg,0.2mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离(a相为0.1%的三氟乙酸的乙腈溶液,b相为含0.1%三氟乙酸的水溶液,梯度洗脱),纯化得到所述产物。所得产物的核磁数据为:1h nmr(400mhz,dmso
‑
d6):δ8.17(d,j=7.6hz,1h,nh),7.86(t,j=9.6hz,2h,ar
‑
h),7.62(t,j=8.2hz,2h,ar
‑
h),7.49
‑
7.09(m,15h,ar
‑
h,ch),4.53
‑
4.35(m,1h,ch),4.31
‑
4.21(m,1h,ch),4.19
‑
4.04(m,3h,ch),3.98(s,2h,ch2),3.92(dd,j=8.1,4.6hz,2h,ch2),3.84(s,1h,ch),3.80
‑
3.69(m,2h,ch2),3.66
‑
3.53(m,1h,ch),3.53
‑
3.40(m,1h,ch),3.09(dd,j=13.8,5.1hz,2h,ch2),2.97(ddd,j=18.1,12.1,5.8hz,3h,ch2),2.74(dd,j=11.3,8.9hz,3h,ch2),1.77(d,j=14.0hz,3h,ch3)。所述产物的红外吸收光谱见图9(a)。
[0077]
采用直接溶解法制备糖肽水凝胶:将糖肽分散于水中,调节溶液ph至7,待糖肽溶解后静置于室温形成水凝胶,糖肽终浓度为6mg/ml。
[0078]
糖肽纳米粒的制备:将糖肽溶解于生理盐水中,终浓度为0.2mg/l,即可形成纳米粒。
[0079]
实施例2
[0080][0081]
糖肽制备:在dmso溶剂中,n2保护及室温条件下,将合成得到的1
‑
o
‑
叠氮乙基
‑6‑
o
‑
硫酸基
‑
n
‑
乙酰氨基半乳糖(370.3mg,1mmol)和多肽n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
苯丙氨酰
‑
丙炔胺(457.3mg,0.8mmol),在cucl(5.0mg,0.05mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式所述的糖肽或其药学上可接受的盐,之后采用液相色谱分离(a相为0.1%的三氟乙酸的乙腈溶液,b相为含0.1%三氟乙酸的水溶液,梯度洗脱),纯化得到所
述产物。所得产物的核磁数据为:1h nmr(400mhz,dmso
‑
d6):δ8.16(d,j=7.6hz,1h,nh),7.93
‑
7.80(m,2h,ar
‑
h),7.62(t,j=8.1hz,2h,ar
‑
h),7.41(ddd,j=10.5,10.0,5.6hz,3h,ar
‑
h,ch),7.35
–
7.06(m,12h,ar
‑
h),4.41(dt,j=18.7,9.3hz,1h,ch),4.26(dd,j=13.5,6.1hz,2h,ch),4.20
‑
4.06(m,4h,ch2),3.88
‑
3.77(m,1h,ch),3.75
‑
3.53(m,2h,ch2),3.54
‑
3.40(m,4h,ch2),3.35
‑
3.16(m,1h,ch),3.09(dd,j=13.8,5.1hz,2h,ch),2.96(ddd,j=18.1,12.1,5.8hz,3h,ch,ch2),2.76(s,2h,ch2),1.78(t,j=12.2hz,3h,ch3)。所得糖肽产物的红外吸收光谱见图9(b)。
[0082]
采用加热溶解
‑
冷却法制备糖肽水凝胶:将糖肽分散于水中,加热至80℃,待糖肽完全溶解后,静置于室温冷却形成水凝胶,糖肽终浓度为6mg/ml。
[0083]
糖肽纳米粒的制备:将糖肽溶解于dmso中,然后在搅拌下加入到水中,使糖肽终浓度为0.5mg/l,之后超滤并用水洗涤,去除有机溶剂,即可得到纳米粒。
[0084]
实施例3
[0085][0086]
糖肽制备:在dmf和dmso混合溶剂中,n2保护及室温条件下,将合成得到的1
‑
o
‑
叠氮乙基
‑
n
‑
乙酰氨基葡萄糖(290.3mg,1mmol)和多肽n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
丙炔胺(862.6mg,1.2mmol),在cuso4(47.9mg,0.3mmol)和抗坏血酸钠(198.1mg,1mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离(a相为0.1%的三氟乙酸的乙腈溶液,b相为含0.1%三氟乙酸的水溶液,梯度洗脱),纯化得到所述产物。所得产物的核磁数据为:1h nmr(400mhz,dmso
‑
d6):δ8.28(d,j=7.7hz,4h,nh),7.87(d,j=7.5hz,3h,ar
‑
h),7.68
‑
7.53(m,3h,ar
‑
h),7.53
‑
7.36(m,3h,ar
‑
h,ch),7.36
‑
7.16(m,15h,ar
‑
h),4.59
‑
4.44(m,3h,ch),4.37(d,j=8.5hz,1h,ch),4.33
‑
4.22(m,2h,ch2),4.19
‑
4.05(m,3h,ch,ch2),4.04
‑
3.94(m,1h,ch),3.92
‑
3.81(m,1h,ch),3.69(d,j=11.8hz,4h,ch2),3.59(ddd,j=11.0,7.2,3.5hz,2h,ch),3.49
‑
3.39(m,2h,ch2),3.15
‑
3.00(m,2h,ch2),2.98
‑
2.83(m,2h,ch2),2.72(dd,j=21.1,7.7hz,2h,ch2),1.78(t,j=12.2hz,3h,ch3)。所得糖肽产物的红外吸收光谱见图9(c)。
[0087]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于乙醇溶剂中,然后加入到水中,糖肽终浓度为6mg/ml时形成了水凝胶。
[0088]
糖肽纳米粒的制备:将糖肽溶解于dmf中,然后在搅拌下加入到磷酸盐缓冲液中,使糖肽终浓度为0.1mg/l,之后超滤并用水洗涤,去除有机溶剂,即可得到纳米粒。
[0089]
实施例4
[0090]
[0091]
糖肽制备:在dmf和水混合溶剂中,n2保护及室温条件下,将合成得到的1
‑
o
‑
叠氮丙基
‑
n
‑
,3,4,6
‑
o
‑
硫酸基
‑
氨基葡萄糖(582.5mg,1mmol)和多肽n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
缬氨酰
‑
丙氨酰
‑
缬氨酰
‑
异亮氨酰
‑
丙氨酰
‑
色氨酰
‑
亮氨酰
‑
丙氨酰
‑
天冬氨酰
‑
谷氨酰
‑
甘氨酰
‑
己炔胺(1757.3mg,0.8mmol),在cubr(43.0mg,0.3mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0092]
采用直接溶解法制备糖肽水凝胶:将糖肽分散于磷酸盐缓冲液中,调节溶液ph至7.4,待糖肽溶解后静置于室温形成水凝胶,糖肽终浓度为10mg/ml。
[0093]
糖肽纳米粒的制备:将糖肽溶解于细胞培养液中,终浓度为500mg/l,即可形成纳米粒。
[0094]
实施例5
[0095][0096]
糖肽制备:在dmac溶剂中,n2保护及室温条件下,将合成得到的1
‑
o
‑
叠氮戊基
‑
3,6
‑
o
‑
硫酸基
‑
n
‑
乙酰氨基半乳糖(492.5mg,1mmol)和多肽硬脂酰
‑
酪氨酰
‑
酪氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
异亮氨酰
‑
甲硫氨酰
‑
色氨酰
‑
缬氨酰
‑
丙氨酰
‑
甘氨酰
‑
天冬氨酰
‑
丙炔胺(1543.7mg,0.9mmol),在cui(38.1mg,0.2mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0097]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于dmso溶剂中,然后加入到生理盐水中,糖肽终浓度为10mg/ml时即可形成水凝胶。
[0098]
糖肽纳米粒的制备:将糖肽溶解于乙醇中,然后在搅拌下加入到水中,使糖肽终浓度为10mg/l,之后超滤并用水洗涤,去除有机溶剂,即可得到纳米粒。
[0099]
实施例6
[0100][0101]
糖肽制备:在dmf和nmp混合溶剂中,n2保护及室温条件下,将合成得到的1
‑
叠氮基
‑
4,6
‑
o
‑
硫酸基
‑
n
‑
乙酰氨基半乳糖(406.3mg,1mmol)和多肽月桂酰
‑
苯丙氨酰
‑
酪氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
色氨酰
‑
缬氨酰
‑
甲硫氨酰
‑
谷氨酰
‑
丙氨酰
‑
甘氨酰
‑
甘氨酰
‑
戊炔胺(1778.7mg,1.1mmol),在cucl(29.7mg,0.3mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0102]
采用加热溶解
‑
冷却法制备糖肽水凝胶:将糖肽分散于生理盐水中,加热至50℃,待糖肽完全溶解后,静置于室温冷却形成水凝胶,糖肽终浓度为2mg/ml。
[0103]
糖肽纳米粒的制备:将糖肽溶解于dmso和dmf混合溶剂中,然后在搅拌下加入到生
理盐水中,使糖肽终浓度为20mg/l,之后超滤并用水洗涤,去除有机溶剂,即可得到纳米粒。
[0104]
实施例7
[0105][0106]
糖肽制备:在dmso溶剂中,n2保护及室温条件下,将多肽2
‑
萘乙酰
‑
苯丙氨酰
‑
酪氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
色氨酰
‑
异亮氨酰
‑
组氨酰
‑
谷氨酰胺酰
‑
天冬酰胺(2971.3mg,2mmol)与缩合剂hbtu(1896.2mg,5mmol)混合活化,4小时后加入合成得到的1
‑
o
‑
丁氨基
‑
3,4,6
‑
o
‑
硫酸基
‑
n
‑
乙酰氨基半乳糖(532.5mg,1mmol),并用tea(0.69ml,5mmol)催化,反应4小时完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0107]
采用加热溶解
‑
冷却法制备糖肽水凝胶:将糖肽分散于磷酸盐缓冲液中,加热至60℃,待糖肽完全溶解后,静置于室温冷却形成水凝胶,糖肽终浓度为8mg/ml。
[0108]
糖肽纳米粒的制备:将糖肽溶解于水中,终浓度为50mg/l,即可形成纳米粒。
[0109]
实施例8
[0110][0111]
糖肽制备:在水溶液中,n2保护及室温条件下,将多肽1
‑
萘乙酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
缬氨酰
‑
缬氨酰
‑
丙氨酰
‑
甘氨酸(1455.2mg,1.5mmol)与缩合剂edc(383.4mg,2mmol)混合活化,24小时后加入合成得到的1
‑
氨基
‑
3,4
‑
o
‑
硫酸基
‑
n
‑
乙酰氨基葡萄糖(380.3mg,1mmol),并用diea(0.52ml,3mmol)催化,反应24小时完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0112]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于乙醇和dmf混合溶剂中,然后加入到磷酸盐缓冲液中,糖肽终浓度为5mg/ml时即可形成水凝胶。
[0113]
糖肽纳米粒的制备:将糖肽溶解于乙醇和dmf混合溶剂中,然后在搅拌下加入到生理盐水中,使糖肽终浓度为2mg/l,之后超滤并用水洗涤,去除有机溶剂,即可得到纳米粒。
[0114]
实施例9
[0115][0116]
糖肽制备:在dmf和dmac混合溶剂中,n2保护及室温条件下,将合成得到的3
‑
o
‑
硫酸基
‑
葡萄糖醛酸
‑
β
‑
(1
→
4)
‑1’‑
o
‑
叠氮乙基
‑
n
‑
,6
’‑
o
‑
硫酸基
‑
氨基葡萄糖(664.5mg,1mmol)和多肽n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
酪氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
苯丙氨酰
‑
色氨酰
‑
丙氨
酰
‑
缬氨酰
‑
异亮氨酰
‑
丙氨酰
‑
甘氨酰
‑
谷氨酰胺酰
‑
谷氨酰
‑
丝氨酰
‑
精氨酰
‑
甘氨酰
‑
丙炔胺(1760.4mg,0.8mmol),在cubr(14.3mg,0.1mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0117]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于乙醇和dmso混合溶剂中,然后加入到细胞培养液中,糖肽终浓度为20mg/ml时即形成水凝胶。
[0118]
糖肽纳米粒的制备:将糖肽溶解于hepes缓冲液中,终浓度为2000mg/l,即形成纳米粒。
[0119]
实施例10
[0120][0121]
糖肽制备:在nmp溶剂中,n2保护及室温条件下,将合成得到的4
‑
o
‑
硫酸基
‑
葡萄糖醛酸
‑
β
‑
(1
→
4)
‑1’‑
叠氮基
‑3’
,6
’‑
o
‑
硫酸基
‑
n
‑
乙酰氨基葡萄糖(662.5mg,1mmol)和多肽棕榈酰
‑
苯丙氨酰
‑
酪氨酰
‑
酪氨酰
‑
色氨酰
‑
亮氨酰
‑
异亮氨酰
‑
缬氨酰
‑
丙氨酰
‑
丙炔胺(1619.7mg,1.2mmol),在cui(9.5mg,0.05mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0122]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于四氢呋喃溶剂中,然后加入到hepes缓冲液中,糖肽终浓度为10mg/ml时即形成水凝胶。
[0123]
糖肽纳米粒的制备:将糖肽溶解于dmso和四氢呋喃混合溶剂中,然后在搅拌下加入到hepes缓冲液中,使糖肽终浓度为20mg/l,之后超滤并用水洗涤,去除有机溶剂,即得到纳米粒。
[0124]
实施例11
[0125][0126]
糖肽制备:在dmf和dmac混合溶剂中,n2保护及室温条件下,将多肽乙酰
‑
酪氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
甲硫氨酰
‑
缬氨酰
‑
异亮氨酰
‑
谷氨酸(1137.4mg,1mmol)与缩合剂pybop(520.4mg,1mmol)混合活化,6小时后加入合成得到的2
‑
o
‑
硫酸基
‑
葡萄糖醛酸
‑
β
‑
(1
→
4)
‑1’‑
o
‑
乙氨基
‑6’‑
o
‑
硫酸基
‑
n
‑
乙酰氨基葡萄糖(600.5mg,1mmol),并用diea(0.87ml,5mmol)催化,反应2小时完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0127]
采用直接溶解法制备糖肽水凝胶:将糖肽分散于细胞培养液中,调节溶液ph至7.4,待糖肽溶解后静置于室温形成水凝胶,糖肽终浓度为6mg/ml。
[0128]
糖肽纳米粒的制备:将糖肽溶解于乙醇中,然后在搅拌下加入到tris缓冲液中,使
糖肽终浓度为100mg/l,之后超滤并用水洗涤,去除有机溶剂,即得到纳米粒。
[0129]
实施例12
[0130][0131]
糖肽制备:在dmf和nmp混合溶剂中,n2保护及室温条件下,将多肽1
‑
萘乙酰
‑
酪氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
缬氨酰
‑
异亮氨酰
‑
缬氨酰
‑
缬氨酰
‑
丙氨酰
‑
谷氨酰胺酰
‑
甘氨酸(1965.8mg,1.5mmol)与缩合剂tbtu(642.2mg,2mmol)混合活化,12小时后加入合成得到的3,4,6
‑
o
‑
硫酸基
‑
半乳糖
‑
β
‑
(1
→
4)
‑1’‑
丙氨基
‑
n
‑
乙酰氨基葡萄糖(680.6mg,1mmol),并用diea(0.52ml,3mmol)催化,反应5小时完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0132]
采用加热溶解
‑
冷却法制备糖肽水凝胶:将糖肽分散于细胞培养液中,加热至50℃,待糖肽完全溶解后,静置于室温冷却形成水凝胶,糖肽终浓度为10mg/ml。
[0133]
糖肽纳米粒的制备:将糖肽溶解于tris缓冲液中,终浓度为200mg/l,即可形成纳米粒。
[0134]
实施例13
[0135][0136]
糖肽制备:在dmf、dmso和水混合溶剂中,n2保护及室温条件下,将合成得到的6
‑
o
‑
硫酸基
‑
半乳糖
‑
β
‑
(1
→
4)
‑1’‑
o
‑
叠氮戊基
‑
n
‑
,6
’‑
o
‑
硫酸基
‑
氨基葡萄糖(692.6mg,1mmol)和多肽油酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
缬氨酰
‑
色氨酰
‑
甘氨酰
‑
缬氨酰
‑
异亮氨酰
‑
丙氨酰
‑
赖氨酰
‑
丙炔胺(1224.8mg,0.8mmol),在cuso4(8.0mg,0.05mmol)和抗坏血酸钠(19.8mg,0.1mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0137]
采用直接溶解法制备糖肽水凝胶:将糖肽分散于tris缓冲液中,调节溶液ph至8.5,待糖肽溶解后静置于室温形成水凝胶,糖肽终浓度为12mg/ml。
[0138]
糖肽纳米粒的制备:将糖肽溶解于乙醇中,然后在搅拌下加入到磷酸盐缓冲液中,使糖肽终浓度为60mg/l,之后超滤并用水洗涤,去除有机溶剂,即得到纳米粒。
[0139]
实施例14
[0140][0141]
糖肽制备:在dmf溶剂中,n2保护及室温条件下,将多肽酪氨酰
‑
色氨酰
‑
色氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
丙氨酰
‑
缬氨酰
‑
丙氨酰
‑
天冬氨酰
‑
半胱氨酸(2615.0mg,2mmol)与缩合
剂hatu(760.5mg,2mmol)和hctu(827.4mg,2mmol)混合活化,2小时后加入合成得到的2,4
‑
o
‑
硫酸基
‑
葡萄糖醛酸
‑
β
‑
(1
→
3)
‑1’‑
o
‑
戊氨基
‑6’‑
硫酸基
‑
n
‑
乙酰氨基半乳糖(722.7mg,1mmol),并用diea(0.35ml,2mmol)和tea(0.28ml,2mmol)催化,反应3小时完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0142]
采用加热溶解
‑
冷却法制备糖肽水凝胶:将糖肽分散于hepes缓冲液中,加热至65℃,待糖肽完全溶解后,静置于室温冷却形成水凝胶,糖肽终浓度为10mg/ml。
[0143]
糖肽纳米粒的制备:将糖肽溶解于四氢呋喃中,然后在搅拌下加入到细胞培养液中,使糖肽终浓度为5mg/l,之后超滤并用水洗涤,去除有机溶剂,即得到纳米粒。
[0144]
实施例15
[0145][0146]
糖肽制备:在水溶液中,n2保护及室温条件下,将合成得到的2
‑
o
‑
硫酸基
‑
葡萄糖醛酸
‑
β
‑
(1
→
3)
‑1’‑
叠氮基
‑4’
,6
’‑
硫酸基
‑
n
‑
乙酰氨基半乳糖(662.5mg,1mmol)和多肽胆固醇甲酯酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
丙氨酰
‑
丙氨酰
‑
己炔胺(1242.7mg,1mmol),在cucl(19.8mg,0.2mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0147]
采用直接溶解法制备糖肽水凝胶:将糖肽分散于生理盐水中,调节溶液ph至6.5,待糖肽溶解后静置于室温形成水凝胶,糖肽终浓度为5mg/ml。
[0148]
糖肽纳米粒的制备:将糖肽溶解于磷酸盐缓冲液中,终浓度为20mg/l,即可形成纳米粒。
[0149]
实施例16
[0150][0151]
糖肽制备:在dmso和nmp混合溶剂中,n2保护及室温条件下,将多肽n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
酪氨酰
‑
酪氨酰
‑
苯丙氨酰
‑
丙氨酰
‑
缬氨酰
‑
丙氨酰
‑
缬氨酰
‑
色氨酰
‑
亮氨酰
‑
丙氨酰
‑
甘氨酸(1628.9mg,1mmol)与缩合剂tatu(644.2mg,2mmol)混合活化,0.5小时后加入合成得到的葡萄糖醛酸
‑
β
‑
(1
→
3)
‑1’
,2
’‑
二氨基葡萄糖(354.3mg,1mmol),并用tea(0.14ml,1mmol)催化,反应9小时完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0152]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于dmf溶剂中,然后加入到生理盐水中,糖肽终浓度为10mg/ml时即形成水凝胶。
[0153]
糖肽纳米粒的制备:将糖肽溶解于dmso中,然后在搅拌下加入到hepes缓冲液中,使糖肽终浓度为800mg/l,之后超滤并用水洗涤,去除有机溶剂,即得到纳米粒。
[0154]
实施例17
[0155][0156]
糖肽制备:在dmf溶剂中,n2保护及室温条件下,将合成得到的2,3
‑
o
‑
硫酸基
‑
葡萄糖醛酸
‑
β
‑
(1
→
3)
‑1’‑
o
‑
叠氮乙基
‑6’‑
硫酸基
‑
n
‑
乙酰氨基葡萄糖(706.6mg,1mmol)和多肽肉豆蔻酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
苯丙氨酰
‑
酪氨酰
‑
酪氨酰
‑
色氨酰
‑
丙氨酰
‑
缬氨酰
‑
异亮氨酰
‑
甲硫氨酰
‑
甘氨酰
‑
谷氨酰
‑
谷氨酰
‑
苏氨酰
‑
半胱氨酰
‑
甘氨酰
‑
戊炔胺(1791.0mg,0.8mmol),在cubr(7.2mg,0.05mmol)的催化下,通过“click”反应连接,反应过夜完成,形成如上式的糖肽或其药学上可接受的盐,之后采用液相色谱分离,纯化得到所述产物。
[0157]
采用溶剂分散法制备糖肽水凝胶:将糖肽溶解于dmf和四氢呋喃溶剂中,然后加入到tris缓冲液中,糖肽终浓度为20mg/ml时即形成水凝胶。
[0158]
糖肽纳米粒的制备:将糖肽溶解于乙醇和dmso混合溶剂中,然后在搅拌下加入到水中,使糖肽终浓度为1000mg/l,之后超滤并用水洗涤,去除有机溶剂,即得到纳米粒。
[0159]
对比例1
[0160][0161]
本发明实施例1中多肽分子n
‑
芴甲氧羰基
‑
苯丙氨酰
‑
苯丙氨酸的核磁数据为:1h nmr(400mhz,dmso
‑
d6):δ12.79(s,1h,cooh),8.27(d,j=7.8hz,1h,nh),7.88(d,j=7.5hz,2h,ar
‑
h),7.67
‑
7.52(m,2h,ar
‑
h),7.42(ddd,j=11.2,10.1,5.2hz,3h,ar
‑
h,nh),7.35
‑
7.11(m,12h,ar
‑
h),4.48(dd,j=13.3,8.1hz,1h,ch),4.33
‑
4.21(m,1h,ch),4.19
‑
4.06(m,3h,ch,ch2),3.09(dd,j=13.9,5.2hz,1h,ch2),3.02
–
2.90(m,2h,ch2),2.74(dd,j=13.5,11.2hz,1h,ch2)。所述产物的红外吸收光谱见图9(d)。
[0162]
取上述肽段分子采用溶剂分散法制备多肽水凝胶,具体制备方法为:将上述多肽溶解于有机溶剂乙醇中,然后加入到水溶液中,糖肽终浓度为2mg/ml时即可形成多肽水凝胶。
[0163]
对比例2
[0164]
对比例1中所述的多肽与实施例1中所述糖衍生物混合。首先将多肽溶解于乙醇中,之后加入到溶解有糖衍生物的水溶液中,混合均匀后于室温下静置形成水凝胶,最终多肽浓度为6mg/ml,糖衍生物浓度为2.9mg/ml(5.4mmol/l),糖衍生物具有与实施例1中所述的糖肽(6mg/ml,5.4mmol/l)同等的摩尔浓度。
[0165]
测试例
[0166]
形貌观测
[0167]
将实施例1中的糖肽分别配制成0.2mg/l、2mg/l、20mg/l和2000mg/l的溶液,静置待自组装完成,将溶液样品直接滴加到碳覆膜铜网上,将形成水凝胶的样品在水中超声分散后滴加到碳覆膜铜网,自然风干后用2%磷钨酸溶液染色,之后用透射电子显微镜观察形貌,实验结果见图2。
[0168]
如图2所示,实施例1所述糖肽在水溶液中可自组装成不同形貌的纳米材料。在0.2mg/l浓度条件下,糖肽可在水介质中自组装形成球形纳米粒,尺寸约为50
‑
150nm;随着样品浓度增加至2mg/l,球形纳米粒逐渐融合,形成纳米棒和纳米短纤维,超声分散后成为纳米粒,并在静置后再次融合形成对应纳米结构;样品浓度增加至20mg/l,可形成数微米长的纳米纤维;浓度继续增加至2000mg/l后,纤维量增加,并聚集形成三维网络,宏观状态则为水凝胶。表明水凝胶的形成机制是由糖肽通过非共价作用力自组装形成纳米纤维,进而聚集成为三维水凝胶网络。根据不同糖肽分子结构的差异,最低成胶浓度存在一定的差别。
[0169]
流变学测试
[0170]
将实施例1中的糖肽水凝胶样品置于流变仪载样台上,在25℃条件下,分别测试动态应变范围0.01
‑
1000%,转速范围0.1
‑
100rad/s条件下水凝胶的流变学性能。在应变为1%和300%的交替变化下测试水凝胶的触变性能。
[0171]
如图3所示,在应变为100%条件下,糖肽水凝胶的储存模量(g’)大于损耗模量(g”),样品以弹性形变为主,保持固态或半固态凝胶状;随着应变继续增加,g”大于g’,此时样品以黏性形变为主,发生凝胶
‑
溶胶转变;无论是应力变化还是频率变化,水凝胶的g’和g”均在1000pa以下,机械强度较低。如图4所示,当处于1%和300%交替变化的应力条件下,水凝胶会快速发生溶胶
‑
凝胶的反复转变,且g’和g”能快速恢复原先水平,这表明糖肽水凝胶以物理相互作用驱动形成,具有剪切稀化的特征,具备良好的触变性和可注射性。这些结果说明糖肽能够作为在皮肤、粘膜表面或腔道内给药,或者体内注射给药水凝胶制剂的辅料。
[0172]
圆二色谱测试
[0173]
采用圆二色谱测试实施例1中糖肽、bmp
‑
2在与糖肽水凝胶复合前后二级结构的变化。分别配制bmp
‑
2水溶液(50μg/ml)、糖肽水溶液(2mg/ml)以及复合bmp
‑
2的糖肽水溶液(bmp
‑
2:50μg/ml,糖肽:2mg/ml),混合均匀后于4℃条件下静置16小时,之后在25℃条件下测定样品的圆二色谱。
[0174]
如图5所示,bmp
‑
2水溶液的圆二色谱图在210nm处出现了α
‑
螺旋的特征吸收,这于bmp
‑
2的理论构象一致;而糖肽水凝胶则在202nm处出现了β
‑
折叠的特征吸收,这是含苯丙氨酸多肽自组装形成纳米纤维后的特征构象;当在同等浓度条件下将bmp
‑
2和糖肽水凝胶复合,从图中可看出,两者特征的二级结构吸收峰位置并未发生变化,但吸收的强度均有所增加,这说明糖肽纳米纤维和bmp
‑
2之间产生了相互作用,稳定并增强了bmp
‑
2的构象。由于蛋白质的构象与其生物活性密切联系,这一结果表明bmp
‑
2的活性可能得到保持甚至增强。
[0175]
细胞相容性测试
[0176]
采用mtt法测试水凝胶的细胞相容性。将实施例1中的糖肽配制成不同浓度的溶液(1、5、10、20、50mg/ml),按100μl/孔加入到96孔板中(n=6),之后紫外照射灭菌,再将mc3t3
‑
e1细胞按5000个/孔密度接种于水凝胶中,在含5%co2的细胞培养箱中于37℃培养48小时,之后弃去培养基,用pbs(ph7.4)润洗,再在每孔中加入100μl的mtt溶液(0.5mg/ml),于培养箱中继续培养4小时后,弃去溶液,每孔加入100μl的dmso,待甲瓒溶解后测定570nm处的光密度值,并按照公式:细胞存活率(%)=(od
样品
‑
od
空白
)
×
100/(od
对照
‑
od
空白
),计算细胞存活率。
[0177]
如图6所示,mc3t3
‑
e1细胞与不同浓度的糖肽共培养后,细胞存活率均保持在90%
以上水平,这说明糖肽具有良好的细胞相容性。在较低浓度条件下,细胞水平甚至超过100%,表明糖肽还能够促进细胞的增殖。
[0178]
细胞三维培养及“活
‑
死”细胞染色
[0179]
将实施例1中的糖肽配制成5mg/ml溶液,并以1ml/皿接种于共聚焦专用皿中形成水凝胶,用紫外灭菌24小时,之后将mc3t3
‑
e1细胞按20000/皿接种在水凝胶表面,再在含5%co2的细胞培养箱中于37℃培养3天。之后弃去培养基,用pbs(ph7.4)润洗后每孔再加入400μl的calcein
‑
am/pi染色溶液,在培养箱中培养30分钟,弃去溶液,用pbs(ph7.4)润洗后加入4%多聚甲醛溶液孵育15分钟固定细胞,之后用pbs(ph7.4)润洗,再用激光共聚焦显微镜观察并拍照,记录细胞在水凝胶支架中生长、迁移的情况,以及“活
‑
死”细胞比。
[0180]
如图7所示,细胞在水凝胶中三维培养3天后,细胞在水凝胶中显示良好的生长和增殖情况。细胞铺展于凝胶内部,数量明显增加,这表明糖肽纳米纤维形成的三维网络能够为细胞提供类似于细胞外基质的生长环境,细胞不仅能有效黏附、生长,还能向水凝胶内部迁移,帮助组织修复。“活
‑
死”染色结果显示,水凝胶中死细胞数量极少,细胞存活状态良好。
[0181]
细胞成骨分化评价
[0182]
设定以下7个对照组,(1)空白对照组;(2)高浓度bmp(10μg/ml);(3)低浓度bmp
‑
2(100ng/ml);(4)对比例1多肽水凝胶+bmp
‑
2(100ng/ml);(5)对比例2多肽混合糖单元+bmp
‑
2(100ng/ml);(6)实施例1糖肽水凝胶+bmp
‑
2(100ng/ml);(7)肝素(10μg/ml)+bmp
‑
2(100ng/ml)。将上述组中水凝胶制备之后紫外照射灭菌,然后加入bmp
‑
2溶液,混合均匀后于4℃条件下静置16小时。之后将上述500μl溶液或水凝胶接种于24孔板中,再将mc3t3
‑
e1细胞接种于水凝胶中(n=3),于在含5%co2的细胞培养箱中于37℃培养。7天后,采用碱性磷酸酶检(alp)测试剂盒对细胞分泌的alp进行染色,在显微镜下拍照;采用0.2%茜素红染色液对细胞的钙沉积和钙化结节染色,并在显微镜下拍照;采用天狼星红染色液对细胞分泌的胶原蛋白染色,并在显微镜下拍照。
[0183]
如图8所示,mc3t3
‑
e1细胞在各组中显示出不同的成骨分化程度,alp、钙沉积与结节以及胶原蛋白分泌量均显示出一定的差异。在组(1)未加入糖肽和药物的空白对照组中,细胞仅能生长,难以向成骨分化;而在组(2)高浓度bmp
‑
2对照组中,细胞能够分泌alp和胶原蛋白,并产生钙沉积,但总体量均偏低,这也是bmp
‑
2应用中存在的主要问题,稳定性较低,易失活;在组(3)低浓度bmp
‑
2对照组、组(4)和组(5)中,三种成骨分化标志物的分泌量均较低;在组(6)中,糖肽水凝胶可明显增强bmp
‑
2蛋白的活性,三种标志物的分泌量均显著增加,较组(7)肝素的促进作用更强。上述结果表明,bmp
‑
2促细胞向成骨分化的作用与其用量及活性成正相关,单独的多肽和简单混合多肽与糖单元无法促进bmp
‑
2蛋白的活性,糖肽水凝胶能够有效提高bmp
‑
2的稳定性,增强其活性,显著提高细胞向成骨分化的能力,并且能降低bmp
‑
2的用量,最高可达100倍。
[0184]
糖肽纳米粒的癌细胞抑制活性评价
[0185]
采用mtt法测试糖肽纳米粒对癌细胞的抑制作用。将b16、hepg2、a549和mgc80
‑
3四种癌细胞分别以5000个/孔的密度接种于96孔板中,孵育24小时后,加入100μl由实施例1中的糖肽制备,已经过220nm滤膜过滤灭菌,不同浓度的纳米粒培养基溶液(0、50、100、200和400mg/l),在含5%co2的细胞培养箱中于37℃培养48小时,之后弃去培养基,用pbs(ph7.4)
润洗,再在每孔中加入100μl的mtt溶液(0.5mg/ml),于培养箱中继续培养4小时后,弃去溶液,每孔加入100μl的dmso,待甲瓒溶解后测定570nm处的光密度值,并按照公式:细胞存活率(%)=(od
样品
‑
od
空白
)
×
100/(od
对照
‑
od
空白
),计算细胞存活率及半数致死量(ic
50
)。
[0186]
如图10显示糖肽纳米粒能够抑制四种癌细胞的生长,不仅显示出剂量依赖性,也表现出对不同癌细胞不同的抑制作用。而对应的糖单元在相同浓度条件下难以影响癌细胞的生长,仅对b16黑色素瘤细胞具有一定的抑制作用。这是因为形成的纳米粒能够干扰细胞表面的蛋白聚糖受体,进入细胞后会干扰癌细胞内蛋白质的功能,因而显示出对癌细胞一定的抑制作用。糖肽纳米粒对四种癌细胞的半数抑制浓度(ic
50
值)分别为b16细胞32.9mg/l,hepg2细胞55.8mg/l,a549细胞282.1mg/l,mgc
‑
803细胞155.1mg/l。
[0187]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1