一种全基因组整体5hmC检测方法及其应用
一种全基因组整体5hmc检测方法及其应用
技术领域
1.本发明属于基因检测领域,具体涉及一种全基因组整体5hmc检测方法及其应用。
背景技术:
2.dna甲基化是表观遗传学的重要研究内容。基因组中的胞嘧啶作为遗传密码的一部分,通过其嘧啶环的化学修饰携带表观遗传信息,这些化学修饰主要是5
‑
甲基胞嘧啶(5mc)及其氧化产物5
‑
羟甲基胞嘧啶(5hmc)、5
‑
醛基胞嘧啶(5fc)和5
‑
羧基胞嘧啶(5cac)。5mc可以使基因表达沉默,但其可以通过tet酶介导的氧化和一系列主动去甲基化过程使沉默的基因重新表达,因此,5mc的氧化产物对于基因精确调控具有重大意义。而且,5hmc也是潜在的癌症标志物,异常的5hmc水平与癌症的发生和发展具有密切联系,因此,5hmc的检测对于癌症的早期筛选和治疗具有指导意义。
3.相关技术中,5hmc的检测方法主要包括:依赖于重亚硫酸盐的测序技术、质谱法、聚合酶链式反应法、薄层色谱法和基于抗体的检测方法。但是,由于5hmc在基因组中含量极低,且自身结构与其他碱基高度相似,机加之各种检测仪器操作的复杂性和灵敏度限制,使5hmc在基因组中的实际检测情况并不理想。而且,检测5hmc的样品量通常需要达到微克级别,对样品的要求相对较高,从而进一步提高了其检测难度。
4.因此,开发这一种低成本、高灵敏度、低样本量的全基因组5hmc定量方法对于5hmc及其相关研究具有极为重大的现实意义。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种全基因组整体5hmc检测方法及其应用,能够不基于复杂的仪器操作,实现微克级别的全基因组5hmc检测效果,有效降低了检测成本和检测难度,实现了全基因组5hmc的高效准确检测。
6.根据本发明的第一个方面,提供一种探针,该探针的核苷酸序列为:5
’‑
ccggagtccgctttcctctt
‑3’
(seq id no.2)。
7.该探针能够准确识别目标5hmc位点,从而启动后续反应。
8.在本发明的一些优选实施方式中,所述探针用于靶向seq id no.1或含有seq id no.1所示核苷酸序列基因的5hmc或全基因组的5hmc。
9.当然,本领域技术人员也可以设计其他任何大于三个碱基的dna链作为探针均可,原因在于该探针仅针对于5hmc,而非特定的靶序列,因此,只要5’端修饰dbco且长度大于三个碱基的寡核苷酸链即可。
10.在本发明的第一个方面中,在本发明的一些实施方式中,所述探针的5’端连接有点击化学试剂。
11.在本发明的一些优选实施方式中,所述点击化学试剂包括:乙炔和二苯并环辛炔中的任意一种。
12.当然,本领域技术人员可以根据实际使用需求,合理选择其他点击化学试剂使其可以实现“click”反应。
13.本发明的第二个方面,提供一种5hmc检测试剂,该5hmc检测试剂中含有本发明第一个方面所述的探针。
14.该检测试剂能够准确识别靶标序列,从而启动后续反应。
15.在本发明的一些优选实施方式中,所述探针用于靶向seq id no.1或含有seq id no.1所示核苷酸序列基因的5hmc或全基因组的5hmc。
16.当然,本领域技术人员也可以设计其他任何大于三个碱基的dna链作为探针均可,原因在于该探针仅针对于5hmc,而非特定的靶序列,因此,只要5’端修饰dbco且长度大于三个碱基的寡核苷酸链即可。
17.本发明的第三个方面,提供一种5hmc检测试剂盒,该5hmc检测试剂盒中含有本发明第二个方面所述的5hmc检测试剂。
18.根据本发明的第三个方面,在本发明的一些实施方式中,所述5hmc检测试剂盒还含有ddttp、tdt、udp
‑6‑
n3‑
glu、t4
‑
βgt和金属纳米颗粒试剂中的至少一种。
19.在本发明的一些优选实施方式中,所述5hmc检测试剂盒还含有ddttp、tdt、udp
‑6‑
n3‑
glu、t4
‑
βgt、dttp和金属纳米颗粒试剂。
20.在本发明中,使用polyt配合稳定荧光铜纳米颗粒检测5hmc,克服了tdt的非特异性延伸。因为在正常情况下,所需要检测的核酸分子,只要具有3’端
‑
oh基团就会被延伸,而这会导致无法特异性检测5hmc。而发明人利用tdt将检测样品3’端
‑
oh使用ddttp封闭,以去除样品本身的3’端
‑
oh基团干扰,保证了5hmc上所修饰引物的3’端
‑
oh为唯一的3’端
‑
oh,从而产生了特异性。
21.根据本发明的第三个方面,在本发明的一些实施方式中,所述金属纳米颗粒试剂包括:银和铜纳米颗粒中的任意一种。
22.在本发明的一些优选实施方式中,所述金属纳米颗粒试剂为铜纳米颗粒。
23.在本发明的一些优选实施方式中,所述铜纳米颗粒的制备方法为:
24.在3
‑
(n
‑
吗啉代)丙烷磺酸缓冲液(mops,含nacl)中加入cuso4溶液,混匀后再加入抗坏血酸溶液(aa),室温避光静置反应5min,即得铜纳米颗粒溶液。
25.当然,也可以采用其他本领域常规方法制备铜纳米颗粒。
26.本发明实施例中制备得到的铜纳米颗粒最大激发波长为345nm,最大发射波长为627nm,cunp呈尺寸均匀的球形颗粒,直径约为5nm。
27.铜纳米颗粒(cunps)具有强烈的荧光,可由铜离子(cu
2+
)以聚胸腺嘧啶单链dna(poly t)为模板,以抗坏血酸(aa)为还原剂反应制得。由于5hmc位点上poly t的存在,可以将多个具有强荧光的cunps修饰到5hmc位点,从而实现低样品量下5hmc的高灵敏检测。
28.本发明的第四个方面,提供一种定性检测基因组中5hmc含量的方法,包括如下步骤:
29.(1)取待测基因组dna,加入ddttp和tdt封端,孵育;
30.(2)加热灭活tdt,加入udp
‑6‑
n3
‑
glu和t4
‑
βgt,孵育;
31.(3)加入dttp和tdt,孵育,以获得poly t延伸;
32.(4)加入本发明第一个方面所述的探针,电泳检测条带情况。
33.根据本发明的第四个方面,在本发明的一些实施方式中,步骤(1)中,每1μg待测基因组dna中加入0.5~1nmol的ddttp和10~20u的tdt。
34.根据本发明的第四个方面,在本发明的一些实施方式中,步骤(2)中,所述udp
‑6‑
n3‑
glu的终浓度为0.2~0.5mm,所述t4
‑
βgt的终浓度为1~2u/μl。
35.根据本发明的第四个方面,在本发明的一些实施方式中,步骤(4)中,所述探针的终浓度为20~50μm,所述铜纳米颗粒的终浓度为300~500μm。
36.本发明的第五个方面,提供一种定量检测基因组中5hmc含量的方法,包括如下步骤:
37.(1)取待测基因组dna,加入ddttp和tdt封端,孵育;
38.(2)加热灭活tdt,加入udp
‑6‑
n3
‑
glu和t4
‑
βgt,孵育;
39.(3)加入dttp和tdt,孵育,以获得poly t延伸;
40.(4)加入本发明第一个方面所述的探针和铜纳米颗粒,检测荧光强度,带入标准曲线方程计算5hmc含量。
41.根据本发明的第五个方面,在本发明的一些实施方式中,步骤(1)中,每1μg待测基因组dna中加入0.5~1nmol的ddttp和10~20u的tdt。
42.根据本发明的第五个方面,在本发明的一些实施方式中,步骤(2)中,所述udp
‑6‑
n3‑
glu的终浓度为0.2~0.5mm,所述t4
‑
βgt的终浓度为1~2u/μl。
43.根据本发明的第五个方面,在本发明的一些实施方式中,步骤(3)中,孵育时间为30~150min;以溶液中的primer
‑
5hmc的浓度为基准,所述dttp的浓度为primer
‑
5hmc浓度的500~5000倍。
44.根据本发明的第五个方面,在本发明的一些实施方式中,步骤(4)中,所述探针的终浓度为20~50μm,所述铜纳米颗粒的终浓度为300~500μm。
45.在本发明的一些优选实施方式中,所述定量检测基因组中5hmc含量的方法具体为:
46.采用本领域常规方法(可以使用商用dna提取试剂盒或其他常规dna提取手段)从待测样品中提取基因组dna,加入ddttp、tdt和tdt缓冲液,37℃孵育4h,加热至70℃保持30min以灭活tdt,过柱纯化以去除过量的ddttp。取纯化后的产物,加入udp
‑6‑
n3‑
glu、t4
‑
βgt和neb buffer 4溶液,37℃下孵育24h,过柱纯化,除去过量的udp
‑6‑
n3‑
glu和t4
‑
βgt。加入tdt buffer、tdt和dttp,在37℃条件下孵育2h,然后升温至70℃,孵育30min,以获得poly t延伸。加入连接有dbco的探针和pbs缓冲液,37℃反应24h。过柱纯化,除去过量的探针,加入3
‑
(n
‑
吗啉代)丙烷磺酸缓冲液(mops,含nacl)和cuso4溶液,再加入抗坏血酸溶液(aa),得到铜纳米颗粒,使用荧光分光光度计读取荧光光谱。同时,以标准品构建标准曲线,根据标准曲线方程计算基因组中的5hmc百分含量。
47.本发明的第五个方面,提供本发明第一个方面所述探针、本发明第二个方面所述5hmc检测试剂或本发明第三个方面所述的5hmc检测试剂盒在检测5hmc中的应用。
48.本发明中的探针、检测试剂或5hmc检测试剂盒均基于同一套检测原理制备得到。本发明利用polyt稳定荧光铜纳米颗粒检测5hmc,并解决了tdt的非特异性延伸,使用ddttp封闭了样品上的3
’–
oh基团,使5hmc上所修饰引物的3
’–
oh基团为唯一的3
’–
oh,从而确保了检测的特异性。而其通过polyt与荧光铜纳米颗粒的结合,提高了检出限,脱离了传统信号
放大技术的局限性,将信号放大效率进行了很有效的提高,使样品量可以达到5ng,远胜于当前主流方法的几百纳克的样品量,且无需大型仪器和磁珠富集,可适用于所有核酸的检测,采用小型的荧光分光光度计即可满足测试需要。
49.本发明的有益效果是:
50.1.本发明中的探针、检测试剂或检测试剂盒特异性强,均利用polyt稳定荧光铜纳米颗粒检测5hmc,不会产生tdt的非特异性延伸,提高了检出限,脱离了传统信号放大技术的局限性,将信号放大效率进行了很有效的提高,使样品量可以达到5ng,且无需大型仪器和磁珠富集,可适用于所有核酸的检测。
51.2.本发明中的检测方法无需大型仪器,操作简单,灵敏度高,不局限于单个荧光小分子修饰,而是将大量荧光信号的分子修饰在一个5hmc位点上,实现高效5hmc信号的放大,提高荧光检测灵敏度,进而降低所需样品量。
附图说明
52.图1为本发明实施例中的铜纳米颗粒的荧光光谱;
53.图2为本发明实施例中的铜纳米颗粒的透射电子显微镜表征图像;
54.图3为本发明实施例中的各组检测样品的电泳对比图;
55.图4为本发明实施例中的样品在不同孵育时间下的电泳对比图;
56.图5为本发明实施例中的样品在不同dttp浓度下的电泳对比图;
57.图6为本发明实施例中的不同5hmc浓度样品的荧光光谱;
58.图7为本发明实施例中的5hmc样品标准曲线;
59.图8为本发明实施例中的5hmc检测方法的特异性实验结果;
60.图9为本发明实施例中的成年小鼠脑组织dna中5hmc检测标准曲线;
61.图10为本发明实施例中的不同生物样品5hmc含量检测结果对比图。
具体实施方式
62.为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
63.所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
64.实验材料
65.(1)模型链ssdna的制备:
66.下述实施例中所使用的模型链ssdna的核苷酸序列为:
[0067]5’‑
gagaccggagtccgctttcctcttccggaaaatgtaagccgaacctaaagcaat caccaggg
‑3’
(seq id no.1)。
[0068]
其中,上述模型链ssdna的第26位碱基c(加粗且标有下划线)可以根据检测情况为c、5mc、5hmc、5fc或5cac中的一种。
[0069]
探针的核苷酸序列为:5
’‑
ccggagtccgctttcctctt
‑3’
(seq id no.2)。
[0070]
其中,上述探针5’端连接有点击化学试剂,点击化学试剂主要用于应变促进的炔
叠氮化物环加成。在下述实施例中,上述探针5’端连接的点击化学试剂为二苯并环辛炔(dbco,dibenzocyclooctyne)。
[0071]
(2)铜纳米颗粒(cunps)的制备:
[0072]
在10μl的50mm 3
‑
(n
‑
吗啉代)丙烷磺酸缓冲液(mops,ph=7.6,含750mm nacl)中加入2μl的10mm cuso4溶液,混匀后再加入10μl的10mm抗坏血酸溶液(aa),加水补足50μl,此时各组分最终浓度分别为10mm mops、150mm nacl、0.4mm cuso4和2mm aa。室温避光静置反应5min,即得铜纳米颗粒溶液。
[0073]
使用荧光分光光度计读取混合液的荧光光谱,若荧光光谱表明其最大激发波长为345nm,最大发射波长为627nm(如图1),则说明混合液中含有铜纳米颗粒。
[0074]
为了进一步验证是否成功制得cunp,将上述实施例中的混合液滴加在碳膜铜网表面,在空气中自然干燥后用二次水(记经过二次蒸馏的水)清洗数次,以除掉溶液中的杂质(大量的盐)。其中,清洗过程具体为:将二次水滴在碳膜铜网表面,再用滤纸从边缘小心吸走。真空干燥,使用透射电子显微镜(tem)进行观测。
[0075]
结果如图2所示。
[0076]
可以发现,通过tem表征,制备得到的cunp呈尺寸均匀的球形颗粒,直径约为5nm。
[0077]
5hmc的化学修饰
[0078]
(1)样品封端:
[0079]
在模型链ssdna(小于或等于1μg)中加入1nmol的双脱氧胸苷三磷酸(ddttp)、10u的末端脱氧核苷酸转移酶(末端转移酶,terminal deoxyribonucleotidyl transferase,tdt)和1
×
tdt缓冲液(购自碧云天),在37℃孵育4h。孵育结束后,加热至70℃保持30min,以灭活tdt,终止反应。所得产物用核酸柱(生工uniq
‑
10寡聚核苷酸纯化试剂盒)纯化,以除去过量的ddttp。
[0080]
(2)5hmc位点修饰:
[0081]
取1μg的步骤(1)得到的已封端的模型链ssdna,构建如表1所示体系,37℃下孵育24h。
[0082]
表1 5hmc位点修饰反应体系
[0083]
组分含量步骤(1)得到的已封端的模型链ssdna1μg200nm udp
‑6‑
n3‑
glu8μl10u t4β
‑
葡糖基转移酶(t4
‑
βgt)0.5μl1
×
neb buffer 4溶液8μl总体积50μl
[0084]
其中,neb buffer 4溶液(购自neb)中含有50mm乙酸钾、20mm三羟甲基氨基甲烷(tris)
‑
乙酸混合液、10mm乙酸镁、1mm二硫苏糖醇,neb buffer 4溶液ph为7.9。
[0085]
udp
‑6‑
n3‑
glu为尿苷5'
‑
(三氢二磷酸酯)p'
‑
(6
‑
叠氮基
‑6‑
脱氧
‑
alpha
‑
d
‑
吡喃葡萄糖基)酯(udp
‑6‑
azido
‑6‑
deoxy
‑
d
‑
glucose,cas:537039
‑
67
‑
1)。
[0086]
孵育结束后,所得产物用核酸柱(生工uniq
‑
10寡聚核苷酸纯化试剂盒)纯化,以除去多余的udp
‑6‑
n3‑
glu和t4β
‑
葡糖基转移酶。在得到的纯化产物中加入40μm的探针(连接有dbco),和1
×
pbs缓冲液,37℃反应24h。所得产物用核酸柱(zymo research,dna clean&
concentrator
‑
5试剂盒)纯化,以除去过量的探针。
[0087]
纯化后的产物用凝胶回收试剂盒回收纯化。若将模型链ssdna替换为基因组样品,则使用dna纯化柱纯化,即可得到修饰后的5hmc(primer
‑
5hmc)。
[0088]
primer
‑
5hmc的表征及反应特异性验证
[0089]
(1)primer
‑
5hmc的表征:
[0090]
模型链或基因组中的5hmc经过“click”反应修饰探针后,空间位阻大大增加,因此,可以利用聚丙烯酰胺凝胶电泳(page)进行表征来鉴别引物是否修饰成功。
[0091]
使用凝胶电泳对上述实施例中得到的primer
‑
5hmc进行表征的具体操作为:
[0092]
取上述实施例中得到的primer
‑
5hmc进行聚丙烯酰氨凝胶电泳,实验使用15%聚丙烯酰胺凝胶电泳,工作电压为80v,运行时间为90min。电泳完成后进行染色,使用凝胶成像系统进行拍照。
[0093]
(2)primer
‑
5hmc的反应特异性:
[0094]
在实际样品检测中,由于样品中所含成分复杂以及碱基结构的相似性,dna的其他甲基化形式,如5mc,5fc,5cac经常会对5hmc的检测造成一定的干扰,为了验证上述实施例中的检测方法是否能够有效的克服这种干扰,发明人将模型链中的5hmc碱基分别替换为c、5mc、5fc和5cac,以验证该方法的特异性。
[0095]
其中,样品处理方式、化学修饰方法及检测条件均采用上述实施例中的方法。
[0096]
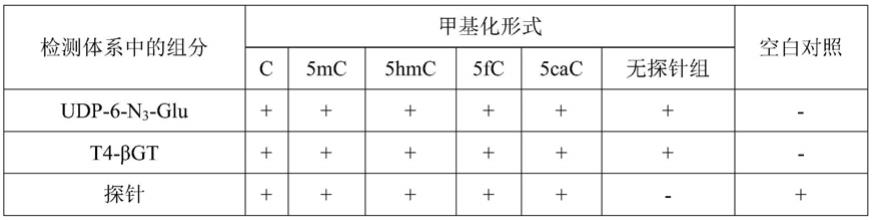
各组具体检测条件如表2所示。
[0097]
表2各组检测样品的设置
[0098][0099]
其中,+表示含有该组分,
‑
表示未添加该组分。
[0100]
采用本实施例步骤(1)中的凝胶电泳操作对各组进行检测,结果如图3所示。
[0101]
从图3中,可以发现,经过电泳之后,只有使用探针修饰过的5hmc出现了新的产物,其他不含5hmc或未修饰探针的模型链没有任何新的条带出现,说明使用上述实施例中的探针修饰后的5hmc具有极好的特异性,且修饰率高,可以排除其他碱基的干扰。
[0102]
poly t的获得
[0103]
取5ng上述实施例中的primer
‑
5hmc,加入2μl末端脱氧核苷酰转移酶缓冲液(5
×
tdt buffer)、2u末端脱氧核苷酰转移酶(tdt)和1μl的1mm脱氧胸苷三磷酸(dttp),加水补足10μl,在37℃条件下孵育2h,然后升温至70℃,孵育30min。
[0104]
其中,发明人分别验证了孵育时间(测试的孵育时间包括0、30、60、90、120和150min)和dttp浓度(测试的dttp浓度包括:以1μm primer
‑
5hmc的浓度为基准,dttp浓度分别为其0倍、500倍、1000倍、2000倍和5000倍)对primer
‑
5hmc获得poly t的影响。
[0105]
以无tdt酶且无dttp的1μm primer
‑
5hmc作为对照。
[0106]
结果如图4和5所示。
[0107]
可以发现,通过对比不同孵育时间后电泳图,孵育时间为2h(120min)时以及dttp浓度为primer
‑
5hmc的浓度的2000倍时,primer
‑
5hmc上的poly t延伸情况最好,在泳道起始位置较亮,说明poly t已经完全形成,长度远超500个碱基。
[0108]
5hmc检测可行性验证实验
[0109]
以上述实施例中制备得到的形成poly t的primer
‑
5hmc作为试验对象,验证其在定量检测5hmc的可行性。
[0110]
具体检测步骤为:
[0111]
将模型链ssdna和基于该模型链制备得到的带有poly t的primer
‑
5hmc以不同比例混合,得到一系列不同5hmc百分含量的混合溶液(5hmc占所有碱基的质量百分含量分别为0%、0.097%、0.16%、0.32%、0.48%、0.64%、0.81%)。以模型链ssdna作为稀释液的意义在于其可以起到稀释5hmc质量百分含量的作用,而其他可用的稀释液,如水等,仅能稀释5hmc摩尔浓度。而5hmc的摩尔浓度在实际检测中并没有实质意义,检测其在总碱基中的质量百分含量才有意义。
[0112]
加入铜纳米颗粒后,使用荧光分光光度计读取混合溶液的荧光光谱,并绘制标准曲线。
[0113]
结果如图6和7所示。
[0114]
从图6中可以发现,不同primer
‑
5hmc模型链百分比下所得溶液荧光强度与5hmc百分含量成正相关关系,含量越高,荧光强度越强。而根据其荧光强度数据,绘制成标准曲线后,可以发现其标准曲线方程为:
[0115]
i=308.6m
5hmc
+69.7;
[0116]
其中,i表示荧光强度,m
5hmc
为模型链中的5hmc百分含量(占样品所有碱基的质量分数),r2=0.995。
[0117]
标准曲线方程的线性范围为0.097~0.81%,检出限为0.064%,可以满足绝大部分实际样品的检测要求,具备应用于实际样品的检测能力。
[0118]
5hmc检测特异性验证实验
[0119]
以上述实施例中制备得到的形成poly t的primer
‑
5hmc作为试验对象,进一步检测其对于5hmc检测的特异性。
[0120]
以仅含有c、5mc、5hmc、5fc和5cac的模型链为基础,根据上述实施例中的方法处理(化学修饰和poly t获得),加入铜纳米颗粒后,使用荧光分光光度计读取荧光光谱。
[0121]
结果如图8所示。
[0122]
在5组试验组中,仅含有的模型链有较强荧光,且与其他4组的荧光轻度存在显著差异性,因此,可以说明上述实施例中的制备得到的形成poly t的primer
‑
5hmc能够用于5hmc的检测,且检测5hmc的特异性良好,可以进一步用于实际样品检测。
[0123]
5hmc检测准确性验证实验
[0124]
以上述实施例中制备得到的形成poly t的primer
‑
5hmc作为试验对象,进一步检测其对于5hmc检测的准确性。
[0125]
在本实施例中,通过使用标准加入法计算回收率来确定上述5hmc检测方法的准确性,具体检测步骤为:
[0126]
以已知含有确定浓度(质量分数为0.081%)5hmc的样品为检测对象,分别加入质
量分数为0.048%、0.144%和0.338%的5hmc标准品,启动3
’‑
oh封端,使用探针对5hmc进行化学修饰,加入tdt对primer
‑
5hmc进行poly t延长以及加入cunps进行信号放大,测试荧光,根据标准曲线计算回收率和相对标准偏差(rsd)。
[0127]
其中,每组实验样品平行测定三次,测定结果如表3所示。
[0128]
表3各组试验样品的回收率和相对标准偏差(n=3)
[0129][0130][0131]
由表3可以发现,三组实验的平均回收率在96.1%~105.0%之间,rsd值在3.0%~9.1%之间,其中,回收率超出100%可能是由于背景信号的波动导致,但该误差属于可接受的范围,因此,该实验能够充分说明上述实施例中的检测方法具有良好的准确性和重复性。
[0132]
5hmc检测的实际应用效果
[0133]
在本实施例中,以成年小鼠脑组织作为检测样品测试上述实施例中的检测方法在实际应用中的效果。成年小鼠脑组织含有极为大量的5hmc,因此,极适合作为检测5hmc的样品使用。
[0134]
具体检测方法为:
[0135]
采用本领域常规方法(可以使用商用dna提取试剂盒或其他常规dna提取手段)从成年小鼠脑组织提取基因组dna,使用lc
‑
ms/ms确定其含有的5hmc含量,然后使用上述实施例中的检测方法检测不同稀释度下的基因组dna中的5hmc含量,构建标准曲线。
[0136]
上述实施例中的检测方法具体为:
[0137]
随机取其中5ng基因组dna,加入ddttp、tdt和tdt缓冲液,37℃孵育4h,加热至70℃保持30min灭活tdt,过柱纯化以去除过量的ddttp。取纯化后的产物,加入udp
‑6‑
n3‑
glu、t4
‑
βgt和neb buffer 4溶液,37℃下孵育24h,过柱纯化以除去过量的udp
‑6‑
n3‑
glu和t4
‑
βgt,加入tdt buffer、tdt和dttp,在37℃条件下孵育2h,然后升温至70℃,孵育30min,以获得poly t延伸,然后再加入连接有dbco的探针和pbs缓冲液,37℃反应24h,过柱纯化除去过量的探针。加入铜纳米颗粒,使用荧光分光光度计读取荧光光谱。
[0138]
标准曲线图如图9所示。
[0139]
可以发现构建得到的标准曲线方程为:
[0140]
i=336.3m
5hmc
+88.1;
[0141]
其中,i表示荧光强度,m
5hmc
为基因组中的5hmc百分含量(质量分数),r2=0.992。
[0142]
线性范围为0.0435%~0.435%,检出限为0.0358%。
[0143]
基于5hmc在生物体的不同发育阶段和不同器官中差异很大,为了验证上述实施例中的检测方法对于生物样品检测具有普适性,选择三种基因组dna(分别提取自成年小鼠海马体(ahc)、成年小鼠肾组织(ak)和新生小鼠脑组织(nb))作为样品进行检测,并与标准方法lc
‑
ms/ms比较。
[0144]
结果如图10所示。
[0145]
检测发现,使用上述实施例中的检测方法测得成年小鼠海马体(ahc)、成年小鼠肾组织(ak)和新生小鼠脑组织(nb)基因组dna中的5hmc质量百分含量分别占基因组dna的0.274%,0.093%和0.107%。对比使用lc
‑
ms/ms方法测得的结果接近,并未产生显著差异性,说明上述实施例中的检测方法能够替代lc
‑
ms/ms方法,对于不同来源的生物样品的检测均具有普适性和准确性。
[0146]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1