修饰核苷单体、包含修饰核苷酸的siRNA、药物组合物和缀合物的制作方法
修饰核苷单体、包含修饰核苷酸的sirna、药物组合物和缀合物
技术领域
1.本公开涉及一种修饰核苷单体、以及由该核苷单体制备得到的包含修饰核苷酸的sirna、药物组合物与sirna缀合物。本公开还涉及该修饰核苷、sirna、药物组合物和sirna缀合物的制备方法和用途。
背景技术:
2.sirna作为药物活性成分已为公众所知。近年来,在sirna成药方面取得了相当程度的进展。本领域技术人员公知的是,目前sirna的制备方法主要是通过由不同的核苷单体按照亚磷酰胺固相合成法逐一连接来进行。其中,核苷亚磷酰胺单体作为该合成方法的重要反应原料,与所制备的sirna的结构和性能直接相关,具有非常重要的作用。为了提高所制备的sirna的活性、体内稳定性和药代动力学性能,本领域技术人员经常会选择对sirna中特定的核苷酸进行化学修饰,为此,实现该化学修饰的通常手段是,在sirna制备方法的相应步骤中使用修饰的核苷亚磷酰胺单体。然而,sirna药物的开发中的另一问题是sirna本身的安全性,即如何尽量降低sirna的毒性。而对于如何获得同时具有良好的药学活性和低毒性的sirna,以及如何获得能够使得所制备的sirna毒性降低的修饰的核苷亚磷酰胺单体,本领域中仍需要进一步深入探索,并且在实际研发中仍然存在相关未解决的需求。
技术实现要素:
3.本公开的发明人意外发现,对核苷单体的核糖5’位以及核糖碱基进行修饰,获得修饰的核苷单体可用于sirna的制备。由该修饰的核苷单体制备得到的包含修饰的核苷酸的sirna、药物组合物与sirna缀合物生物利用度高,具有较好的目标基因表达的mrna的抑制活性,并具有较低的毒性。
4.在一方面,本公开提供了一种化合物,所述化合物具有如式(1)所示的结构。
[0005][0006]
其中:
[0007]
每个j1独立地为c1-c6烷基或取代的c1-c6烷基;
[0008]e101
为o或s;
[0009]r203
为具有式(2)所示结构的亚磷酰胺官能团:
[0010][0011]
其中,每个b1独立地选自取代或未取代的c1-c5烃基;b2选自c1-c5的烷基、氰乙基、氰丙基和氰丁基中的一种;
[0012]
d0为式(d1)-(d4)表示的二价连接基团中的一种:
[0013][0014]
p1和p2各自独立地为h、卤素、c1-c6烷基、取代的c1-c6烷基、c1-c6烷氧基、取代的c1-c6烷氧基、c2-c6烯基或取代的c2-c6烯基;
[0015]
p3为o或s;
[0016]
bm为苯基或取代苯基,所述取代苯基是指苯基上的至少一个氢原子被取代基取代而形成的基团,每个所述取代基独立地选自f、cl、ch3、ch2f或cf3;
[0017]
z0为h、经保护的羟基、och3、f或och2ch2och3;
[0018]
表示基团共价连接的位点。
[0019]
在另一方面,本公开提供了一种sirna,所述sirna包含正义链和反义链,所述正义链和反义链包含14-30个修饰或未修饰的核苷酸,正义链和反义链的一部分反向互补形成双链区,其中,在所述反义链的5
’‑
末端核苷酸具有式(5)所示的结构:
[0020][0021]
其中:
[0022]r201
和r
202
各自独立地为oh或oj1,j1为c1-c6烷基或取代的c1-c6烷基;
[0023]
每个e
101
各自独立地为o或s;
[0024]
d0为具有下式(d1)-(d4)所示结构表示的二价连接基团之一的基团:
[0025][0026][0027]
p1和p2各自独立地为h、卤素、c1-c6烷基、取代的c1-c6烷基、c1-c6烷氧基、取代的c1-c6烷氧基、c2-c6烯基或取代的c2-c6烯基;
[0028]
bm为苯基或取代苯基,所述取代苯基是指苯基上的至少一个氢原子被取代基取代而形成的基团,每个所述取代基独立地选自f、cl、ch3、ch2f或cf3;
[0029]
z为h、oh、och3、f或och2ch2och3;
[0030]
表示基团共价连接的位点;
[0031]
所述反义链与目标基因表达的mrna中的一段长度与所述反义链相同的核苷酸序列基本上反向互补或实质上反向互补。
[0032]
在又一方面,本公开还提供了一种药物组合物,该药物组合物含有本公开的sirna以及药学上可接受的载体。
[0033]
在又一方面,本公开提供还提供一种sirna缀合物,所述sirna缀合物含有本公开的sirna以及缀合连接至该sirna的缀合基团,所述缀合基团包含接头和药学上可接受的靶向基团和/或递送辅助基团,并且,所述sirna、所述接头和所述靶向基团或者所述递送辅助基团依次共价或非共价连接,每个所述靶向基团选自能够和细胞表面受体结合的配体,每
个递送辅助基团选自能够增加所述sirna缀合物在递送目标器官或组织中的生物相容性的基团。
[0034]
在又一方面,本公开还提供了本公开的sirna、药物组合物和/或sirna缀合物在制备用于治疗和/或预防与目标基因表达的mrna水平相关的疾病或症状的药物中的用途。
[0035]
在又一方面,本公开还提供了一种治疗和/或预防与目标基因表达的mrna水平相关的疾病或症状的方法,所述方法包括向有需要的受试者给予本公开的sirna、药物组合物和/或sirna缀合物。
[0036]
在又一方面,本公开还提供了一种抑制细胞中目标基因表达水平的方法,所述方法包括将有效量的本公开的sirna、药物组合物和/或sirna缀合物与所述细胞接触。
[0037]
此外,本公开还提供了一种试剂盒,所述试剂盒包含本公开的sirna、药物组合物和/或sirna缀合物。
[0038]
以引用的方式并入
[0039]
本说明书中提及的所有出版物、专利以及专利申请均以引用的方式并入本文,其程度与每一单独的出版物、专利或专利申请均专门并且单独地以引用的方式并入本文的程度相同。
[0040]
有益效果
[0041]
由本公开的修饰核苷单体制备获得的、包含修饰的核苷酸的sirna、药物组合物和/或sirna缀合物在保持良好的稳定性,较好的目标基因表达调节活性的同时,显示出明显较低的毒性。具体说明如下:
[0042]
第一,本公开提供的sirna、药物组合物和/或sirna缀合物在体内表现出较低的毒性反应。例如,本公开提供的sirna缀合物在每只大鼠皮下单次30mg/kg的给药剂量下,连续观察14天,对大体进行解剖,在光学显微镜下观察肝脏组织病理学切片,发现给予本公开的缀合物的大鼠的肝脏组织肝索结构清晰,肝细胞排列紧密,界限清晰,胞质丰富,着色均匀,胞核圆形,大小正常,静脉内皮完整正常,组织未见明显异常,而给予参比缀合物的大鼠的肝细胞广泛水肿变性,细胞肿胀,胞质疏松淡染,大量肝细胞还伴有脂肪变性,胞质内可见数量不等的圆形空泡,小叶内可见多处炎性细胞灶性浸润。表明与参比sirna缀合物相比,本公开的包含特定修饰的核苷酸的sirna缀合物的肝毒性显著降低。
[0043]
第二,本公开提供的sirna、药物组合物和/或sirna缀合物在体外细胞实验中显示出优异的目标基因表达调节活性。例如,在10nm的sirna浓度下,本公开提供的sirna缀合物在hbv转基因小鼠肝原代细胞中显示出96.71%-97.25%的优异的靶mrna表达量抑制率。
[0044]
此外,本公开提供的sirna、药物组合物和/或sirna缀合物可在体内还具有更高的稳定性和/或更高的活性。例如,即使在0.1mg/kg的较低给药剂量下,本公开提供的sirna缀合物在hbv转基因小鼠中仍表现出74.5%-77.2%的高hbv mrna抑制率。
[0045]
由此说明,由本公开提供的修饰核苷单体制备得到的sirna、药物组合物和/或sirna缀合物能够在体内外有效抑制目标基因的表达,因此可在具有显著更高的安全性的同时,有效治疗和/或预防由目标基因表达的mrna水平相关的疾病症状,具有良好的应用前景。
具体实施方式
[0046]
以下对本公开的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本公开,并不用于限制本公开。
[0047]
在上文及下文中,除非提供特定的含义,否则关于本文所描述的分析化学、合成有机化学和医药化学所用的命名及其程序和技术是本领域中熟知和常用的那些。标准计算可用于化学合成和化学分析。
[0048]
定义
[0049]
在上文及下文中,如无特别说明,大写字母c、g、u、t、a表示核苷酸的碱基组成;小写字母m表示该字母m左侧相邻的一个核苷酸为甲氧基修饰的核苷酸;小写字母f表示该字母f左侧相邻的一个核苷酸为氟代修饰的核苷酸;小写字母s表示与该字母s左右相邻的两个核苷酸之间为硫代磷酸酯基连接。
[0050]
在上文及下文中,所述“氟代修饰的核苷酸”指核苷酸的核糖基2'位的羟基被氟取代形成的核苷酸,“非氟代修饰的核苷酸”指核苷酸的核糖基2'位的羟基被非氟基团取代形成的核苷酸或核苷酸类似物。“核苷酸类似物”指能够在核酸中代替核苷酸,但结构不同于腺嘌呤核糖核苷酸、鸟嘌呤核糖核苷酸、胞嘧啶核糖核苷酸、尿嘧啶核糖核苷酸或胸腺嘧啶脱氧核糖核苷酸的基团。如异核苷酸、桥联的核苷酸(bridged nucleic acid,简称bna)或无环核苷酸。所述“甲氧基修饰的核苷酸”指核糖基的2'-羟基被甲氧基取代而形成的核苷酸。
[0051]
在本文的上下文中,表述“互补”或“反向互补”可互相替代使用,并具有本领域技术人员周知的含义,即,在双链核酸分子中,一条链的碱基各自与另一条链上的碱基以互补的方式相配对。在dna中,嘌呤碱基腺嘌呤(a)始终与嘧啶碱基胸腺嘧啶(t)(或者在rna中为尿嘧啶(u))相配对;嘌呤碱基鸟嘌呤(c)始终与嘧啶碱基胞嘧啶(g)相配对。每个碱基对都包括一个嘌呤和一个嘧啶。当一条链上的腺嘌呤始终与另一条链上的胸腺嘧啶(或尿嘧啶)配对,以及鸟嘌呤始终与胞嘧啶配对时,两条链被认为是彼此相互补的,以及从其互补链的序列中可以推断出该链的序列。与此相应地,“错配”在本领域中意指在双链核酸中,对应位置上的碱基并未以互补的形式配对存在。
[0052]
在上文及下文中,如无特别说明,“基本上反向互补”是指所涉及的两段核苷酸序列之间存在不多于3个的碱基错配;“实质上反向互补”是指两段核苷酸序列之间存在不多于1个的碱基错配;“完全反向互补”是指两段核苷酸序列之间不存在碱基错配。
[0053]
在上文及下文中,特别是在描述本公开的sirna、药物组合物或sirna缀合物的制备方法时,除非特别说明,所述核苷单体(nucleoside monomer)是指,根据欲制备的sirna或sirna缀合物中核苷酸的种类和顺序,亚磷酰胺固相合成中使用的修饰或未修饰的核苷亚磷酰胺单体(unmodified or modified rna phosphoramidites,有时rna phosphoramidites也称为nucleoside phosphoramidites)。亚磷酰胺固相合成为本领域技术人员所公知的目前rna合成领域中主要使用的方法。除非另有提及,除本公开提供的特定修饰核苷单体之外,本公开所用的其它核苷单体均可商购得到。
[0054]
在上文或下文中,如无其他说明,“取代的”基团是指该基团中的氢原子被一个或多个取代基所替代而形成的基团。例如,“取代的c1-c5烃基”是指c1-c5烃基中的一个或多个氢原子被取代基所替代而形成的基团。本领域技术人员能够理解,可用于本公开应用的
化合物中可以包含各种取代基,只要是该取代基的引入不会影响本公开的功能,能够实现本公开的目的,就可用于本公开。在一些实施方式中,所述取代基选自于由以下基团所组成的组:c
1-c
10
烷基、c
6-c
10
芳基、c
5-c
10
杂芳基、c
1-c
10
卤代烷基、-oc
1-c
10
烷基、-oc
1-c
10
烷基苯基、-c
1-c
10
烷基-oh、-oc
1-c
10
卤代烷基、-sc
1-c
10
烷基、-sc
1-c
10
烷基苯基、-c
1-c
10
烷基-sh、-sc
1-c
10
卤代烷基、卤素取代基、-oh、-sh、-nh2、-c
1-c
10
烷基-nh2、-n(c
1-c
10
烷基)(c
1-c
10
烷基)、-nh(c
1-c
10
烷基)、-n(c
1-c
10
烷基)(c
1-c
10
烷基苯基)、-nh(c
1-c
10
烷基苯基)、氰基、硝基、-co2h、-c(o)o(c
1-c
10
烷基)、-con(c
1-c
10
烷基)(c
1-c
10
烷基)、-conh(c
1-c
10
烷基)、-conh2,-nhc(o)(c
1-c
10
烷基)、-nhc(o)(苯基)、-n(c
1-c
10
烷基)c(o)(c
1-c
10
烷基)、-n(c
1-c
10
烷基)c(o)(苯基)、-c(o)c
1-c
10
烷基、-c(o)c
1-c
10
烷基苯基、-c(o)c
1-c
10
卤代烷基、-oc(o)c
1-c
10
烷基、-so2(c
1-c
10
烷基)、-so2(苯基)、-so2(c
1-c
10
卤代烷基)、-so2nh2、-so2nh(c
1-c
10
烷基)、-so2nh(苯基)、-nhso2(c
1-c
10
烷基)、-nhso2(苯基)和-nhso2(c
1-c
10
卤代烷基)。在一些实施方式中,所述取代基是c
1-c3烷基、c
6-c8芳基、-oc
1-c3烷基、-oc
1-c3烷基苯基、卤素取代基、氰基或硝基中的一种。本领域技术人员将理解的是,对于包含一个或多个取代基的任何基团,这些基团不打算引入空间上不切实际、合成上不可行和/或本身不稳定的任何取代或取代模式。
[0055]
如本文所使用的,“卤素”是指f、cl、br或i。
[0056]
如本文所使用的,“烃基”是指相应烃失去一个氢原子后形成的基团。例如,c4烃基是指含有4个碳原子的烃失去一个氢原子后形成的基团。
[0057]
如本文所使用的,“烷基”是指具有指定数量的碳原子的直链和支链饱和烃基,通常为1至20个碳原子,例如1至10个碳原子,如1至8个或1至3个碳原子。例如,c1-c5烷基包含1至5个碳原子的直链和支链烷基。当提及具有特定数量的烷基的残基时,旨在涵盖具有该数量的碳的所有支链和直链形式;因此,例如,“丁基”意味着包括正丁基、仲丁基、异丁基和叔丁基;“丙基”包括正丙基和异丙基。亚烷基是烷基的子集,指与烷基相同,但具有两个连接点的残基。
[0058]
如本文所使用的,“烯基”是指具有至少一个碳-碳双键的不饱和支链或直链烷基,所述碳-碳双键是通过从母体烷基的相邻碳原子中除去一个氢分子而获得的。该基团可以处于双键的顺式或反式构型。典型的烯基基团包括但不限于:乙烯基;丙烯基,如丙-1-烯-1-基、丙-1-烯-2-基、丙-2-烯-1-基(烯丙基)、丙-2-烯-2-基;丁烯基,例如丁-1-烯-1-基、丁-1-烯-2-基、2-甲基丙-1-烯-1-基、丁-2-烯-1-基、丁-2-烯-2-基、丁-1,3-二烯-1-基、丁-1,3-二烯-2-基等等。在某些实施方式中,烯基基团具有2到20个碳原子,而在其他实施方式中,具有2至10个、2至8个或2至6个碳原子。亚烯基是烯基的一个子集,指与烯基相同、但具有两个附着点的残基。
[0059]
如本文所使用的,“炔基”是指具有至少一个碳-碳三键的不饱和支链或直链烷基,所述碳-碳三键是通过从母体烷基的相邻碳原子中除去两个氢分子而获得的。典型的炔基基团包括但不限于:乙炔基;丙炔基,如丙-1-炔-1-基,丙-2-炔-1-基;丁炔基,例如丁-1-炔-1-基,丁-1-炔-3-基,丁-3-炔-1-基等。在某些实施方式中,炔基具有2到20个碳原子,而在其他实施方式中,具有2至10、2至8或2至6个碳原子。亚炔基是炔基的一个子集,指的是与炔基相同、但有两个附着点的残基。
[0060]
如本文所使用的,“烷氧基”是指通过氧桥附着的指定数量碳原子的烷基,例如,甲
氧基、乙氧基、丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、戊氧基、2-戊氧基、异戊氧基、新戊氧基、己氧基、2-己氧基、3-己氧基、3-甲基戊氧基等。烷氧基通常具有1至10个、1至8个、1至6个,或1至4个通过氧桥附着的碳原子。
[0061]
如本文所使用的,“芳基”是指通过从环碳原子上去除氢原子而衍生自芳香族单环或多环烃环系统的基团。所述芳香族单环或多环烃环系统仅含有氢和6至18个碳原子的碳,其中所述环系统中的至少一个环是完全不饱和的,即,其包含根据h
ü
ckel理论的环状、离域的(4n+2)π-电子体系。芳基包括但不限于诸如苯基、芴基和萘基的基团。
[0062]“杂芳基”指由3至18元芳香环自由基衍生的基团,其包含2个至17个碳原子和选自氮、氧和硫的1至6个杂原子。如本文所使用的,杂芳基可以是单环、双环、三环或四环系统,其中环系统中的至少一个环是完全不饱和的,即,其包含根据h
ü
ckel理论的环状离域(4n+2)π-电子体系。杂芳基包括稠环或桥环系统。或者,杂芳基中的杂原子是被氧化的杂原子。或者,一个或多个氮原子(如果存在的话)被季铵化。杂芳基通过任何环原子连接至分子的其余部分。杂芳基的实例包括但不限于:氮杂环庚三烯基、吖啶基、苯并咪唑基、苯并吲哚基、1,3-苯并二噁唑基、苯并呋喃基、苯并噁唑基、苯并[d]噻唑基、苯并噻二唑基、苯并[b][1,4]二噁庚英基(benzo[b][1,4]dioxepinyl)、苯并[b][1,4]噁嗪基(benzo[b][1,4]oxazinyl)、1,4-苯并二噁烷基(1,4-benzodioxanyl)、苯并萘并呋喃基、苯并噁唑基、苯并间二氧杂环戊烯基(benzodioxolyl)、苯并二噁英基(benzodioxinyl)、苯并吡喃基、苯并吡喃酮基、苯并呋喃基、苯并呋喃酮基、苯并噻吩基、苯并噻吩并[3,2-d]嘧啶基、苯并三唑基、苯并[4,6]咪唑并[1,2-a]吡啶基、咔唑基、噌啉基(cinnolinyl)、环戊烷并[d]嘧啶基、6,7-二氢-5h-环戊烷并[4,5]噻吩并[2,3-d]嘧啶基、5,6-二氢苯并[h]喹唑啉基(5,6-dihydrobenzo[h]quinazolinyl)、5,6-二氢苯并[h]噌啉基(5,6dihydrobenzo[h]cinnolinyl)、6,7-二氢-5h-苯并[6,7]环庚烷并[1,2-c]哒嗪基、二苯并呋喃基、二苯并噻吩基、呋喃基、呋喃酮基、呋喃并[3,2-c]吡啶基、5,6,7,8,9,10-六氢环辛烷并[d]嘧啶基、5,6,7,8,9,10-六氢环辛烷并[d]哒嗪基、5,6,7,8,9,10-六氢环辛烷并[d]吡啶基、异噻唑基、咪唑基、吲唑基(indazolyl)、吲哚基、异吲哚基、二氢吲哚基、异二氢吲哚基、异喹啉基、吲哚嗪基(indolizinyl)、异噁唑基、5,8-甲醇-5,6,7,8-四氢喹唑啉基(5,8-methano-5,6,7,8-tetrahydroquinazolinyl)、萘啶基(naphthyridinyl)、1,6-萘啶酮基(1,6-naphthyridinonyl)、噁二唑基、2-氧杂吖庚因基(2-oxoazepinyl)、噁唑基、氧杂环丙烷基(oxiranyl)、5,6,6a,7,8,9,10,10a-八氢苯并[h]喹唑啉基、1-苯基-1h-吡咯基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基(phthalazinyl)、蝶啶基(pteridinyl)、嘌呤基、吡咯基、吡唑基、吡唑并[3,4-d]嘧啶基、吡啶基、吡啶并[3,2-d]嘧啶基、吡啶并[3,4-d]嘧啶基、吡嗪基、嘧啶基、哒嗪基、喹唑啉基、喹喔啉基(quinoxalinyl)、喹啉基、四氢喹啉基、5,6,7,8-四氢喹唑啉基、5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶基、6,7,8,9-四氢-5h-环庚烷并[4,5]噻吩并[2,3-d]嘧啶基、5,6,7,8-四氢吡啶并[4,5-c]哒嗪基、噻唑基、噻二唑基、三唑基、四唑基、三嗪基、噻吩并[2,3-d]嘧啶基、噻吩并[3,2-d]嘧啶基、噻吩并[2,3-c]吡啶基(thieno[2,3-c]pridinyl)和噻吩基(thiophenyl/thienyl)。
[0063]“杂环基”是指稳定的3至18元非芳香族环基,其包含2-12个碳原子和选自氮、氧和硫的1-6个杂原子。除非说明书中另有说明,否则杂环基是单环、双环、三环或四环系统,可包括稠环或桥环系统。或者,该杂环基中的杂原子是被氧化的杂原子。或者,一个或多个氮
原子(如果存在的话)被季铵化。杂环基是部分饱和或完全饱和的。杂环基可以通过任何环原子连接至分子的其余部分。此类杂环基的实例包括但不限于:二噁烷基、噻吩基[1,3]二硫酰基(thienyl[1,3]dithianyl)、十氢异喹啉基、咪唑啉基、咪唑烷基、异噻唑烷基、异噁唑烷基、吗啉基、八氢吲哚基、八氢异吲哚基、2-氧杂哌嗪基、2-氧杂哌啶基、2-氧杂吡咯烷基、噁唑烷基、哌啶基、哌嗪基、4-哌啶酮基、吡咯烷基、吡唑烷基、奎宁环基、噻唑烷基、四氢呋喃基、三硫酰基(trithianyl)、四氢吡喃基、硫代吗啉基(thiomorpholinyl)、硫杂吗啉基(thiamorpholinyl)、1-氧代硫吗啉基(1-oxo-thiomorpholinyl)和1,1-二氧代硫吗啉基(1,1-dioxo-thiomorpholinyl)。
[0064]
如本文所使用的,“杂环碱基”是指核碱基或修饰核碱基。在一些实施方式中,杂环碱基是嘧啶、取代的嘧啶、嘌呤或取代的嘌呤。在一些实施方式中,杂环碱基是天然存在的嘌呤或取代的嘌呤。在一些实施方式中,杂环碱基是非天然存在的嘌呤或取代的嘌呤。在一些实施方式中,杂环碱基是天然存在的嘧啶或取代的嘧啶。在一些实施方式中,杂环碱基是非天然存在的嘧啶或取代的嘧啶。
[0065]
在本公开中可以使用各种保护基团,例如羟基保护基团。一般来说,保护基团使化学官能团对特定的反应条件不敏感,并且可以在分子中的该官能团上添加以及去除,而不实质上损害分子的其余部分。代表性的羟基保护基团公开于beaucage等人,tetrahedron 1992,48,2223-2311,以及greeneand wuts,protective groups in organic synthesis,chapter 2,2d ed,john wiley&sons,new york,1991中,以引用的方式将上述文献各自整体并入本文。在一些实施方式中,保护基团在碱性条件下稳定,但可以在酸性条件下脱除。在一些实施方式中,本文可使用的羟基保护基的非排他性实例包括二甲氧基三苯甲基(dmt)、单甲氧基三苯甲基、9-苯基氧杂蒽-9-基(pixyl)和9-(对甲氧基苯基)氧杂蒽-9-基(mox)。在一些实施方式中,本文可使用的羟基保护基的非排他性实例包括tr(三苯甲基)、mmtr(4-甲氧基三苯甲基)、dmtr(4,4'-二甲氧基三苯甲基)和tmtr(4,4',4
”‑
三甲氧基三苯甲基)。
[0066]“受试者”一词,如本文所使用的,指任何动物,例如哺乳动物或有袋动物。本公开的受试者包括但不限于人类、非人灵长类(例如,恒河猴或其他类型的猕猴)、小鼠、猪、马、驴、牛、兔、绵羊、大鼠和任何种类的家禽。如本文所使用的,“治疗”指的是获得有益的或期望的结果的方法,包括但不限于治疗益处。“治疗益处”意味着根除或改善被治疗的潜在障碍。此外,治疗益处通过根除或改善与潜在障碍相关的一个或多个生理症状,从而在受试者中观察到改善而获得,尽管受试者可能仍然受到潜在障碍的折磨。
[0067]
如本文所使用的“预防”指获得有益或期望的结果的方法,包括但不限于预防性益处。为了获得“预防性益处”,可将sirna、药物组合物或sirna缀合物给予有罹患特定疾病风险的受试者,或给予报告疾病的一种或多种生理症状的受试者,即便可能该疾病的诊断尚未作出。
[0068]
核苷单体化合物
[0069]
在一方面,本公开提供了一种如式(1)所示的化合物:
[0070][0071]
其中:每个j1独立地为c1-c6烷基或取代的c1-c6烷基;
[0072]e101
为o或s;
[0073]r203
为具有式(2)所示结构的亚磷酰胺官能团:
[0074][0075]
其中,每个b1独立地选自取代或未取代的c1-c5烃基;b2选自c1-c5的烷基、氰乙基、氰丙基和氰丁基中的一种;
[0076]
d0为具有下式(d1)-(d4)所示结构表示的二价连接基团之一的基团:
[0077][0078]
p1和p2各自独立地为h、卤素、c1-c6烷基、取代的c1-c6烷基、c1-c6烷氧基、取代的c1-c6烷氧基、c2-c6烯基或取代的c2-c6烯基;
[0079]
bm为苯基或取代苯基,所述取代苯基是指苯基上的至少一个氢原子被取代基取代而形成的基团,每个所述取代基独立地选自f、cl、ch3、ch2f或cf3;
[0080]
z0为h、经保护的羟基、och3、f或och2ch2och3;
[0081]
表示基团共价连接的位点。
[0082]
bm为苯基或取代苯基。不受理论限制地,当bm为取代苯基时,所述取代苯基中,取
代基的选择可对苯环上的电子密度产生影响,从而进一步通过超共轭效应增强或降低与核糖环1’位碳原子和核糖环中相邻的氧原子之间的共价键的反应活性。在一些实施方式中,每个所述取代基各自独立地是给电子基团。在一些实施方式中,本领域技术人员可以理解,当所述取代基各自独立地选自f、cl、ch3、ch2f或cf3时,不改变本公开提供的化合物的性质,均可实现本公开的目的。出于简化化合物结构的考虑,在一些实施方式中,所述取代苯基中,每个取代基独立地为f、cl或ch3。在一些实施方式中,所述bm基团选自于以下结构中的一种:
[0083][0084][0085]
在一些实施方式中,g为式(g1)所示的结构。
[0086]
不受理论限制地,d0为式(d1)至(d4)中的任意一个所表示的能够实现式(1)中五元环核糖分子与磷酸结构连接的二价基团。在一些实施方式中,d0具有式(d1)或(d2)所示
的结构,且p1和p2各自独立地为h。在一些实施方式中,d0具有式(d4)所示的结构。
[0087]
在本公开中,根据所期望的式(1)所示的修饰核苷的结构和性质需要,对j1和e
101
进行选择。。在一些实施方式中,j1为乙基,e
101
为o。
[0088]
在一些实施方式中,所述经保护的羟基是指被tms(三甲基硅烷基)、tes(三乙基硅烷基)、tips(三异丙基硅烷基)、tbdps(叔丁基二苯基硅烷基)或tbdms(叔丁基二甲基硅烷基)基团保护的羟基。
[0089]
在一些实施方式中,z0为h、经保护的羟基、och3、f或och2ch2och3;。
[0090]
在一些实施方式中,为了便于化合物的合成,每个b1独立地选自异丙基或异丁基,b2选自氰乙基或氰丙基。
[0091]
在一些实施方式中,式(2)所述亚磷酰胺官能团具有如下式(4)所示的结构:
[0092][0093]
在一些实施方式中,如式(1)所示的化合物具有如式(101)、(102)、(103)、(104)、(105)、(106)、(107)、(108)、(109)、(110)、(111)、(112)或(113)所示的结构:
[0094]
[0095]
[0096]
[0097]
[0098][0099]
通过式(101)-(113)之一所示的修饰核苷单体制备的sirna可具有更进一步的目标基因表达抑制活性和低毒性的良好平衡。
[0100]
修饰核苷单体化合物的制备
[0101]
本领域技术人员可以采用任意合理的合成路线制备本公开的修饰核苷单体化合物。
[0102]
例如,可通过包含如下步骤的方法得到式(1)所示化合物:在有机溶剂中,在偶联反应条件下,以及在偶联试剂和反应助剂存在下,将式(401)所示化合物与式(402)所示化合物接触,分离得到式(1)所示化合物:
[0103][0104]
其中,j1、e
101
、d0、z0、bm、b1、b2各自的定义和可选择的范围如前所述。
[0105]
b3为n(b1)2或卤素,在一些实施方式中,b3为二异丙基氨基(n(ipr)2)或氯。
[0106]
所述偶联反应条件和偶联试剂可使用任何能够实现上述偶联反应的条件和试剂。
[0107]
一般来说,所述偶联反应条件包括反应温度为0-50℃,在一些实施方式中为15-35℃。反应时间为0.5-5h,在一些实施方式中为1-3h。反应压力可以是常压。
[0108]
偶联试剂与式(401)化合物的摩尔比为1:1-1:50,在一些实施方式中为1:1-1:10。偶联试剂选自四氮唑、5-乙硫基1h-四氮唑、5-苄硫基1h-四氮唑中的一种或多种,在一些实施方式中为四氮唑。
[0109]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为n,n-二甲基甲酰胺。相对于所述式(401)所示化合物,所述有机溶剂的用量为1-50l/mol,在一些实施方式中为3-20l/mol。
[0110]
所述反应助剂为n-甲基咪唑。所述反应助剂与式(401)所示化合物的摩尔比为0.1:1-10:1,在一些实施方式中为0.5:1-3:1。
[0111]
式(402)所示化合物与式(401)所示化合物的摩尔比为1:1-20:1,在一些实施方式中为1:1-10:1。式(402)所示化合物是可通过商购得到,或可由本领域技术人员通过公知的方法合成获得的亚磷酰胺化合物。在一些实施方式中,式(402)化合物为容易商购获得的双(二异丙基氨基)(2-氰基乙氧基)膦或3-((氯(二异丙基氨基)膦酰基)氧)丙腈。
[0112]
可使用任何合适的分离方法从反应混合物中分离式(1)所示的化合物。在一些实施方式中,可通过蒸发除去溶剂,并使用例如柱层析对反应产生的如式(1)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=2:3(v:
v)或石油醚∶二氯甲烷=1:1(v:v)的混合洗脱液作为流动相进行。
[0113]
式(401)所示的化合物可以商购得到,或者由本领域技术人员通过合理的合成路线制备获得。在一些实施方式中,式(401)所示化合物可以通过以下制备方法得到:该方法包括在有机溶剂中,在脱保护反应条件下,将式(403)所示化合物与脱保护试剂接触,分离得到式(401)所示化合物:
[0114][0115][0116]
其中,j1、e
101
、d0、z0、bm各自的定义和可选择的范围如前所述。
[0117]rk
为羟基保护基团。在一些实施方式中,所述保护基团rk为硅烷类保护基团,例如可以是tms(三甲基硅烷基)、tes(三乙基硅烷基)、tips(三异丙基硅烷基)、tbdps(叔丁基二苯基硅烷基)或tbdms(叔丁基二甲基硅烷基)。在一些实施方式中,rk可以是tbdps(叔丁基二苯基硅烷基)。
[0118]
所述脱保护反应条件包括反应温度为0-50℃,在一些实施方式中为15-35℃。反应时间为0.5-5h,在一些实施方式中为0.5-3h。反应压力可以是常压。
[0119]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为四氢呋喃。相对于所述式(403)所示化合物,所述有机溶剂的用量为1-50l/mol,在一些实施方式中为3-20l/mol。
[0120]
所述脱保护试剂为含氟离子的铵盐溶液,例如可以是含氟化氢吡啶盐、氟化氢三乙胺盐、四丁基氟化铵、四辛基氟化铵、四甲基氟化铵、四乙基氟化铵、或苄基三甲基氟化铵的溶液;在一些实施方式中,所述脱保护试剂为四丁基氟化铵的四氢呋喃溶液。所述脱保护试剂(以氟离子计)与式(403)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-5:1。
[0121]
可使用任何合适的分离方法从反应混合物中分离式(401)所示的化合物。在一些实施方式中,使用例如柱层析对反应产生的如式(401)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=5:1(v:v)的混合洗脱液作为流动相进行洗脱。
[0122]
式(403)所示的化合物可以商购得到,或者由本领域技术人员通过合理的合成路线制备获得。在一些实施方式中,式(403)所示化合物中的d0为式(d4)所示的二价连接基
团,此时,式(403)所示化合物可以通过以下制备方法得到:该方法包括在有机溶剂中,在亚甲基化反应条件下,在催化剂存在下,将式(404)所示化合物与亚甲基化试剂接触,分离得到式(403)所示化合物:
[0123][0124]
其中,j1、e
101
、z0、bm、rk各自的定义和可选择的范围如前所述。式(404)中的d0为式(d1)或(d2)所示的基团。
[0125]
所述亚甲基化反应条件包括反应温度为0-50℃,在一些实施方式中为15-35℃。反应时间为0.5-5h,在一些实施方式中为1-3h。反应压力可以是常压。
[0126]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为二甲基亚砜。相对于所述式(404)所示化合物,所述有机溶剂的用量为1-50l/mol,在一些实施方式中为3-20l/mol。
[0127]
所述催化剂为醇钠或碱金属氢化物。在一些实施方式中,所述催化剂为氢化钠、氢化钾或氢化锂中的一种。在一些实施方式中,所述催化剂与式(404)所示化合物的摩尔比为10:1-1:1,在一些实施方式中为5:1-1:1。
[0128]
所述亚甲基化试剂为任何能够使双键与亚甲基发生加成,形成环丙烷亚基的试剂。在一些实施方式中,所述亚甲基化试剂为卡宾类试剂。在一些实施方式中,所述亚甲基化试剂为三甲基碘化亚砜。在一些实施方式中,所述亚甲基化试剂与式(404)所示化合物的摩尔比为1:1-5:1,在一些实施方式中为1:1-3:1。
[0129]
可使用任何合适的分离方法从反应混合物中分离式(403)化合物。在一些实施方式中,对反应混合物进行萃取,有机相蒸发除去溶剂后,使用例如柱层析对反应产生的如式(403)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=30:1-3:1(v:v)的梯度洗脱进行。
[0130]
在一些实施方式中,式(403)所示化合物中的d0为式(d1)或(d2)所示的二价连接基团,此时,式(403)与式(404)所示化合物相同,可以通过以下制备方法得到:该方法包括在有机溶剂中,在缩合反应条件下,在缩合反应助剂、催化剂和碱存在下,将式(405)所示化合物与式(406)所示化合物接触,分离得到式(403)所示化合物:
[0131][0132]
其中,e
101
、j1、z0、bm、rk、p1各自的定义和可选择的范围如前所述。
[0133]
所述缩合反应条件包括反应温度为0-50℃,在一些实施方式中为15-35℃。反应时间为0.5-30h,在一些实施方式中为2-20h。反应压力可以是常压。
[0134]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为二甲基亚砜和四氢呋喃的混合溶剂。相对于所述式(405)所示化合物,所述有机溶剂的用量为1-50l/mol,在一些实施方式中为3-20l/mol。
[0135]
所述碱为无机或有机强碱。在一些实施方式中,所述碱为碱金属氢氧化物或醇碱金属盐。在一些实施方式中,所述碱为叔丁醇钾。所述碱与与式(405)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-5:1。
[0136]
所述缩合反应助剂为任何能够促进式(406)所示化合物与式(405)所示化合物发生缩合的试剂。在一些实施方式中,所述缩合反应助剂为二环己基碳二亚胺(dcc)。在一些实施方式中,所述缩合反应助剂与式(405)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-5:1。
[0137]
所述催化剂为任何能够提高所述缩合反应的效率,但自身在反应前后的量不发生改变的试剂。在一些实施方式中,所述催化剂为三氟乙酸吡啶盐。在一些实施方式中,所述催化剂分别以吡啶和三氟乙酸的形式加入反应混合物中,并在反应液中反应生成三氟乙酸吡啶盐,发挥催化作用。在一些实施方式中,所述催化剂与式(405)所示化合物的摩尔比为0.2:1-10:1,在一些实施方式中为0.8:1-5:1。
[0138]
式(406)所示化合物可通过商购得到,或可由本领域技术人员通过公知的方法合
成获得。另一方面,式(406)所示化合物的结构决定了式(403)或(404)化合物中e
101
、j1、p1的选择。在一些实施方式中,式(406)化合物为能够商购获得的四乙基亚甲基二磷酸酯,此时式(403)或(404)化合物中,d0具有式(d1)的结构,且每个e
101
均为o,或者至少一个e
101
为s、每个j1均为乙基,且p1为氢。式(406)所示化合物与式(405)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-5:1。在一些实施方式中,式(406)所示化合物以碱溶液的形式加入到反应混合物中。在一些实施方式中,式(406)所示化合物与上述碱和有机溶剂形成溶液,再加入到包含式(405)所示化合物的反应混合物中。在一些实施方式中,所述有机溶剂是四氢呋喃。在一些实施方式中,相对于所述式(406)所示化合物,所述有机溶剂的用量为0.5-20l/mol,在一些实施方式中为1-10l/mol。
[0139]
可使用任何合适的分离方法从反应混合物中分离式(403)所示化合物。在一些实施方式中,在萃取、分液后,有机相使用例如柱层析对反应产生的如式(403)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=30:1-2:1(v:v)的梯度洗脱进行。
[0140]
在一些实施方式中,式(403)所示化合物中的d0为式(d3)所示的二价连接基团,此时,式(403)所示化合物可通过按照cn103154014b中实施例25所示的方法制备,区别仅在于,以式(405)所示的化合物代替cn103154014b中实施例25中的化合物15进行所述制备。
[0141]
式(405)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。式(405)所示化合物可以通过以下制备方法得到:该方法包括在有机溶剂中,在脱保护条件下,将式(407)所示化合物与酸接触,分离得到式(405)所示化合物:
[0142][0143]
其中,z0、bm、rk各自的定义和可选择的范围如前所述。
[0144]rj
为羟基保护基团,选自三苯甲基、4-甲氧基三苯甲基、4,4
’‑
双甲氧基三苯甲基、4,4’,4
’‑
三甲氧基苯甲基中的一种;在一些实施方式中,rj为4,4
’‑
双甲氧基三苯甲基。
[0145]
所述脱保护反应条件包括反应温度为0-100℃,反应时间为0.1-24小时,在一些实施方式中为反应温度为10-40℃,反应时间为0.5-16小时。反应压力可以是常压。
[0146]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为二氯甲烷。相对于式(407)所示的化合物,有机溶剂用量为3-50l/mol,在一些实施方式中5-20l/mol。
[0147]
所述酸可以是羟基保护基团脱保护中常用的酸。在一些实施方式中,所述酸例如为对甲苯磺酸。在一些实施方式中,所述酸为tsoh(对甲苯磺酸)溶于二氯甲烷和无水乙醇后得到的溶液,其中二氯甲烷和无水乙醇相对于对甲苯磺酸的用量比分别为1:1-100:1ml/g和1:1-50:1ml/g。所述酸与式(407)所示的化合物,的摩尔比为0.1:1-10:1,在一些实施方式中为0.3:1-5:1。
[0148]
可使用任何合适的分离方法从反应混合物中分离式(405)所示的化合物。在一些实施方式中,在萃取、分液后,有机相蒸发去除溶剂,并使用例如柱层析对反应产生的如式(405)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚:乙酸乙酯=50:1-5:1(v:v)的梯度洗脱进行。在一些实施方式中,所得到的式(405)化合物粗产品不作进一步分离直接用于后续反应。
[0149]
式(407)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。在一些实施方式中,式(407)所示的化合物可以通过以下制备方法得到:该方法包括在有机溶剂中,在羟基保护反应条件下,在碱性条件下将式(408)所示化合物与硅烷类羟基保护试剂接触,分离得到式(407)所示化合物:
[0150][0151]
其中,z0、bm、rj各自的定义和可选择的范围如前所述。
[0152]
所述羟基保护反应条件包括反应温度为0-100℃,反应时间为0.1-24小时,在一些实施方式中为反应温度为10-40℃,反应时间为0.5-16小时。反应压力可以是常压。
[0153]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为n,n-二甲基甲酰胺。相对于式(408)化合物,有机溶剂用量为1-50l/mol,在一些实施方式中为3-20l/mol。
[0154]
所述碱性条件是指在反应过程中含有碱性化合物存在。所述碱性化合物与式(408)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-8:1。在一些实施方式,所述碱性化合物是咪唑。
[0155]
所述硅烷类羟基保护试剂为tbdmscl(叔丁基二甲基氯硅烷)或tbdpscl(叔丁基二苯基氯硅烷)。在一些实施方式中,所述硅烷类羟基保护试剂为tbdpscl(叔丁基二苯基氯硅烷)。所述硅烷类羟基保护试剂与式(408)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为2:1-5:1。
[0156]
可使用任何合适的分离方法从反应混合物中分离式(407)化合物。在一些实施方
式中,反应混合物经萃取、分液后,有机相蒸发去除溶剂,来对反应产生的如式(407)所示的化合物进行分离。在一些实施方式中,所得到的式(407)化合物粗产品不作进一步分离直接用于后续反应。
[0157]
式(408)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。在一些实施方式中,式(408)所示的化合物可以通过以下制备方法得到:该方法包括在有机溶剂存在下,在羟基保护反应条件下,将式(409)所示化合物与三苯甲基类羟基保护试剂接触,分离得到式(408)所示化合物:
[0158][0159]
其中,z0、bm各自的定义和可选择的范围如前所述。
[0160]
所述羟基保护反应条件包括反应温度为0-100℃,反应时间为0.1-24小时,在一些实施方式中为反应温度为10-40℃,反应时间为0.5-16小时。反应压力可以是常压。
[0161]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺、n,n-二异丙基乙胺或无水吡啶中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种。在一些实施方式中,所述有机溶剂为无水吡啶。相对于式(409)化合物,有机溶剂用量为0.5-50l/mol,在一些实施方式中为1-20l/mol。
[0162]
所述三苯甲基类羟基保护试剂为含有rj基团的羟基保护试剂。在一些实施方式中,rj选自三苯甲基、4-甲氧基三苯甲基、4,4
’‑
双甲氧基三苯甲基、4,4’,4
’‑
三甲氧基三苯甲基中的一种。在一些实施方式中,所述三苯甲基类羟基保护试剂为dmtrcl,即4,4'-双甲氧基三苯甲基氯。所述三苯甲基类羟基保护试剂与式(409)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-3:1。
[0163]
可使用任何合适的分离方法从反应混合物中分离式(408)化合物。在一些实施方式中,反应混合物经萃取、分液后,有机相蒸发去除溶剂,来对反应产生的如式(408)所示的化合物进行分离。在一些实施方式中,所得到的式(408)化合物粗产品不作进一步分离直接用于后续反应。。
[0164]
式(409)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。在一些实施方式中,式(409)所示化合物可以通过以下制备方法得到:该方法包括在有机溶剂存在下,在水解反应条件下,将式(410)所示化合物与脱保护试剂接触,分离得到式(409)所示化合物。
[0165][0166]
其中,z0、bm各自的定义和可选择的范围如前所述。每个r
410
独立地为c1-c5烷基。在一些实施方式中,每个r
409
独立地为异丙基或叔丁基。
[0167]
所述水解反应条件包括反应温度为0-100℃,反应时间为0.1-24小时,在一些实施方式中为反应温度为10-40℃,反应时间为0.5-16小时。反应压力可以是常压。
[0168]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为四氢呋喃。相对于式(410)化合物,有机溶剂用量为1-50l/mol,在一些实施方式中为2-30l/mol。
[0169]
所述脱保护试剂为含氟离子的铵盐,例如可以是含氟化氢吡啶盐、氟化氢三乙胺盐、四丁基氟化铵、四辛基氟化铵、四甲基氟化铵、四乙基氟化铵或苄基三甲基氟化铵。在一些实施方式中,所述脱保护试剂为四丁基氟化铵。在一些实施方式中,所述脱保护试剂以溶于有机溶剂形成溶液的形式加入到包含式(410)所示化合物的反应混合物中。所述脱保护试剂与式(410)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-3:1。
[0170]
可使用任何合适的分离方法从反应混合物中分离式(409)化合物。在一些实施方式中,通过蒸发去除溶剂,并使用例如柱层析对反应产生的如式(409)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=1:5(v:v)的混合洗脱液作为流动相进行洗脱。
[0171]
式(410)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。在一些实施方式中,式(410)中的z0为och3或och2ch2och3,式(410)所示的化合物可以通过以下制备方法得到:该方法包括在有机溶剂存在下,在取代反应条件下,在碱性条件下将式(411)所示化合物与反应试剂接触,分离得到式(410)所示化合物。
[0172][0173]
其中,bm和r
410
的定义和可选择的范围如前所述。
[0174]
所述取代反应条件包括反应温度为-10℃-100℃,反应时间为0.1-24小时,在一些实施方式中为反应温度为-10℃-40℃,反应时间为0.5-16小时。反应压力可以是常压。
[0175]
所述有机溶剂为环氧类溶剂、醚类溶剂、卤代烷类溶剂、二甲基亚砜、n,n-二甲基甲酰胺和n,n-二异丙基乙胺中的一种或多种。所述环氧类溶剂在一些实施方式中为二氧六环和/或四氢呋喃,所述醚类溶剂在一些实施方式中为乙醚和/或甲基叔丁基醚,所述卤代烷类溶剂在一些实施方式中为二氯甲烷、三氯甲烷和1,2-二氯乙烷中的一种或多种,在一些实施方式中,所述有机溶剂为n,n-二甲基甲酰胺。相对于式(411)化合物,有机溶剂用量为3-50l/mol,在一些实施方式中5-20l/mol。
[0176]
所述碱性条件是指在反应过程中含有碱性化合物存在。所述碱性化合物与式(411)所示化合物的摩尔比为1:1-10:1,在一些实施方式中为1:1-5:1。在一些实施方式中,所述碱性化合物是强碱。在一些实施方式中,所述碱性化合物为nah。
[0177]
式(410)中z0的结构的不同,决定了所选择的反应试剂的不同。当式(410)中的z0为och3时,所述反应试剂为ch3i、ch3cl、ch3br或ch3f;当式(410)中的z0为och2ch2och3时,所述反应试剂为ch3och2ch2i、ch3och2ch2f、ch3och2ch2br或ch3och2ch2cl。所述反应试剂与式(411)所示化合物的摩尔比为1:1-20:1,在一些实施方式中为1:1-10:1。
[0178]
可使用任何合适的分离方法从反应混合物中分离式(410)化合物。在一些实施方式中,在萃取、分液后,浓缩除去溶剂,并使用例如柱层析对反应产生的如式(410)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=20:1(v:v)的混合洗脱液作为流动相进行洗脱。
[0179]
式(411)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。在一些实施方式中,式(411)所示化合物可以通过以下制备方法得到:该方法包括在有机溶剂存在下,在取代反应条件下,将式(412)所示化合物与四烷基二硅氧烷类羟基保护剂接触,分离得到式(411)所示化合物。
[0180][0181]
其中,bm的定义和可选择的范围如前所述。
[0182]
所述取代反应条件包括反应温度为0-100℃,反应时间为0.1-24小时,在一些实施方式中为反应温度为0-40℃,反应时间为0.5-16小时。反应压力可以是常压。
[0183]
所述有机溶剂为无水吡啶、4-二甲氨基吡啶、2-氯吡啶、2,6-二氯吡啶、2-氨基吡啶、无水n,n-二甲基酰胺、无水n,n-二甲基乙酰胺中的一种。在一些实施方式中,所述有机溶剂为无水吡啶。相对于式(412)化合物,有机溶剂用量为1-50l/mol,在一些实施方式中为5-20l/mol。
[0184]
所述四烷基二硅氧烷类保护剂可以是例如tipdscl2(1,3-二氯-1,1,3,3-四异丙基二硅氧烷)。在一些实施方式中,tipdscl2与式(412)所示化合物的摩尔比为1:1-1:10,在一些实施方式中为1:1-1:2。
[0185]
可使用任何合适的分离方法从反应混合物中分离式(411)化合物。在一些实施方式中,可蒸发去除溶剂,并使用例如柱层析对反应产生的如式(411)所示的化合物进行分离,分离条件可以例如使用正相硅胶填充,用石油醚(pe):乙酸乙酯(acoet)=5:1-1:1(v:v)的梯度洗脱进行。
[0186]
式(412)所示的化合物可通过商购得到,或可由本领域技术人员通过公知的方法合成获得。在一些实施方式中,式(412)化合物可按照文献acs chem.biol.2006,1,3,176
–
183中公开的方法制备得到。
[0187]
本公开的sirna
[0188]
在另一方面,本公开还公开了一种sirna,所述sirna包含正义链和反义链,所述正义链和反义链各自包含14至30个修饰或未修饰的核苷酸,正义链和反义链的一部分反向互补形成双链区,其中,所述反义链的5
’‑
末端核苷酸具有式(5)所示的结构:
[0189][0190]
其中,
[0191]r201
和r
202
各自独立地为oh或oj1,j1为c1-c6烷基或取代的c1-c6烷基;
[0192]
每个e
101
各自独立地为o或s;
[0193]
d0为具有下式(d1)-(d4)所示结构表示的二价连接基团之一的基团:
[0194][0195]
p1和p2各自独立地为h、卤素、c1-c6烷基、取代的c1-c6烷基、c1-c6烷氧基、取代的c1-c6烷氧基、c2-c6烯基或取代的c2-c6烯基;
[0196]
bm为苯基或取代苯基,所述取代苯基是指苯基上的至少一个氢原子被取代基取代而形成的基团,每个所述取代基独立地选自f、cl、ch3、ch2f或cf3;
[0197]
z为h、oh、och3、f或och2ch2och3;
[0198]
表示基团共价连接的位点;
[0199]
所述反义链与目标基因表达的mrna中的一段长度与所述反义链相同的核苷酸序列基本上反向互补或实质上反向互补。
[0200]
如前所述,本公开的sirna中,每个核苷酸均是修饰或未修饰的核苷酸。在本公开的上下文中,所使用的术语“修饰的核苷酸”是指核苷酸的核糖基2'位羟基被其他基团取代形成的核苷酸或核苷酸类似物,或者核苷酸上的碱基是经修饰的碱基的核苷酸。所述修饰的核苷酸不会导致sirna调节基因表达的功能明显削弱或丧失。例如,可以选择j.k.watts,g.f.deleavey,and m.j.damha,chemically modified sirna:tools and applications.drug discov today,2008,13(19-20):842-55中公开的修饰的核苷酸。
[0201]
在一些实施方式中,所述sirna包含正义链和反义链,其中,所述正义链包含核苷酸序列i,所述反义链包含核苷酸序列ii,所述核苷酸序列ii的5’末端核苷酸具有式(5)所示结构;所述核苷酸序列i和核苷酸序列ii均由19个核苷酸组成,且所述核苷酸序列ii与所述核苷酸序列i构成双链区,所述核苷酸序列ii至少部分地与第一段核苷酸序列反向互补,所述第一段核苷酸序列为目标基因表达的mrna中的一段长度为19个核苷酸的核苷酸序列;按照5'末端到3'末端的方向,所述核苷酸序列i的第7-9个核苷酸为氟代修饰的核苷酸;将式(5)所示的基团作为1个核苷酸计数,按照5'末端到3'末端的方向,所述核苷酸序列ii的第2、6、14、16个核苷酸为氟代修饰的核苷酸。
[0202]
在一些实施方式中,按照5'末端到3'末端的方向,所述核苷酸序列i的第7-9个核苷酸为氟代修饰的核苷酸,所述核苷酸序列i其他位置的每个核苷酸独立地为非氟代修饰的核苷酸中的一种;按照5'末端到3'末端的方向,所述核苷酸序列ii的第2、6、14、16个核苷酸为氟代修饰的核苷酸,所述核苷酸序列ii其他位置的每个核苷酸独立地为非氟代修饰的核苷酸中的一种。
[0203]
在一些实施方式中,按照5'末端到3'末端的方向,所述核苷酸序列ii与所述第一段核苷酸序列基本上反向互补或实质上反向互补。
[0204]
在一些实施方式中,按照5'末端到3'末端的方向,所述核苷酸序列ii的第2-19位的核苷酸与所述第一段核苷酸序列第1-18位的核苷酸完全反向互补。在一些实施方式中,所述核苷酸序列ii与所述核苷酸序列i基本上反向互补或实质上反向互补。
[0205]
在一些实施方式中,按照5'末端到3'末端的方向,所述核苷酸序列ii的第2-19位与所述核苷酸序列i的1-18位完全反向互补构成双链区。
[0206]
在一些实施方式中,按照5'末端到3'末端的方向,所述核苷酸序列ii与所述核苷酸序列i实质上反向互补,或者按照5'末端到3'末端的方向,所述核苷酸序列ii中的第2个核苷酸与按照3'末端到5'末端的方向,所述核苷酸序列i中的第2个核苷酸之间存在碱基错配。
[0207]
在一些实施方式中,所述正义链还含有核苷酸序列iii,所述反义链还含有核苷酸序列iv,所述核苷酸序列iii和所述核苷酸序列iv的每个核苷酸独立地为非氟代修饰的核苷酸中的一种,所述核苷酸序列iii的长度为1个、2个、3个或4个核苷酸,所述核苷酸序列iv和所述核苷酸序列iii长度相等,并且所述核苷酸序列iv和所述核苷酸序列iii实质上反向互补或完全反向互补,所述核苷酸序列iii连接在所述核苷酸序列i的5'末端,所述核苷酸序列iv连接在所述核苷酸序列ii的3'末端,并且所述核苷酸序列iv与第二段核苷酸序列实质上反向互补或完全反向互补,该第二段核苷酸序列是指和目标基因表达的mrna中与第一段核苷酸序列相邻、且长度与所述核苷酸序列iv相同的核苷酸序列。从而,本公开的sirna可具有19-23个核苷酸长度的双链互补区。
[0208]
在一些实施方式中,所述sirna还含有核苷酸序列v,所述核苷酸序列v的每个核苷酸独立地为非氟代修饰的核苷酸中的一种,所述核苷酸序列v的长度为1至3个核苷酸,连接在所述反义链的3'末端,从而构成所述反义链的3'突出端。这样,本公开提供的sirna的正义链和反义链的长度之比可以是19/19、19/20、19/21、19/22、20/20、20/21、20/22、20/23、21/21、21/22、21/23、21/24、22/22、22/23、22/24、22/25、23/23、23/24、23/25或23/26。
[0209]
在一些实施方式中,所述核苷酸序列v的长度为2个核苷酸,并且按照5'末端到3'
末端的方向,所述核苷酸序列v为连续的2个胸腺嘧啶脱氧核糖核苷酸、连续的2个尿嘧啶核糖核苷酸、或者与第三段核苷酸序列完全反向互补,所述第三段核苷酸序列是指和目标基因表达的mrna中与第一段核苷酸序列或第二段核苷酸序列的5'端相邻、并且长度与所述核苷酸序列v相等的核苷酸序列。因此,在一些实施方式中,本公开的sirna的正义链和反义链各自具有19/21个核苷酸或21/23个核苷酸长度,此时,本公开的sirna具有更好的目标基因表达调节活性。
[0210]
在一些实施方式中,每一个非氟代修饰的核苷酸独立地选自核苷酸的核糖基2'位的羟基被非氟基团取代形成的核苷酸或核苷酸类似物中的一种。
[0211]
在一些实施方式中,每一个所述非氟代修饰的核苷酸均为甲氧基修饰的核苷酸,所述甲氧基修饰的核苷酸指核糖基的2'-羟基被甲氧基取代而形成的核苷酸。在本公开的上下文中,“氟代修饰的核苷酸”指核苷酸的核糖基2'位的羟基被氟取代形成的核苷酸,其具有以下式(507)所示的结构。“非氟代修饰的核苷酸”指核苷酸的核糖基2'位的羟基被非氟基团取代形成的核苷酸、或核苷酸类似物。在一些实施方式中,每一个非氟代修饰的核苷酸独立地选自核苷酸的核糖基2'位的羟基被非氟基团取代形成的核苷酸或核苷酸类似物中的一种。
[0212]
这些核糖基2'位的羟基被非氟基团取代形成的核苷酸是本领域技术人员所公知的,这些核苷酸可以选自2'-烷氧基修饰的核苷酸、2'-烷基修饰的核苷酸、2'-经取代的烷基修饰的核苷酸、2'-氨基修饰的核苷酸、2'-经取代的氨基修饰的核苷酸、2'-脱氧核苷酸中的一种。
[0213]
在一些实施方式中,2'-烷氧基修饰的核苷酸为甲氧基修饰的核苷酸(2'-ome),如式(508)所示。在一些实施方式中,2'-氨基修饰的核苷酸(2'-nh2)如式(509)所示。在一些实施方式中,2'-脱氧核苷酸(dna)如式(510)所示:
[0214][0215]
核苷酸类似物指能够在核酸中代替核苷酸,但结构不同于腺嘌呤核糖核苷酸、鸟嘌呤核糖核苷酸、胞嘧啶核糖核苷酸、尿嘧啶核糖核苷酸或胸腺嘧啶脱氧核糖核苷酸的基团。在一些实施方式中,核苷酸类似物可以是异核苷酸、桥联的核苷酸(bridged nucleic acid,简称bna)或无环核苷酸。
[0216]
bna是指受约束的或不能接近的核苷酸。bna可以含有五元环、六元环、或七元环的具有“固定的”c3'-内切糖缩拢的桥联结构。通常将该桥掺入到该核糖的2'-、4'-位处以提供一个2',4'-bna核苷酸。在一些实施方式中,bna可以是lna、ena、cet bna等,其中,lna如式(512)所示,ena如式(513)所示,cet bna如式(514)所示:
[0217][0218]
无环核苷酸是核苷酸的糖环被打开形成的一类核苷酸。在一些实施方式中,无环核苷酸可以是解锁核酸(una)或甘油核酸(gna),其中,una如式(515)所示,gna如式(516)所示:
[0219][0220]
上述式(515)和式(516)中,r选自h、oh或烷氧基(o-烷基)。
[0221]
异核苷酸是指核苷酸中碱基在核糖环上的位置发生改变而形成的化合物。在一些实施方式中,异核苷酸可以是碱基从核糖环的1'-位移动至2'-位或3'-位而形成的化合物,如式(517)或(518)所示。
[0222]
上述式(517)-式(518)化合物中,base表示核酸碱基,例如a、u、g、c或t;r选自h、oh、f或者如上所述的非氟基团。
[0223][0224]
在一些实施方式中,核苷酸类似物选自异核苷酸、lna、ena、cet、una和gna中的一种。在一些实施方式中,每一个非氟代修饰的核苷酸均为甲氧基修饰的核苷酸,在上文和下文中,所述甲氧基修饰的核苷酸指核糖基的2'-羟基被甲氧基取代而形成的核苷酸。
[0225]
在上文及下文中,“氟代修饰的核苷酸”、“2'-氟修饰的核苷酸”、“核糖基团的2'-羟基被氟取代的核苷酸”和“具有2'-氟代核糖基的核苷酸”意义相同,均指核苷酸的2'-羟基被氟取代,而形成的具有如式(507)所示结构的化合物;“甲氧基修饰的核苷酸”、“2'-甲氧基修饰的核苷酸”、“核糖基团的2'-羟基被甲氧基取代的核苷酸”和“具有2'-甲氧基核糖基的核苷酸”意义相同,均指核苷酸核糖基团的2'-羟基被甲氧基取代而形成的具有如式(508)所示结构的化合物。
[0226]
具有上述修饰的sirna不仅成本低,而且可使血液中的核糖核酸酶不易切割sirna,由此增加sirna的稳定性,使其具有更强的抵抗核酸酶水解的性能。同时,上述修饰的sirna具有较高的调节目标基因表达的活性。
[0227]
在一些实施方式中,所述正义链和所述反义链中至少一条单链的磷酸-糖骨架中的磷酸酯基中的至少1个为具有修饰基团的磷酸酯基。在一些实施方式中,具有修饰基团的磷酸酯基为磷酸酯基中的磷酸二酯键中的至少一个氧原子被硫原子取代而形成的硫代磷酸酯基;在一些实施方式中,所述具有修饰基团的磷酸酯基为具有如式(521)所示结构的硫代磷酸酯基:
[0228][0229]
这种修饰能稳定sirna的双链结构,保持碱基配对的高特异性和高亲和力。
[0230]
在一些实施方式中,所述sirna中,所述具有修饰基团的磷酸酯基存在于由以下位置所组成的组中的至少一处:
[0231]
所述正义链的5'末端端部第1个核苷酸和第2个核苷酸之间;
[0232]
所述正义链的5'末端端部第2个核苷酸和第3个核苷酸之间;
[0233]
所述正义链的3'末端端部第1个核苷酸和第2个核苷酸之间;
[0234]
所述正义链的3'末端端部第2个核苷酸和第3个核苷酸之间;
[0235]
所述反义链的5'末端端部第1个核苷酸和第2个核苷酸之间;
[0236]
所述反义链的5'末端端部第2个核苷酸和第3个核苷酸之间;
[0237]
所述反义链的3'末端端部第1个核苷酸和第2个核苷酸之间;以及
[0238]
所述反义链的3'末端端部第2个核苷酸和第3个核苷酸之间。
[0239]
本公开的sirna可以是各种调解基因表达的sirna。采用本公开的sirna出人意料地降低了毒性,还显示出优异的目标基因表达调节活性。
[0240]
本公开提供的sirna、药物组合物和sirna缀合物可以用于调节各种基因异常表达,治疗各种由于基因异常表达引起的病理状况或疾病。这些基因可以是人体或动物体内各种内源性基因,也可以是在人体或动物体内繁殖的病原体基因。可以根据目标基因表达的mrna设计和制备具有特定核苷酸序列和所述修饰方案的sirna。在一些实施方式中,所述目标基因表达的mrna选自以下基因转录的mrna中的一种:ace2、angptl3、apoa、apob、apoc、ar、ask1、c5、col1a1、ctgf、ebola、foxo1、fto、fvii、fxi、fxii、gcgr、hbv、hcv、hsd、p53、pcsk9、pnp、plg、pkk、kng、sars-cov-2、scd1、scnn1a、sod1、stat3、timp-1、tmprss6、xo。
[0241]
在一些实施方式中,所述目标基因表达的mrna选自乙型肝炎病毒基因表达的mrna。
[0242]
在一些实施方式中,如式(5)所示的化合物具有如式(201)、(202)、(203)、(204)、(205)、(206)、(207)、(208)、(209)、(210)、(211)、(212)、或(213)所示的结构:
[0243]
[0244]
[0245]
[0246]
[0247][0248]
在一些实施方式中,所述sirna为具有如下表1中所示的sirna。
[0249]
表1 sirna序列
[0250][0251]
其中,sirna1-13中的bxs分别是指式(201)-式(213)所示的结构。其中,大写字母c、g、u、a表示核苷酸的碱基组成;小写字母m表示该字母m左侧相邻的一个核苷酸为甲氧基修饰的核苷酸;小写字母f表示该字母f左侧相邻的一个核苷酸为氟代修饰的核苷酸;小写字母s表示该字母左右两个核苷酸之间为硫代磷酸酯基连接。
[0252]
本公开的sirna的制备方法
[0253]
本公开的sirna核苷酸的制备方法包括,用固相亚磷酰胺法,按照预期得到的sirna序列,分别合成sirna的正义链和反义链,在连接反义链的5’端的最后一个核苷酸时,以式(1)所示的结构作为核苷亚磷酰胺单体进行连接,并进行硫化反应。
[0254]
在一些实施方式中,本公开的sirna的制备方法包括:
[0255]
(1)按照按照3'-5'的方向通过亚磷酰胺固相合成方法合成sirna的正义链;
[0256]
(2)按照按照3'-5'的方向通过亚磷酰胺固相合成方法合成sirna的反义链;
[0257]
(3)分离出sirna的正义链和反义链并退火,获得本公开的sirna。
[0258]
本领域技术人员容易理解的是,在步骤(1)中和(2)中所述固相合成的反应条件,
包括核苷单体脱保护条件,脱保护试剂种类和用量,偶联反应条件,偶联试剂的种类和用量,盖帽反应的条件,盖帽试剂的种类和用量,氧化反应条件,氧化试剂种类和用量,硫化反应条件,硫化试剂种类和用量可以是任何合理的工艺路线和方法条件、试剂种类、用量。。
[0259]
例如,在一些实施方式中,步骤(1)和(2)中所述固相合成可使用如下条件:
[0260]
核苷单体脱保护条件包括温度为0-50℃,在一些实施方式中为15-35℃,反应时间为30-300秒,在一些实施方式中为50-150秒,脱保护试剂可以选自三氟乙酸、三氯乙酸、二氯乙酸、一氯乙酸中的一种或多种,在一些实施方式中为二氯乙酸。脱保护试剂与固相载体上4,4'-二甲氧基三苯甲基保护基的的摩尔比可为2:1-100:1,在一些实施方式中为3:1-50:1。
[0261]
偶联反应条件包括温度为0-50℃,在一些实施方式中为15-35℃,固相载体上连接的核酸序列与核苷单体的摩尔比可为1:1-1:50,在一些实施方式中为1:5-1:15;固相载体上连接的核酸序列和偶联试剂的摩尔比可为1:1-1:100,在一些实施方式中为1:50-1:80,反应时间和偶联试剂的选择与前述相同。
[0262]
盖帽反应条件包括温度为0-50℃,在一些实施方式中为15-35℃,反应时间为5-500秒,在一些实施方式中为10-100秒,盖帽试剂的选择与前述相同。盖帽试剂的总量与固相载体上连接的核酸序列的摩尔比可为1:100-100:1,在一些实施方式中为1:10-10:1。在使用等摩尔量的乙酸酐与n-甲基咪唑作为盖帽试剂的情况下,乙酸酐、n-甲基咪唑以及固相载体上连接的核酸序列的摩尔比可为1:1:10-10:10:1,在一些实施方式中为1:1:2-2:2:1。
[0263]
氧化反应条件包括温度为0-50℃,在一些实施方式中为15-35℃,反应时间为1-100秒,在一些实施方式中为5-50秒,氧化试剂在一些实施方式中为碘(在进一步实施方式中,以碘水的形式提供)。氧化试剂与偶联步骤中固相载体上连接的核酸序列的摩尔比可为1:1-100:1,在一些实施方式中为5:1-50:1。在一些实施方式中,所述氧化反应在四氢呋喃:水:吡啶=3:1:1-1:1:3的混合溶剂中进行。硫化反应条件包括温度为0-50℃,在一些实施方式中为15-35℃,反应时间为50-2000秒,在一些实施方式中为100-1000秒,硫化试剂在一些实施方式中为氢化黄原素。硫化试剂与偶联步骤中固相载体上连接的核酸序列的摩尔比可为10:1
–
1000:1,在一些实施方式中为10:1-500:1。在一些实施方式中,所述硫化反应在乙腈:吡啶=1:3-3:1的混合溶剂中进行。
[0264]
步骤(3)中退火的方法也是本领域技术人员熟知的。例如,可简单地将所合成的正义链与反义链以等摩尔比混合在注射用水中加热至70-95℃,随后室温冷却,使其通过氢键形成双链结构。这样即可得到本公开的sirna。
[0265]
在合成过程中,可随时对核酸序列的纯度和分子量进行检测,从而更好地把控合成质量,检测的方法为本领域技术人员所公知。例如,可通过离子交换色谱检测核酸纯度,并通过液质联用色谱(lc-ms)测定分子量。
[0266]
在获得本公开的sirna后,在一些实施方式中,还可利用例如液质联用色谱等方法,通过分子量检测等方式对所合成的sirna进行表征,确定所合成的sirna为目标设计的sirna,例如与上述表1中所列的序列之一相符。
[0267]
药物组合物
[0268]
在一方面,本公开提供了一种药物组合物,所述药物组合物包含本公开提供的
sirna,以及药学上可接受的载体。
[0269]
所述药学上可接受的载体可以是sirna给药领域常规使用的载体,例如但不限于磁性纳米粒(magnetic nanoparticles,如基于fe3o4或fe2o3的纳米粒)、碳纳米管(carbon nanotubes)、介孔硅(mesoporous silicon)、磷酸钙纳米粒(calcium phosphate nanoparticles)、聚乙烯亚胺(polyethylenimine,pei)、聚酰胺型树形高分子(polyamidoamine(pamam)dendrimer)、聚赖氨酸(poly(l-lysine),pll)、壳聚糖(chitosan)、1,2-二油酰基-3-三甲铵丙烷(1,2-dioleoyl-3-trimethylammonium-propane,dotap)、聚d型或l型乳酸/羟基乙酸共聚物(poly(d&l-lactic/glycolic acid)copolymer,plga)、聚(氨乙基乙撑磷酸酯)(poly(2-aminoethyl ethylene phosphate),ppeea)和聚(甲基丙烯酸-n,n-二甲氨基乙酯)(poly(2-dimethylaminoethyl methacrylate),pdmaema)以及它们的衍生物中的一种或多种。
[0270]
在一些实施方式中,所述药物组合物中,对sirna和药学上可接受的载体的含量没有特别要求,在一些实施方式中,sirna与药学上可接受的载体的重量比可以为1:(1-500),在一些的实施方式中,上述重量比为1:(1-50)。
[0271]
在一些实施方式中,所述药物组合物中,还可以包含药学上可接受的其它辅料,该辅料可以为本领域常规采用的各种制剂或化合物的一种或多种。例如,所述药学上可接受的其它辅料可以包括ph缓冲液、保护剂和渗透压调节剂中的至少一种。
[0272]
所述ph缓冲液可以为ph值7.5-8.5的三羟甲基胺基甲烷盐酸盐缓冲液和/或ph值5.5-8.5的磷酸盐缓冲液,例如可以为ph值5.5-8.5的磷酸盐缓冲液。
[0273]
所述保护剂可以为肌醇、山梨醇、蔗糖、海藻糖、甘露糖、麦芽糖、乳糖和葡萄糖中的至少一种。以所述药物组合物的总重量为基准,所述保护剂的含量可以为0.01-30重量%。
[0274]
所述渗透压调节剂可以为氯化钠和/或氯化钾。所述渗透压调节剂的含量使所述药物组合物的渗透压为200-700毫渗摩尔/千克(mosm/kg)。根据所需渗透压,本领域技术人员可以容易地确定所述渗透压调节剂的含量。在一些实施方式中,所述药物组合物所制成的制剂在给药过程中的剂量会因给药方式的不同而发生调整。
[0275]
在一些实施方式中,所述药物组合物可以为液体制剂,例如注射液;也可以为冻干粉针剂,实施给药时与液体辅料混合,配制成液体制剂。所述液体制剂可以但不限于用于皮下、肌肉或静脉注射给药,也可以但不限于通过喷雾给药到肺部、或通过喷雾经肺部给药到其它脏器组织(如肝脏)、或通过口咽吸入、或鼻腔给药等方式递送所述药物组合物。在一些实施方式中,所述药物组合物用于喷雾给药。
[0276]
在一些实施方式中,所述药物组合物可以为脂质体制剂的形式。在一些实施方式中,所述脂质体制剂中使用的药学上可接受的载体包含含胺的转染化合物(下文也可将其称为有机胺)、辅助脂质和/或聚乙二醇化脂质。其中,所述有机胺、辅助脂质和聚乙二醇化脂质可分别选自于中国专利申请cn103380113a(通过引用的方式将其整体并入本文)中所描述的含胺的转染化合物或其药学上可接受的盐或衍生物、辅助脂质和聚乙二醇化脂质中的一种或多种。
[0277]
在一些实施方式中,所述有机胺可为中国专利申请cn103380113a中描述的如式(601)所示的化合物或其药学上可接受的盐:
[0278][0279]
其中:
[0280]
x
101
和x
102
各自独立地是o、s、n-a或c-a,其中a是氢或c
1-c
20
烃链;
[0281]y101
和z
101
各自独立地是c=o、c=s、s=o、ch-oh或so2;
[0282]r101
、r
102
、r
103
、r
104
、r
105
、r
106
和r
107
各自独立地是氢,环状或无环的、被取代的或未被取代的、支链或直链脂族基团,环状或无环的、被取代的或未被取代的、支链或直链杂脂族基团,被取代的或未被取代的、支链或直链酰基,被取代的或未被取代的、支链或直链芳基,被取代的或未被取代的、支链或直链杂芳基;
[0283]
x是1-10的整数;
[0284]
n是1-3的整数,m是0-20的整数,p是0或1;其中,如果m=p=0,则r
102
是氢;
[0285]
并且,如果n或m中的至少一个是2,那么r
103
和在式(601)中的氮形成如式(602)或式(603)所示的结构:
[0286][0287]
其中,g、e和f各自独立地是1-6的整数,“hcc”代表烃链,且每个*n代表式(601)中的氮原子。
[0288]
在一些实施方式中,r
103
是多胺。在其它实施方式中,r
103
是缩酮。在一些实施方式中,在式(601)中的r
101
和r
102
中的每一个独立地是任意的被取代的或未被取代的、支链或直链烷基或烯基,所述烷基或烯基具有3至约20个碳原子,诸如8至约18个碳原子,和0至4个双键,诸如0至2个双键。
[0289]
在一些实施方式中,如果n和m中的每一个独立地具有1或3的值,那么r
103
可以是下述式(604)-式(613)中的任一个:
[0290][0291][0292]
其中,式(604)-式(613)中,g、e和f各自独立地是1-6的整数,每个“hcc”代表烃链,且每个*显示r
103
与在式(601)中的氮原子的可能连接点,其中在任意*位置上的每个h可以被替换以实现与在式(601)中的氮原子的连接。
[0293]
本领域技术人员可以通过任何合理的方法获得式(601)所示的化合物。在一些实施方式中,式(601)所示化合物可以根据中国专利申请cn103380113a中的描述制备。
[0294]
在一些实施方式中,所述有机胺为如式(614)所示的有机胺和/或如式(615)所示的有机胺:
[0295][0296]
所述辅助脂质为胆固醇、胆固醇的类似物和/或胆固醇的衍生物;
[0297]
所述聚乙二醇化脂质为1,2-二棕榈酰-sn-甘油-3-磷脂酰乙醇胺-n-[甲氧基(聚乙二醇)]-2000。
[0298]
在一些实施方式中,所述药物组合物中,所述有机胺、所述辅助脂质和所述聚乙二醇化脂质三者之间的摩尔比为(19.7-80):(19.7-80):(0.3-50),例如可以为(50-70):(20-40):(3-20)。
[0299]
在一些实施方式中,由本公开的sirna与上述含胺的转染试剂形成的药物组合物颗粒具有约30nm至约200nm的平均直径,通常为约40nm至约135nm,更通常地,该脂质体颗粒的平均直径是约50nm至约120nm、约50nm至约100nm、约60nm至约90nm或约70nm至约90nm,例如,该脂质体颗粒的平均直径是约30、40、50、60、70、75、80、85、90、100、110、120、130、140、150或160nm。
[0300]
在一些实施方式中,由本公开的sirna与上述含胺的转染试剂形成的药物组合物中,sirna与全部脂质(例如有机胺、辅助脂质和/或聚乙二醇化脂质)的重量比(重量/重量比)在从约1:1至约1:50、从约1:1至约1:30、从约1:3至约1:20、从约1:4至约1:18、从约1:5至约1:17、从约1:5至约1:15、从约1:5至约1:12、从约1:6至约1:12或从约1:6至约1:10的范围内,例如,本公开的sirna与全部脂质的重量比为约1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17或1:18。
[0301]
在一些实施方式中,所述药物组合物在销售时各组分可以独立存在,在使用时可以液体制剂的形式存在。在一些实施方式中,本公开提供的sirna与上述药学上可接受的载体形成的药物组合物可以按照已知的各种方法制备,只是用本公开提供的sirna替代现有sirna即可;在一些实施方式中,可以按照如下方法制备:
[0302]
将有机胺、辅助脂质和聚乙二醇化脂质按照上述摩尔比悬浮于醇中并混匀得到脂质溶液;醇的用量使得到的脂质溶液的总质量浓度为2-25mg/ml,例如可以为8-18mg/ml。所述醇选自药学上可接受的醇,诸如在室温附近为液体的醇,例如,乙醇、丙二醇、苯甲醇、甘
油、聚乙二醇200,聚乙二醇300,聚乙二醇400中的一种或多种,例如可以为乙醇。
[0303]
将本公开提供的sirna溶解于缓冲盐溶液中,得到sirna水溶液。缓冲盐溶液的浓度为0.05-0.5m,例如可以为0.1-0.2m,调节缓冲盐溶液的ph至4.0-5.5,例如可以为5.0-5.2,缓冲盐溶液的用量使sirna的浓度不超过0.6mg/ml,例如可以为0.2-0.4mg/ml。所述缓冲盐选自可溶性醋酸盐、可溶性柠檬酸盐中的一种或多种,例如可以为醋酸钠和/或醋酸钾。
[0304]
将脂质溶液和sirna水溶液混合,将混合后得到的产物在40-60℃孵育至少2分钟,例如可以为5-30分钟,得到孵育后的脂质体制剂。脂质溶液和sirna水溶液的体积比为1:(2-5),例如可以为1:4。
[0305]
将孵育后的脂质体制剂浓缩或稀释,去除杂质,除菌,得到本公开提供的药物组合物,其理化参数为ph值为6.5-8,包封率不低于80%,粒径为40-200nm,多分散指数不高于0.30,渗透压为250-400mosm/kg;例如理化参数可以为ph值为7.2-7.6,包封率不低于90%,粒径为60-100nm,多分散指数不高于0.20,渗透压为300-400mosm/kg。
[0306]
其中,浓缩或稀释可以在去除杂质之前、之后或同时进行。去除杂质的方法可以采用现有各种方法,例如可以使用切相流系统、中空纤维柱,在100k da条件下超滤,超滤交换溶液为ph7.4的磷酸盐缓冲液(pbs)。除菌的方法可以采用现有各种方法,例如可以在0.22μm滤器上过滤除菌。
[0307]
sirna缀合物
[0308]
本公开提供了一种sirna缀合物,该sirna缀合物含有本公开提供的sirna,以及缀合连接至该sirna的缀合基团。在一些实施方式中,所述缀合基团包含接头和药学上可接受的靶向基团和/或递送辅助基团,并且,所述sirna、所述接头和所述靶向基团或者所述递送辅助基团依次共价或非共价连接,每个所述靶向基团选自能够和细胞表面受体结合的配体,每个递送辅助基团选自能够增加所述sirna缀合物在递送目标器官或组织中的生物相容性的基团。
[0309]
在本公开的上下文中,除非另有说明,“缀合”是指两个或多个各自具有特定功能的化学部分之间以共价连接的方式彼此连接;相应地,“缀合物”是指该各个化学部分之间通过共价连接而形成的化合物。进一步地,“sirna缀合物”表示一个或多个具有特定功能的化学部分共价连接至sirna上而形成的化合物。sirna缀合物应根据上下文,理解为多个sirna缀合物的总称或者某个化学式所示的sirna缀合物。在本公开的上下文中,“缀合分子”应当理解为可通过反应缀合至sirna,最终形成本公开的sirna缀合物的特定化合物。
[0310]
一般来说,所述缀合基团包含药学上可接受的至少一个靶向基团和任选的接头(linker),并且,所述sirna、所述接头和所述靶向基团依次连接。在一种实施方式中,所述靶向基团为1-6个。在一种实施方式中,所述靶向基团为2-4个。所述sirna分子可以非共价或共价缀合至所述缀合基团,例如可以共价缀合至所述缀合基团。sirna与缀合基团的缀合位点可以在sirna正义链的3'端或5'端,也可在反义链的5'端,还可以在sirna的内部序列中。在一些具体的实施方式中,所述sirna与缀合基团的缀合位点在sirna正义链的3'末端。
[0311]
在一些实施方式中,所述缀合基团可以连接在核苷酸的磷酸基团、2'-位羟基或者碱基上。在一些实施方式中,所述缀合基团可以连接在3'-位羟基上,此时核苷酸之间采用2'-5'磷酸二酯键连接。当缀合基团连接在sirna链的末端时,所述缀合基团通常连接在核
苷酸的磷酸基团上;当缀合基团连接在sirna的内部序列时,所述缀合基团通常连接在核糖糖环或者碱基上。各种连接方式可参考:muthiah manoharan et.al.sirna conjugates carrying sequentially assembled trivalent n-acetylgalactosamine linked through nucleosides elicit robust gene silencing in vivo in hepatocytes.acs chemical biology,2015,10(5):1181-7.
[0312]
在一些实施方式中,所述sirna与缀合基团间可以通过酸不稳定的、或可还原的化学键相连,在细胞内涵体的酸性环境下,这些化学键可降解,从而使sirna成为自由状态。对于不可降解的缀合方式,缀合基团可连接至sirna的正义链,从而尽量降低缀合对sirna活性的影响。
[0313]
靶向基团可经由合适的接头与sirna分子相连,本领域技术人员可以根据靶向基团的具体类型选择合适的接头。这些接头、靶向基团的种类以及与sirna的连接方式可参见wo2015006740a2的公开内容,通过引用的方式将其整体内容并入本文。
[0314]
在一些实施方式中,所述靶向基团可以是sirna给药领域常规使用的配体,例如wo2009082607a2中描述的各种配体,以引用的方式将其全部公开内容并入本文。
[0315]
在一些实施方式中,至少一个或每个所述靶向基团选自能够和表达所述目标基因的细胞表面受体结合的配体。
[0316]
在一些实施方式中,至少一个或每个所述靶向基团选自能够和哺乳动物肝实质细胞表面受体结合的配体。在一些实施方式中,每个所述靶向基团独立地为与哺乳动物肝细胞表面的去唾液酸糖蛋白受体亲和的配体。在一些实施方式中,每个所述靶向基团独立地为去唾液酸糖蛋白或糖。在一些实施方式中,每个所述靶向基团独立地选自d-吡喃甘露糖、l-吡喃甘露糖、d-阿拉伯糖、d-呋喃木糖、l-呋喃木糖、d-葡萄糖、l-葡萄糖、d-半乳糖、l-半乳糖、α-d-呋喃甘露糖、β-d-呋喃甘露糖、α-d-吡喃甘露糖、β-d-吡喃甘露糖、α-d-吡喃葡萄糖、β-d-吡喃葡萄糖、α-d-呋喃葡萄糖、β-d-呋喃葡萄糖、α-d-呋喃果糖、α-d-吡喃果糖、α-d-吡喃半乳糖、β-d-吡喃半乳糖、α-d-呋喃半乳糖、β-d-呋喃半乳糖、葡糖胺、唾液酸、半乳糖胺、n-乙酰半乳糖胺、n-三氟乙酰半乳糖胺、n-丙酰半乳糖胺、n-正丁酰半乳糖胺、n-异丁酰半乳糖胺、2-氨基-3-o-[(r)-1-羧乙基]-2-脱氧-β-d-吡喃葡萄糖、2-脱氧-2-甲基氨基-l-吡喃葡萄糖、4,6-二脱氧-4-甲酰胺基-2,3-二-o-甲基-d-吡喃甘露糖、2-脱氧-2-磺氨基-d-吡喃葡萄糖、n-乙醇酰基-α-神经氨酸、5-硫代-β-d-吡喃葡萄糖、2,3,4-三-o-乙酰基-1-硫代-6-o-三苯甲基-α-d-吡喃葡萄糖苷甲酯、4-硫代-β-d-吡喃半乳糖、3,4,6,7-四-o-乙酰基-2-脱氧-1,5-二硫代-α-d-吡喃葡庚糖苷乙酯、2,5-脱水-d-阿洛糖腈、核糖、d-核糖、d-4-硫代核糖、l-核糖、l-4-硫代核糖中的一种。在一些实施方式中,至少一个或每个所述靶向基团为半乳糖或n-乙酰半乳糖胺。
[0317]
在一些实施方式中,至少一个或每个所述靶向基团选自能够和肺上皮细胞表面受体结合的配体。在一些实施方式中,每个所述靶向基团选自于靶向整合素αvβ6的基团或靶向整合素αvβ3的基团。在一些实施方式中,每个所述靶向基团独立地为多肽或小分子配体。
[0318]
在一些实施方式中,至少一个或每个所述递送辅助基团选自能够增加所述sirna缀合物在中枢神经系统中的生物相容性的基团。在一些实施方式中,至少一个或每个所述递送辅助基团选自亲脂性分子。在一些实施方式中,每个所述递送辅助基团是c
5-c
18
直链烃基或甾类化合物。
[0319]
在一些实施方式中,本公开的sirna缀合物中的接头具有如式(701)所示的结构:
[0320][0321]
其中,k为1-3的整数;
[0322]
la具有如式(702)所示的包含酰胺键的结构,lb具有如式(303)所示的包含n-酰基吡咯烷的结构,含有羰基和氧原子,lc为基于羟甲基氨基甲烷、二羟甲基氨基甲烷或三羟甲基氨基甲烷的连接基团;
[0323][0324]
其中,n
302
、q
302
和p
302
各自独立地为2-6的整数,可选地,n
302
、q
302
和p
302
各自独立地为2或3;n
303
为4-16的整数,可选地,n
303
为8-12的整数,表示基团共价连接的位点。
[0325]
所述接头中,每个la分别与一个所述靶向基团通过醚键连接,并通过lc部分中羟基的氧原子与lc部分形成醚键而连接;lb通过式(703)中的羰基与lc部分中氨基的氮原子形成酰胺键而连接,并通过式(703)中的氧原子与所述sirna通过氧原子形成磷酸酯键或硫代磷酸酯键相连接。
[0326]
在一些实施方式中,本公开提供的sirna缀合物具有如式(705)所示的结构:
[0327][0328]
其中,nu表示本公开提供的sirna,或者根据本公开的方法获得的sirna。
[0329]
在一些实施方式中,本公开的sirna缀合物中的接头具有式(706)所示的结构:
[0330][0331]
其中,n
306
为0-3的整数,每个p
306
独立地为1-6的整数,表示基团共价连接的位点;所述连接基团通过由*标出的氧原子与所述靶向基团形成醚键连接;所述连接基团由#标出的氧原子中的至少一个与所述sirna形成磷酸酯键或硫代磷酸酯键而连接,其余由#标出的氧原子与氢原子连接形成羟基,或者与c
1-c3烷基连接形成c
1-c3烷氧基;
[0332]
在一些实施方式中,本公开的sirna缀合物具有如式(707)所示的结构:
[0333][0334]
其中,nu表示本公开提供的sirna,或者根据本公开的方法获得的sirna。
[0335]
在一些实施方式中,本公开的sirna缀合物具有中国专利申请cn110959011a中式(1)所示的结构,同时,该专利也详细公开了制备式(1)所示的sirna缀合物的方法,以引用的方式将上述文献各自整体并入本文。
[0336]
在一些实施方式中,本公开的sirna缀合物具有式(708)所示的结构:
[0337][0338]
其中,
[0339]
n1为选自1-3的整数,n3为选自0-4的整数;
[0340]
每个m1、m2或m3各自独立地为选自2-10的整数;
[0341]r10
、r
11
、r
12
、r
13
、r
14
或r
15
各自独立地为h,或选自于由以下基团所组成的组:c
1-c
10
烷基、c
1-c
10
卤代烷基以及c
1-c
10
烷氧基;
[0342]
r3具有式a59所示的结构:
[0343][0344]
其中,e1为oh、sh或bh2,nu表示本公开提供的sirna;
[0345]
r2是长度为1-20个碳原子的直链亚烷基,其中一个或多个碳原子任选地被选自于以下基团所组成的组中的任何一个或多个所替换:c(o)、nh、o、s、ch=n、s(o)2、c
2-c
10
亚烯基、c
2-c
10
亚炔基、c
6-c
10
亚芳基、c
3-c
18
亚杂环基和c
5-c
10
亚杂芳基;并且其中r2可任选地具有由以下基团所组成的组中的任何一个或多个的取代基:c
1-c
10
烷基、c
6-c
10
芳基、c
5-c
10
杂芳基、c
1-c
10
卤代烷基、-oc
1-c
10
烷基、-oc
1-c
10
烷基苯基、-c
1-c
10
烷基-oh、-oc
1-c
10
卤代烷基、-sc
1-c
10
烷基、-sc
1-c
10
烷基苯基、-c
1-c
10
烷基-sh、-sc
1-c
10
卤代烷基、卤素取代基、-oh、-sh、-nh2、-c
1-c
10
烷基-nh2、-n(c
1-c
10
烷基)(c
1-c
10
烷基)、-nh(c
1-c
10
烷基)、-n(c
1-c
10
烷基)(c
1-c
10
烷基苯基)、-nh(c
1-c
10
烷基苯基)、氰基、硝基、-co2h、-c(o)o(c
1-c
10
烷基)、-con(c
1-c
10
烷基)(c
1-c
10
烷基)、-conh(c
1-c
10
烷基)、-conh2、-nhc(o)(c
1-c
10
烷基)、-nhc(o)(苯基)、-n(c
1-c
10
烷基)c(o)(c
1-c
10
烷基)、-n(c
1-c
10
烷基)c(o)(苯基)、-c(o)c
1-c
10
烷基、-c(o)c
1-c
10
烷基苯基、-c(o)c
1-c
10
卤烷基、-oc(o)c
1-c
10
烷基、-so2(c
1-c
10
烷基)、-so2(苯基)、-so2(c
1-c
10
卤代烷基)、-so2nh2、-so2nh(c
1-c
10
烷基)、-so2nh(苯基)、-nhso2(c
1-c
10
烷基)、-nhso2(苯基)和-nhso2(c
1-c
10
卤代烷基);
[0346]
每个l1独立地是长度为1-70个碳原子的直链亚烷基,其中一个或多个碳原子任选地被选自于以下基团所组成的组中的任何一个或多个所替换:c(o)、nh、o、s、ch=n、s(o)2、c
2-c
10
亚烯基、c
2-c
10
亚炔基、c
6-c
10
亚芳基、c
3-c
18
亚杂环基和c
5-c
10
亚杂芳基;并且其中,l1可任选地具有由以下基团所组成的组中的任何一个或多个的取代基:c
1-c
10
烷基、c
6-c
10
芳基、c
5-c
10
杂芳基、c
1-c
10
卤代烷基、-oc
1-c
10
烷基、-oc
1-c
10
烷基苯基、-c
1-c
10
烷基-oh、-oc
1-c
10
卤代烷基、-sc
1-c
10
烷基、-sc
1-c
10
烷基苯基、-c
1-c
10
烷基-sh、-sc
1-c
10
卤代烷基、卤素取代基、-oh、-sh、-nh2、-c
1-c
10
烷基-nh2、-n(c
1-c
10
烷基)(c
1-c
10
烷基)、-nh(c
1-c
10
烷基)、-n(c
1-c
10
烷基)(c
1-c
10
烷基苯基)、-nh(c
1-c
10
烷基苯基)、氰基、硝基、-co2h、-c(o)o(c
1-c
10
烷基)、-con(c
1-c
10
烷基)(c
1-c
10
烷基)、-conh(c
1-c
10
烷基)、-conh2,-nhc(o)(c
1-c
10
烷基)、-nhc(o)(苯基)、-n(c
1-c
10
烷基)c(o)(c
1-c
10
烷基)、-n(c
1-c
10
烷基)c(o)(苯基)、-c(o)c
1-c
10
烷基、-c(o)c
1-c
10
烷基苯基、-c(o)c
1-c
10
卤烷基、-oc(o)c
1-c
10
烷基、-so2(c
1-c
10
烷基)、-so2(苯基)、-so2(c
1-c
10
卤代烷基)、-so2nh2、-so2nh(c
1-c
10
烷基)、-so2nh(苯基)、-nhso2(c
1-c
10
烷基)、-nhso2(苯基)和-nhso2(c
1-c
10
卤代烷基);
[0347]
表示基团共价连接的位点;
[0348]
m1表示靶向基团,其定义和可选择的范围与上述相同。在一些实施方式中,每个m1独立地选自对哺乳动物肝脏细胞表面上的去唾液酸糖蛋白受体具有亲合力的配体中的一种。
[0349]
技术人员会理解的是,尽管为了方便起见,l1被定义为线性烷基,但是它可能不是
线性基团或者名称不同,例如由于上述替换和/或置换而产生的胺或烯基。为了本公开内容的目的,l1的长度是连接两个附着点的链中的原子数。为此目的,将替换所述直链亚烷基的碳原子而得到的环(如亚杂环基或亚杂芳基)计为一个原子。在一些实施方式中,每个l1独立地选自式a1-a26基团中的一种或多种的连接组合:
[0350]
[0351][0352]
其中,j1为1-20的整数;j1为1-20的整数;r’为c1-c10的烷基;ra选自式a27-a45基团中的一种:
[0353][0354]
rb为c1-c10的烷基;
[0355]
当m1为对哺乳动物肝脏细胞表面上的去唾液酸糖蛋白受体具有亲合力的配体时,
在一些实施方式中,n1可以是1-3的整数,n3可以是0-4的整数,保证所述缀合物中m1配体的个数至少为2;在一些实施方式中,n1+n3≥2,这样可以使得m1配体的个数至少为3,使得m1配体与肝表面去唾液酸糖蛋白受体更容易结合,进而促进所述缀合物通过内吞作用进入细胞。实验表明,当m1配体的个数大于3个时,m1配体与肝表面去唾液酸糖蛋白受体结合的容易程度增加并不明显,因此,从合成容易程度、结构/工艺成本和递送效率等多方面综合考虑,在一些实施方式中,n1为1-2的整数,n3为0-1的整数,且n1+n3=2-3。
[0356]
在一些实施方式中,m1、m2和m3独立地选自2-10的整数时,可以使多个m1配体之间的空间位置适合m1配体与肝表面去唾液酸糖蛋白受体的结合,为了使本公开提供的缀合物更为简单,更容易合成和/或降低成本,在一些实施方式中,m1、m2和m3各自独立地为2-5的整数,在一些实施方式中,m1=m2=m3。
[0357]
本领域技术人员可以理解,当r
10
、r
11
、r
12
、r
13
、r
14
和r
15
各自独立地选自h、c
1-c
10
烷基、c
1-c
10
卤代烷基、以及c
1-c
10
烷氧基中的一种时,不会改变本文公开的缀合物的性质,均可以实现本公开的目的。在一些实施方式中,r
10
、r
11
、r
12
、r
13
、r
14
和r
15
各自独立地选自h、甲基和乙基。在一些实施方式中,r
10
、r
11
、r
12
、r
13
、r
14
和r
15
均为h。
[0358]
根据本公开提供的sirna缀合物,r3为式a59所示结构的基团,其中,e1为oh、sh或bh2,基于制备原料易获取性的考虑,在一些实施方式中,e1为oh或sh。
[0359]
在一些实施方式中,r2的选择是为了实现与含氮骨架上的n与a59的连接。在本公开的上下文中,“含氮骨架”是指连接有r
10
、r
11
、r
12
、r
13
、r
14
和r
15
的碳原子与n互相连接的链状结构。因此,r2可以是任何能够以适当方式将a59基团连接至含氮骨架上的n的连接基团。在一些实施方式中,在通过固相合成的工艺制备本公开的sirna缀合物的情况下,r2基团中需要同时含有与含氮骨架上的n连接的连接位点和与r3中的p相连接的连接位点。在一些实施方式中,r2中所述与含氮骨架上的n连接的位点与n形成酰胺键,所述与r3上的p连接的位点与p形成磷酸酯键。在一些实施方式中,r2是b5、b6、b5’或b6’:
[0360]
[0361]
其中,表示基团共价键连接的位点。
[0362]
q2的取值范围可以是1-10的整数,在一些实施方式中,q2为1-5的整数。
[0363]
l1的作用是将m1配体与含氮骨架上的n连接,为本公开的sirna缀合物提供靶向功能。在一些实施方式中,l1选自式a1-a26基团中的一种或多种的连接组合。在一些实施方式中,l1选自a1、a4、a5、a6、a8、a10、a11和a13中的一种或多种的连接组合;在一些实施方式中,l1选自a1、a4、a8、a10和a11中至少2个的连接组合;在一些实施方式中,l1选自a1、a8、a10中至少2个的连接组合。
[0364]
在一些实施方式中,l1的长度可以为3-25个原子,3-20个原子、4-15个原子或5-12个原子。在一些实施方式中是,l1的长度为3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、30个、35个、40个、45个、50个、55个、60个原子。
[0365]
在一些实施方式中,j1为2-10的整数,在一些实施方式中,j1为3-5的整数。在一些实施方式中,j2为2-10的整数,在一些实施方式中,j2为3-5的整数。r’为c1-c4的烷基,在一些实施方式中,r’为甲基、乙基和异丙基中的一种。ra为a27、a28、a29、a30和a31中的一种,在一些实施方式中,ra为a27或a28。rb为c1-c5的烷基,在一些实施方式中,rb为甲基、乙基、异丙基和丁基中的一种。在一些实施方式中,在式a1-a26中各自对j1、j2、r’、ra、rb进行选择,以实现m1配体与含氮骨架上的n连接,并使m1配体之间的空间位置更适合m1配体与肝表面去唾液酸糖蛋白受体结合。
[0366]
在一些实施方式中,本公开的sirna缀合物具有式(903)、(904)、(905)、(906)、(907)、(908)、(909)、(910)、(911)、(912)、(913)、(914)、(915)、(916)、(917)、(918)、(919)、(920)、(921)或(922)所示的结构:
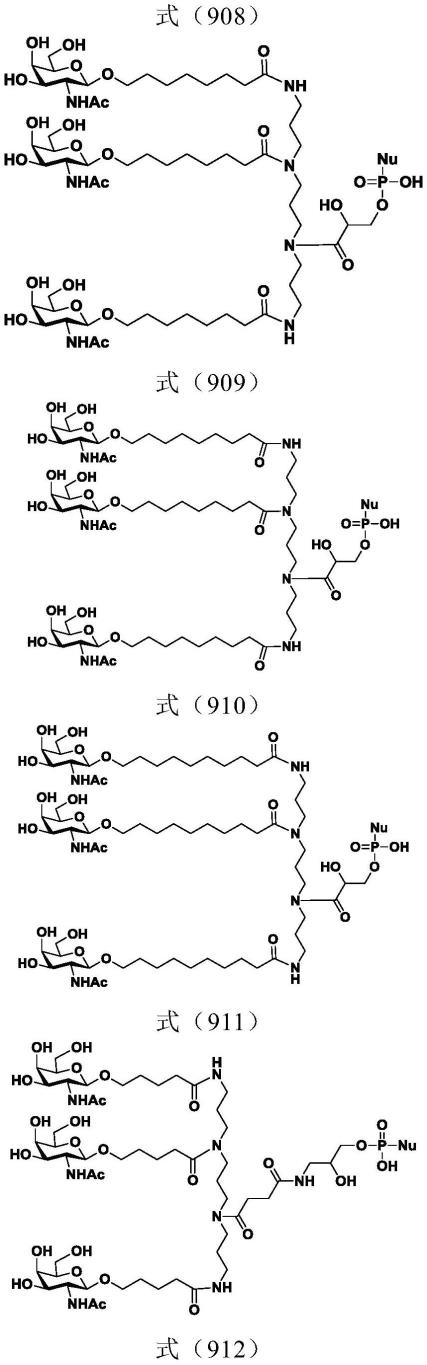
[0367]
[0368]
[0369]
[0370]
[0371]
[0372][0373]
在一些实施方式中,式a59中的p可以连接到sirna序列中任何可能的位置,例如,式a59中的p可以连接到sirna正义链或反义链的任何一个核苷酸上;在一些实施方式中,式a59中的p连接到sirna正义链的任何一个核苷酸上。在一些实施方式中,式a59中的p连接到sirna正义链或反义链的端部;在一些实施方式中,式a59中的p连接到sirna正义链的端部。所述端部指所述正义链或所述反义链中从其一端起算的前4个核苷酸。在一些实施方式中,式a59中的p连接到sirna正义链或反义链的末端;在一些实施方式中,式a59中的p连接到sirna正义链的3'末端。在连接至sirna的正义链的上述位置的情况下,本公开提供的缀合物进入细胞后,在解旋时,可以释放出单独的sirna反义链,以调节靶基因表达。
[0374]
式a59中的p可以连接到sirna中的核苷酸上任何可能的位置,例如,核苷酸的5'位、核苷酸的2'位、核苷酸的3'位或核苷酸的碱基上。在一些实施方式中,式a59中的p可通过形成磷酸二酯键连接至所述sirna中的核苷酸的2'位、3'位或5'位。在一些实施方式中,式a59中的p连接在sirna正义链3'末端核苷酸的3'羟基脱氢后形成的氧原子上,或者式a59中的p通过取代sirna正义链中的一个核苷酸的2'-羟基中的氢与核苷酸连接,或者式a59中的p通过取代sirna正义链5'末端核苷酸的5'羟基中的氢与核苷酸连接。
[0375]
在一些实施方式中,本公开的sirna缀合物包含的sirna可以是例如表1中列出的sirna。包含这些sirna的sirna缀合物表现出低的脱靶效应和高的目标基因表达的mrna抑制活性。
[0376]
本公开sirna缀合物的制备
[0377]
上述sirna缀合物可以通过现有技术中已经详细描述的方法进行合成。本领域技术人员可通过本领域熟知的方式,获得本公开的sirna缀合物。如wo2014025805a1中记载了式(705)所示结构的制备方法,rajeev等人在chembiochem 2015,16,903-908中描述了式(707)所示结构的制备方法。中国专利申请cn110959011a也详细公开了制备式(708)所示的寡核苷酸缀合物的方法。以引用的方式将上述文献内容整体并入本文。
[0378]
本公开的sirna缀合物也可以与药学上可接受的其它辅料联用,该辅料可以为本领域常规采用的各种制剂或化合物的一种或多种,详情可参见上文关于本公开的药物组合物的描述。
[0379]
本公开的sirna、药物组合物及sirna缀合物的应用
[0380]
在一些实施方式中,本公开提供了本公开提供的sirna、药物组合物和/或sirna缀合物在用于治疗和/或预防与目标基因表达的mrna水平相关的疾病或症状的药物中的用途。在一些实施方式中,所述特定基因是肝细胞中异常表达的基因。在一些实施方式中,所述特定基因是肝脏中表达的内源性基因。在一些实施方式中,所述特定基因是在肝脏中繁殖的病原体基因。在一些实施方式中,所述特定基因是肺上皮细胞中表达的基因。在一些实施方式中,所述特定基因是中枢神经系统中表达的基因。在一些实施方式中,所述特定基因是肿瘤细胞中表达的基因。在一些实施方式中,所述所述目标基因表达的mrna选自以下基因转录的mrna中的一种:ace2、angptl3、apoa、apob、apoc、ar、ask1、c5、col1a1、ctgf、ebola、foxo1、fto、fvii、fxi、fxii、gcgr、hbv、hcv、hsd17b13、p53、pcsk9、pnp、plg、pkk、kng、sars-cov-2、scd1、scnn1a、sod1、stat3、timp-1、tmprss6、xo、insr、srebf1、hdv、rptor、tlk2、lpa、c3、agt。在一些实施方式中,所述目标基因表达的mrna选自乙型肝炎病毒基因(hbv)表达的mrna、血管生成素样蛋白3(angptl3)基因表达的mrna或者载脂蛋白c3(apoc3)基因表达的mrna。在一些实施方式中,所述与目标基因表达的mrna水平相关的疾病或症状是慢性肝病、肝炎、肝纤维化疾病、肝增生性疾病和/或血脂异常。在一些实施方式中,所述与目标基因表达的mrna水平相关的疾病或症状是乙型肝炎。
[0381]
在一些实施方式中,本公开提供了一种治疗和/或预防与目标基因表达的mrna水平相关的疾病或症状的方法,所述方法包括向有需要的受试者给予有效量的本公开提供的sirna、药物组合物和/或sirna缀合物。在一些实施方式中,所述所述目标基因表达的mrna选自以下基因转录的mrna中的一种:ace2、angptl3、apoa、apob、apoc、ar、ask1、c5、col1a1、ctgf、ebola、foxo1、fto、fvii、fxi、fxii、gcgr、hbv、hcv、hsd17b13、p53、pcsk9、pnp、plg、pkk、kng、sars-cov-2、scd1、scnn1a、sod1、stat3、timp-1、tmprss6、xo、insr、srebf1、hdv、rptor、tlk2、lpa、c3、agt。在一些实施方式中,所述目标基因表达的mrna选自乙型肝炎病毒基因(hbv)表达的mrna、血管生成素样蛋白3(angptl3)基因表达的mrna或者载脂蛋白c3(apoc3)基因表达的mrna。在一些实施方式中,所述与目标基因表达的mrna水平相关的疾病或症状是慢性肝病、肝炎、肝纤维化疾病、肝增生性疾病和/或血脂异常。在一些实施方式中,所述与目标基因表达的mrna水平相关的疾病或症状是乙型肝炎。
[0382]
在一些实施方式中,本公开提供的缀合物也可以用于治疗其他肝脏疾病,包括以不需要的细胞增殖为特征的疾病、血液疾病、代谢疾病和以炎症为特征的疾病。肝脏的增殖疾病可以是良性或恶性疾病,例如癌症、肝细胞癌(hcc)、肝转移或肝母细胞瘤。肝脏血液学或炎症疾病可以是涉及凝血因子、补体介导的炎症或纤维化的疾病。肝脏的代谢疾病包括
血脂异常和葡萄糖调节的不规则性。在一个实施方案中,通过施用一种或多种具有与参与疾病的基因序列高度同源的sirna来治疗所述疾病。
[0383]
在一些实施方式中,本公开提供了一种抑制细胞中目标基因表达水平的方法,所述方法包括将有效量的本公开提供的sirna、药物组合物和/或sirna缀合物与所述细胞接触。在一些实施方式中,所述目标基因表达的mrna选自以下基因转录的mrna中的一种:ace2、angptl3、apoa、apob、apoc、ar、ask1、c5、col1a1、ctgf、ebola、foxo1、fto、fvii、fxi、fxii、gcgr、hbv、hcv、hsd17b13、p53、pcsk9、pnp、plg、pkk、kng、sars-cov-2、scd1、scnn1a、sod1、stat3、timp-1、tmprss6、xo、insr、srebf1、hdv、rptor、tlk2、lpa、c3、agt。在一些实施方式中,所述目标基因表达的mrna选自乙型肝炎病毒基因(hbv)表达的mrna、血管生成素样蛋白3(angptl3)基因表达的mrna或者载脂蛋白c3(apoc3)基因表达的mrna。
[0384]
通过将本公开提供的sirna、药物组合物和/或sirna缀合物给予有需要的受试者,可以通过对基因表达进行调控的机制达到预防和/或治疗由细胞中特定基因的表达而引起的病理状况或疾病的目的。因此,本公开提供的sirna、根据本公开的方法获得的sirna、药物组合物和/或sirna缀合物可用于预防和/或治疗所述病理状况或疾病、或用于制备用于预防和/或治疗本文所述病理状况或疾病的药物。
[0385]
本文所使用的术语“给药/给予”是指通过使得至少部分地将sirna、药物组合物和/或sirna缀合物定位于期望的位点以产生期望效果的方法或途径,将sirna、药物组合物和/或sirna缀合物放置入受试者体内。适于本公开方法的给药途径包括局部给药和全身给药。一般而言,局部给药导致与受试者整个身体相比将更多sirna、药物组合物和/或sirna缀合物递送至特定位点;而全身给药导致将所述sirna、药物组合物和/或sirna缀合物递送至受试者的基本整个身体。
[0386]
可通过本领域已知的任何合适途径向受试者给药,所述途径包括但不仅限于:口服或胃肠外途径,如静脉内给药、肌肉内给药、皮下给药、经皮给药、气道给药(气雾剂)、肺部给药、鼻部给药、直肠给药和局部给药(包括口腔含化给药和舌下给药)。给药频率可以是每天、每周、每两周、每三周、每个月或每年1次或多次。
[0387]
本公开所述的sirna、药物组合物和/或sirna缀合物的使用剂量可为本领域常规的剂量,所述剂量可以根据各种参数、尤其是受试者的年龄、体重和性别来确定。可在细胞培养或实验动物中通过标准药学程序测定毒性和疗效,例如测定ld50(使50%的群体致死的剂量)和ed50(在量反应中指能引起50%最大反应强度的剂量,在质反应中,指引起50%实验对象出现阳性反应时的剂量)。可基于由细胞培养分析和动物研究得到的数据得出人用剂量的范围。
[0388]
在给予本公开所述的sirna、药物组合物和/或sirna缀合物时,例如,对于雄性或雌性、6-12周龄、体重18-25g的c57bl/6j或c3h/hencrlvr小鼠,以所述sirna、药物组合物和/或sirna缀合物中的sirna的量计:对于sirna与药学上可接受的缀合分子形成的sirna缀合物,其sirna用量可以为0.001-100mg/kg体重,在一些实施方式中为0.01-50mg/kg体重,在进一步的实施方式中为0.05-20mg/kg体重,在更进一步的实施方式中为0.1-15mg/kg体重,在又进一步的实施方式中为0.1-10mg/kg体重。在给予本公开所述的sirna、药物组合物和/或sirna缀合物时,可优选上述用量。
[0389]
另外,通过将本公开的sirna、药物组合物和/或sirna缀合物导入特定基因异常表
达的细胞,还可以通过基因表达调控的机制达到抑制细胞中该特定基因的表达这一目的。在一些实施方式中,所述细胞为肝细胞。在一些实施方式中,所述肝细胞可以是选自hep3b、hepg2、huh7等肝癌细胞系的细胞或分离的原代肝细胞,在一些实施方式中为原代肝细胞。
[0390]
采用本公开提供的方法抑制特定基因在细胞中表达,所提供的sirna、药物组合物和/或sirna缀合物中的sirna的用量是本领域技术人员根据期望获得的效果容易确定的。例如,在一些实施方式中,所述sirna、药物组合物和/或sirna缀合物是sirna缀合物,所提供的sirna缀合物中的sirna用量是这样的量:其足以减少靶基因的表达,并导致在靶细胞表面处1pm至1μm、或0.01nm至100nm、或0.05nm至50nm或至约5nm的细胞外浓度。达到该局部浓度所需的量将随各种因素而变化,所述因素包括递送方法、递送部位、在递送部位和靶细胞或组织之间的细胞层的数目、递送是局部还是全身等。在递送部位处的浓度可以显著高于在靶细胞或组织的表面处的浓度。
[0391]
试剂盒
[0392]
本公开提供了一种试剂盒,所述试剂盒包含本公开提供的sirna、药物组合物和/或sirna缀合物。
[0393]
在一些实施方式中,本文所述的试剂盒可在一个容器中提供sirna、药物组合物和/或缀合物。在一些实施方式中,本文所述的试剂盒可包含一个提供药学上可接受的赋形剂的容器。在一些实施方式中,所述试剂盒中还可包含其它成分,如稳定剂或防腐剂等。在一些实施方式中,本文所述的试剂盒可在不同于提供本文所述sirna、药物组合物和/或缀合物的容器以外的其它容器中包含至少一种其它治疗剂。在一些实施方式中,所述试剂盒可包含用于将sirna、药物组合物和/或缀合物与药学上可接受的载体和/或辅料或其它成分(若有的话)进行混合的说明书。
[0394]
在本公开的试剂盒中,所述sirna和药学上可接受的载体和/或辅料以及所述药物组合物和/或缀合物,和/或药学上可接受的辅料可以任何形式提供,例如液体形式、干燥形式或冻干形式。在一些实施方式中,所述sirna和药学上可接受的载体和/或辅料以及所述药物组合物和/或缀合物和任选的药学上可接受的辅料基本上纯净和/或无菌。在一些实施方式中,可在本公开的试剂盒中提供无菌水。
[0395]
下面将通过实施例来进一步说明本公开,但是本公开并不因此而受到任何限制。
[0396]
实施例
[0397]
除非特别说明,以下实施例中所用到的试剂均为市售商品。
[0398]
实施例1化合物z10的制备
[0399]
本制备例中,按照以下方法,合成了实施例1中的化合物。
[0400]
(1-1)z2的合成
[0401][0402]
在0℃下,将87.27g的tipdscl2(1,3-二氯-1,1,3,3-四异丙基二硅氧烷,276.67mmol,北京偶合科技有限公司)和72g的化合物z1(276.67mmol)加入到857.14ml的无水吡啶(10.62mol)溶液中,升至25℃反应12h。然后向反应液中加入2000ml的乙酸乙酯,并用500ml的饱和食盐水洗涤1次,有机相经na2so4干燥、过滤、浓缩,得到的剩余物经柱色谱纯化(硅胶,v(石油醚)∶v(乙酸乙酯)=5:1-1:1)梯度洗脱,收集包含反应产物的洗脱液,蒸发除去溶剂得到34g化合物z2。1h nmr:(400mhz,cdcl3)δ7.25(t,j=8.4hz,1h),6.68(t,j=9.6hz,1h),4.98(d,j=2.0hz,1h),4.27-4.26(m,1h),4.06-4.00(m,1h),3.97-3.94(m,3h),2.80(d,j=2.4hz,1h),2.14(s,3h),1.03-0.89(m,3h).m/z(es+):理论,[m+h]
+
,502.75,检测,[m+h]
+
,502.20。
[0403]
(1-2)z3的合成
[0404][0405]
在-10℃下,将4.95g氢化钠(123.88mmol)、12.85ml碘甲烷(12.85ml)和按照步骤(1-1)中所述方法得到的51.9g的化合物z2(103.23mmol)加入到520ml的无水dmf中,反应3h。将反应液加入到0℃的2000ml的饱和的氯化铵溶液中,用1000ml乙酸乙酯萃取1次,合并得到有机相,用饱和食盐水洗涤3次,每次500ml,然后用无水na2so4干燥、过滤和减压浓缩,得到的剩余物经柱色谱纯化(硅胶,v(石油醚)∶v(乙酸乙酯)=20:1),收集包含反应产物的洗脱液,蒸发除去溶剂得到36g的化合物z3。m/z(es+):理论,[m+h]
+
,517.77,检测,[m+h]
+
,517.89。
[0406]
(1-3)z4的合成
[0407][0408]
室温下,将27.58ml浓度为1m的四丁基氟化铵(tbaf)的四氢呋喃溶液和5.70g的化合物z3加入到70ml的四氢呋喃溶液中,反应12h。反应液经减压浓缩后,剩余物用1000ml乙酸乙酯溶解后,得到的有机相经饱和食盐水洗涤3次,每次500ml,然后用无水na2so4干燥、过滤和减压浓缩后,得到的剩余物经柱色谱纯化(硅胶,v(石油醚)∶v(乙酸乙酯)=1:5),收集包含反应产物的洗脱液,蒸发除去溶剂得到21g的化合物z4。1h nmr(400mhz,cdcl3):δ7.25(t,j=9.6hz,1h),6.78(t,j=9.6hz,1h),5.06(d,j=4.4hz,1h),4.19-4.17(m,1h),3.98-3.95(m,2h),3.87-3.82(m,1h),3.76-3.74(m,1h),3.48(s,3h),2.75(d,j=7.2hz,1h),2.24(s,3h),2.01(t,j=5.6hz,1h).m/z(es+):理论,[m+h]
+
,576.64,检测,[m+h]
+
:576.10
[0409]
(1-4)z5的合成
[0410][0411]
在氩气保护下,将8.24g化合物z4(30.0mmol)溶于60ml的无水吡啶中,将反应液降温至5℃,将12.8g的dmtrcl(36.06mmol)加入反应液中,搅拌20min后升至室温,继续反应7h,向反应液中加入100ml饱和碳酸氢钠溶液和100ml乙酸乙酯,有机相用5wt%的柠檬酸水溶液洗涤六次,每次100ml,然后用100ml饱和碳酸氢钠水溶液和100ml饱和食盐水溶液洗涤,用无水硫酸钠干燥,减压蒸除溶剂并用油泵抽滤至干得到18.4g的化合物z5。m/z(es+):理论,[m+h]
+
,577.64,检测,[m+h]
+
,577.24。
[0412]
(1-5)z6的合成
[0413][0414]
氩气保护下,将18.4g化合物z5(26.7mmol)和10.89g咪唑(160.2mmol)溶解于200ml干燥的dmf中,然后加入22g的tbdpscl(80.1mmol),室温下反应3h,然后向反应液中加200ml的水和200ml的乙酸乙酯分液,水相经乙酸乙酯萃取3次,每次100ml,合并有机相,并经5wt%柠檬酸的水溶液淋洗两次,每次100ml,再用100ml饱和食盐水溶液洗涤一次,用无水硫酸钠干燥和减压浓缩,得到21.76g的化合物z6。m/z(es+):理论,[m+h]
+
,816,04,检测,[m+h]
+
,815.68。
[0415]
(1-6)z7的合成
[0416][0417]
将21.76g的化合物z6(26.7mmol)溶于100ml的dcm中,加入预先在4℃冷藏的100ml的缓冲液(所述缓冲液为的2.0g的tsoh溶于70ml dcm和30ml的无水甲醇),反应30min。向反应液中滴加饱和碳酸氢钠溶液至溶液变成无色,加入100ml的dcm溶液,分液得到的有机相再次用200ml的饱和碳酸氢钠溶液萃取至水相呈碱性后,经100ml的饱和食盐水溶液洗涤,用无水硫酸钠干燥和减压脱溶,得到的剩余物经硅胶柱纯化(v(石油醚)∶v(乙酸乙酯)=50:1-5:1)梯度洗脱,收集包含反应产物的洗脱液,蒸发除去溶剂并真空干燥,得到12.88g的化合物z7。m/z(es+):理论,[m+h]
+
,513.67,检测,[m+h]
+
:513.57。
[0418]
(1-7)z8的合成
[0419][0420]
氩气保护下,将12.82g的亚甲基二磷酸四乙酯(44.51mmol)溶于90ml四氢呋喃溶液中,降温至0℃后,缓慢地加入6.79g的叔丁醇钾(60.54mmol),搅拌15min后,升至室温后反应30min,以得到含有亚甲基二磷酸四乙酯的混合液。
7.29(m,1h),7.20(t,j=10.2hz,1h),6.77(tdd,j=21.8,17.0,5.5hz,1h),6.19-6.00(m,1h),5.05(t,j=4.9hz,1h),4.59(s,1h),4.53(s,1h),4.33-4.12(m,1h),4.08
–
3.90(m,4h),3.89-3.52(m,4h),3.36(d,j=11.7hz,3h),2.86-2.73(m,2h),2.20(s,3h),1.30-1.18(m,6h),1.24-1.07(m,12h).1p nmr(122mhz,dmso)δ149.0,148.8,17.10,16.70.m/z(es+):理论,[m+h]
+
,607.58,检测,[m+h]
+
,607.00。
[0428]
制备例2p10化合物的制备
[0429]
本制备例中,按照以下方法,合成了实施例2的化合物。
[0430]
(2-1)按照制备例1步骤(1-7)所述的的方法,制备z8化合物。
[0431]
(2-2)p9化合物的合成
[0432][0433]
氩气保护下,将4.75g的tmsoi(三甲基碘化亚砜,式中以me3si表示)溶于25ml的二甲基亚砜中,加入浓度为60wt%的1.55g氢化钠,搅拌反应1h,向反应液中加入5.0g的化合物z8,室温下反应2h。然后将反应液置于冰浴下降温至0℃,再加入饱和的氯化铵溶液淬灭反应,搅拌片刻后,向反应液中加入乙酸乙酯分液,有机相经食盐水洗涤两次,每次100ml,经减压浓缩、真空干燥后,剩余物用50ml的四氢呋喃溶解,再加入8.5ml浓度为1m的四丁基氟化铵(tbaf)的四氢呋喃溶液,室温下反应30min后,将反应体系浓缩除去溶剂后,进行柱层析纯化(以v(石油醚)∶v(乙酸乙酯)=30:1-3:1进行梯度洗脱),收集包含反应产物的洗脱液,蒸发除去溶剂,得到400mg的化合物p9。m/z(es+):理论,[m+h]
+
,421.39,检测,[m+h]
+
,421.16。
[0434]
(2-3)p10化合物的合成
[0435][0436]
室温下,将400mg的化合物p9、19.5mg的1-甲基咪唑、50mg的四氮唑加入到50ml的二氯甲烷溶液中,氩气置换三次后,加入430mg的双(二异丙基氨基)(2-氰基乙氧基)膦,室温下反应2h,将反应液置于冰水浴中降温至0℃,然后加入10ml饱和碳酸氢钠溶液淬灭反应,用50ml二氯甲烷分液,得到的有机相用100ml的碳酸氢钠溶液洗涤,浓缩后柱层析纯化,
以v(石油醚)∶v(二氯甲烷)=1:1的混合洗脱液作为流动相洗脱,收集包含反应产物的洗脱液,蒸发除去溶剂后得到150mg的化合物p10。所得到的p10化合物的结构如式(102)所示。1h nmr(400mhz,dmso-d6)δ7.36(td,j=8.6,2.5hz,1h),7.21(t,j=10.2hz,1h),6.78(dddd,j=29.2,21.8,17.1,5.5hz,1h),6.18
–
6.03(m,1h),5.06(t,j=5.6hz,1h),4.64
–
4.50(m,1h),4.24(ddt,j=33.9,10.7,5.3hz,1h),4.10
–
3.93(m,4h),3.89
–
3.73(m,3h),3.77
–
3.60(m,2h),3.63
–
3.54(m,2h),3.39(s,2h),2.88
–
2.71(m,2h),2.67
–
2.55(m,1h),2.21(d,j=2.3hz,3h),1.34
–
1.18(m,9h),1.22
–
1.06(m,15h).1p nmr(202mhz,dmso)δ149.3,149.1,16.7,16.3.m/z(es+):理论,[m+h]
+
,621.67,检测,[m+h]
+
,621.00。
[0437]
制备例3 sirna1-13的合成
[0438]
(3-1)合成sirna的正义链
[0439]
通过固相亚磷酰胺法,按照表1中各sirna的正义链核苷酸排布顺序自3'-5'方向逐一连接核苷单体。每连接一个核苷单体都包括脱保护、偶联、盖帽、氧化或硫化四步反应。其中,两个核苷酸之间采用磷酸酯连接时,连接后一个核苷单体时,包括脱保护、偶联、盖帽、氧化四步反应。两个核苷酸之间采用硫代磷酸酯连接时,连接后一个核苷单体时,包括保护、偶联、盖帽、硫化四步反应。合成条件给定如下:
[0440]
核苷单体以0.1m浓度的乙腈溶液提供,每一步的脱保护反应的条件相同,即温度为25℃,反应时间为70秒,脱保护试剂为二氯乙酸的二氯甲烷溶液(3%v/v),二氯乙酸与固相载体上4,4'-二甲氧基三苯甲基保护基的摩尔比为5:1。
[0441]
每一步偶联反应条件均相同,包括温度为25℃,固相载体上连接的核酸序列与核苷单体的摩尔比为1:10,固相载体上连接的核酸序列和偶联试剂的摩尔比为1:65,反应时间为600秒,偶联试剂为5-乙硫基-1h-四氮唑的0.5m乙腈溶液。
[0442]
每一步盖帽条件均相同,包括温度为25℃,反应时间为15秒。盖帽试剂溶液为摩尔比为1:1的capa和capb的混合溶液,盖帽试剂与固相载体上连接的核酸序列的摩尔比为乙酸酐:n-甲基咪唑:固相载体上连接的核酸序列=1:1:1。
[0443]
每一步氧化反应条件相同,包括温度为25℃,反应时间为15秒,氧化试剂为浓度为0.05m的碘水。碘与偶联步骤中固相载体上连接的核酸序列的摩尔比为30:1。反应在四氢呋喃:水:吡啶=3:1:1的混合溶剂中进行。
[0444]
每一步硫化反应的条件相同,包括温度为25℃,反应时间为300秒,硫化试剂为氢化黄原素。硫化试剂与偶联步骤中固相载体上连接的核酸序列的摩尔比为120:1。反应在乙腈:吡啶=1:1的混合溶剂中进行。
[0445]
切割和脱保护条件如下:将合成的连接有载体的核苷酸序列加入浓度为25wt%的氨水中,氨水用量为0.5ml/μmol,在55℃反应16h,除去液体,真空浓缩至干。
[0446]
纯化与脱盐:利用制备型离子色谱纯化柱(source 15q),通过nacl的梯度洗脱,完成核酸的纯化。具体而言为:洗脱剂a:20mm磷酸钠(ph 8.1),溶剂为水/乙腈=9:1(体积比);洗脱剂b:1.5m氯化钠,20mm磷酸钠(ph 8.1),溶剂为水/乙腈=9:1(体积比);洗脱梯度:洗脱剂a:洗脱剂b=100:0-50:50梯度洗脱。收集产品洗脱液后合并,采用反相色谱纯化柱进行脱盐,具体条件包括采用葡聚糖凝胶柱进行脱盐,填料为葡聚糖凝胶g25,以去离子水洗脱。
[0447]
检测:使用离子交换色谱(iex-hplc)检测纯度,使用液质联用(lc-ms)分析分子
量。
[0448]
(3-2)合成sirna的反义链
[0449]
通过固相亚磷酰胺法,利用通用固相载体(unylinker
tm loaded hl solid supports,kinovate life sciences公司)起始循环,按照表1中sirna的反义链组成分别合成sirna1-13的反义链。固相合成方法中的脱保护、偶联、盖帽、氧化或硫化反应条件,切割和脱保护,纯化与脱盐条件与合成正义链相同。
[0450]
(3-3)退火
[0451]
将正义链与反义链以等摩尔比混合,溶于注射用水中并加热至95℃,缓慢降到室温后,两条单链通过氢键作用形成双链结构。在上述合成完成后,使用离子交换色谱(iex-hplc)检测纯度,并以液质联用色谱(lc-ms)进行分子量检测,确认所合成的sirna为表1中的sirna1-13。
[0452]
制备例4缀合物1的合成
[0453]
按照wo2019/105437a1中制备例1中“缀合物1”的方法得到本公开的缀合物1,唯一的区别在于:在连接反义链的最后一个核苷酸(即5’末端核苷酸)时,将该核苷酸替换为本公开实施例1中的z10。采用液质联用仪(lc-ms,liquid chromatography-mass spectrometry,购于waters公司,型号:lct premier)进行分子量检测。其结果,实测值与理论值一致,从而确定所合成的缀合物1是目标设计的含有式(201)所示基团的双链核酸序列。缀合物1的结构如下式(801)所示:
[0454][0455]
其中,式(801)中的nu为本公开表1中的sirna1。
[0456]
制备例5缀合物2的合成
[0457]
按照wo2019/105437a1中制备例1中“缀合物1”的方法得到本公开的缀合物2,唯一的区别在于:在连接反义链的最后一个核苷酸(即5’末端核苷酸)时,将该核苷酸替换为本公开实施例2中的化合物p10。采用液质联用仪(lc-ms,liquid chromatography-mass spectrometry,购于waters公司,型号:lct premier)进行分子量检测。其结果,实测值与理论值一致,从而确定所合成的缀合物2是目标设计的含有式(202)所示基团的双链核酸序列。缀合物2的结构如下式(802)所示:
[0458][0459]
其中,式(802)中的nu为本公开表1中的sirna2。
[0460]
对比制备例1参比缀合物1的合成
[0461]
按照wo2019/105437a1中制备例1中“缀合物1”的方法得到参比缀合物1。参比缀合物1的结构如下式(803)所示:
[0462][0463]
其中,式(803)中的nu为具有如下组成的sirna14。
[0464]
sirna14
[0465]
正义链:.
[0466]
cmscmsumumgmamgfgfcfamumamcmumumcmamamam
[0467]
(seq id no:27)
[0468]
反义链:
[0469]
vpumsufsumgmamafgmumamumgmcmcmufcmafamgmgmsumsum
[0470]
(seq id no:28)
[0471]
其中,字母组合vp表示该字母组合vp右侧相邻的一个核苷酸为乙烯基磷酸酯(5'-(e)-vinylphosphonate,e-vp)修饰的核苷酸。
[0472]
在上述本公开的sirna或缀合物制备完成后,使用标准手段冻干为固体粉末保存备用。
[0473]
实验例1本实验说明本公开的sirna缀合物在体外(in vitro)对hbv mrna表达量的抑制效率。
[0474]
在本实验例中,对缀合物1、缀合物2和参比缀合物1在hbv转基因小鼠c57bl/6j-tgn(alblhbv)44bri的肝原代细胞中对hbv mrna表达量的抑制效率进行了考察。
[0475]
hbv转基因小鼠c57bl/6j-tg(a1b1hbv)44bri/j购自北京大学医学部实验动物科学部,于实验前选择s/cov》10的小鼠进行试验,以下简称为44bri小鼠。
[0476]
从44bri小鼠新鲜肝组织中提取获得小鼠肝原代细胞,在opti-mem(1x)培养基(gibco公司,货号31985-070)中调整小鼠肝原代细胞密度至2
×
105细胞/ml,得到小鼠肝原代细胞悬液。随后在12孔板的不同培养孔中分别加入得到的小鼠肝原代细胞悬液,将小鼠肝原代细胞接种到培养孔中。加入小鼠肝原代细胞悬液的体积为0.5ml/孔,小鼠肝原代细胞数量为1
×
105细胞/孔。
[0477]
用depc化水将下面的sirna缀合物中的每一个分别配制成20μm(以sirna计)的sirna缀合物工作液,所用sirna缀合物分别为缀合物1、缀合物2或参比缀合物1。
[0478]
在不同的上述加入了小鼠肝原代细胞悬液的培养孔中,分别加入每个缀合物的sirna缀合物工作液,均匀混合,加入量为2.5μl/孔,每一sirna缀合物分别加入3个培养孔,得到含sirna(以sirna计,终浓度为10nm)的转染混合物,记为测试组。将另外3个加入小鼠肝原代细胞悬液的培养孔中的细胞液记为空白对照组。
[0479]
将每一含sirna的转染混合物和空白对照组置于含5%co2的培养箱中,在37℃下继续培养24h。
[0480]
随后,使用trizol(购自sigma公司,货号t9424)根据说明书记载的方法提取各孔细胞中的总rna,得到总rna水溶液。
[0481]
对于每孔细胞,分别取包含1μg总rna的总rna水溶液,使用反转录试剂盒goldenstar
tm rt6 cdna synthesis kit(购自北京擎科新业生物技术有限公司,货号tsk301m)提供的试剂,其中选取goldenstar
tm oligo(dt)
17
作为引物,按试剂盒说明书中反转录操作步骤配置反转录反应体系20μl,对各孔细胞的总rna进行反转录。反转录的条件为:对于每一反转录反应体系,将反转录反应体系置于50℃孵育50min,然后85℃孵育5min,最后4℃孵育5min,反应结束后,向反转录反应体系中加入depc水80μl,得到含cdna的溶液。
[0482]
对于每一反转录反应体系,分别取上述含cdna的溶液5μl做模板,使用sybr qpcr supermix plus试剂盒(购自近岸蛋白质科技有限公司,货号e096-01b)提供的试剂配制qpcr反应体系15μl,其中,用于扩增目标基因hbv和内参基因gapdh的pcr引物序列如表2所示,每条引物的终浓度为0.25μm。将各qpcr反应体系置于abi steponeplus real-time pcr仪上,使用三步法进行扩增,扩增程序为95℃预变性10min,然后95℃变性30s,60℃退火25s,72℃延伸25s,重复上述变性、退火、延伸的过程共40次后,得到含有扩增了目标基因hbv和内参基因gapdh的产物w。产物w随即依次经过95℃1min,55℃30s,95℃30s的孵育,实时荧光定量pcr仪分别收集产物w中目标基因hbv和内参基因gapdh的溶解曲线,得到目标基因hbv和内参基因gapdh的ct值。
[0483]
表2检测引物的序列
[0484][0485]
采用比较ct(δδct)法,对各测试组中目标基因hbv的相对表达水平和抑制率进行相对定量计算,计算方法如下:
[0486]
δct(测试组)=ct(测试组目标基因)
–
ct(测试组内参基因)
[0487]
δct(对照组)=ct(对照组目标基因)
–
ct(对照组内参基因)
[0488]
δδct(测试组)=δct(测试组)-δct(对照组平均)
[0489]
δδct(对照组)=δct(对照组)-δct(对照组平均)
[0490]
其中,δct(对照组平均)是对照组三个培养孔各自的δct(对照组)的算术平均值。从而,测试组和对照组的每一培养孔均对应一个δδct值。
[0491]
以对照组为基准,对测试组hbv mrna的表达水平进行归一化,定义空白对照组hbv mrna表达水平为100%,
[0492]
测试组hbv mrna相对表达水平=2-δδct(测试组)
×
100%
[0493]
测试组hbv mrna抑制率=(1-测试组hbv mrna相对表达水平)
×
100%
[0494]
以下表3示出了本公开的各缀合物在肝原代细胞中对hbv mrna表达抑制活性的检测结果。
[0495]
表3 sirna缀合物体外活性测试
[0496][0497][0498]
从表3的结果可以看出,表3中的本公开的缀合物1和缀合物2在细胞水平上均显示出优异的hbv基因表达抑制活性,和参比缀合物1相比,保持了相同的水平。
[0499]
实验例2本实验说明本公开的sirna缀合物在体内(in vivo)对hbv mrna表达量的抑制效率。
[0500]
使用乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)(上海科华生物)按照说明书记载的方法检测44bri小鼠血清hbsag含量,选取s/cov》10的小鼠,随机分组(均为雄性),每组5只小鼠,分别编号,以皮下注射的方式,向每只小鼠分别以0.1mg/kg小鼠体重的剂量(以sirna计)给予缀合物1、缀合物2或参比缀合物1,sirna缀合物分别以含0.02mg/ml(以sirna计)的sirna缀合物的1
×
pbs溶液形式提供,给药体积均为5ml/kg。
[0501]
以给药时间点作为第1天计算,在第8天处死动物,分别收集每只小鼠的肝脏组织,用rna later(sigma aldrich公司)保存;向每份肝组织中加入1ml trizol(sigma公司),在tissuelyset ii型全自动组织匀浆仪中破碎3次,每次30s,获得肝组织匀浆,向其中加入0.2ml氯仿,静置3min。在4℃下以12000rpm离心10min,取0.4ml上清。向上清中加入0.5ml异丙醇,室温下静置10min。4℃下以12000rpm离心10min,弃去上清。向沉淀中加入1ml乙醇洗涤沉淀,4℃下以12000rpm离心5min,弃去上清。沉淀中加入70μl depc化水,得到提取的总
rna溶液。
[0502]
对于每一小鼠的肝脏组织总rna,分别取包含1μg总rna的总rna水溶液10.5μl,使用反转录试剂盒reverse transcription system(购自promega公司,货号a3500),按试剂盒说明书中反转录操作步骤配制为反转录反应体系20μl,对总rna进行反转录。反转录的条件为:对于每一反转录反应体系,将反转录反应体系置于42℃孵育30min,然后于95℃孵育5min,最后于4℃孵育5min,反应结束后,向反转录反应体系中加入depc水80μl,得到含cdna的溶液。
[0503]
对于每一反转录反应体系,分别取上述含cdna的溶液5μl做模板,使用sybr select master mix试剂盒(applied biosystem公司)提供的试剂配制qpcr反应体系20μl,其中,用于扩增目标基因hbv和内参基因gapdh的pcr引物序列如表2所示,每条引物的终浓度为0.25μm。将各qpcr反应体系置于abi steponeplus real-time pcr仪上,使用三步法进行扩增,扩增程序为95℃预变性10min,然后95℃变性30s,60℃退火30s,72℃延伸30s,重复上述变性、退火、延伸的过程共40次后,得到含有扩增了目标基因hbv和内参基因gapdh的产物w。产物w随即依次经过95℃1min,55℃30s,95℃30s的孵育,实时荧光定量pcr仪分别收集产物w中目标基因hbv和内参基因gapdh的溶解曲线,得到目标基因hbv和内参基因gapdh的ct值。
[0504]
按照实验例1记载的方法,由ct值计算给予各sirna缀合物后,小鼠体内肝组织中hbv mrna的相对表达水平和抑制率。
[0505]
以下表4示出了本公开的各缀合物在小鼠体内对hbv mrna表达抑制活性的检测结果。
[0506]
表4 sirna缀合物在小鼠体内对hbv mrna表达的抑制活性
[0507][0508]
从表4的结果可以看出,表4中的本公开的缀合物1和缀合物2在小鼠体内均显示出优异的hbv基因表达抑制活性,同时和参比缀合物1相比,缀合物1和缀合物2在体内表现出相当的水平。
[0509]
实验例3本实验说明本发明的sirna缀合物的动物水平毒性。
[0510]
在sd大鼠(购自斯贝福(北京)生物技术有限公司)上,分别向每只大鼠皮下单次给予30mg/kg(以sirna计)的本公开的缀合物1、缀合物2和参比缀合物1,pbs为对照组,连续观察14天,期间大鼠表现无死亡或行为异常。对大体进行解剖,剖取肝组织,经取材、脱水、包埋、制片和染色后,制成病理切片,在光学显微镜下(显微镜型号:nikon eclipse ci,成像系统:nikon digital sight ds-fi2,made in japan)观察。其结果,给予缀合物1和缀合物2的大鼠的肝脏病理切片中,组织肝索结构清晰,肝细胞排列紧密,界限清晰,胞质丰富,着色均匀,胞核圆形,大小正常,静脉内皮完整正常,组织未见明显异常,而给予参比缀合物1的大鼠的肝脏病理切片中,可见肝细胞广泛水肿变性,细胞肿胀,胞质疏松淡染,大量肝细
胞还伴有脂肪变性,胞质内可见数量不等的圆形空泡,小叶内可见多处炎性细胞灶性浸润。由此可见,和参比缀合物1相比,本公开的缀合物1和缀合物2在毒性方面有着明显改善。
[0511]
以上详细描述了本公开的一些实施方式,但是,本公开并不限于上述实施方式中的具体细节,在本公开的技术构思范围内,可以对本公开的技术方案进行多种简单变型,这些简单变型均属于本公开的保护范围。
[0512]
另外需要说明的是,在上述一些实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本公开对各种可能的组合方式不再另行说明。
[0513]
此外,本公开的各种不同的实施方式之间也可以进行任意组合,只要其不违背本公开的思想,其同样应当视为本公开所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1