一种提高CE酶结构异构催化活性的方法及其突变体
一种提高ce酶结构异构催化活性的方法及其突变体
技术领域
1.本发明涉及一种提高ce酶结构异构催化活性的方法及其突变体,属于酶工程领域。
背景技术:
2.乳果糖(lactulose,β
‑
d
‑
半乳糖基
‑
1,4
‑
d
‑
果糖)是一种非消化性二糖,因其具有促进双歧杆菌的生长、 调节肠道ph值、抑制病原菌的生长等益生元特性而被广泛应用于食品和药品行业。目前,市场上的商业 化乳果糖主要通过化学法生产,生产过程中会产生高水平的副产物,并且化学法涉及复杂的分离和纯化步 骤易造成严重的环境污染,这些缺陷制约了乳果糖的应用。酶法合成乳果糖由于催化条件温和且生产更为 安全成为当前生产乳果糖的研究热点。当前用于酶法生产乳果糖的酶主要为β
‑
半乳糖苷酶和纤维二糖差向 异构酶(ce)。其中,β
‑
半乳糖苷酶生产过程中需要加入共底物果糖,存在副产物较多和乳果糖转化率较 低(约15%)的缺点。
3.当前报道的ce酶主要具有差向异构活性,而一些来源于嗜热微生物的ce酶,如caldicellulosiruptor saccharolyticus(csce),dictyoglomus turgidum(dtce),spirochaeta thermophila(stce),caldicellulosiruptor obsidiansis(coce)和dictyoglomus thermophilum(dhce)具有结构异构催化活性,即可以催化乳糖底物生成 乳果糖,成为新型生产乳果糖的方法。与传统的β
‑
半乳糖苷酶法生产乳果糖相比,ce酶具有更高的生产效 率且不需要共底物的参加,这为乳果糖的生产提供了更好的选择。
4.然而,利用ce酶制备乳果糖的方法仍存在着底物亲和力差、结构异构活性较低(大多数情况下不超 过差向异构化活性的10%)且有副产物依匹乳糖生成等缺陷,制约了其工业化应用进程。迄今为止,csce 的改造取得诸多成果,如通过随机突变方法提高了其结构异构活性;通过定点突变的方法提高了ce酶的 热稳定性等,但是其底物亲和力、乳果糖转化率及热稳定性等催化特性并未得到较大改善。
技术实现要素:
5.[技术问题]
[0006]
现有技术中ce酶的底物亲和力、乳果糖转化率和热稳定性未得到较大的改善,无法应用到乳果糖工 业化生产。
[0007]
[技术方案]
[0008]
本发明提供一种提高ce酶催化性能的分子改造方法,即基于半理性设计,通过点饱和突变技术重塑 ce底物结合口袋,获得具有高底物亲和力、结构异构活性的ce酶。本发明构建的突变体具有良好的催化 特性,对于促进乳果糖的绿色、高效合成具有重要意义。
[0009]
本发明的第一个目的是提供一种纤维二糖差向异构酶突变体,所述突变体是在氨基酸序列如seq id no.1所示的野生酶的基础上,将第371位和/或第355位进行突变。
[0010]
在一种实施方式中,所述突变体是在氨基酸序列如seq id no.1所示的野生酶的
基础上,将第371位 谷氨酰胺突变为丙氨酸、谷氨酸、半胱氨酸、苯丙氨酸、甘氨酸或精氨酸,将355位的色氨酸突变为丙氨 酸或谷氨酰胺。
[0011]
在一种实施方式中,所述突变体的氨基酸序列如seq id no.2~seq id no.9所示。
[0012]
本发明的第二个目的是提供编码所述纤维二糖差向异构酶突变体的基因。
[0013]
本发明的第三个目的是提供表达所述纤维二糖差向异构酶突变体或含有上述基因的载体。
[0014]
本发明的第四个目的是提供含有上述纤维二糖差向异构酶突变体或上述载体的重组菌。
[0015]
在一种实施方式中,所述的基因工程菌以大肠杆菌为宿主。
[0016]
在一种实施方式中,所述大肠杆菌包括bl21(de3)。
[0017]
在一种实施方式中,所述的基因工程菌的表达载体包括pet系列载体。
[0018]
在一种实施方式中,所述的基因工程菌的表达载体包括pet
‑
28b。
[0019]
本发明的第五个目的是提供一种提高纤维二糖差向异构酶结构异构活性的方法,所述方法为,在氨基 酸序列如seq id no.1所示的野生酶的基础上,将第371位谷氨酰胺和/或第355位色氨酸进行突变。
[0020]
在一种实施方式中,所述突变是在氨基酸序列如seq id no.1所示的野生酶的基础上,将第371位谷 氨酰胺突变为丙氨酸、谷氨酸、半胱氨酸、苯丙氨酸、甘氨酸或精氨酸,将355位的色氨酸突变为丙氨酸 或谷氨酰胺。
[0021]
本发明还提供所述纤维二糖差向异构酶突变体或上述重组菌在制备乳果糖中的应用。
[0022]
在一种实施方式中,在ph 7~8,70~80℃的反应条件下,以150~250mm的乳糖为底物,添加上述纤 维二糖差向异构酶突变体或上述重组菌,反应5~480min。
[0023]
本发明还提供所述纤维二糖差向异构酶突变体或上述重组菌在制备食品和药物中的应用。
[0024]
有益效果:
[0025]
通过对csce底物结合相关位点的改造,成功获得了催化性能提高的突变体。相较于原始酶,突变体 csce
‑
q371a、csce
‑
q371e、csce
‑
q371c、csce
‑
q371f、csce
‑
q371g、csce
‑
q371r的结构异构活性 较野生型ce酶提高了约36~232%,其中突变体csce
‑
q371e表现出较好的催化性能,结构异构酶活提高 了约232%,75℃条件下半衰期提高了约42%;且当反应达到平衡时对底物乳糖的转化效率较原始酶csce 提高了约14%。不仅如此,csce
‑
w355a、csce
‑
w355q的结构异构活性较原始酶csce提高了约45%和 198%,其中csce
‑
w355a突变体差向异构活性也较原始酶csce提高了约25%,在反应达到平衡时对乳 糖转化率提高至85%。
附图说明
[0026]
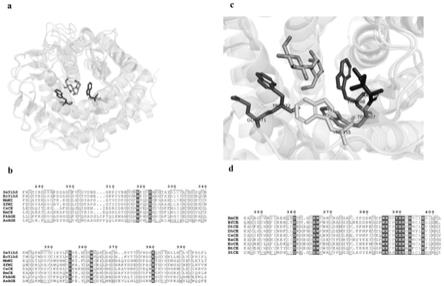
图1为csce底物结合相关位点晶体结构图及age家族和ce酶序列比对;
[0027]
图2为csce及阳性突变体在75℃条件下的相对活性及衰变常数;
[0028]
图3为csce及阳性突变体对乳糖底物的转化曲线。
具体实施方式
[0029]
primerstar mix dna聚合酶(takara)、上样缓冲液(takara)、sanprep柱式pcr产物纯化试剂盒及 sanprep柱式质粒dna小量抽提试剂盒(sangon biotech,shanghai);le琼脂糖(核酸电泳)、s4 核酸电泳染料(takara)。低分子质量标准蛋白、dna 5000ladder和dna 10000ladder购买于上海宝生物有 限公司;胰蛋白胨和酵母提取物购买于英国oxoid公司。
[0030]
lb液体培养基配置(1l):nacl 10g,胰蛋白胨10g,酵母提取物5g。
[0031]
lb琼脂培养基配置(1l):1l体积的lb液体培养基中加入15g琼脂糖粉,高压蒸汽灭菌后倒入9cm 无菌平板,为无抗生素lb固体培养基;加抗生素则为对应的抗生素选择性lb固体培养基,冷凝后放于 4℃冰箱放置备用。
[0032]
纤维二糖差向异构酶的差向异构活性和结构异构活性测定:在ph 7.5,75℃的反应条件下,以200mm 的乳糖为底物,添加0.2mg/ml纯化酶液,反应10或20min,反应10min的反应液用于检测差向异构反 应酶活性,反应20min的反应液用于检测结构异构反应酶活性,使用15%三氯乙酸(tca)溶液去除反应 液中的蛋白,稀释后进行hplc检测。依匹乳糖和乳果糖的检测通过hplc法检测,利用示差折光检测仪 分离和检测糖的浓度;其中色谱柱为asahipakvg
‑
504e预装柱和vg
‑
504e色谱分离柱,流动 相为乙腈、甲醇和水(75:20:5)的混合液。
[0033]
96孔板比色法检测乳果糖:
[0034]
(1)用灭过菌的牙签将菌落转移到96深孔板900μl lb培养基(含有kana 30ng/μl,iptg 0.4mm)。 使用封口膜密封96孔板,于30℃,800rpm条件下培养24h;每个孔取100μl培养液转移到新96孔板中 保存。
[0035]
(2)原96深孔板于3500rpm离心15min,弃上清,菌体在50μlpipes(50mm,ph7.5,含有10mg/ml 溶菌酶)中重新悬浮,于37℃培养箱中反应1h。
[0036]
(3)向步骤(2)中的96深孔板的每个孔加入50μl25 mm的乳糖溶液,使用微平板振荡器混匀后, 75℃反应10min,添加浓hcl(终浓度200mm)终止反应。
[0037]
(4)将反应液使用pipes缓冲液(50mm,ph7.5)稀释2倍,取50μl于新的96孔反应板中,加入 150μl乳果糖分析试剂(140μl 75%硫酸+10μl显色剂;显色剂为:2.5%半胱氨酸盐酸盐和0.08%色氨 酸溶液)。
[0038]
(5)48℃水浴保持70min,酶标仪518nm检测吸光度值。
[0039]
实施例1:确定csce的底物结合位点并构建突变质粒
[0040]
(1)氨基酸序列及结晶结构对比分析确定突变位点
[0041]
如图1的晶体结构比对图及氨基酸序列比对所示,ce酶活性中心的两个色氨酸(tryptophan,w)可 以识别和固定二糖底物,底物还原端附近的色氨酸w308在n
‑
乙酰基
‑
葡萄糖胺超家族中保守,而非还原 端的色氨酸w372仅在ce酶家族中保守。因此推测w372位点影响ce酶催化二糖的活性。
[0042]
(2)构建野生型重组质粒pet
‑
28b
‑
csce
[0043]
①
提取caldicellulosiruptorsaccharolyticus dsm 8903的全基因组作为模板,根据csce基因序列(geneaccession:yp_0011791132.1)设计引物,并引入酶切位点bamhi和ecori,通过pcr扩增表达csce的 基因片段。
[0044]
②
目的基因c端含有6个his
‑
tag,与pet
‑
28b(+)质粒分别进行bamhi和ecori双酶切,通过t4连接 酶连接,获得重组dna。
[0045]
③
通过热激法将重组dna导入至感受态e.coli top10菌株,将转化细胞涂布于含有kana的lb琼脂 平板,37℃倒置培养16h。
[0046]
④
挑取平板上的单菌落进行菌落pcr,使用琼脂糖核酸电泳检测条带,挑选条带大小正确的单菌落进 行测序。
[0047]
⑤
对测序成功的菌液进行质粒抽提,将质粒转化进e.coli bl21(de3),再次进行菌落pcr及测序对其 进行验证,最终获得野生型重组质粒pet
‑
28b
‑
csce。
[0048]
ce
‑
f:cgcggatccatggatattacaaggttttaag;
[0049]
ce
‑
r:ccggaattcttagtcaaccctttttattatc。
[0050]
(3)构建突变质粒
[0051]
为验证w372位点在ce酶催化中的作用,本发明以步骤(2)构建的野生型重组质粒pet
‑
28b
‑
csce 为模板,设计引物,采用pcr方法对底物非还原端csce
‑
w372位点进行饱和突变。
[0052]
突变引物如下所示:表1 csce
‑
w372突变引物如下
[0053]
[0054][0055]
pcr扩增:反应体系参照表2,总体积为50μl:
[0056][0057]
表2 pcr反应体系
[0058][0059]
反应程序:pcr反应扩增条件参照表3:
[0060]
表3 pcr反应扩增条件
[0061][0062]
使用pcr产物纯化试剂盒纯化pcr产物,得到高质量的dna纯化产物,向纯化后的pcr反应液中 加入quickcut dpn i酶,37℃消化5min;之后转化至感受态e.coli top10体系克隆宿主;将转化液涂布 于含kana的lb平板上,于37℃恒温恒湿培养箱培养12h;挑取单菌落37℃,200rpm过夜培养用于重组 质粒抽提及测序验证,经序列比对后,得到正确的19个csce
‑
w372位点的突变质粒。
[0063]
(4)突变体酶的表达纯化
[0064]
将步骤(3)中测序成功的19个突变质粒分别转入e.coli bl21(de3)感受态细胞中,转化液涂平板, 37℃过夜培养;然后挑取单菌落过夜培养获得活化菌液,将活化菌液以
1%(v/v)的接种量接种于lb培养基中,37℃培养至od
600
值为0.8,加入浓度为1m的iptg诱导8h,获得发酵液。
[0065]
将发酵液离心,收集菌体用于蛋白质的纯化:将收集的菌体用lysisbuffer(50mmna2hpo4,200mmnacl,10mmimidazole,ph7.5)悬浮混匀,放置冰浴中超声破碎,得到粗酶液,将粗酶液用0.22μm过滤膜过滤,备用;
[0066]
将过滤过的粗酶液通过ni离子亲和层析柱,先用washingbuffer(50mmna2hpo4,200mmnacl,100mmimidazole,ph7.5)清洗蛋白,最后用elutionbuffer(50mmna2hpo4,200mmnacl,250mmimidazole,ph7.5)洗脱,收集含有目的蛋白的洗脱液;对含有目的蛋白的洗脱液进行透析,透析液为浓度10mmpipesph7.5的缓冲液,共透析3次,每次6个小时,透析结束后,收集透析袋中的纯酶液于ep管中,4℃保存备用。采用sds
‑
page蛋白电泳检验蛋白纯化效率及纯度。
[0067]
(5)底物结合位点催化活性分析
[0068]
对步骤(4)中获得的19个突变体酶进行结构异构催化活性和差向异构催化活性的测定,结果如表4所示,csce
‑
w372位点进行饱和突变的大部分突变体完全丧失了催化活性,其中对结构异构催化活性影响较大,仅csce
‑
w372f、csce
‑
w372y两个突变体分别保留了约22%和49%的结构异构活性;w372位点突变体的差向异构催化活性也有不同程度的降低。这些结果表明了372位点的芳香族氨基酸色氨酸在催化中对乳糖底物的识别和固定作用。
[0069]
表4csce
‑
w372位点突变体结构异构及差向异构活性测定
[0070][0071]
实施例2:基于半理性设计重塑底物结合口袋并构建突变体
[0072]
为了提高csce结构异构活性,采用半理性设计策略,对底物结合相关位点csce
‑
w308和csce
‑
w372 周围的氨基酸进行饱和突变。对ce家族酶进行了序列比对和晶体结构分析,选取了两个色氨酸附近及底 物入口处的残基进行分子改造(图2),分别是底物还原端csce
‑
w308附近的csce
‑
i306和csce
‑
w307 (划分为a区域);底物非还原端csce
‑
w372附近的csce
‑
q371(划分为b区域);csce活性中心入 口处csce
‑
w355(划分为c区域),采用pcr的方法针对这4个位点进行饱和突变。
[0073]
pcr扩增反应体系和反应扩增条件同实施例1步骤(3),构建获得突变质粒,进行测序验证与序列 比对,得到正确的84个突变质粒,将突变质粒分别导入到宿主细胞e.coli bl21(de3),37℃过夜培养,挑 取单菌落接种于含有900μl lb培养基(含有kana 30ng/μl,iptg 0.4mm)的96孔深孔板中培养24h, 获得发酵液。通过比色法检测乳果糖的生成,初步筛选出8个结构异构活性较野生型ce酶提高的阳性突 变体(表5),其它突变体均无提高或者颜色减弱。
[0074]
表5比色法检测乳果糖
[0075][0076]
采用实施例2步骤(4)的方法进行突变体酶的纯化,已备后续实验使用。
[0077]
实施例3:纤维二糖差向异构酶的酶学性质研究
[0078]
热稳定性测定:将实施例2获得的8个纯化后的突变体酶分别与乳糖进行反应,测定乳果糖的生成量: 将2mg/ml的突变体酶与浓度为200mm的乳糖在温度75℃反应,于不同时间点(5min,10min,20min, 30min,60min,120min,240min,480min)取样,将不同时间点收取的反应液稀释后通过hplc检测乳果糖的 生成量以测定突变体酶的残余活性,如图2所示。以热处理前的酶活力为初始酶活(u0),热处理后的酶 活性为残余酶活(u0),所得数据根据方程ln(u
t
/u0)=k
d
*t作图,获得衰变常数k
d
,如图2所示。酶的半 衰期由t
1/2
=ln(2)/
‑
k
d
计算得出。
[0079]
酶反应时间曲线:将实施例2获得的8个纯化后的突变体酶分别与乳糖进行反应,测定乳果糖的生成 量:将2mg/ml的突变体酶与浓度为200mm的乳糖在温度75℃反应,于不同时间点(5min,10min,20min, 30min,60min,120min,240min,480min)取样,hplc法检测不同时间点样品中的产物(乳果糖、依匹乳糖) 及剩余底物乳糖的浓度,并绘制酶反应时间曲线(图3)。
[0080]
利用软件graphpadprism 8对乳果糖生成速率与底物浓度进行非线性michaelis
‑
menten拟合,获得米 氏常数km值和最大反应速率vmax,再由vmax=kcat*[e]公式计算得出催化常数kcat。
[0081]
酶催化活性见表6,csce
‑
q371a、csce
‑
q371e、csce
‑
q371c、csce
‑
q371f、csce
‑
q371g、 csce
‑
q371r的结构异构活性较野生型ce酶提高了约36~232%,其中突变体csce
‑
q371e表现出较好的 催化性能,结构异构酶活提高了约232%,75℃条件下半衰期提高了约42%(表7);当反应达到平衡时 对底物乳糖的转化效率提高至80%,相比野生型提高了14%(野生型乳糖转化率为70%)(图3)。不仅 如此,csce
‑
w355a、csce
‑
w355q的结构异构活性较野生型ce酶提高了约45%和198%,其中 csce
‑
w355a突变体差向异构活性也较野生型ce酶提高了约25%,在反应达到平衡时对乳糖转化率提高 至83%。
[0082]
表6酶催化活性及动力学参数测定
[0083][0084]
表7 csce及其突变体热稳定性参数
[0085][0086]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本 发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1