一种含花色苷果酒的护色发酵的方法
1.本发明涉及果酒加工技术领域,具体地,涉及一种生成methyl
‑
vitisin b的含花色苷果酒的护色发酵的方法。
背景技术:
2.果酒是以新鲜水果或果汁为原料,经过破碎、发酵或者浸泡等不同工艺制成的含有一定酒精度数的饮料酒。发酵型果酒的酿造过程包括原料预处理、发酵、澄清、陈酿等。其中发酵是果酒酿造环节最为重要的一步,受到各种因素的影响,其中发酵微生物是果酒酿造的关键,影响到果酒的色泽。颜色是衡量果酒品质的主要参数之一,它可以直观地反映出果酒的酿造工艺、风味和酒龄等,给消费者带来最明显的直观感受。
3.果酒的颜色主要源自于花色苷,花色苷的形态与含量对果酒的色调、颜色及稳定性有很大影响。c3g是自然界中含量最丰富的花色苷,广泛分布于桑葚、杨梅、蓝莓等多种水果中,对果酒的颜色起到至关重要的作用。花色苷的变化主要发生在果酒发酵的前期,该阶段花色苷及其衍生物的成分及含量直接影响着后期发酵过程中果酒色泽的改变和颜色的稳定性。目前,现有技术一般通过在酿造过程中添加色素或化学护色剂来调节和维持果酒的颜色,存在很大的食品安全隐患。
4.酿酒酵母是生产发酵型果酒的重要微生物,它对红酒的品质和感官质量起到重要影响。在果酒发酵过程中,一方面,酵母细胞壁会吸附溶液中的花色苷;另一方面,酵母细胞分泌的β
‑
葡萄糖苷酶也会导致花色苷被降解,从而导致溶液中的花色苷含量发生降低,最终导致酒体的色泽降低。由于不同酿酒酵母对花色苷的吸附作用和降解花色苷的能力存在差异,故而选择合适的酿酒菌株进行果酒发酵,可以有效减少发酵过程中的颜色损失,从而在一定程度上起到护色的作用。这将为保留果酒中花色苷的含量,稳定果酒的酒体颜色,增加营养功能性,生产出高品质果酒提供理论指导。
5.有研究报道“在糖酵解阶段由酵母产生的代谢物(乙醛和丙酮酸)会和葡萄花色苷缩合形成稳定性较高的吡喃花青素vitisin a和vitisin b”(何英霞.酿造因子对干红葡萄酒中花色苷衍生物vitisins和色泽品质的影响分析[d].甘肃农业大学,2016.),vitisins有利于酒品颜色的稳定性。
技术实现要素:
[0006]
本发明的目的是为了克服现有技术的上述不足,提供一种生成methyl
‑
vitisin b的含花色苷果酒的护色发酵的方法,保留溶液中的花色苷含量及增加methyl
‑
vitisin b含量,改善果酒的颜色品质。
[0007]
本发明的目的是提供一种生成methyl
‑
vitisin b的含花色苷果酒的护色发酵的方法。
[0008]
本发明的另一个目的是提供花色苷的衍生物methyl
‑
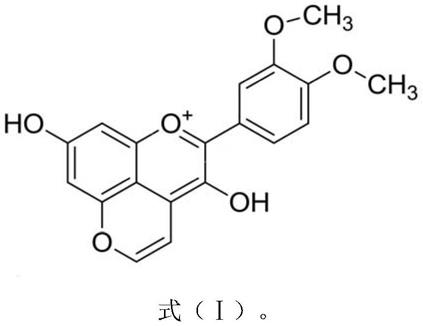
vitisin b,其特征在于,其化学结构式如式(ⅰ)所示:
[0009][0010]
为了实现上述目的,本发明是通过以下方案予以实现的:
[0011]
根据实际生产中果酒前期发酵的条件,添加适合酵母生长的各种辅助因子,调整糖度、ph值,构建果酒前期发酵的模拟发酵液,为后续探究花色苷在酵母发酵过程中的机制探究做铺垫。接种单菌株或复合菌株的酿酒酵母至含花色苷的模拟发酵液中,观察发酵过程中的颜色变化情况。取不同时间的发酵样品,利用uplc
‑
ms对发酵液中的呈色物质(花色苷及其产物)进行定性和定量分析。从而明确酵母在果酒发酵过程中花色苷的保留情况及衍生物methyl
‑
vitisin b的生成情况。
[0012]
一种生成methyl
‑
vitisin b的含花色苷果酒的护色发酵的方法,其特征在于,使用保藏于中国工业微生物菌种保藏管理中心的酿酒酵母cicc 31898、酿酒酵母cicc 31895、酿酒酵母cicc 31905和/或酿酒酵母cicc 31966中的一种或多种进行发酵,所述的methyl
‑
vitisin b是花色苷的衍生物,其化学结构式如式(ⅰ)所示:
[0013][0014][0015]
优选地,使用保藏于中国工业微生物菌种保藏管理中心的酿酒酵母cicc 31905进行发酵。
[0016]
优选地,所述的花色苷为矢车菊素
‑3‑
o
‑
葡萄糖苷(c3g)等一种或者多种花色苷。
[0017]
更优选地,所述的花色苷为矢车菊素
‑3‑
o
‑
葡萄糖苷(c3g)。
[0018]
优选地,所述的护色发酵的发酵液初始ph值在3.0~3.5范围内。
[0019]
优选地,所述的护色发酵的发酵液糖度以白利糖度计测定,其数值在19~22范围内。
[0020]
一种花色苷的衍生物methyl
‑
vitisin b,其特征在于,其化学结构式如式(ⅰ)所示:
[0021][0022]
与现有技术相比,本发明具有以下有益效果:
[0023]
本发明利用酿酒酵母d254酵母、2323酵母、rc212酵母、vl1酵母酿造果酒,保留了较多的c3g,促进矢车菊素生成methyl
‑
vitisin b,其中rc212酵母的保留c3g最多且生成的methyl
‑
vitisin b也最多。methyl
‑
vitisin b是花色苷衍生物进一步发生甲基化后得到的产物,该物质是一种新的花色苷衍生物。本发明提供了一种果酒酿造中有效的护色方法,为改善果酒的颜色品质提供了有效的工具和工艺。
附图说明
[0024]
图1为不同时间发酵液的颜色变化图;
[0025]
图2为520nm下各组的液相色谱图;
[0026]
图3为c3g的紫外
‑
可见吸收光谱图;
[0027]
图4为c3g的二级质谱图;
[0028]
图5为矢车菊素的紫外
‑
可见吸收光谱图;
[0029]
图6为矢车菊素的二级质谱图;
[0030]
图7为methyl
‑
vitisin b的紫外
‑
可见吸收光谱图;
[0031]
图8为methyl
‑
vitisin b的二级质谱图;
[0032]
图9为四株酵母在不同发酵时间下的c3g含量情况,各组分别选取3个样本,标注不同小写字母表示组间差异性显著(p<0.05),标注相同小写字母表示组间差异性不显著(p>0.05);
[0033]
图10为四株酵母在不同发酵时间下的矢车菊素含量情况,各组分别选取3个样本,标注不同小写字母表示组间差异性显著(p<0.05),标注相同小写字母表示组间差异性不显著(p>0.05);
[0034]
图11为四株酵母在不同发酵时间下的methyl
‑
vitisin b含量情况,各组分别选取3个样本,标注不同小写字母表示组间差异性显著(p<0.05),标注相同小写字母表示组间差异性不显著(p>0.05)。
具体实施方式
[0035]
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂
和材料。
[0036]
以下实施例所用材料如下:
[0037]
酿酒酵母均来自中国工业微生物菌种保藏管理中心(cicc),cicc 31898(原始编号d254)、cicc 31895(原始编号2323)、cicc 31905(原始编号rc212)及cicc 31966(原始编号vl1)。
[0038]
实验试剂:矢车菊素
‑3‑
o
‑
葡萄糖苷,本实验室分离得到,纯度>94%;甲醇,上海泰坦科技股份有限公司;甲酸(色谱级),天津市科密欧化学试剂有限公司;乙腈(色谱级),德国默克集团有限公司。
[0039]
实验仪器设备:le104e/02电子天平,梅特勒
‑
托利多仪器有限公司;ks15生物安全柜,美国thermo scientific公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;bxm
‑
30r灭菌锅,厦门致微仪器有限公司;uplc/ms
‑
8045三重四极杆液质联用仪,岛津(shimadzu)公司;c18(2.1
×
100mm,1.8μm)色谱柱,艾杰尔
‑
飞诺美公司;waters液相色谱仪,沃特世科技有限公司;c18(4.6
×
250mm,5.0μm)色谱柱,博纳艾杰尔科技有限公司。
[0040]
实施例1四种酵母在果酒发酵过程中对花色苷的影响
[0041]
1、实验方法
[0042]
(1)准备阶段
[0043]
将60ml专用发酵瓶清洗后置于烧杯内,封装好后置于高压蒸汽灭菌锅内121℃高温灭菌20min后,放入温度为65℃的烘箱里烘干,再将其置于超净工作台内备用。
[0044]
(2)模拟体系构建
[0045]
准确称取110.0g葡萄糖、110.0g果糖、2.0g酒石酸、2.0g磷酸二氢钾、0.5g氯化铵、0.2g七水硫酸镁,使用容量瓶定容到1000ml配成发酵液备用,再向发酵液中加入单体花色苷矢车菊素
‑3‑
葡萄糖苷(c3g),配制成含花色苷的模拟发酵液。使用饱和氢氧化钠溶液将溶液的ph值调至3.5,然后使用注射器取50ml溶液过0.22μm滤膜后转移到60ml发酵瓶中。
[0046]
(3)酵母接种与发酵条件
[0047]
用接种环从活化后的琼脂培养基上蘸取酵母转移至ypd培养基,在30℃、150r/min条件下培养24h。从液体培养基中分别吸取20μl菌悬液到装有200μl蒸馏水的1.5ml ep管内涡旋混匀,取20μl混合液滴至细胞计数板上,使用盖玻片覆盖后在显微镜上对其进行计数,记录相应的酵母数量。根据酵母数量确定接种的液体培养基体积,不足的体积使用已灭菌的空白培养基补足,使得每一瓶发酵液中的酵母数量相等,添加的培养基总体积为5ml。接种后的发酵液放置在25℃的生化培养箱中进行发酵,保持瓶盖不完全拧紧的状态,以便二氧化碳排出,发酵过程中严格避光。
[0048]
(4)花色苷及其衍生物定性分析
[0049]
利用uplc
‑
ms分析发酵液中的花色苷衍生物成分。
[0050]
样品前处理:取1.0ml发酵液离心后,使用0.22μm孔径的水系滤膜过滤后置于棕色的液相小瓶中备用。
[0051]
液相条件:使用c18反向色谱分析柱(2.1
×
100mm,1.8μm),色谱柱温度为35℃,流动相a为2%甲酸水,流动相b为100%乙腈,单次进样体积为5.0μl,流速为0.3ml/min,检测波长520nm,梯度洗脱程序为0~3min,6%~6%b;3~8min,6%~13%b;8~11min,13%~25%b;11~15min,25%~95%b;15~16min,95%~95%b;16~19min,95%~30%b;19~
21min,30%~13%b;21~23min,13%~6%b;23~25min,6%~6%b。
[0052]
质谱条件:使用岛津公司的ms
‑
8045型号的三重四级杆质谱仪进行质谱分析,esi接口,接口电压为4.0kv,接口温度为300℃,dl管温度为250℃,加热块温度为400℃,使用正、负离子扫描模式进行分析;使用氮气作为雾化气、干燥气和加热气,使用氩气作为碰撞气,其中雾化气流量为3.0l/min,干燥气流量为10.0l/min,加热气流量为10.0l/min,碰撞室压强为230kpa。
[0053]
(5)花色苷及其衍生物定量分析
[0054]
花色苷衍生物在520nm波长下有吸收且其含量与对应的峰面积成正比,故而可以通过分析液相色谱图的峰面积,参照c3g的标准曲线计算得到其含量变化情况。
[0055]
2、实验结果
[0056]
(1)发酵液颜色变化
[0057]
四株酿酒酵母(2323、d254、rc212、vl1)用于发酵实验,观察各株酵母在发酵过程中的颜色变化情况。
[0058]
由实验结果(图1)可知,发酵0天时,酵母组与无酵母组颜色无明显差别,各组的溶液均呈现鲜艳的红色。发酵2天时,未加酵母的溶液呈现鲜艳的红色;酵母的发酵作用会显著降低溶液中的颜色;发酵液在不同酵母发酵作用下的颜色差异不明显。发酵5天时,未加酵母的溶液颜色未出现明显衰减;酵母的发酵作用会显著降低溶液中的颜色,其中vl1酵母发酵后的溶液颜色偏红,其他酵母发酵后溶液的颜色偏黄,rc212发酵液的颜色高于其他三组酵母发酵液。
[0059]
(2)液相与质谱分析结果
[0060]
无酵母发酵对照组、酵母2323、酵母d254、酵母rc212、酵母vl1的发酵液在520nm波长下均有三个吸收峰(图2),其中1号峰的保留时间为13.6min,最大吸收波长(图3)为517nm,二级质谱结果(图4)表明该物质为c3g。2号峰的保留时间为15.5min,最大吸收波长(图5)为527nm,二级质谱结果(图6)表明该物质为矢车菊素。3号峰的保留时间为16.1min,最大吸收波长(图7)为505nm,二级质谱结果(图8)表明,推测该物质其为矢车菊素发生甲基化和衍生化生成的methyl
‑
vitisin b。
[0061]
利用hplc对发酵液中的花色苷以及花色苷相关产物进行含量分析。通过外标法分析得到c3g的标准曲线,矢车菊素与methyl
‑
vitisin b含量利用c3g的标准曲线进行计算得到。实验结果表明,发酵1~5天时,rc212酵母发酵液中的c3g含量(图9)显著高于其他三株酵母。发酵1~5天时,四株酵母发酵液中的矢车菊素苷元含量(图10)无显著性变化。发酵第5天时,rc212酵母发酵液中的methyl
‑
vitisin b含量(图11)显著高于其他三株酵母。
[0062]
(3)结果分析
[0063]
发酵液中的颜色变化主要与呈色物质的含量有关,本次实验只添加了花色苷这一种呈色物质进行实验。所以可以通过对比发酵现象与主要的呈色物质(花色苷及其产物)含量变化情况可以解释溶液中的颜色变化情况。
[0064]
rc212发酵液的颜色高于其他三组酵母发酵液,主要是由于发酵液中的c3g和methyl
‑
vitisin b含量显著高于其他三组酵母。
[0065]
研究表明,不同酿酒酵母的细胞壁对花色苷的吸附作用存在差异,不同酵母细胞的β
‑
葡萄糖苷酶活性也会影响花色苷的含量变化,rc212酵母对花色苷的保留作用可能与
酵母细胞壁的吸附作用和β
‑
糖苷酶活性有关。
[0066]
研究表明,果酒发酵过程中的活性小分子物质,如丙酮酸、乙醛等物质可以与花色苷发生化学反应,生成比花色苷结构更稳定的花色苷衍生物。而本实验所得到的methyl
‑
vitisin b是花色苷衍生物进一步发生甲基化后得到的产物,该物质是一种新的花色苷衍生物,尚未见过有其他人报道。它的产生与发酵液的配方有很大关系,同时也与酵母的发酵和代谢作用有很大的关系,这也是导致不同酵母最后methyl
‑
vitisin b的含量存在差异的原因,而rc212酵母在这种发酵条件下能够生成更高含量的methyl
‑
vitisin b,从而起到对果酒颜色的保护作用。
[0067]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1