一种制备手性四氢β-咔啉的酶及其制备方法和应用
一种制备手性四氢
β
‑
咔啉的酶及其制备方法和应用
技术领域
1.本发明涉及酶工程技术领域,尤其涉及一种制备手性四氢β
‑
咔啉的酶及其制备方法和应用。
背景技术:
2.β
‑
咔啉类化合物具有常见的三环吡啶[3,4
‑
b]吲哚环结构,是一大类天然或人工合成的吲哚生物碱。自1941年第一个β
‑
咔啉类化合物被gobel分离得到以来,目前已经有约400多个β
‑
咔啉类化合物被分离和鉴定。β
‑
咔啉类化合物通常根据其含氮六元环的饱和程度进行分类:完全饱和的β
‑
咔啉类化合物称为1,2,3,4
‑
四氢
‑
β
‑
咔啉,而部分或完全芳香化的分别称为3,4
‑
二氢
‑
β
‑
咔啉和β
‑
咔啉。β
‑
咔啉类化合物广泛存在于自然界,包括各种食品、植物、动物以及真菌和细菌。研究表明,β
‑
咔啉类化合物具有多样的生物活性。其中一些化合物已经被实验证明能够嵌入到dna分子中,有些甚至能够抑制拓扑异构酶和单胺氧化酶的活性,并与苯二氮卓受体或5
‑
羟基色胺受体等相互作用。目前已有9种包含β
‑
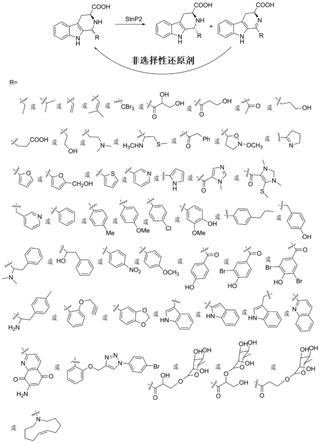
咔啉骨架的药物上市,如从pausinystalia yohimbe中分离得到的yohimbine,临床用于治疗男性各种类型疹以及性功能减退;礼来公司开发的5型磷酸二酯酶(pde5)抑制剂tadalafil,作为一线药物被用于治疗男性勃起功能障碍;人工合成的abecarnil,临床上可以作为抗焦虑药使用。
[0003]
β
‑
咔啉类化合物作为一类重要的化合物,合成化学家们开发了多种方法用于合成β
‑
咔啉类化合物。由于四氢β
‑
咔啉类化合物的c
‑
1位取代基的构型不同,往往会影响化合物的生物学活性或者药理活性,因此合成化学家们尝试了一些不对称化学合成方法用于合成c
‑
1具有不同构型的四氢β
‑
咔啉,这些合成方法都要使用手性催化剂或者手性配基,如附图1所示,八类手性催化剂或者手性配基的化学结构式,其中第一类,取代基为cl、br或者otf;第二类,取代基为h或者br;第三类中包括两种取代方式,其中3a类,指的是取代基r1和r2相同,都为i
‑
bu;3b类,指的是取代基r1和r2不同,r1为ch3,r2为nc5h
11
;第四类中包括两种取代方式,其中4a类,指的是取代基r1为t
‑
bu;4b类,指的是取代基r1为i
‑
pr;第六类中取代基r为2,4,6
‑
(ipr)3ph。2005年,kim,jong
‑
mi课题组报道了一种利用手性二异辛烷基硼烷(附图1中的1)作为催化剂,立体选择性的生成四氢β
‑
咔啉,这个催化剂的催化性能主要是由硼表面的两个异辛醇基和卤素基决定的,利用该催化剂nakagawa等人于1996年通过nb
‑
羟色胺与醛发生不对称pictet
‑
spengler反应,得到相应的s
‑
构型2
′‑
羟基四氢
‑
β
‑
咔啉(90%ee)。随后该课题组又在此基础上开发了一种类似的催化剂,如附图1中的化合物2。
[0004]
2004年,jacobsen课题组报道了另外一种含有n,n
‑
二异丁基酰胺手性硫脲催化剂(附图1中的3a),催化色胺类似物与醛反应生成ee为86
‑
95%的s
‑
四氢β
‑
咔啉、。2007年,该课题组通过将3a的n,n
‑
二异丁基酰胺基团改变为n,n
‑
甲基,戊基获得了手性硫脲催化剂,如附图1中的化合物3b,可以利用该催化剂使更多的色胺类似物与更多的醛反应,以81
‑
99%ee的选择性获得手性的s
‑
构型四氢β
‑
咔啉。2007年,该课题组还开发了手性硫脲催化剂,如附图1中的化合物4a和4b,和苯甲酸共同催化用于合成具有光学活性的r
‑
四氢β
‑
咔啉
的方法。seidel课题组在2014报道了另外一种手性硫脲催化剂,如附图1中的化合物5,该催化剂可以催化没有取代的色胺高效的生成手性的r
‑
四氢β
‑
咔啉。2006年,b.list开发了一种方法,该方法利用手性催化剂binol,如附图1中的化合物6,催化形成了r
‑
构型的四氢β
‑
咔啉。2002年,winterfeldt等利用附图1中的化合物7,与色胺类似物反应生成了高达89%的收率获得了r
‑
构型的四氢β
‑
咔啉。2018年,zhong等利用金鸡纳生物碱方胺,如附图1中的化合物8,作为催化剂,开发了一种在色胺衍生物和醛之间发生不对称pictet
‑
spengler反应,以获得良到优产率和ee值的r
‑
构型的四氢β
‑
咔啉的方法。
[0005]
目前多采用不对称化学合成的方法得到手性的四氢β
‑
咔啉,尚没有酶法合成手性四氢β
‑
咔啉。
[0006]
因此,本领域的技术人员致力于开发一种高活性和高立体选择性的酶,用来合成手性四氢β
‑
咔啉。
技术实现要素:
[0007]
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是开发一种酶法合成手性四氢β
‑
咔啉的方法。
[0008]
为实现上述目的,本发明提供了一种高活性和高立体选择性的酶,使其应用于c
‑
1位具有不同构型不同取代的四氢β
‑
咔啉拆分,用于合成c
‑
1手性四氢
‑
β
‑
咔啉。
[0009]
本发明提供一种制备手性四氢β
‑
咔啉的酶,其蛋白氨基酸序列如seq id no.1所示;编码该蛋白的dna分子核苷酸序列如seq id no.2所示。
[0010]
进一步地,制备手性四氢β
‑
咔啉的酶来源于streptomyces flocculus cgmcc4.1223,该菌种已经由公告号为cn102993168a的专利公开。
[0011]
进一步地,制备手性四氢β
‑
咔啉的酶还包括蛋白fad结合域;蛋白fad结合域氨基酸序列为seq id no.1中“gggvig”和“gid”部分。
[0012]
本发明还提供一种制备手性四氢β
‑
咔啉的酶的制备方法,包括以下步骤:
[0013]
步骤1、构建dna片段stnp2的宿主细胞,对来源于streptomyces flocculus cgmcc 4.1223的dna片段stnp2进行了克隆,获得含有dna片段stnp2的重组表达质粒的宿主细胞;
[0014]
步骤2、酶的表达纯化,将步骤1获得的宿主细胞接种、培养、收集和纯化,获得高活性蛋白;
[0015]
步骤3、蛋白生化分析,将步骤2获得的高活性蛋白用来催化四氢β
‑
咔啉底物,考察立体选择性。
[0016]
进一步地,上述步骤1还包括:
[0017]
步骤1.1、以streptomyces flocculus cgmcc 4.1223为模板,以stnp2_f和stnp2_r为引物,利用dna聚合酶进行pcr扩增,得到pcr扩增产物;pcr扩增产物经切胶纯化回收后以ndei和xhoi进行双酶切处理,获得pcr的双酶切产物;
[0018]
stnp2
‑
f核苷酸序列为:ccgttacatatgcctgaccggaagaacc,
[0019]
stnp2
‑
r核苷酸序列为:ccttactcgagtcaagccggtttggccgc;
[0020]
步骤1.2、将pet28a质粒以ndei和xhoi进行双酶切处理后进行切胶纯化回收,获得pet28a的双酶切产物。
[0021]
步骤1.3、以t4连接酶将步骤1.2获得的pet28a的双酶切产物和步骤1.1获得的pcr
的双酶切产物进行酶连反应,后转化至e.coli dh10b感受态细胞,涂布复苏液于卡那霉素抗性lb固体培养基中37℃过夜培养,获得单菌落。
[0022]
步骤1.4、挑取单菌落于卡那霉素抗性lb培养基,一部分培养液用于测序,另一部分培养液暂时置于4℃冰箱短期保存;测序正确转化子培养液以接种量转接至装有新鲜的含卡那霉素抗性的lb培养基培养,37℃过夜培养后,获得菌落培养液,取菌落培养液离心收集菌体,加入20%甘油重悬菌体,置于
‑
80℃冰箱保存;另取菌落培养液使用提取试剂盒获取重组质粒。
[0023]
步骤1.5、将步骤1.4获得的重组质粒转化至bl21(de3)/pgro7异源表达宿主细胞。
[0024]
进一步地,上述步骤1中,dna片段stnp2为编码制备手性四氢β
‑
咔啉的酶的dna分子。
[0025]
进一步地,上述步骤2中纯化包括亲和层析方法。
[0026]
进一步地,上述步骤3中四氢β
‑
咔啉底物包括一系列在c
‑
1位有不同取代基的四氢
‑
β
‑
咔啉。
[0027]
进一步地,制备手性四氢β
‑
咔啉的酶的制备方法还包括对步骤1.2中pet28a质粒、步骤1.5中bl21(de3)/pgro7异源表达的宿主细胞和步骤2中高活性蛋白的表达和纯化。
[0028]
本发明还提供一种制备手性四氢β
‑
咔啉的酶的应用,制备手性四氢β
‑
咔啉的酶作为手性催化剂应用于拆分c
‑
1具有不同构型的四氢β
‑
咔啉。
[0029]
进一步地,拆分具有不同构型的四氢β
‑
咔啉包括制备手性四氢β
‑
咔啉的酶识别在c
‑
1位具有s
‑
构型四氢
‑
β
‑
咔啉,将其转化为二氢β
‑
咔啉,从而产生r
‑
构型四氢
‑
β
‑
咔啉和识别在c
‑
1位具有r
‑
构型四氢
‑
β
‑
咔啉,将其转化为二氢β
‑
咔啉,从而产生s
‑
构型四氢
‑
β
‑
咔啉。
[0030]
进一步地,制备手性四氢β
‑
咔啉的酶或编码该酶的dna分子或含有编码该酶突变体的dna分子的重组表达质粒或含有该重组表达质粒的宿主细胞均可用于手性四氢β
‑
咔啉的制备。
[0031]
进一步地,一种高立体选择性的新型的催化四氢β
‑
咔啉转化为二氢β
‑
咔啉的酶,该酶来源于streptomyces flocculus cgmcc 4.1223,蛋白氨基酸序列如seq id no.1所示。
[0032]
进一步地,本发明还提供了一种编码该蛋白的dna分子,其核苷酸序列如seq id no.2所示。
[0033]
进一步地,本发明还提供了一种含有编码该蛋白的dna分子的重组表达质粒。
[0034]
进一步地,本发明还提供了一种含有上述重组表达质粒的宿主细胞。
[0035]
进一步地,上述蛋白或编码该蛋白的dna分子或含有编码该突变体的dna分子的重组表达质粒或含有上述重组表达质粒的宿主细胞均可用于合成手性四氢β
‑
咔啉。
[0036]
进一步地,本发明具有生物活性的蛋白可以通过iptg诱导的方式大量表达获得,通过亲和层析方法,对该蛋白或突变体蛋白进行分离纯化,得到高活性的蛋白。结果表明,利用l
‑
色氨酸或者色胺或者取代的色胺合成了一系列四氢
‑
β
‑
咔啉作为底物,且在c
‑
1有不同取代基(包括氢、甲基、乙基、丙基、苄基、苯基、取代苯基、羟基取代的烷基等),发现这些四氢
‑
β
‑
咔啉都可以被stnp2作为底物,立体选择性地将其中一个构型转化为二氢β
‑
咔啉,产生另一个构型的四氢β
‑
咔啉。
[0037]
进一步地,本发明对来源于streptomyces flocculus cgmcc 4.1223的stnp2进行了克隆,蛋白表达和生化分析,表明stnp2具有很好的底物宽泛性和严格的立体选择性,根据c
‑
1位的取代基不同用于催化合成c
‑
1不同构型的四氢
‑
β
‑
咔啉。本发明为利用stnp2对c
‑
1位具有不同构型的四氢
‑
β
‑
咔啉进行手性拆分奠定了基础,stnp2是目前第一个对c
‑
1位具有不同构型的四氢
‑
β
‑
咔啉进行手性拆分的酶。
[0038]
在本发明的较佳实施方式中,详细说明制备手性四氢β
‑
咔啉的酶stnp2宿主细胞的构建过程;
[0039]
在本发明的另一较佳实施方式中,详细说明制备手性四氢β
‑
咔啉的酶的表达和纯化过程;
[0040]
在本发明的另一较佳实施方式中,详细说明制备手性四氢β
‑
咔啉的酶stnp2催化对四氢β咔啉立体选择性的考察方法和结果。
[0041]
技术效果
[0042]
本发明提供的制备手性四氢β
‑
咔啉的酶,合成手性四氢β
‑
咔啉产率高,催化条件温和,专一性强,使用广泛。具体技术效果如下:
[0043]
1.只能把在c
‑
1位具有单一构型的四氢
‑
β
‑
咔啉转化为二氢β
‑
咔啉,而把另一构型的四氢
‑
β
‑
咔啉保留下来,所以其具有严格的立体选择性;
[0044]
2.在c
‑
1有不同取代基(包括氢、甲基、乙基、丙基、苄基、苯基、取代苯基、羟基取代的烷基等,附图2所示)的四氢
‑
β
‑
咔啉,发现这些四氢
‑
β
‑
咔啉都可以被stnp2作为底物,结果证实stnp2具有宽泛的底物选择性,可以接受c
‑
1不同取代的四氢
‑
β
‑
咔啉作为底物,所以stnp2具有很好的底物宽泛性,可以用来合成不同取代的手性四氢
‑
β
‑
咔啉
[0045]
3.制备手性四氢β
‑
咔啉的酶同时具有区域专一性,只能催化c
‑
1和n
‑
2位的脱氢。
[0046]
以下将结合附图2对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
[0047]
图1是现有技术中不对称化学合成方法用于合成c
‑
1具有不同构型四氢β
‑
咔啉的化学催化剂的结构式。
[0048]
图2是实施例3中表示制备手性四氢β
‑
咔啉的酶stnp2催化对c
‑
1位有不同取代基的四氢β
‑
咔啉转化产生手性四氢β
‑
咔啉的化学方程式,表明stnp2对四氢β
‑
咔啉立体选择性的原理。
具体实施方式
[0049]
以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
[0050]
实施例1:stnp2宿主细胞的构建
[0051]
(1)以streptomyces flocculus cgmcc 4.1223为模板,以stnp2_f和stnp2_r为引物,利用phanta max聚合酶(购自诺唯赞)进行pcr扩增(95℃5min;95℃30s,65℃30s,72℃1min,34个循环;72℃10min);pcr产物经切胶纯化回收后以ndei和xhoi进行双酶切处理。
[0052]
stnp2
‑
f:ccgttacatatgcctgaccggaagaacc
[0053]
stnp2
‑
r:ccttactcgagtcaagccggtttggccgc
[0054]
(2)将pet28a质粒以ndei和xhoi进行双酶切处理后进行切胶纯化回收。
[0055]
(3)以t4连接酶将pet28a的双酶切产物和pcr的双酶切产物进行酶连反应,后转化至e.coli dh10b感受态细胞,涂布复苏液于卡那霉素抗性lb固体培养基中37℃过夜培养。
[0056]
(4)挑取3
‑
4个单菌落于卡那霉素抗性lb培养基,一部分培养液用于测序,另一部分培养液暂时置于4℃冰箱短期保存。测序正确转化子培养液以接种量转接至装有新鲜的含卡那霉素抗性的5ml lb培养基培养,37℃过夜培养后,取2ml离心收集菌体,加入20%甘油重悬菌体,置于
‑
80℃冰箱保存;另取1ml使用之列提取试剂盒获取重组质粒。
[0057]
(5)将获得的重组质粒转化至bl21(de3)/pgro7异源表达宿主细胞
[0058]
实施例2:酶的表达纯化
[0059]
表达纯化方法:在lb固体培养基上挑取含重组质粒的大肠杆菌e.coli bl21(de3)单菌落,接种至40ml lb液体培养基(含50μg/ml卡那霉素抗生素和50μg/ml氯霉素),在37℃培养箱中,220rpm培养过夜。将7.5ml细菌培养液转移至含500ml液体lbbs培养基的2l摇瓶中,接种两瓶,在37℃培养箱中,220rpm培养至od600达到0.6
‑
0.8,加入0.3mm阿拉伯糖和0.4mm iptg诱导,于16℃,200rpm下诱导培养24h。收集1l发酵液,于5000rpm,离心20min收集细胞,将收集得到的细胞重悬于30ml镍柱结合缓冲液中,并置于冰水混合物中。超声破碎条件:工作5s,停顿10s,总计30min。将经过破碎处理后的混合物,于12,000rpm离心1h后,上清液过0.22μm滤膜过滤。将过滤后的样品上样经镍柱结合缓冲液预先平衡过的2ml镍填料,用10倍柱体积的50mm咪唑洗脱缓冲液冲洗杂蛋白,然后用5ml 250mm咪唑洗脱缓冲液洗脱目的蛋白,分管接样,每管500ul。nanodrop测定每管的蛋白浓度,合并浓度较高的几管蛋白液,稀释或者浓缩至2.5ml,上样经甘油缓冲液平衡过的脱盐柱,蛋白液流干后,加入3.5ml甘油缓冲液洗脱蛋白。
[0060]
实施例3:stnp2催化对四氢β
‑
咔啉立体选择性转化的考察
[0061]
如附图2所示制备手性四氢β
‑
咔啉的酶stnp2催化对四氢β
‑
咔啉产生手性四氢β
‑
咔啉过程的化学方程式,制备手性四氢β
‑
咔啉的酶stnp2可以以c
‑
1位有不同取代基的四氢
‑
β
‑
咔啉作为底物,其中一个构型的四氢
‑
β
‑
咔啉转化为相应的二氢β
‑
咔啉,同时产生另一个构型的四氢
‑
β
‑
咔啉,其中r表示c
‑
1位取代基,可以为43种不同的基团,分别为甲基、异丙基、乙烯基、2
‑
甲基丙
‑1‑
烯
‑1‑
基、三溴甲基、2,3
‑
二羟基丙酮基,乙酮基、正丙醇基、丙酸基、乙醇基、n,n
‑
二甲基
‑2‑
乙胺基、n
‑
甲基
‑2‑
(甲硫基)
‑1‑
乙胺基、苯乙酮基、2
‑
甲氧基异恶唑烷基、3,4
‑
二氢吡咯基、呋喃基、
‑
呋喃
‑2‑
甲醇基、2
‑
噻吩基、3
‑
吡啶基、2
‑
吡咯基、n
‑
甲基咪唑
‑2‑
酮基、1,3
‑
二甲基
‑5‑
甲硫基
‑
2,3
‑
二氢
‑
咪唑
‑4‑
甲酮基、3
‑
甲基吡啶、苯基、对甲基苯基、对甲氧基苯基、对氯苯基、3
‑
甲氧基
‑
对苯酚基、对丙基苯基、对甲基苯酚基、2
‑
(二甲氨基)
‑3‑
苯乙烷基、1
‑
苯基乙烷
‑2‑
醇、对硝基苯基、对甲氧基苯基、对羟基苯甲酮基、3
‑
溴
‑4‑
羟基
‑
苯甲酮基、3,5
‑
二溴
‑4‑
羟基
‑
苯甲酮基、1
‑
氨基
‑2‑
对甲苯基
‑
乙烷基、2
‑
(丙
‑2‑
炔
‑1‑
酰氧基)苯基、苯并[d][1,3]二恶英基、2
‑
吲哚基、1
‑
吲哚基、2
‑
甲基吲哚基、2
‑
喹啉基、7
‑
氨基
‑
5,8
‑
二酮
‑
喹啉基、1
‑
(4
‑
溴苯基)
‑4‑
(苯氧基)甲基
‑
1h
‑
1,2,3
‑
三唑基、3
‑
羟基
‑4‑
(((3r,5r,6s)
‑
3,4,5
‑
三羟基
‑6‑
甲基四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)丙酮基、4
‑
羟基
‑3‑
(((3r,5r,6s)
‑
3,4,5
‑
三羟基
‑6‑
甲基四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)丙酮基、4
‑
(((3r,5r,6s)
‑
3,4,5
‑
三羟基
‑6‑
甲基四氢
‑
2h
‑
吡喃
‑2‑
基)氧基)丙烷
‑2‑
酮基、氮杂环十一碳烯
‑6‑
烯基等。stnp2催化对四氢β
‑
咔啉立体选择性的具体考察步骤如下:
[0062]
(1)反应体系共100μl(50mm硼酸盐缓冲液,ph 8.0),1mm四氢β
‑
咔啉,10μm stnp2纯蛋白,30℃反应2小时,加入200μl乙腈终止反应。离心去除蛋白后,上清经过滤后用于hplc检测。
[0063]
(2)产物的分析采用安捷伦液相,色谱柱luna phenyl(phenomenex)柱(4.6
×
250mm,粒径5μm),a相:h2o(含千分之一的甲酸),b相:乙腈。色谱条件如下:
[0064]
0 min 95:5
[0065]
15 min 60:40
[0066]
20 min 0:100
[0067]
25 min 0:100
[0068]
26 min 95:5
[0069]
30 min 95:5
[0070]
当以r基团为甲基、乙基、丙基或苄基的底物测试时,经分离鉴定发现生成的产物为r
‑
构型。当以r基团是1,2
‑
二羟基乙基或者是1,2,3
‑
三羟基丙基的底物测试时,经hplc检测分析发现生成的产物为s
‑
构型。hplc检测分析以上产率均为50%,ee值均大于99%。以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1