一种抗HBeAg抗体及其应用的制作方法
一种抗hbeag抗体及其应用
技术领域
1.本发明属于抗体技术领域。更具体地,涉及一种抗hbeag抗体及其应用。
背景技术:
2.乙肝病毒(hbv)感染是全球肝病的主要原因之一,目前有超过20亿的人感染了乙肝病毒。这种疟疾在很大程度上是通过接触含有病毒的体液传播,包括无保护措施的性接触、输血、受污染针头和注射器的重复使用,分娩期间母婴传播等。乙肝是严重危害人类健康的重大传染病,我国是乙肝感染大国。慢性乙型肝炎是指由乙型肝炎病毒持续感染引起的肝脏慢性炎症性疾病,慢性乙型肝炎至今仍缺乏有效的控制手段和彻底解决方案,hbv与肝细胞及免疫细胞之间相互作用的分子机制研究进展相对滞后,是严重影响新型治疗方法和药物研发的重要原因之一。
3.乙肝e抗原(hbv e antigen,hbeag)为hbv感染的病毒学标志物被广泛应用于临床,具有重要的临床价值。hbeag不是病毒体的必要结构成分,并且它似乎也不参与病毒复制周期。hbeag在围产期感染hbv后的慢性化过程中发挥了重要作用,hbeag阳性母亲的新生儿,在围产期感染hbv后,往往会出现慢性hbv感染。hbeag消失而hbeab出现的转换过程,通常情况下(除外前c/c基因变异所致)意味着病毒复制水平的降低和肝脏炎症活动程度的减弱;因此,国内外学者一直都将hbeag血清学转换作为评价抗病毒治疗疗效的重要指标之一。
4.hbeag的检测方法有很多,主要是基于抗原-抗体反应的夹心方法。该方法具有成本低、操作简单、适用于大规模筛选等优点,是目前最为常用的检测方法。近年来,相继有新的检测方法与技术问世,包括微粒子酶免疫分析、化学发光免疫分析和时间分辨荧光免疫测定法等方法,这些方法均是在原始的双抗体夹心法的基础上进行了优化和升级。这些方法大多主要是基于抗原和抗体特异性的结合反应,总体而言,特异性好且敏感性高的单克隆抗体始终是各种方法与技术发展的基础与前提。
5.目前检测hbeag的抗体来源少,亲和力、灵敏度和特异性等性能都存在缺陷。因此,亟需性能更优、效果更好的检测hbeag的抗体。
技术实现要素:
6.本发明要解决的技术问题是克服现有检测hbeag的抗体性能不好的缺陷和不足,提供一种抗hbeag抗体及其应用。
7.本发明的目的是提供抗hbeag抗体或其抗原结合片段,所述抗体含有以下重链互补决定区hcdrs:
8.氨基酸序列如seq id no.1所示的hcdr1,氨基酸序列如seq id no.2所示的hcdr2,氨基酸序列如seq id no.3所示的hcdr3。
9.本发明另一目的是提供所述抗hbeag抗体或其抗原结合片段相关的核酸、载体或细胞。
10.本发明还提供了所述抗hbeag抗体或其抗原结合片段,及其相关的核酸、载体或细胞在制备用于检测/诊断hbv感染的试剂/试剂盒中的应用。
11.本发明还提供了一种用于检测/诊断hbv感染的试剂/试剂盒,含有所述抗体或其抗原结合片段、所述核酸、所述载体或所述细胞。
12.本发明还提供了一种检测hbeag的方法,将所述抗体或其抗原结合片段与待测样本接触。
附图说明
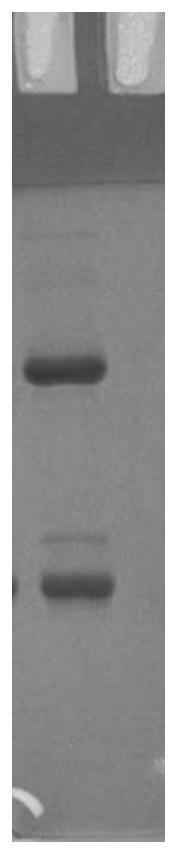
13.图1是4e6rmb1抗体的还原性sds-page结果。
具体实施方式
14.以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
15.除非特别说明,以下实施例所用试剂和材料均为市购。
16.本发明涉及一种抗hbeag抗体或其抗原结合片段,所述抗体含有以下重链互补决定区hcdrs:
17.氨基酸序列如seq id no.1所示的hcdr1,氨基酸序列如seq id no.2所示的hcdr2,氨基酸序列如seq id no.3所示的hcdr3。
18.在一些实施方式中,所述抗体还含有以下轻链互补决定区lcdrs:
19.氨基酸序列如seq id no.4所示的lcdr1,氨基酸序列如seq id no.5所示的lcdr2,氨基酸序列如seq id no.6所示的lcdr3。
20.本发明所述抗体或其抗原结合片段对hbeag的亲和力高、结合活性高(其活性显著高于对照抗体),稳定性高,能够广泛应用于检测/诊断hbv感染。
21.在本发明中,术语“抗体”在最广义上使用,其可以包括全长单克隆抗体,双特异性或多特异性抗体,以及嵌合抗体,只要它们展示所需的生物学活性。术语“抗原结合片段”是包含抗体cdr的一部分或全部的物质,其缺乏至少一些存在于全长链中的氨基酸但仍能够特异性结合至抗原。此类片段具生物活性,因为其结合至抗原,且可与其他抗原结合分子(包括完整抗体)竞争结合至给定表位。此类片段选自fab(由完整的轻链和fd构成),fv(由vh和vl构成),scfv(单链抗体,vh和vl之间由一连接肽连接而成)或单域抗体(仅由vh组成)。此类片段可通过重组核酸技术产生,或可通过抗原结合分子(包括完整抗体)的酶裂解或化学裂解产生。在本发明具体实施方式中,4e6rmb1抗体能够特异性结合hbeag,且对hbeag具有很好的结合活性和亲和力。
22.在本发明中,术语“互补性决定区”、“cdr”或“cdrs”是指免疫球蛋白的重链和轻链的高度可变区,指包含一种或多种或者甚至全部的对抗体或其抗原结合片段与其识别的抗原或表位的结合亲和力起作用的主要氨基酸残基的区域。重链互补决定区用hcdr表示,其包括hcdr1、hcdr2和hcdr1;轻链互补决定区用lcdr表示,其包括lcdr1、lcdr2和lcdr1。本领域常用的cdr标示方法包括:kabat编号方案、chothia和lesk编号方案以及1997年lefranc等人为免疫球蛋白超家族的所有蛋白质序列引入的新的标准化编号系统。kabat等人是第一个为免疫球蛋白可变区提出标准化编号方案的人。在过去的几十年中,序列的积累导致
了kabatman数据库的创建,kabat编号方案通常被认为是编号抗体残基广泛采用的标准。本发明采用kabat注释标准标示cdr区,但其他方法标示的cdr区也属于本发明的保护范围。在本发明具体实施方式中,cdrs是指4e6rmb1抗体的重链和轻链的高度可变区。
23.在一些实施方式中,所述抗体还含有重链可变区和轻链可变区的至少之一;所述抗体的重链可变区的氨基酸序列如seq id no:7所示,所述抗体的轻链可变区的氨基酸序列如seq id no:8所示。
24.在一些实施方式中,所述抗体还含有重链恒定区和轻链恒定区;所述重链恒定区为igg1、igg2、igg3、igg4、iga、igd、ige或igm中的任一种或几种,所述轻链恒定区为κ链或λ链。
25.在一些实施方式中,所述重链恒定区和轻链恒定区的种属来源为牛、马、乳牛、猪、绵羊、山羊、大鼠、小鼠、狗、猫、兔、骆驼、驴、鹿、貂、鸡、鸭、鹅、火鸡、斗鸡或人。
26.在一些实施方式中,所述抗体的重链的氨基酸序列如seq id no:9所示,所述抗体的轻链的氨基酸序列如seq id no:10所示。
27.在一些实施方式中,所述抗原结合片段选自fab,fab',f(ab')2,scfv,fv,fd,单链抗体,双价抗体或结构域抗体。
28.本发明还涉及核酸,所述核酸编码所述抗体或其抗原结合片段。
29.核酸通常是rna或dna,核酸分子可以是单链或双链的。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接至所述编码序列。当其连入载体时采用dna核酸。
30.本发明还涉及载体,所述载体含有所述核酸。
31.本发明还涉及细胞,所述细胞含有所述核酸或所述载体。
32.另外,所述抗体或其抗原结合片段、所述核酸、所述载体或所述细胞在制备用于检测/诊断hbv感染的试剂/试剂盒中的应用,都应在本发明的保护范围之内。
33.本发明还涉及一种用于检测/诊断hbv感染的试剂/试剂盒,含有所述抗体或其抗原结合片段、所述核酸、所述载体或所述细胞。
34.在一些实施方式中,所述试剂盒为免疫层析检测试剂盒、酶免检测试剂盒、化学发光试剂盒或免疫比浊检测试剂盒。
35.在一些实施方式中,所述试剂盒可以包括测试条或测试卡,来自于所述受试者的所述液体样品放置到所述测试条上,或者elisa测定板,所述elisa测定板具有其中可放置来自于单个受试者的液体样品的孔。在一些实施方案中,所述试剂盒可以包括配置用于流式细胞仪、生物分析仪、生物传感器中的测试装置。
36.在一些实施方式中,所述试剂盒中包含的所述抗hbeag抗体可为液体溶液形式、附着于固体支持物上的形式、或为干燥粉剂。当抗hbeag抗体为一种液体溶液时,该液体溶液可以是水溶液。当抗hbeag抗体是附着于固体支持物上的形式时,优选的固体支持物可以是层析介质如薄膜、测试条、塑料珠或平板、或显微镜栽玻片。当抗hbeag抗体为一种干燥粉剂时,通过加入适当溶剂可重构粉剂。
37.本发明还涉及一种检测hbeag的方法,将所述抗体或其抗原结合片段与待测样本接触。
38.需要说明的是,上述方法是以非疾病的诊断为目的。本领域技术人员可以基于抗
体/抗原结合形成免疫复合物的特点,利用本发明抗hbeag抗体对待测样本中的hbeag进行定性或定量检测。基于抗体抗原结合形成免疫复合物对抗原或抗体进行检测的方法包括:
39.(1)通过沉淀反应实现检测目的,包括:单向免疫扩散试验、双向免疫扩散试验、免疫比浊法、对流免疫电泳、免疫电泳以及免疫印迹法等;
40.(2)通过标记显示信号强度的指示剂实现检测目的,包括:免疫荧光法、放射免疫分析法、化学发光免疫分析法以及酶联免疫分析法(例如双抗体夹心法、间接法或竞争法等)等。
41.本发明具有以下有益效果:
42.本发明提供的抗hbeag抗体对hbeag的亲和力高,能够特异性结合hbeag,且其结合活性显著高于对照抗体,成本低、稳定性高,因此,本发明的抗hbeag抗体能够广泛应用于检测/诊断hbv感染、制备检测/诊断hbv感染的试剂/试剂盒中。
43.以下实施例中,限制性内切酶、prime star dna聚合酶购自takara公司。magextractor-rna提取试剂盒购自toyobo公司。bd smart
tm race cdna amplification kit试剂盒购自takara公司。pmd-18t载体购自takara公司。质粒提取试剂盒购自天根公司。引物合成和基因测序由invitrogen公司完成。
44.实施例1抗hbeag抗体(4e6rmb1抗体)的制备
45.1、表达质粒构建
46.(1)4e6rmb1抗体基因制备
47.从分泌4e6rmb1抗体的杂交瘤细胞株中提取mrna,通过rt-pcr方法获得dna产物,该产物用rtaq dna聚合酶进行加a反应后插入到pmd-18t载体中,转化到dh5α感受态细胞中,长出菌落后分别取重链(heavy chain)及轻链(light chain)基因克隆各4个克隆送基因测序公司进行测序。
48.(2)4e6rmb1抗体可变区基因的序列分析
49.将上述测序得到的基因序列放在imgt抗体数据库中进行分析,并利用vnti11.5软件进行分析确定重链和轻链引物对扩增出的基因都是正确的;其中,light chain扩增出的基因片段中,轻链可变区(variable region of light chain,vl)基因序列为321bp,属于vkii基因家族,其前方有57bp的前导肽序列;heavy chain引物对扩增出的基因片段中,重链可变区(variable region of heavy chain,vh)基因序列为357bp,属于vh1基因家族,其前方有57bp的前导肽序列。
50.(3)重组抗体表达质粒的构建
51.pcdna
tm 3.4vector为构建的重组抗体真核表达载体,该表达载体已经引入hindiii、bamhi、ecori等多克隆酶切位点,并命名为pcdna3.4a表达载体,后续简称3.4a表达载体;根据上述pmd-18t载体中抗体可变区基因测序结果,设计4e6rmb1抗体的vl和vh基因特异性引物,两端分别带有hindiii、ecori酶切位点和保护碱基,通过pcr扩增方法扩出0.71kb的light chain基因片段和1.41kb的heavy chain基因片段。
52.heavy chain和light chain基因片段分别采用hindiii/ecori双酶切,3.4a载体采用hindiii/ecori双酶切,将片段和载体纯化回收后heavy chain基因和light chain基因分别连接3.4a表达载体中,分别得到heavy chain和light chain的重组表达质粒。
53.2、稳定细胞株筛选
54.(1)重组抗体表达质粒瞬时转染cho细胞,确定表达质粒活性
55.质粒用超纯水稀释至40μg/100μl,调节cho细胞1.43
×
107cells/ml于离心管中,100μl质粒与700μl细胞混合,转入电转杯,电转,第3、5、7天取样计数,第7天收样检测。
56.用包被液(主要成分为nahco3)稀释hbeag-5#(可购自菲鹏生物)至3μg/ml,每孔100μl,4℃过夜;次日,洗涤液(主要成分为na2hpo4+nacl)清洗2次,拍干;加入封闭液(20%bsa+80%pbs),每孔120μl,37℃,1h,拍干;加入稀释后的细胞上清,100μl/孔,37℃,30min(部分上清1h);洗涤液清洗5次,拍干;加入羊抗鼠igg-hrp,每孔100μl,37℃,30min;洗涤液清洗5次,拍干;加入显色液a液(50μl/孔,显色液a液的主要成分为柠檬酸、醋酸钠、乙酰苯胺和过氧化脲),加入显色液b液(50μl/孔,显色液b液的主要成分为柠檬酸、edta
·
2na、tmb和浓hcl),10min;加入终止液(终止液的主要成分为edta
·
2na和浓h2so4),50μl/孔;酶标仪上450nm(参考630nm)处读od值。
57.结果显示,细胞上清稀释1000倍后反应od仍大于1.0,未加细胞上清孔反应od小于0.1,表明质粒瞬转后产生的抗体对hbeag有活性。
58.(2)重组抗体表达质粒线性化
59.准备下述试剂:buffer 50μl、dna100μg/管、pvuⅰ酶10μl、无菌水补至500μl,37℃水浴酶切过夜;先用等体积酚/氯仿/异戊醇(下层)25:24:1,再用氯仿(水相)依次进行抽提;0.1倍体积(水相)3m醋酸钠和2倍体积乙醇冰上沉淀,70%乙醇漂洗沉淀,去除有机溶剂,待乙醇挥发完全用适量的灭菌水进行复融,最后进行浓度的测定。
60.(3)重组抗体表达质粒稳定转染,加压筛选稳定细胞株
61.质粒用超纯水稀释至40μg/100μl,调节cho细胞1.43
×
107cells/ml于离心管中,100μl质粒与700μl细胞混合,转入电转杯,电转,次日计数;25μmol/lmsx 96孔加压培养约25天。
62.显微镜下观察标记长有细胞的克隆孔,并记录汇合度;取培养上清,送样检测;挑选抗体浓度、相对浓度高的细胞株转24孔,3天左右转6孔;3天后保种批培,调整细胞密度0.5
×
106cells/ml,2.2ml进行批培养,细胞密度0.3
×
106cells/ml,2ml进行保种;7天6孔批培上清送样检测,挑选抗体浓度及细胞直径较小的细胞株转tpp保种传代。
63.3、4e6rmb1抗体制备
64.(1)细胞扩培
65.细胞复苏之后先在125ml规格的摇瓶中培养,接种体积为30ml,培养基为100%dynamis培养基,放置于转速120r/min,温度为37℃,二氧化碳为8%的摇床中。培养72h,以50万cells/ml接种密度接种扩培,扩培体积根据生产需求进行计算,培养基为100%dynamis培养基。之后每72h扩培一次。当细胞量满足生产需求时,严格控制接种密度为50万cells/ml左右进行生产。
66.(2)摇瓶生产及纯化
67.摇瓶参数:转速120r/min,温度为37℃,二氧化碳为8%。流加补料:在摇瓶中培养至72h时开始每天补料,hyclonetm cell boosttm feed 7a每天流加初始培养体积的3%,feed 7b每天流加量为初始培养体积的千分之一,一直补到第12天(第12天补料)。葡萄糖在第六天补加3g/l。第13天收样。用proteina亲和层析柱进行亲和纯化,即得到4e6rmb1抗体。取6.6μg 4e6rmb1抗体进行还原性sds-page。
68.4e6rmb1抗体的还原性sds-page结果如图1所示,结果显示两条带,1条mr为50kd(重链),另一条mr为28kd(轻链)。
69.4e6rmb1抗体的hcdr1的氨基酸序列如seq id no.1所示,hcdr2的氨基酸序列如seq id no.2所示,hcdr3的氨基酸序列如seq id no.3所示;lcdr1的氨基酸序列如seq id no.4所示,lcdr2的氨基酸序列如seq id no.5所示,lcdr3的氨基酸序列如seq id no.6所示;
70.重链可变区的氨基酸序列如seq id no:7所示,轻链可变区的氨基酸序列如seq id no:8所示;
71.重链的氨基酸序列如seq id no:9所示,轻链的氨基酸序列如seq id no:10所示。
72.实施例2抗hbeag抗体的亲和力分析
73.利用amc传感器,实施例1制备得到的4e6rmb1抗体和市售对照抗体用pbst稀释到10μg/ml,hbeag-5#(可购自菲鹏生物)用pbst进行梯度稀释;
74.运行流程:缓冲液1(pbst,主要成分为na2hpo4+nacl+tw-20)中平衡60s,抗体溶液中固化抗体300s,缓冲液2(pbst,主要成分为na2hpo4+nacl+tw-20)中孵育180s,抗原溶液中结合420s,缓冲液2中解离1200s,用10mm ph 1.69gly溶液及缓冲液3(pbst,主要成分为na2hpo4+nacl+tw-20)进行传感器再生,输出数据。
75.4e6rmb1抗体的亲和力分析结果如表1所示,结果显示,4e6rmb1抗体对hbeag的亲和力显著高于对照抗体。
76.表1
77.样品名称kd(m)kon(1/ms)kdis(1/s)对照抗体8.87e-111.24e+051.10e-054e6rmb1抗体9.71e-121.03e+041.00e-07
78.注:表1中,kd表示平衡解离常数即亲和力;kon表示结合速率;kdis表示解离速率。kd值越低,代表亲和力越高。
79.实施例3抗hbeag抗体的活性鉴定
80.用包被液(主要成分为nahco3)稀释hbeag-5#(可购自菲鹏生物)至3μg/ml,每孔100μl,4℃过夜;次日,洗涤液(主要成分为na2hpo4+nacl)清洗2次,拍干;加入封闭液(20%bsa+80%pbs),每孔120μl,37℃,1h,拍干;加入稀释后的实施例1制备得到的4e6rmb1抗体和对照抗体,100μl/孔,37℃,30min;洗涤液清洗5次,拍干;加入羊抗鼠igg-hrp,每孔100ul,37℃,30min;洗涤液清洗5次,拍干;加入显色液a液(50ul/孔),加入显色液b液(50ul/孔),10min;加入终止液,50ul/孔;酶标仪上450nm(参考630nm)处读od值。
81.4e6rmb1抗体的活性鉴定结果如表2所示,结果显示4e6rmb1抗体对hbeag的活性显著高于对照抗体,且4e6rmb1抗体浓度为0.195ng/ml时,其对hbeag仍然具有很好的活性。
82.表2
83.样品浓度(ng/ml)12.56.253.1251.5630.1950对照抗体2.0971.4240.7860.660.15050.0324e6rmb1抗体2.21.9721.5341.0170.2140.039
84.注:表2中,od值越高,代表抗体对hbeag的活性越好。
85.实施例4抗hbeag抗体的稳定性考核
86.将实施例1制备得到的4e6rmb1抗体置于4℃(冰箱)、-80℃(冰箱)、37℃(恒温箱)放置21天,取7天、14天、21天样品进行状态观察,并对21天样品进行活性检测(利用酶免检测od结果考核样品的活性)。
87.4e6rmb1抗体稳定性测试结果如表3所示,结果显示,三种考核条件下抗体放置21天均未见明显蛋白状态变化,活性也未随考核温度的升高呈下降趋势,说明本发明制备得到的4e6rmb1抗体的稳定高。
88.表3
89.样品浓度(ng/ml)3.1250.19504℃,21天样品1.4690.2130.046-80℃,21天样品1.4790.2860.04737℃,21天样品1.4350.2950.046
90.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1