一种基于CRISPR-Cas12a的猪链球菌快速可视化RPA检测试剂盒及其应用
一种基于crispr
‑
cas12a的猪链球菌快速可视化rpa检测试剂盒及其应用
技术领域
1.本发明涉及一种猪链球菌检测试剂盒及其应用,特别涉及基于一种基于crispr
‑
cas12a的猪链球菌快速可视化rpa检测试剂盒及其应用。本发明属于医学检测技术领域。
背景技术:
2.猪链球菌(streptococcus suis)是引起猪链球菌病的主要病原,能够导致猪淋巴结脓肿和败血性链球菌病,以败血症、脑膜炎、关节炎、化脓性淋巴结炎和猝死为主要特征。各种日龄猪均可感染,一年四季均可发生。随着我国规模化养猪业的发展,猪链球菌病已成为养猪生产中的常见病和多发病,特别是近十多年来,其发病率不断升高,给我国以及世界养猪业造成了巨大的经济损失。猪链球菌还是一种人兽共患病病原,能够引起人类感染。因此,为了有效预防和控制猪链球菌感染的爆发,对猪链球菌的检测,特别是早期检测,对养猪产业和公共卫生均具有重要的意义。
3.猪链球菌属于链球菌属,革兰氏染色阳性,多数有荚膜,无鞭毛。菌体呈圆形或椭圆形,一般呈链状或成对排列。多数为兼性厌氧,少数为厌氧菌。最适生长温度为37℃,ph7.4
‑
7.6,菌落较小,呈灰白色透明,在羊血琼脂平板上生长时,呈现α溶血。根据荚膜抗原的差异,猪链球菌分为29个血清型,不同血清型致病力之间存在差异。猪链球菌的自然感染部位是上呼吸道(主要是扁桃体和鼻腔)、消化道和生殖道。猪链球菌是一种机会性致病菌,在猪场中的检出率非常高。猪群之间的感染通常是因为病猪和健康带菌猪只的流动而发生,病猪和健康带菌猪的排泄物和分泌物中均有猪链球菌,猪只直接接触或接触带病原菌的污染物(饮水、饲料及圈舍物体)均可引起猪群的大批发病,进而造成流行。各日龄猪都具有易感性,仔猪多发生败血症和脑膜炎,中猪则多发化脓性淋巴结炎。一年四季均可发生,春秋多发,呈地方性流行。在规模化猪场,猪链球菌感染常常造成病毒性疾病如猪繁殖和呼吸障碍综合征、猪瘟等的继发病。人感染猪链球菌主要通过生食猪肉制品和皮肤伤口,造成细菌性脑膜炎或引起中毒样休克综合征。
4.猪链球菌进化出了多种致病因子,在其对宿主的黏附、入侵和定殖中发挥重要作用,这些致病因子在猪链球菌鉴定中也具有重要地位。目前从猪链球菌中已经鉴定到几十种致病因子,包括荚膜(cps)、溶菌酶释放蛋白(mrp)、细胞外因子(ef)、溶血素(sly)、细菌表面蛋白、纤维蛋白结合蛋白等,但公认对其毒力具有重要贡献的主要有cps和sly。编码合成cps的关键蛋白基因wzy由于具有血清型特异性,目前被广泛用来鉴定猪链球菌的血清型。
5.聚合酶链式反应(polymerase chain reaction,pcr)是一种灵敏度高,特异性强、反应迅速的诊断技术,其灵敏性可以准确到单个细菌。因此,在诊断应用方面得到了广阔的发展。目前,基于pcr技术已经建立了多种方法用于早期诊断猪链球菌病及菌株的鉴定。这些方法无论足在灵敏度还是在特异性上,都具有其它方法不可比拟的优势,然而这种方法繁琐,不仅需要相关专业操作培训,还需采购pcr仪、照胶仪等体积较大、价格昂贵的设备。
6.在pcr方法基础上,通过引入荧光标记的探针,可以实时检测靶标的扩增情况,称为real
‑
time pcr。real
‑
time pcr不仅是快速、高灵敏的检测方法,同时这种方法也可以进行定量分析。但是仍需要精密的仪器以及繁琐的试验程序,且耗时较长,难以满足非实验室环境下现场检测的要求。
7.除了传统pcr,环介导等温扩增(lamp)和重组酶聚合酶扩增技术(recombinase polymerase amplification,rpa)技术也已被开发用于检测动物病原体。与传统pcr相比,lamp检测灵敏度高,但反应中的多对引物的加入使其可靠性降低,可能产生假阳性检测结果。rpa是一种新型的恒温核酸扩增技术,其最显著的优势就是可在37
‑
42℃的恒温下实现特定核酸序列的扩增,可以在10~40min内完成数十亿的dna拷贝。rpa属于等温扩增技术,对仪器设备要求低,仅需要恒温水浴锅即可完成反应,无需精密仪器。
8.crispr
‑
cas技术是一种最新涌现的基因组编辑技术,具有很强的靶标特异性,其利用自身的rna来和目标dna进行序列配对,从而识别特异性序列。对于双链dna来说,crispr系统需要额外识别目标dna上的一个protospacer adjacent motif(pam)序列。cas12a的pam偏好于含有at的序列,因此通过使用含有不同grna(guide rna,其是指代sgrna或者crrna)的crispr系统就可识别带有pam序列并和grna序列匹配的双链dna。cas12a蛋白在识别靶标后,它的单链dna的酶活性被激活,并对体系中任意单链dna进行不加区别的切割,切割速度极快,达到大于1000个分子每秒,且可以持续数小时以上。利用此特性,可将发光分子通过单链dna与一种阻止这种发光分子发光的抑制分子连接在一起(简称为报告序列)。当cas12a被序列特异性的双链dna激活后,它会切割将这种发光分子和这种抑制分子连接在一起的单链dna,这就移除了发光抑制分子,让发光分子发光,从而检测到光信号。2018年,doudna团队基于此建立了基于crispr的核酸检测方法detectr。张峰团队将crispr技术与横向流动试纸条结合,开发出sherlock技术,可在2h之内检测出寨卡病毒(zikv)和登革热(dhf)。
9.本发明通过rpa增强cas12a检测灵敏度,并利用crispr cas12a的侧裂效应,针对保守的猪链球菌特异基因cps2j并结合免疫层析,对猪链球菌进行灵敏、特异、无需昂贵设备和可视化检测。
技术实现要素:
10.本发明的目的在于提供一种基于crispr
‑
cas12a的猪链球菌快速可视化rpa检测试剂盒及其应用。
11.为了达到上述目的,本发明采用了以下技术手段:
12.本发明一种基于crispr
‑
cas12a的猪链球菌快速可视化rpa检测试剂盒,包含一对用于扩增猪链球菌cps2j基因的特异性引物对、用于crispr
‑
cas12a反应的grna和荧光报告探针,其中,所述的用于扩增猪链球菌cps2j基因的特异性引物对的核苷酸序列如seq id no:6和7或seq id no:8和9所示,与所述的用于crispr
‑
cas12a反应的grna互补的dna的核苷酸序列如seq id no:2或3所示。
13.如上所述的引物对和grna可以任意组合使用。
14.其中,优选的,所述的试剂盒中还包括cas12a蛋白。
15.其中,优选的,所述的荧光报告探针为含有ttatt、tttta、aaaat、atatat中的至少
一种的单链dna报告序列;用于荧光检测时,所述的荧光报告探针的5'端用fam、fitc、rb200、tritc、tet、pe、pi、amca、atto425、percp、apc、alexa fluor488、joe、vic、hex、ned、cy3、tamra、rox、texas red、cy5、quasar 670、cy5.5和cy7中的任意一种进行修饰且3'端用淬灭基团修饰;用于免疫层析检测时,所述的荧光报告探针的5'端用fam标记,3'端用biotin修饰。
16.其中,优选的,用于荧光检测时,所述的荧光报告探针为5
’‑
fam
‑
ttatt
‑
tamra
‑3’
,用于免疫层析检测时,所述的荧光报告探针为5
’‑
fam
‑
ttatt
‑
biotin
‑3’
。
17.其中,优选的,所述的用于扩增猪链球菌cps2j基因的特异性引物对的核苷酸序列如seq id no:8和9所示,与所述的用于crispr
‑
cas12a反应的grna互补的dna的核苷酸序列如seq id no:2所示。
18.其中,优选的,使用所述的试剂盒检测猪链球菌时,rpa反应体系50μl:其中包括rpa上游扩增引物0.48μm,rpa下游扩增引物0.48μm,1
×
rehydration buffer,14mm mgoac,待检测样本基因组dna 1μl,其余用水补足50μl;rpa扩增程序:恒温37
‑
40℃反应15min。
19.其中,优选的,使用所述的试剂盒检测猪链球菌时,荧光检测体系20ul:包含100ng rpa扩增靶基因产物,50nm grna,50nm cas12a,500nm荧光报告探针,1
×
nebuffer,其中所述的荧光报告探针为5
’‑
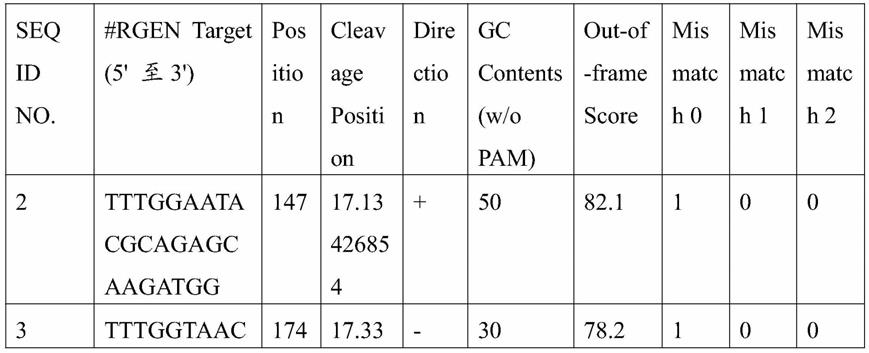
fam
‑
ttatt
‑
tamra
‑3’
。
20.其中,优选的,使用所述的试剂盒检测猪链球菌时,免疫层析检测体系20ul:包含100ng rpa扩增靶基因产物,50nm grna,50nm cas12a,500nm荧光报告探针,10%聚乙二醇,其中所述的荧光报告探针为5
’‑
fam
‑
ttatt
‑
biotin
‑3’
。
21.进一步的,本发明还提出了所述的试剂盒在制备快速可视化检测猪链球菌试剂中的应用。
22.本发明基于重组酶聚合酶扩增(recombinase polymerase amplification,rpa)及crispr/cas12a系统,建立了一种可以应用于临床的快速检测猪链球菌的检测方法。具体地,本发明人选取猪链球菌特异性基因cps2j的保守区,依据grna结合位点附近需带有pam序列的特性,在保守区内设计并筛选crispr/cas12a系统的探针grna,并根据该grna的结合位点设计并筛选特异性rpa引物,以实现rpa特异性靶基因扩增,以及crispr/cas12a系统对报告基因的切割,建立可用于检测猪链球菌的方法,并对rpa体系和crispr/cas12a反应体系进行优化,并对该方法的特异性,敏感性进行评价,结果表明:该检测方法猪链球菌特异性良好,对副猪嗜血杆菌、沙门氏菌、胸膜肺炎放线杆菌、猪圆环病毒、猪伪狂犬病毒、猪流行性腹泻病毒均无交叉反应,敏感性为100copies/μl,最快可在30分钟时间内获得检测结果,并减少凝胶染色时产生的染料污染。
23.本发明通过rpa增强cas12a检测灵敏度,并利用crispr cas12a的侧裂效应,针对保守的cps2j基因并结合免疫层析,对app进行灵敏、特异、无需昂贵设备和可视化的检测。
24.该方法将rpa特异性扩增与grna特异性序列鉴定相结合,使增强的cas12a检测更具特异性;并在37℃条件下进行检测,适合在缺乏pcr仪等仪器设备的实验室或现地使用;同时可以根据现有条件选取荧光法(通过蓝光激发肉眼观察)或免疫层析法(直接裸眼观察)。
25.cas12a检测猪链球菌有很高的特异性和灵敏度,检出极限为100copies/μl。
26.相较于现有技术,本发明的有益效果是:
hybridetect 1dipstick(twistdx)、离心机(eppendorf)、恒温水浴锅(精宏)、电泳仪(bio
‑
rad)、涡旋仪(vortex
‑
genie2)、及核酸检测成像系统(bio
‑
rad)、nanodrop(implen)、多功能酶标仪(perkin elmer enspire)、蓝光凝胶成像仪(上海生工)、引物及报告序列均由吉林省库美生物科技有限公司合成。
42.2.方法
43.2.1猪链球菌靶序列的选取和rpa扩增以及grna设计和扩增
44.1)靶标选择:cps2j基因在猪链球菌2型血清中高度保守,在其密切相关的其他物种中均不存在,临床上常用于病原学检测的靶标,因此本方法选择cps2j基因中的保守区作为靶标序列,其具体序列如seq id no:1所示。
45.2)grna设计:由于lb cas12a特异性切割双链dna时需要在结合位点附近含有pam序列(tttn,n为任意一个核苷酸),所以,rpa扩增后的产物作为待检测模板时必须含有pam序列,因此,在靶标序列中寻找含有pam序列的最优区域(cas12a可以切割的序列)至关重要。结合待检靶标需含有pam序列和rpa扩增产物长度有更大调整范围(100
‑
300bp)的特性,我们采取先优选grna靶向位点,再依据grna靶向位点所在区域优选rpa引物的策略。首先利用crisprrgen tools,以靶标(seq id no:1)为模板,设定参数:grna长度为20bp、score分值大于66,选取满足以上参数的2条grna序列作为候选grna序列,这2条grna靶向保守区内不同位置的不同的pam序列。依据荧光强度筛选出最优grna序列后,依据其结合位点所在区域再设计筛选出最优rpa引物。
46.3)grna的制备:参照hiscribe t7 quick highyieldrna synthesis kit说明书,在grna互补的dna序列(核苷酸序列如seq id no:2以及3所示)前加入t7启动子序列作为体外转录的模板,加入试剂盒内提供的试剂后,在37℃孵育过夜,并用dnasei消化掉dna模板,用rna纯化试剂盒回收生成的grna。用nanodrop测定grna浓度,并将其分装、冻存于
‑
80℃。
47.4)ssdna
‑
reporter(ssdna荧光报告探针)合成
48.crispr
‑
cas12a蛋白在与靶标结合后可以激活其附属切割活性,即对体系内的任意单链dna进行无差别切割的特点,被切割后的带有荧光基团的核苷酸序列可发出荧光,并可通过荧光检测设备对反应体系中的荧光值进行检测,或通过蓝光激发后通过肉眼直接观察、或通过试纸条进行免疫层析检测。分别合成5'端用fam、fitc、rb200、tritc、tet、pe、pi、amca、atto425、percp、apc、alexa fluor 488、joe、vic、hex、ned、cy3、tamra、rox、texas red、cy5、quasar 670、cy5.5和cy7中的任意一种进行修饰且3'端用淬灭基团修饰的单链dna序列用于荧光检测;或者5'端用fam标记和3'端用biotin修饰的单链dna用于免疫层析检测。cas12a的pam是at偏好,所述单链dna报告序列含有ttatt、tttta、aaaat、atatat中的至少一种。
49.5)最优grna的确定
50.grna的筛选以经pcr扩增后的靶标序列作为模板。在50μl pcr反应体系包含0.5μl猪链球菌基因组dna样品,经变性:95℃,15s;退火,55℃,15s;延伸:72℃,30s;循环数:30s,获得grna筛选用模板。pcr引物:正向引物:5'
‑
atggaaaaagtcagcattattgtac
‑
3'(seq id no:4),反向引物:5'
‑
ccctcccgacaaatcactat
‑
3'(seq id no:5)。在20ul筛选grna体系中包含5ul target(即,上述pcr扩增出的靶基因产物),50nm grna(即,体外转录合成的不同grna),50nm cas12a(购自new englandbiolabs公司),500nm ssdna
‑
reporter,1
×
nebuffer2.1;37℃反应15
‑
60min。通过荧光报告实验过程中能否激发出荧光并结合荧光强度初步筛选出一条特异性较强的grna及对应的检测区域。
51.6)rpa引物设计:参考上述筛选得到的最优grna序列的结合位点,在其上下游区域内,利用primerpremier 5.0设计rpa引物,普通pcr引物虽然可以使用,但不是最优的,引物过短会降低重组率,影响扩增速度和检测灵敏度,因此,rpa引物比一般pcr引物长,但rpa反应的产物不能超过500bp。基于rpa扩增对引物要求,设定参数为:引物长度30
‑
36bp之间,扩增产物长度在100
‑
200bp之间,gc含量在30
‑
70%之间,tm>50℃。初步选取满足上述参数的2对rpa引物,其核苷酸序列分别如seq id no:6、7以及seq id no:8、9所示,并依据荧光强度选择最优rpa引物。
52.7)rpa扩增体系及程序:依照basic产品说明书,rpa反应体系50μl:其中包括rpa上游扩增引物0.48μm,rpa下游扩增引物0.48μm,1
×
rehydration buffer,14mm mgoac,待检测样本基因组dna 1μl,其余用水补足50μl。rpa扩增程序:恒温37
‑
40℃反应15min。
53.2.2病原菌培养及基因组提取
54.取猪链球菌05z(中国农业科学院哈尔滨兽医研究所提供)在含5%马血清tsa平板上划线,37℃培养过夜,挑取单菌落于tsb中培养12h,使用天根细菌基因组dna提取试剂盒提取细菌基因组,使用nanodrop为基因组进行定量。
55.2.3临床样品基因组提取
56.依照血液和组织样品基因组dna提取试剂盒(dp304
‑
03)提取基因组,并使用nanodrop为基因组进行定量。
57.2.4 crispr
‑
cas12a结合rpa扩增进行荧光检测
58.取rpa扩增靶基因产物,加入crispr
‑
cas12a反应体系。20ul终体系中包含100ng targe(即,rpa扩增靶基因产物),50nm grna(即,针对rpa扩增靶基因产物的grna),50nm cas12a(购自new englandbiolabs公司),500nm ssdna
‑
reporter,1
×
nebuffer,此处所述ssdna
‑
reporter所用的序列为5
’‑
fam
‑
ttatt
‑
tamra
‑3’
(seq id no:10)。37℃条件下反应60min,通过多功能酶标仪(perkin elmer enspire)在485nm激发波长和535nm发射波长下,每间隔1min采集fam荧光;或在反应15min后直接用蓝光凝胶成像仪直接通过肉眼观察。阴性对照设置为将target换做去离子水。
59.2.5 crispr
‑
cas12a结合rpa扩增进行免疫层析检测
60.取rpa扩增产物,加入crispr
‑
cas12a反应体系。20ul终体系中包含100ng target(即,rpa扩增靶基因产物),100nm grna,50nm cas12a,500nm ssdna
‑
reporter,1
×
nebuffer,37℃条件下反应60min。此处所述ssdna
‑
reporter所用的序列为5
’‑
fam
‑
ttatt
‑
biotin
‑3’
(seq id no:11)。将上述20μl反应体系转移到80μl检测缓冲液中,然后将免疫层析试纸条(milenia hybridetect 1dipstick,twistdx公司)放入溶液中,孵育5分钟后肉眼观察结果。阴性对照设置为将target
‑
cps2j换做去离子水。
61.2.6特异性实验
62.利用本实施例已建立的检测方法,对包括猪链球菌、胸膜肺炎放线杆菌、副猪嗜血杆菌、沙门氏菌、猪圆环病毒、猪伪狂犬病毒、猪流行性腹泻病毒在内的常见细菌和病毒进行了检测,并设立水为阴性对照。根据检测结果判断该检测方法的特异性。
63.2.7敏感性实验
64.根据cps2j保守区设计扩增带有同源重组位点的pcr引物:
65.p1:gcttgcatgcctgcagatggaaaaagtcagcattattgtac
66.p2:ctgaattcgagctcggtaccccctcccgacaaatcact
67.将扩增产物回收,并连接至put18载体上以获得含有保守区的质粒,测定dna浓度,计算其拷贝数,并对其进行10倍连续稀释,设立水为阴性对照,利用已建立的检测方法评价其敏感性。
68.2.8临床样品检验
69.选取经常规pcr确认的8例猪链球菌感染阳性组织样本和6例阴性样本,利用已建立的pcr检测方法对其进行检测,以猪链球菌基因组作为阳性对照,水为阴性对照,对检出结果进行比较。
70.3.结果
71.3.1.特异性grna序列筛选
72.以经pcr扩增后的靶标序列保守区作为模板,在20ul筛选体系中包含5ul target(即,pcr扩增靶基因保守区产物),50nm grna(即,体外转录合成的不同grna),50nm cas12a(购自new england biolabs公司),500nm ssdna
‑
reporter,1
×
nebuffer 2.1(其组分为50mm nacl、10mm tris
‑
hcl、10mm mgcl2、100μg/ml bsaph 7.9);37℃反应60min。通过荧光报告实验过程中能否激发出荧光并结合荧光强度初步筛选出一条特异性较强的grna及对应的检测区域。依据靶基因的保守区设计并合成2条候选grna的dna序列,经体外转录生成grna(见表1),并通过荧光法(图1a)筛选最佳grna,荧光法结果表明:grna
‑
1能在30min时间内达到峰值。且grna
‑
1(互补dna序列如seq id no:2所示)序列荧光值更高,因此,优选grna
‑
1(互补dna序列如seq id no:2所示)序列作为后续检测用grna,而grna
‑
2(互补dna序列如seq id no:3所示)也可作为备选grna。
73.表1 grna候选序列
[0074][0075][0076]
3.2.rpa引物筛选
[0077]
依据筛选到的最优grna(互补dna序列如seq id no:2所示)的结合位点,在满足
rpa引物设计要求的情况下,设计合成2对候选rpa引物(见表2),并通过rpa和crispr
‑
cas方法以及荧光法筛选最佳rpa引物,结果表明:序号id
‑
1、id
‑
2的引物组合均能通过肉眼观察到蓝色荧光产生,但序号2的引物组合荧光强度最强(见图2),因此,优选组合ss
‑
295
‑
rpa
‑
f/r(即ss
‑
295
‑
rpa
‑
f和ss
‑
295
‑
rpa
‑
r)这对引物,作为后续检测用rpa扩增用引物。
[0078]
表2 rpa候选引物序列
[0079][0080]
注:从rpa产物的起始和终止位点可以看出序号1、2号引物对扩增出来的产物中涵盖了grnaseq
‑
1、2所结合的区域,所以本领域技术人员能够理解,这些序号1、2的rpa引物对和grnaseq
‑
1、2可以任意组合使用,用于荧光法和免疫层析。
[0081]
3.3.反应体系优化
[0082]
为获得更好的检测效果,我们对检测体系内的ssdna报告分子浓度、grna浓度和检测缓冲液组分等方面进行了优化。结果表明免疫层析法在ssdna报告分子浓度为500nm时,阴性样品的检测线最浅,假阳性效果最弱(图3a),荧光法在ssdna报告分子浓度为500nm时,荧光强度最强(图3b);免疫层析法显示体系中grna浓度为50nm时仍可以达到理想的效果(图3c),免疫层析法在使用试剂条进行最后检测时,比较了购买试剂条时自带的缓冲液和10%聚乙二醇作为缓冲液的效果,结果表明:在使用10%w/v聚乙二醇(分子量10,000)作为缓冲液时阴性样品检测线可以完全消失(图3d)。
[0083]
所以基于本发明的实施方案中的rpa及crispr/cas12a结合检测胸膜肺炎放线杆菌的最佳crispr
‑
cas12a反应体系为:
[0084]
荧光检测:20ul终体系中包含100ng target(即,rpa扩增靶基因产物),50nm grna,50nm cas12a,500nm ssdna
‑
reporter,1
×
nebuffer。
[0085]
免疫层析检测:20ul终体系中包含100ng targe(即,rpa扩增靶基因产物),50nm grna,50nm cas12a,500nm ssdna
‑
reporter,10%w/v聚乙二醇(分子量10,000)。
[0086]
3.4.特异性检测
[0087]
为了评估cas12a免疫层析法和荧光法检测的特异性,我们对包括副猪嗜血杆菌、沙门氏菌、胸膜肺炎放线杆菌、猪圆环病毒、猪伪狂犬病毒、猪流行性腹泻病毒在内的多种细菌和病毒进行了检测。结果表明:通过免疫层析测定法,荧光法(肉眼法、荧光值统计)的显示方法对核酸样品检测,结果除猪链球菌外其它6种病原的免疫层析检测条带均为阴性(图4a
‑
4c)。
[0088]
3.5.敏感性检测
[0089]
为了分析增强的cas12a免疫层析检测的灵敏度,我们使用免疫层析测定法(图5a),荧光法(肉眼法,图5b;荧光值统计,图5c)测试了10倍连续稀释的上述2.7节制备的含有保守区的质粒,结果表明:荧光法与免疫层析法的检测极限均为100copies/μl。
[0090]
3.6.临床样品检测
[0091]
为进一步确认该可视化方法在临床样本中的应用效果,对来源于不同猪场的感染猪链球菌菌的肺脏组织样本(中国农业科学院哈尔滨兽医研究所)进行基因组提取,选取经常规pcr方法确认的8例猪链球菌阳性组织样本和6例阴性组织样本,利用实施例1的方法结合实施例2所述的最佳反应体系对其进行检测,免疫层析检测结果表明:阳性样品除阴性对照外,免疫层析检测条带均为阳性(图6a);阴性样本除阳性对照外其余免疫层析检测条带均为阴性(图6d)。肉眼法观察结果表明:除阴性对照外阳性样品均发绿色荧光(图6b),阴性样品均不发光(图6e)。荧光法检测结果表明:阳性样本荧光值均可达到12000以上,阴性对照值在2000以下(图6c),阴性样品中除阳性对照荧光值达12000以上,其余样本荧光值均在2000以下(图6f)。该方法的检测结果与pcr方法检测结果一致。
[0092]
以上结果证明该检测方法可用于临床样品中猪链球菌的快速检测,结合现地的实验条件和检测样品的数量可以采取不同的检测方法,在以肉眼观察和使用荧光检测仪操作时,在实验室预先制备样品基因组条件下,可在30min中内完成检测过程,而在通过试剂条检测时亦可在75min之内获得检测结果,相对于实验室常规pcr检测方法(扩增60min,琼脂糖凝胶电泳检测30min),本发明的方法可以实现快速可视化检测,并减少凝胶染色时产生的染料污染。
[0093]
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1