一种T4SS靶向型噬菌体vB_EcoM_X4及其应用
一种t4ss靶向型噬菌体vb_ecom_x4及其应用
技术领域
1.本发明涉及生物工程领域,特别是涉及一种t4ss靶向型噬菌体vb_ecom_x4及其应用。
背景技术:
2.抗生素是治疗细菌感染的有效药物,然而抗生素在人类医学及农业生产中的大规模使用催生了细菌耐药性在环境中的快速扩散和传播,特别是多种抗生素的联合使用更是促进了多重耐药性的产生,严重威胁着人类和动物健康及食品与环境安全,相关问题已经引起人们的警觉。
3.寻找抗生素替代品是控制耐药性发展的重要手段。目前常见的抗生素替代品包括免疫调节剂、噬菌体、抗菌肽、益生元、植物提取物等。其中噬菌体与抗生素相比,具有很多优势,如相对安全、专一性强、不影响正常微生物群落生长等,并且对于病原菌有足够的特异性,解决了“菌变药不变”的抗药性本质。当追踪流行菌株并筛选和组合裂解性噬菌体时,动态抑制病原菌就成为一种自然的生态控制策略。
4.细菌iv型分泌系统(type4 secretory system,简称t4ss)是一种在革兰氏阴性菌和阳性菌中均广泛存在的多功能、多组分的跨膜通道结构,该系统能够介导细菌接合转移、dna释放和摄取以及效应蛋白分泌等功能。t4ss所介导的接合转移是耐药基因在细菌之间水平转移的重要机制之一,包括碳青霉烯类耐药基因blandm,粘菌素耐药基因mcr
‑
1和替加环素耐药基因tet(x4)所在的质粒均具有t4ss。
5.目前已发现噬菌体在细菌表面的主要吸附位点为多糖和蛋白质,以上部位在耐药菌和非耐药菌中均存在,因此传统噬菌体在应用于肠道耐药菌感染时,可能会对正常肠道菌群产生杀灭作用。
技术实现要素:
6.鉴于t4ss是耐药菌普遍具有的并且在耐药基因水平转移中发挥重要作用的元件,t4ss编码的性菌毛可能是噬菌体识别的重要受体之一。因此筛选靶向t4ss的噬菌体,就可以获得特异性针对耐药菌的噬菌体。基于本思路,本发明涉及一种t4ss靶向型噬菌体vb_ecom_x4及其应用,该噬菌体可以特异识别携带t4ss的耐药菌并产生裂解作用,因此可用于高效阻断耐药基因在动物养殖环境、动物性食品加工环境和医疗环境中的传播扩散。
7.为实现上述目的,本发明提供了如下方案:
8.本发明提供一种t4ss靶向型噬菌体vb_ecom_x4,在中国典型培养物保藏中心保藏,保藏编号为cctcc no:m 2021519,保藏地址为中国武汉武汉大学,保藏日期为2021年5月19日,分类命名为大肠杆菌噬菌体vb_ecom_x4(escherichia coli phage vb_ecom_x4)。
9.本发明提供的t4ss靶向型噬菌体vb_ecom_x4可以特异裂解同时携带t4ss和耐药基因的耐药菌,包括携带blandm,mcr
‑
1或tet(x4)基因的多重耐药菌。
10.所述噬菌体vb_ecom_x4是这样获得的:通过将典型t4ss质粒电转入多种大肠杆菌
标准株j53,dh5a,jm109,bl21和k12中,获得携带t4ss质粒的标准菌株,以上述标准菌株为宿主菌,以相应的不携带t4ss质粒的标准菌株为对照,从污水中分离出一株可以同时裂解以上携带t4ss质粒标准菌株的噬菌体,并且该噬菌体对不携带t4ss质粒的标准菌株没有裂解作用。
11.所述的噬菌体vb_ecom_x4具有呈正多面体的头部和可伸缩性的尾部;噬菌体菌株在固体培养基上可以形成透亮空斑,周围无晕环,边缘清晰规则,直径为1~2mm;噬菌体基因组核酸的酶切图谱显示该噬菌体核酸是双链dna(dsdna);根据国际病毒分类委员会(ictv)2005年发表的《病毒分类—国际病毒分类委员会第八次报告》,该噬菌体vb_ecom_x4应属于肌尾病毒科。
12.所述的噬菌体vb_ecom_x4在30
‑
70℃中放置60min,其活性稳定,在80℃中则失活;处于ph5.0
‑
10.0时,其效价与初始效价无显著性差异。
13.本发明还提供一种杀菌组合物,含有所述的噬菌体vb_ecom_x4。
14.进一步地,所述的杀菌组合物中还含有辅料。
15.进一步地,所述杀菌组合物的剂型包括水剂;所述水剂包括喷洒液、药浴液或注射液。
16.本发明还提供一种所述的噬菌体vb_ecom_x4或所述的杀菌组合物在杀灭和/或预防多重耐药菌中的应用。
17.进一步地,所述多重耐药菌携带t4ss和耐药基因。
18.进一步地,所述耐药基因包括blandm、mcr
‑
1或tet(x4)基因。
19.进一步地,所述噬菌体vb_ecom_x4施加浓度为5
×
107pfu/ml~5
×
108pfu/ml,施加量为1ml/m2。
20.进一步地,所述应用具体为将噬菌体vb_ecom_x4纯化后,用于杀灭动物养殖环境、动物性食品加工环境及人类医疗环境中的多重耐药菌。
21.进一步地,所述动物养殖环境是指畜禽体内、体表、饲料、养殖器具、地面、墙面、粪便、垫料及空间环境等。
22.进一步地,所述动物性食品加工环境是指屠宰线不同环节、食品生产车间以及肉制产品仓储、运输、销售环节涉及的各种器械、台面、空间环境等。
23.进一步地,所述人类医疗环境是指大中小型医院、诊所、社区卫生服务中心、卫生防疫机构的诊疗器械、空间环境等。
24.本发明还提供一种所述的噬菌体vb_ecom_x4或所述的杀菌组合物在制备杀灭和/或预防多重耐药菌感染的药物中的应用。
25.本发明公开了以下技术效果:
26.t4ss靶向型噬菌体vb_ecom_x4可以裂解同时携带t4ss和耐药基因的耐药菌,包括携带碳青霉烯类耐药基因blandm,粘菌素耐药基因mcr
‑
1和替加环素耐药基因tet(x4)的多重耐药菌,而对于不携带t4ss的非耐药菌没有裂解作用;该噬菌体vb_ecom_x4具有较好的亲水相,可以配制成喷洒液、药浴液或注射液,该噬菌体vb_ecom_x4可以单独或与其他物质复配使用,对动物养殖环境、食品加工环境和人类医疗环境中的多重耐药菌进行杀灭,可简便、快速、高效阻断耐药基因在环境中的传播扩散。
附图说明
27.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
28.图1为噬菌体的噬菌斑形态;
29.图2为噬菌体的透射电镜照片;
30.图3为温度对噬菌体活性的影响;
31.图4为ph值对噬菌体活性的影响;
32.图5为噬菌体在培养基中的杀菌效果;
33.图6为噬菌体在动物养殖环境中的杀菌效果;
34.图7为噬菌体在食品加工环境中的杀菌效果;
35.图8为噬菌体在人类医疗环境中的杀菌效果。
具体实施方式
36.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
37.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
38.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
39.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
40.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
41.实施例1 t4ss质粒携带菌的获得
42.选择本实验室保存的tet(x4)阳性菌株,该菌株携带了一个典型t4ss质粒(genbank号:nz_mt219822),将该质粒电转入大肠杆菌标准株j53,dh5a,jm109,bl21和k12中,获得仅携带t4ss质粒的各种标准菌株,以以上标准菌株为宿主菌分离t4ss靶向型噬菌体。
43.实施例2 t4ss靶向型噬菌体的初始分离
44.本发明样品采自江苏省南京市某肉鸡养殖场污水,取上清经双层滤纸过滤,
10000rpm离心20min,再用0.22μm滤膜过滤上清。取10ml过滤上清,加入0.5ml上述构建的宿主菌过夜培养物,再加入无菌cacl2母液至终浓度1.25mm混匀后,加入20ml lb培养基,室温作用30min,再放置于37℃,待培养至6~8h后,取上述培养物以12000rpm,4℃,离心30min,取上清;再取此上清10ml,加入0.5ml宿主菌过夜培养物,加入无菌cacl2母液至终浓度1.25mm混匀后,加入20ml lb培养基,按上述培养方法培养离心,获得富集的上清;按照以上的试验方法再富集一次,将富集三次的上清用0.22μm滤膜过滤,形成噬菌体原液。
45.以携带t4ss质粒的大肠杆菌标准株j53,dh5a,jm109,bl21和k12为宿主菌,分别吸取各宿主菌液0.1ml滴于不同的lb琼脂平板正中央,用涂棒将菌液均匀地涂开;待其晾干后,取噬菌体原液10μl滴于其中一个区域;待自然晾干后,置于37℃培养箱培养10h后,观察滴加噬菌体区域有无空斑形成。
46.如果有空斑形成,证明有噬菌体存在。取噬菌体原液100μl,进行一系列的10倍稀释,取10
‑2、10
‑4和10
‑6稀释液各0.1ml与过夜培养的宿主菌液0.1ml混匀,室温作用15min后,加入约4ml 0.6%lb培养基,混匀后迅速倾倒入lb培养基平板上层,摇匀平置10min,待其凝固,置于37℃温箱培养12h后观察,获得形成单个噬菌斑的双层平板。
47.实施例3t4ss靶向型噬菌体的纯化及确证
48.在形成噬菌斑的双层平板上,用移液器的枪头挑取直径较大的单个噬菌斑,接种于3~5ml lb液体培养基中,加入噬菌体宿主菌液0.1ml,混匀,室温作用15min,37℃培养10~14h,12000rpm,4℃离心10min,取上清,加入0.3%氯仿。如此反复挑取4
‑
5次单个噬菌斑,将噬菌体纯化成大小一样的噬菌斑。
49.将纯化后的不同大小噬菌体进行点样:同时使用携带t4ss质粒的大肠杆菌标准株(j53、dh5a、jm109、bl21和dh10b)和其对应的不携带t4ss质粒的标准菌株作为宿主菌,分别吸取各宿主菌液0.1ml滴于不同的lb琼脂平板正中央,用涂棒将菌液均匀地涂开;待其晾干后,取噬菌体原液10μl滴于其中一个区域;待自然晾干后,置于37℃培养箱培养10h后,观察滴加噬菌体区域有无空斑形成。结果仅有一株噬菌体可以裂解所有的t4ss质粒阳性大肠杆菌,而对不携带t4ss质粒的标准菌株没有裂解作用。
50.将该噬菌体扩增后,使用双层平板检测纯化的噬菌体颗粒(图1)。纯化的噬菌体命名为vb_ecom_x4,在中国典型培养物保藏中心保藏,保藏单位地址:中国武汉武汉大学,保藏号:cctcc no:m 2021519,分类命名:大肠杆菌噬菌体vb_ecom_x4(escherichia coli phage vb_ecom_x4),保藏日期为2021年5月19日。
51.实施例4噬菌体透射电镜检测
52.取纯化的噬菌体vb_ecom_x4做电镜观察,加10μl样本滴在铜网上,待其沉淀15min,用滤纸吸去多余的液体,用2%的磷钨酸(pta)染色1
‑
2min,干燥后透射电镜(日立h
‑
7650)观察。
53.如图2所示,噬菌体属于肌尾噬菌体科,头部呈正多面体,头部直径约为78nm,尾长约为118nm。
54.实施例5温度及ph对噬菌体的影响
55.取1ml 5.2
×
108pfu/ml纯化的噬菌体vb_ecom_x4于30℃~80℃水浴分别作用30min和60min,将样品冷却后测其效价;分别取ph2.0~13.0的蛋白胨水和2.5
×
108pfu/ml纯化噬菌体等量混合,37℃水浴作用2h后测其效价。
56.结果如图3所示,噬菌体在30~50℃分别作用30min和60min后,其活性无显著变化;在60℃和70℃作用下,活性有显著降低;80℃作用30min后,无噬菌体存活。
57.结果如图4所示,在ph为2.0和3.0时,检测不到噬菌体;ph为4.0和5.0时,其效价与初始效价相差较大,ph为6.0~10.0时,其效价与初始效价无显著性差异;而当ph为11.0、12.0和13.0时,检测不到噬菌体。
58.实施例6噬菌体宿主谱分析
59.选取30株临床分离的t4ss阳性菌株,其中10株携带tet(x4)基因,10株携带mcr
‑
1基因,其余10株携带bla
ndm
‑1基因;另选择5株t4ss阴性标准菌株(j53、dh5a、jm109、bl21和dh10b)作为对照。对t4ss靶向型噬菌体的宿主谱进行分析,具体操作如下:分别取35株大肠杆菌的过夜培养物100μl,滴加在1.5%lb培养基平板中央,用涂棒分别将它们涂制成均匀的菌苔。然后将每个平板平均分成两个区域,其中一个区域,取10μl噬菌体(1
×
108pfu/ml)滴加在菌苔表面,另一个区域滴加10μl生理盐水作对照,待液滴干燥后倒置于37℃培养12~16h,观察结果。
60.结果如表1所示,该t4ss靶向型噬菌体对30株t4ss阳性耐药菌中的26株有裂解作用,裂解率为86.67%,对5株t4ss阴性标准菌株无裂解作用,说明该噬菌体对t4ss耐药菌具有特异性识别和裂解能力,并且裂解能力较强。
61.表1.t4ss靶向型噬菌体的宿主谱分析
62.[0063][0064]
实施例7噬菌体在培养基中的杀菌效果
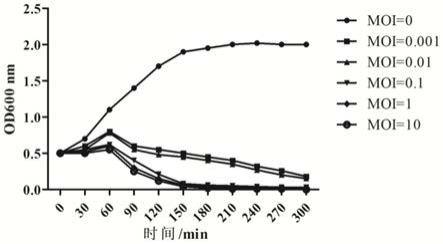
[0065]
以tet(x4)阳性大肠杆菌ec
‑
tgc
‑
js1为代表菌株检测t4ss靶向型噬菌体在培养基中的杀菌效果。取其ec
‑
tgc
‑
js1过夜培养物1.0ml,用lb将其od
600nm
值调整为0.5(约为5
×
108cfu/ml),分别加入不同moi的噬菌体vb_ecom_x4:(1)5
×
104pfu/ml(moi=0.0001)、(2)5
×
107pfu/ml(moi=0.1)和(3)5
×
108pfu/ml(moi=1),于37℃静置培养,同时设置不加噬菌体的对照组。每隔30min检测od
600nm
值的变化。
[0066]
结果见图5,与细菌对照组相比,噬菌体vb_ecom_x4处理组,60min后,大肠杆菌数量开始下降,且噬菌体浓度越大,细菌数量降低越明显,当moi>0.1时,2h时大肠杆菌的数量已控制到较低值,且23h时od
600nm
接近于0,说明噬菌体vb_ecom_x4在培养基中杀菌迅速而且彻底。
[0067]
实施例8利用t4ss靶向型噬菌体控制动物养殖场环境中的mcr
‑
1阳性沙门氏菌污染
[0068]
选择肉鸡养殖场作为实验地点,将浓度为105cfu/ml的mcr
‑
1阳性沙门氏菌sal
‑
col
‑
js1取1ml均匀喷洒在养殖鸡笼表面,然后以1ml浓度为108pfu/ml噬菌体vb_ecom_x4对养殖鸡笼实施喷杀,以不加噬菌体的对照组为阳性对照组进行对照试验,1h后,开始检测噬菌体消毒组和阳性对照组mcr
‑
1阳性沙门氏菌。
[0069]
检测结果如图6所示,2h后,经噬菌体消毒组处理的鸡笼表面mcr
‑
1阳性沙门氏菌的数量降到102cfu左右,3h后,鸡笼表面mcr
‑
1阳性沙门氏菌的数量降到10cfu以下,而经阳性对照组处理的鸡笼表面mcr
‑
1阳性沙门氏菌的数量没有下降,说明本发明分离纯化得到的噬菌体有望高效杀灭动物养殖环境中的mcr
‑
1阳性沙门氏菌。
[0070]
实施例9利用噬菌体清除动物性食品加工环境中的tet(x4)阳性大肠杆菌
[0071]
选择生猪屠宰场作为实验地点,将浓度为105cfu/ml的tet(x4)阳性大肠杆菌ec
‑
tgc
‑
js1取1ml均匀喷洒在屠宰车间台面,然后以1ml浓度为108pfu/ml噬菌体vb_ecom_x4对屠宰车间台面进行喷杀,同实施例8一样设置阳性对照组,1h后,同时检测阳性对照组和噬菌体消毒组tet(x4)阳性大肠杆菌。
[0072]
检测结果如图7所示,2h后,阳性对照组tet(x4)阳性大肠杆菌数量没有下降,而经噬菌体消毒组处理的屠宰车间台面tet(x4)阳性大肠杆菌的数量已经降到10cfu以下,说明该噬菌体有望用于杀灭动物性食品加工环境中的tet(x4)阳性大肠杆菌。
[0073]
实施例10利用噬菌体杀灭人类医疗环境中的bla
ndm
‑1阳性肺炎克雷伯氏菌
[0074]
选择社区服务中心作为实验地点,将浓度为105cfu/ml的bla
ndm
‑1阳性肺炎克雷伯氏菌1ml均匀喷洒在医用剪刀表面,然后以1ml浓度为108pfu/ml噬菌体vb_ecom_x4对医用剪刀进行喷杀,同实施例8一样设置阳性对照组,1h后,同时检测阳性对照组和噬菌体消毒组bla
ndm
‑1阳性肺炎克雷伯氏菌。
[0075]
检测结果如图8所示,1h后,阳性对照组处理的医用剪刀表面bla
ndm
‑1阳性肺炎克雷伯氏菌的数量下降不明显,而噬菌体消毒组处理后bla
ndm
‑1阳性肺炎克雷伯氏菌数量降到10cfu以下,2h后,医用剪刀表面bla
ndm
‑1阳性肺炎克雷伯氏菌的数量已经降到0cfu,说明该噬菌体有望用于高效杀灭人类医疗环境中的bla
ndm
‑1阳性肺炎克雷伯氏菌。
[0076]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1