双特性抗体在制备治疗先天性α-肌营养不良症药物中的应用的制作方法
双特性抗体在制备治疗先天性
α
‑
肌营养不良症药物中的应用
技术领域
1.本发明生物医药技术领域,尤其涉及双特性抗体在制备治疗先天性α
‑
肌营养不良症药物中的应用。
背景技术:
2.alpha
‑
dystroglycanopathy是先天性肌肉营养不良症的一种亚型,其本身再临床和遗传学上表现出异质性和复杂性。该疾病类型的生化标志是α
‑
dystroglycan(adg)蛋白上面的特异性的o
‑
连接糖基化减少或缺失。导致adg与配体的结合减弱,包括肌肉、神经细胞外面的的层粘连蛋白211(laminin 211)、集聚蛋白和基底蛋白聚糖等,这些畸变导致病人的肌肉、中枢神经系统和眼睛的出现临床异常。患有严重a
‑
dystroglycanopathy亚型的患者,如walker
‑
warburg综合征(wws),肌肉
‑
眼
‑
脑疾病(meb)和福山型先天性肌营养不良症(fcmd),在出生后不久就出现全身性肌肉力量减退以及脑部神经和肌肉发展畸形。而另外的亚型,肢带型肌营养不良(lgmd)患者,出生后具备正常的行动能力,但肌肉发育3
‑
4岁后开始萎缩,在十几岁的时候身体变得虚弱,大约20多岁开始需要轮椅。
3.α
‑
dystroglycanopathy的遗传异质性和每个亚型的罕见性对开发治疗方法提出了重大挑战。目前的标准疗法是类固醇激素治疗。然而激素疗法只是缓解肌肉损伤带来的炎症,对疾病进展控制毫无帮助。因此α
‑
dystroglycanopathy患者有着高度未满足的医疗需求。
4.针对α
‑
dystroglycanopathy的新型疗法包括反义核酸疗法(anti
‑
sense rna)aav基因治疗方法和酶替代疗法,都处于早期阶段,这些方法的缺陷在于只能治疗α
‑
dystroglycanopathy患者的其中一种基因缺陷。而α
‑
dystroglycanopathy目前已知至少是由超过18种基因引起的。因此目前的这些疗法无法针对所有α
‑
dystroglycanopathy的病人。
5.adg通过基质聚糖和骨骼肌基底层中的粘连蛋白211结合,是肌肉细胞产生和传递机械力的基本结构。因此,从概念上讲,用功能性模拟物修复粘连蛋白211和肌细胞膜之间的联系,可以作为该患者群体的治疗方法(即蛋白质替代)。
6.将纯化的基质聚糖o
‑
糖基化adg局部注射到large
‑
myd小鼠肌肉中的证明可以保护肌膜免受激光诱导的损伤,这表明蛋白质替代可能是可行的。然而,当全身注射基质聚糖糖基化adg时,肌肉中的变化很小,因此寻找新的功能性模拟物可能是另外一个途径。
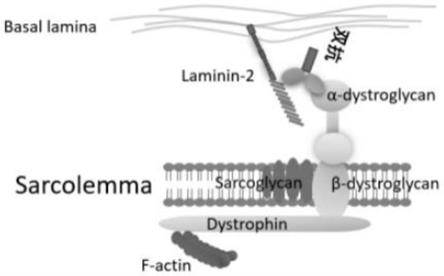
7.正常肌肉组织中,dgc蛋白复合物通过基质聚糖和骨骼肌基底层中的粘连蛋白211结合,实现肌肉力量传导(见图1)。sanofi曾经提出用针对laminin
‑
2以及β
‑
dag1的抗体组成双抗来连接肌膜和粘连蛋白。并在large
‑
myd老鼠模型中,看到了一定的肌肉力量修复的效果(见图2)。
8.然而由于β
‑
dag1靶点开发抗体具有很高的挑战性,sanofi的双抗具有非特性组织结合,聚集以及较差的pk/pd,因而不具备成药性,无法在临床上给病人带来收益,sanofi因此停止了该项目的开发。
9.虽然sanofi提出了一个可行的方案,而由于抗体开发的困难度,他们的设想无法在人体实验得到证实。我们对他们的抗体做了验证实验。的确,sanofi针对β
‑
dag1抗体,亲和力底,并且存在非特性结合,而我们的开发的针对β
‑
dag1抗体体现出高度特异性,和较高的亲和力。
10.sanofi双抗anti
‑
βdag1&anti
‑
laminin211抗体采用了dvd
‑
ig形式。这个双抗出现了较差的生物物理学稳定性。因此急需一种良好生物物理学特性以及不会出现降解或凝集的药物。
技术实现要素:
11.为解决上述技术问题,本发明提供了双特性抗体在制备治疗先天性α
‑
肌营养不良症药物中的应用。本发明首次开发出针对β
‑
dag1具备良好特异性,良好物理学特性的抗体,本发明构建的双特性抗体,具备良好的成药性。
12.一种双特异性抗体,所述双特异性抗体包含:
13.(1)特异性结合dag1的至少一种抗体或其抗原结合片段;以及,
14.(2)特异性结合层粘连蛋白211的至少一种抗体或其抗原结合片段。
15.在本发明的一个实施例中,所述特异性结合dag1的至少一种抗体或其抗原结合片段为:特异性结合至人β
‑
dag1结构域hβ
‑
dag1中的表位;所述特异性结合层粘连蛋白211的至少一种抗体或其抗原结合片段为:特异性结合至鼠层粘连蛋白g样5结构域mlg
‑
5、人层粘连蛋白g样5结构域hlg
‑
5、鼠层粘连蛋白g样4和5结构域mlg
‑
4/5、人层粘连蛋白g样4和5结构域hlg
‑
4/5中的至少一个表位。
16.在本发明的一个实施例中,所述双特异性抗体的构建方法为:将特异性结合层粘连蛋白211的laminin
‑
211lg5 vhh抗体连接到特异性结合dag1的β
‑
dag1抗体的fc末端;所述β
‑
dag1抗体含氨基酸序列如seq id no.1
‑
seq id no.7中任一项所示的重链可变区和氨基酸序列如seq id no.08
‑
seq id no.14中任一项所示的轻链可变区;所述laminin
‑
211lg5vhh抗体的氨基酸序列如seq id no.15
‑
seq id no.19中任一项所示。
17.在本发明的一个实施例中,所述mβ
‑
dag1的氨基酸序列为:uniprot q62165,652
‑
893;所述hβ
‑
dag1的氨基酸序列为:uniprot q14118,654
‑
895。
18.在本发明的一个实施例中,所述mlg
‑
5的氨基酸序列为:uniprot q60675,2932
‑
3118;所述hlg
‑
5的氨基酸序列为:uniprot p24043,2936
‑
3122;所述mlg
‑
4/5的氨基酸序列为:uniprot q60675,2725
‑
3118;所述hlg
‑
4/5的氨基酸序列为:uniprotp24043,2729
‑
3122。
19.一种编码所述的双特异性抗体的核酸。
20.一种所述核酸的载体。
21.一种表达所述载体的宿主细胞。
22.一种药物组合物,所述药物组合物包含所述的双特异性抗体以及至少一种药学上可接受的赋形剂、稀释剂或载体。
23.所述的双特异性抗体的应用,所述应用包括:(a)制备治疗先天性肌肉营养不良症的接头或药物;或(b)制备检测dag1和/或层粘连蛋白211分子的试剂或试剂盒。
24.本发明的上述技术方案相比现有技术具有以下优点:
25.本发明第一次开发出针对β
‑
dag1具备高度特异性和较高的亲和力(见图3),良好物理学特性的抗体;本发明构建的双特性抗体,具备良好的成药性,具备特异性的结合β
‑
dag1&laminin
‑
211,本发明双抗分子未来具备在alpha
‑
dystroglycanopathy患者进行治疗的潜力。
26.本发明双抗在page胶和hplc size exclusion柱上体现了良好的生物物理学特性,没有出现降解或凝集的现象。
附图说明
27.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中
28.图1是在肌肉组织中肌肉膜蛋白dgc和粘连蛋白211结合肌肉功能示意图,其中(a)是正常肌肉组织中,肌肉细胞膜上的肌肉膜蛋白dgc通过基质聚糖和骨骼肌基底层中的粘连蛋白211结合肌肉功能示意图;(b)是dystroglycanopathy患者出现dgc糖基化的缺失后,肌肉膜蛋白dgc和粘连蛋白211的链接减少或缺失,导致肌肉功能缺失。
29.图2是laminin
‑
2以及β
‑
dag1的抗体组成双抗来连接肌膜和粘连蛋白示意图。
30.图3是β
‑
dag1抗体非特性结合cho细胞情况图。
31.图4是本发明p38g1&p57a1抗体展示出特异性结合人和小鼠的β
‑
dag1蛋白,p79d02为阴性抗体,cho对照母细胞,(cho)
‑
hdag1,cho细胞表达人源dag1蛋白,(cho)
‑
mdag1,cho细胞表达小鼠dag1蛋白。
32.图5是蛋白表达质粒部分示意图;其中,a是表达带有his tag蛋白的质粒示意图,b是表达fc融合蛋白的质粒示意图;c是构建稳定细胞株的质粒,质粒的基本骨架结构是pcdna1。
33.图6是单b细胞微流控分装示意图;其中,(a)微流控芯片单b细胞分装,裂解示示意图(b),显微镜下得微流控芯片管道。
34.图7是克隆p79e02,p79f03,p79c112,p80d05,p80a07,p38g1和57a1展示出特异性结cho细胞表面的mdag1和hdag1情况图。
35.图8是克隆p38g1的抗原结合动力学结果图。
36.图9是克隆p57a1的抗原结合动力学结果图。
37.图10是vhh hits pl60b1,pl60b2,pl60b3,pl60c1,pl60c2,pl60f1,pl60f3在不同浓度下,结合cho,cho
‑
hlg5&cho
‑
mlg5的能力情况图。
38.图11是用carterra对抗体hits pl60b1,pl60b2,pl60b3,pl60c1,pl60c2,pl60f1,pl60f3的亲和力鉴定。
39.图12是pl60b1(与pl60b3相同),pl60f3,pl60c1,pl60b2在不同浓度下对laminin家族蛋白的结合结果。
40.图13是本发明anti
‑
βdag1和anti
‑
lg5双抗结构。
41.图14是本发明双抗和母单抗结合细胞上面的βdag1的鉴定结果。
42.图15是本发明双抗和母单抗结合细胞上面的lg5的鉴定结果。
43.图16和图17是本发明双抗和单克隆抗体亲和力测试结果。
44.图18是本发明双抗在非还原性和还原性page胶上电泳分离情况。
45.图19是本发明hplc分离纯化双抗液相色谱图。
具体实施方式
46.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
47.实施例
48.1抗体发现:anti
‑
βdag1 and anti
‑
lg4/5特异性抗体
49.1.1蛋白制备
50.为了表达鼠或人β
‑
dag胞外域(beta
‑
dag ecd)(uniprot q62165,氨基酸652
‑
746,本发明构建了一个质粒(图5
‑
a,5
‑
b),以pcdna1作为骨架,cmv启动子和增强子。将构建质粒瞬时转染exp cho细胞(thermo fisher)。表达在37℃进行。
51.expi
‑
lipofectamine与dna载体复合并添加到悬浮细胞培养物中。在第2天,根据制造商的方案将增强剂和饲料添加到培养物中。
52.细胞在摇床培养中与8%co2在37℃下孵育7天,然后通过离心去除细胞。上清液通过0.22μm过滤器进行灭菌,并与等体积的不含镁或钙的dpbs混合。
53.将来自fc融合蛋白的上清液以1ml/min加载到1ml蛋白a sepharose柱上,然后用50mm naac ph5.5洗涤柱。然后融合蛋白用50mm naac ph3.0洗脱并收集在0.5ml级分中,合并高蛋白质浓度级分并用dpbs渗滤。
54.来自非fc蛋白的上清液用dpbs稀释10倍,然后使用切向流透析浓缩。将浓缩物加载到2mlni柱上,用含有25mm咪唑的pbs缓冲液洗涤,然后用含有300mm咪唑的pbs缓冲液洗脱。合并含有高蛋白质的级分并用dpbs渗滤,然后用nickel柱分离纯化。
55.层粘连蛋白g样5结构域(mlg
‑
5或hlg
‑
5)的表达和上面方法类似构建体,以及mlg
‑
5(参见uniprot q60675,氨基酸2932
‑
3118;seq id no:292)或hlg
‑
5(uniprot p24043,氨基酸2936
‑
3122;seq id no:293)。该构建体用于使用expifectamine试剂(thermo fisher)转染expi293f细胞。表达7天后,用nickel柱分离纯化。
56.1.2细胞系建立
57.具有人或鼠β
‑
dag表面表达的稳定细胞系是通过密码子优化构建体创建的,该构建载体dna用fsp i限制性内切酶线性化(图5
‑
c),n端带有myc标签和β
‑
dag的细胞外和内源性跨膜结构域(小鼠uniprot q62165,氨基酸652
‑
893;人类uniprot q14118,氨基酸654
‑
895)。使用lipofectamine(thermo fisher)转染贴壁人胚胎肾细胞(hek)和贴壁中国仓鼠卵巢细胞(cho
‑
k1),并用遗传霉素(gibco)选择细胞。存活细胞被连续稀释以获得单细胞克隆,并且通过抗myc流式细胞术证实了β
‑
dg的表面表达。
58.具有人或鼠lg
‑
5表面表达的稳定细胞系是通过密码子优化构建体创建的,该构建体包含n端myc标签、gly/ser接头、lg
‑
5(小鼠uniprot q60675,氨基酸2932
‑
3118;人uniprot p24043、氨基酸2936
‑
3122)和用于哺乳动物表达的tfr1跨膜结构域。使用lipofectamine(thermo fisher)转染贴壁的中国仓鼠卵巢细胞(cho
‑
k1),并用遗传霉素(gibco)选择细胞。存活细胞被连续稀释以获得单细胞克隆,并且通过抗myc流式细胞术证实了β
‑
dg的表面表达。
59.具有人或鼠lg
‑
4/5表面表达的稳定细胞系是通过密码子优化构建体创建的,该构
建体包含n端鼠fc标签、lg
‑
4/5(小鼠uniprot q60675,氨基酸2725
‑
3118;人uniprotp24043,氨基酸2729
‑
3122)。使用lipofectamine(thermo fisher)转染粘附的人胚胎肾细胞(hek),并使用遗传霉素(gibco)选择细胞。存活细胞被连续稀释以获得单细胞克隆,并且通过抗鼠fc流式细胞分析技术证实了β
‑
dg的表面表达。
60.1.3老鼠免疫
61.基因枪dna免疫采用helios基因枪系统(biorad,cat#:1652
‑
431)。质粒表达载体(图5
‑
c)用黄金颗粒作为辅料包裹dna(biorad 1652263)总共注射小鼠4
‑
6次。蛋白免疫用弗氏或ribi佐剂乳化抗原溶液。免疫balb/c小鼠、然后每周用这些蛋白质加强2次。大约2周后每隔7天采血测血清抗体水平,当达到足够的抗体滴度时,老鼠的脾脏和骨髓b细胞被纯化出后用ablink平台筛选抗体。
62.llama羊驼用hlg
‑
5蛋白结合弗氏佐剂乳化抗原溶液。进行羊驼免疫,每月免疫一次。大约3个月后检测血清抗体水平,当达到足够的抗体滴度时,羊驼脾脏b细胞被纯化出后用ablink平台筛选抗体。
63.1.4单b细胞微流控分装
64.本发明使用了定制设计的玻璃乳液液滴微流控芯片来分装b细胞并捕获抗体重轻链mrna。微流控芯片有两个氟碳油(白云石)输入通道,一个是细胞悬浮液混合物的输入通道,以及一个细胞裂解缓冲液中1.25mg/ml的oligo
‑
dt磁珠(neb)输入通道(20mm tris ph 7.5、0.5m nacl、1mm edta、0.5%tween
‑
20和20mm dtt)。第三个通道是油混合物,用以包装单b细胞和磁珠(见图6)。b细胞在乳液滴被裂解后乳液收集到冷冻的15ml微量离心管中,捕获mrna的磁珠随后被纯化回收。
65.1.5单b细胞抗体重轻链配对pcr扩增及酵母天然vh
‑
vl scfv
‑
fc文库建立
66.mrna结合的磁珠重新悬浮到rt
‑
pcr混合物中及具有专有矿物油和表面活性剂,利用天梯特有的技术形成独立的大约10nl大小的微液滴rt
‑
pcr混合物包含一步法rt
‑
pcr缓冲液,(2.0mm mgso4,super
‑
script iii逆转录酶和platinum taq(thermo fisher scientific),加上针对igk c区、igg c区和所有vh区的pcr引物。链接重轻链pcr产物的重叠区域是一段gly
‑
ser的接头序列。pcr扩增产物vl
‑
gs
‑
vh载入1%的琼脂胶进行电泳分离,然后使用qiagen gel purificationkit进行纯化回收。
67.纯化的pcr扩增产物vl
‑
gs
‑
vh再度进行pcr在两端加上adapter,然后在琼脂胶分离纯化。
68.酵母细胞(atcc)被电穿孔(bio
‑
rad gene脉冲发生器ii;0.54kv,25uf,电阻设置为无穷大)pcr产物和线性化pyd载体被导入酵母细胞体内后再发生同源重组。转化的细胞是用半乳糖扩增和诱导,以产生酵母scfv
‑
fc抗体展示库。
69.羊驼vhh抗体mrna直接用vhh引物pcr扩增并导入酵母细胞内建立抗体文库。
70.1.6酵母文库的筛选及抗体hits产生
71.抗原mbeta
‑
dg,hbeta
‑
dg以及mlg
‑
5、hlg
‑
5首先使用ez
‑
link micro sulfo
‑
nhs
‑
lc
‑
biotinylation kit(thermo fisher scientific)进行生物素化并结合到磁珠。首先用磁珠富集抗原特异性的酵母,随后富集的酵母被生物素化的抗原(浓度为10nm
‑
1μm)染色。在流式仪器bd facsaria ii(用于双阳性细胞(fitc/pe)分离,然后将回收的克隆接种到sd
‑
caa板上卡那霉素、链霉素和青霉(teknova)和扩增。然后将扩增的酵母接受第二轮(有
时是第三轮)facs流式分析分离。
72.1.7elisa结合测定
73.具备理想特征的酵母克隆接种到半固体ypd培养基生长,扩增,共3天后转移到2ml深度96孔板(12111077,thermo fisher scientific)继续培养。
74.将纯化的抗原(mbeta
‑
dg、mlg
‑
5、hlg
‑
5、mlg
‑
4/5或hlg
‑
4/5)以1μg/ml包被在nunc maxisorp 96孔elisa板(thermo scientific)上。将来自96孔板克隆的单克隆抗体上清液添加到每个孔中,并使用抗鼠,hrp标记的二级抗体(jackson immunoresearch)检测阳性或阴性结合。
75.1.8carterra抗体抗原结合动力学鉴定
76.抗体抗原亲和力是使用基于96
×
96阵列的spr成像系统(carterra usa)测量抗dag1或lg5抗体的结合动力学。对于抗人fc捕获方法:将5ug/ml的抗人fc(soμthern bio,#2047
‑
01)固定在chip
‑
hc200m
‑
polycarboxylate
‑
200nm涂层厚度芯片(carterra bio,cat#hc200m)或chip
‑
hc30m上
‑
聚羧酸盐
‑
30nm涂层厚度芯片(carterra bio,cat#hc30m)通过基于胺的耦合。对于直接偶联,抗体直接偶联到上述芯片上。捕获上清液或纯化形式的抗dag1或lg5抗体,并流过dag1 ag或lg5 ag。注入ag 2
‑
3分钟,在25℃的运行缓冲液中并监测解离5或10分钟。这在使用10mm甘氨酸hcl ph 1.7的结合循环之间再生表面。传感图被减去空白并使用制造商提供的软件使用1:1langmuir结合模型进行分析。对于直接偶联,抗体直接偶联到上述芯片上。
77.carterra lsa的抗体竞争
78.carterra lsa用于对一组抗lg5抗体进行表位定位。纯化的单克隆杂交瘤抗体在10mm醋酸钠缓冲液ph 4.5中以10μg/ml稀释。使用胺偶联,使用连续流动显微点样仪将抗体直接固定在hc200m芯片上以创建抗体阵列。对于分档分析,ibis mx96spri用于评估与固定抗体的结合。实验在25℃下在运行缓冲液中进行。以100nm注射抗原4分钟,然后以10μg/ml注射抗体4分钟。在使用10mm甘氨酸ph 2.0的循环之间再生表面。数据在carterra的kit软件工具中通过点间参考和双重参考数据进行处理和分析,然后使用每个点的全局ka、kd和rmax值将它们拟合到简单的朗缪尔绑定模型中。通过检查残差来确定拟合质量并使用carterra处理数据。
79.1.9抗体可变区测序
80.酵母细胞质粒用qiagen miniprep纯化,并用genscript sanger测序获得可变区抗体序列,结果见表3和表5。
81.2双抗构建质粒
82.β
‑
dag1抗体克隆pl79f3和laminin domain lg5抗体克隆p60c01用来双特异性抗体,抗体表达质粒载体见图5
‑
c,在c末端链接fc。pl97f3抗体fc端和vhh克隆p60c01用gs linker链接。抗体结构见图13。
83.3结果
84.3.1anti
‑
βdag1以及anti
‑
lg5的抗体鉴定
85.为了筛选和选择产生对β
‑
dag1、lg
‑
5特异的抗体的酵母,使用elisa、facs分析和carterra动力学分析来评估抗体结合抗原的特异性。carterra对β
‑
dg的hits测定显示了一系列抗体对β
‑
dg、或lg
‑
5的结合亲和力(见表1和表2)显示出β
‑
dag1抗体亲和力在10
‑9m到
10
‑
10
m。针对laminin
‑
211lg5的抗体亲和力在10
‑
10
m到10
‑
11
m之间。鉴定后的克隆采用sanger测序,β
‑
dag1和lg
‑
5抗体序列见表3和表4。
86.表1β
‑
dag抗体克隆的结合动力学
87.cloneidk
a
(m
‑1s
‑1)k
d
(s
‑1)kdpl57a12.40e+051.20e
‑
045.00e
‑
10pl57b11.30e+041.00e
‑
057.69e
‑
10pl57c11.50e+042.30e
‑
041.53e
‑
08pl57d13.00e+042.50e
‑
048.33e
‑
09pl57d26.20e+049.50e
‑
041.53e
‑
08pl57e29.20e+052.20e
‑
032.39e
‑
09p38g12.00e+041.00e
‑
055.00e
‑
10pl57a13.00e+052.70e
‑
049.00e
‑
10pl79d21.90e+041.90e
‑
051.00e
‑
09pl79e21.90e+041.90e
‑
051.00e
‑
09pl79f32.70e+042.10e
‑
057.78e
‑
10pl79c121.90e+041.10e
‑
055.79e
‑
10pl80d51.70e+041.10e
‑
056.47e
‑
10pl80a71.60e+041.20e
‑
057.50e
‑
10
88.表2laminin
‑
211抗体克隆的结合动力学
89.cloneidk
a
(m
‑1s
‑1)k
d
(s
‑1)kdpl60c24.00e+051.80e
‑
044.50e
‑
10pl60b32.60e+051.70e
‑
056.54e
‑
11pl60f32.40e+052.60e
‑
051.08e
‑
10pl60b22.60e+053.60e
‑
051.38e
‑
10pl60c12.60e+054.10e
‑
051.58e
‑
10
90.lamin
‑
211domain lg5作为底物固定到carterra孔板上,抗体作为inflow。
91.表3βdag抗体克隆vh和vl氨基酸序列
92.93.[0094][0095]
表4laminin
‑
211lg5 vhh抗体克隆氨基酸序列
[0096][0097]
表5β
‑
dag1和laminin
‑
211双特异性vh、vl和vhh氨基酸序列
[0098]
[0099][0100]
cho细胞株表达hβdag1,mβ
‑
dag1用来确定hits的结合及特异性,(图7克隆p79e02,p79f03,p79c112,p80d05,p80a07,p38g1和p57a1展示出特异性结合cho细胞表面的mdag1和hdag1,而没有结合cho细胞,显示出高度的特异性和人鼠交叉反应。carterra spr亲和力鉴定显示p38g1 and p57a1结合hβdag1的结合力都在sub nanomolar级别(见图8和图9)。
[0101]
lg
‑
5抗体鉴定
[0102]
cho细胞株表达hlg5,mlg5用来确定vhh hits的结合及特异性,(图10)克隆pl60b1,pl60b2,pl60b3,pl60c1,pl60c2,pl60f1,pl60f3展示出特异性结cho细胞表面的mlg5和hlg5,而没有结合cho细胞,显示出高度的特异性和人鼠交叉反应。carterra spr亲和力鉴定显示pl60b1(与pl60b3相同),pl60f3,pl60c1,pl60b2结合hlg5的结合力都在10
‑
10
到10
‑
11
级别(见图11),而且在laminin家族蛋白里面显示出很高的特异性(见图12)。
[0103]
3.2双抗的构建和鉴定
[0104]
双抗构建示意图如图13所示vhh anti
‑
laminin
‑
211克隆p60c01经过连接到β
‑
dag1抗体pl79f3的fc末端,抗体序列见表5。双抗和单克隆抗体亲和力非常接近(见图16和图17)在细胞水平上结合βdag1以及laminin
‑
211lg5区域非常接近单克隆抗体(见图14和图15)。在非还原性琼脂胶电泳显示(见图18中nr),双抗是一条大约220kd条带,没有观察到降解或抗体重轻链分离的现象。在还原性琼脂胶电泳显示(图18中rd),双抗重轻链之间的二硫键被打断,抗体分拆成重链和轻链两个片段,其中重链约65kd,轻链约25kd。同样没有观察到抗体重轻链的降解,说明了抗体的良好的生物物理学特性。由图19中hplc size exclusion分析也表明,本发明的双抗只有一个分离峰,表明抗体没有出现降解或聚集,有着良好的稳定性。
[0105]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1