一种13,13a裂环原小檗碱型生物碱及在制备一氧化氮合酶抑制剂中的应用
1.本发明属于医药技术领域,特别涉及一种13,13a裂环原小檗碱型生物碱及含有该生物碱的组合物及应用。
背景技术:
2.一氧化氮(no)作为一种细胞因子,在低浓度时,可作为神经传导信号及舒张血管作用,但在高浓度时却是一种细胞毒素(e.d.garcin等,nature chemical biology,2008,4,700-707)。生物体内no可由存在于内皮细胞、巨噬细胞、神经吞噬细胞及神经细胞中的一氧化氮合酶(nos)催化精氨酸产生(d.a.geller,t.r.billiar.cancer and metastasis reviews,1998,17,7
–
23)。一氧化氮合酶是存在于内皮细胞、巨噬细胞、神经吞噬细胞及神经细胞中的同工酶,包括神经元型一氧化氮合酶(nnos)、内皮型一氧化氮合酶(enos)以及在损伤后诱导表达的诱导型一氧化氮合酶(inos)三种。其中诱导型一氧化氮合酶(inos)在细胞因子或病原体诱导下表达,并诱导产生大量的no。
3.因而inos的过量表达并诱导产生过量no被认为与炎症、疼痛、类风湿关节炎、炎症性肠病、免疫型糖尿病、中风、癌症、血栓形成及感染易感性等疾病有关(k.bian,f.murad.frontiers in bioscience,2003,8,d264
–
d278)。此外,也有研究表明inos产生过多的no也与神经退行性疾病,包括帕金森氏症和阿尔茨海默氏症,以及多发性硬化症有关(a.j.duncan,s.j.heales.mol.aspects med.2005,26,67
–
96)。因此开发inos抑制剂可作为开发治疗上述相关疾病药物的有效策略之一。
4.中药延胡索(corydalis yanhusuo w.t.wang)为罂粟科(papaveraceae)紫堇属(corydalis)多年生草本植物,常以干燥块茎入药,具有活血散瘀,理气止痛的功效(张晓丽等.沈阳药科大学学报,2008,25(7):537
–
539)。近年来对元胡镇痛药效物质开展了大量研究,发现其中原小檗碱类及原阿片碱类成具有活血、行气、止痛的作用(鲁春梅等,中国现代药物应用,2011,5(15):126-127);发现多种可对中枢神经系统产生影响的药效物质,如延胡索乙素等具有显著的镇痛活性、镇静活性,海罂粟碱具有镇静活性、左旋四氢巴马汀具有抗癫痫活性等,但这些成分均为典型的原小檗碱类、阿朴啡类及苄基异喹啉类生物碱(唐逸丰.中医临床研究,2018(23):144-146),关于这些类型的化合物及其药理活性尚不能完全诠释延胡索的传统药效及作用机制。而对于延胡索中其他类型化学成分及其药效学评价的研究鲜有报道,因此延胡索中是否含有其他类型的化合物,这些其他类型的化合物生物活性如何尚不清楚,具有较高的研究意义及开发价值,有望从中发现结构类型新颖,生物活性突出的新型化学成分,为进一步阐明延胡索药效物质基础及新型药物研发提供科学依据。
技术实现要素:
5.本发明的目的是克服现有技术的不足,提供一种13,13a裂环原小檗碱型生物碱。
6.本发明的第二个目的是提供一种含上述生物碱的药物组合物。
7.本发明的第三个目的是提供上述13,13a裂环原小檗碱型生物碱在制备一氧化氮合酶抑制剂中的应用。
8.本发明的第四个目的是提供上述药物组合物在制备一氧化氮合酶抑制剂中的应用。
9.本发明的第五个目的是提供上述13,13a裂环原小檗碱型生物碱在制备抗炎药中的应用。
10.本发明的第六个目的是提供上述药物组合物在制备抗炎药中的应用。
11.本发明的第七个目的是提供上述13,13a裂环原小檗碱型生物碱在制备镇痛药中的应用。
12.本发明的第八个目的是提供上述药物组合物在制备镇痛药中的应用。
13.本发明的技术方案概述如下:
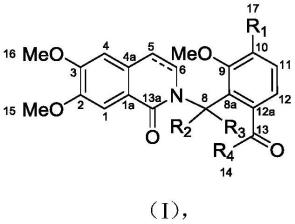
14.一种13,13a裂环原小檗碱型生物碱,其结构如式(i)所示:
[0015][0016]
其中:
[0017]
r1为och3或oh,
[0018]
r2为h;
[0019]
r3为h或r2与r3为同一个氧原子;
[0020]
r4为ch3;或r3与r4为同一个氧原子;
[0021]
5,6位为单键或双键。
[0022]
优选地,13,13a裂环原小檗碱型生物碱选自:
[0023]
[0024][0025]
一种药物组合物,包含上述13,13a裂环原小檗碱型生物碱及其可药用盐,和药用载体或赋形剂。
[0026]
上述13,13a裂环原小檗碱型生物碱在制备一氧化氮合酶抑制剂中的应用。
[0027]
上述药物组合物在制备一氧化氮合酶抑制剂中的应用。
[0028]
上述13,13a裂环原小檗碱型生物碱在制备抗炎药中的应用。
[0029]
上述药物组合物在制备抗炎药中的应用。
[0030]
上述13,13a裂环原小檗碱型生物碱在制备镇痛药中的应用。
[0031]
上述药物组合物在制备镇痛药中的应用。
[0032]
本发明的优点:
[0033]
实验证明本发明的式(i)所示生物碱结构单元简单,可从常用中药中分离获得。实验证明本发明的生物碱在2.25~25.55μm浓度下可显著抑制lps诱导小鼠巨噬细胞raw 264.7释放no及炎症因子tnf-α,il-6和il-1β的功能。进一步作用机制结果表明,本发明的生物碱可显著抑制一氧化氮合酶(inos)的表达,并可通过抑制nf-κb信号通路相关蛋白的表达发挥上述作用。计算机分子对接模拟实验结果显示,本发明的生物碱还可通过多个氢键及π-π相互作用与inos活性位点的关键氨基酸残基结合,从而抑制inos的活性。动物体内镇痛活性实验结果表明,本发明的生物碱可显著抑制醋酸扭体小鼠模型的扭体次数。
附图说明
[0034]
图1为生物碱i-4抑制lps诱导小鼠巨噬细胞raw 264.7释放炎症因子tnf-α(a),il-6(b)和il-1β(c)(*:p《0.05,****:p《0.0001)。
[0035]
图2为生物碱i-4抑制inos及nf-κb信号通路相关蛋白的表达。
[0036]
图3为计算机模拟生物碱i-1~i-5与inos蛋白活性位点相互作用。
具体实施方式
[0037]
下面结合实施例对本发明作进一步的详细描述,但本发明的实施方式不限于此。
[0038]
实施例1
[0039]
13,13a裂环原小檗碱型生物碱(以下13,13a裂环原小檗碱型生物碱简称生物碱)的制备,包括如下步骤:
[0040]
(1)中药延胡索corydalis yanhusuo w.t.wang的块茎50kg经10l体积浓度6%的醋酸水溶液浸泡24小时后,取出,于40℃烘干;粉碎,用水浸泡30min,超声提取1小时,过滤,浸泡、超声提取3次,每次用水50l,合并提取液,减压浓缩,获得提取物;提取物经大孔吸附树脂(hpd-100)柱层析色谱,分别用20l水、20l体积浓度为50%乙醇水溶液和20l体积浓度为95%乙醇水溶液依次洗脱,将体积浓度为95%乙醇水溶液洗脱液减压浓缩,除去乙醇,随后加蒸馏水定容至5l,用乙酸乙酯萃取5次,每次5l,合并,得乙酸乙酯萃取液,减压回收乙酸乙酯,得到浸膏yh-e(250.3g);将yh-e进行硅胶柱色谱分离,依次用5l的体积比为200:1的二氯甲烷-甲醇混合液,和5l体积比为150:1的二氯甲烷-甲醇混合液洗脱,减压浓缩干燥,依次得组分a和组分b;
[0041]
将组分b(14.0g)经反相ods中压柱色谱,分别用5l体积浓度45%、5l体积浓度60%和5l体积浓度95%的甲醇水溶液洗脱,减压浓缩干燥,依次得到组分b-1,b-2和b-3;
[0042]
取组分b-1(900mg)经反相ods中压柱色谱,分别用1l体积浓度分别为45%、1l体积浓度50%和1l体积浓度55%的甲醇水溶液洗脱,减压浓缩干燥,依次分别得到组分b-1-1、b-1-2和b-1-3;将b-1-3(50mg)经制备液相色谱,用体积浓度50%乙腈水溶液洗脱,减压浓缩干燥,得到生物碱i-5(0.6mg);
[0043]
取组分b-2(350mg)经sephadex lh-20柱色谱,用1l的体积比为5:5:1的石油醚、二氯甲烷和甲醇组成的混合溶剂洗脱,前500ml洗脱液收集,减压浓缩干燥,得到b-2-1,后500ml洗脱液收集,减压浓缩干燥,得到b-2-2;b-2-1(123mg)经制备液相色谱,用体积浓度43%乙腈水溶液洗脱,减压浓缩干燥,得到生物碱i-2(1.5mg);b-2-2(93mg)经制备液相色谱,用体积浓度40%乙腈水溶液洗脱,减压浓缩干燥,得到生物碱i-3(1.5mg);
[0044]
取组分b-3(6.5g)经反相ods中压柱色谱,分别用2l的体积浓度为40%、2l的体积浓度60%和2l的体积浓度95%的甲醇水溶液洗脱,减压浓缩干燥,依次得到组分b-3-1、b-3-2和b-3-3;b-3-3(300mg)经制备液相色谱,用体积浓度45%乙腈水溶液洗脱,收集tr=24.0min的部分,减压浓缩干燥,得到生物碱i-4(2.0mg),收集tr=26.0min的部分,减压浓缩干燥,得到生物碱i-1(2.5mg)。取生物碱i-1(1.2mg)再经高效液相色谱手性拆分柱(chiralpak ib-n3,乙腈-水-三氟乙酸,体积比37:63:0.01,254nm)拆分,收集tr=33.3min的部分,减压浓缩干燥,得到得到对映体i-(+)-1(0.54mg);收集tr=34.8min的部分,减压浓缩干燥,得到得到对映体i-(-)-1(0.60mg);
[0045]
生物碱i-1:白色无定型粉末;i-(+)-1{[α]2d0+138.7(c 0.04,meoh)},i-(-)-1{[α]2d0-149.3(c 0.04,meoh)};cd(meoh):i-(+)-1:205(δε+31.21),224(δε-15.78),252(δε-10.45),275(δε+7.03),301(δε+7.82);i-(+)-1:205(δε-34.44),224(δε+19.18),252(δε+12.10),275(δε-6.95),301(δε-7.99);(+)-hr-esi-ms m/z 400.1388[m+h]
+
(calcd for c
21h22
no7,400.1391);1h nmr(dmso-d6,600mhz)and 13
c nmr(dmso-d6,150mhz)数据见表1和表2.
[0046]
生物碱i-2:白色无定型粉末;(+)-hr-esi-ms m/z 400.1764[m+h]
+
(calcd for c
22h26
no6,400.1755);1h nmr(dmso-d6,600mhz)and 13
c nmr(dmso-d6,150mhz)数据见表1和表2.
[0047]
生物碱i-3:浅黄色粉末;(+)-hr-esi-ms m/z 386.1589[m+h]
+
(calcd for c
21h24
no6,386.1598);1h nmr(dmso-d6,600mhz)and 13
c nmr dmso-d6,150mhz)数据见表1和表2.
[0048]
生物碱i-4:白色无定型粉末;(+)-hr-esi-ms m/z 398.1600[m+h]
+
(calcd for c
22h24
no6,398.1598);1h nmr(dmso-d6,600mhz)and 13
c nmr(dmso-d6,150mhz)数据见表1和表2.
[0049]
生物碱i-5:白色无定型粉末;(+)-hr-esi-ms m/z 414.1539[m+h]
+
(calcd for c
22h24
no7,414.1547);1h nmr(dmso-d6,600mhz)and 13
c nmr(dmso-d6,150mhz)数据见表1和表2.
[0050]
表1生物碱i-1~i-5 1
h-nmr(600mhz)数据
[0051][0052]
表2生物碱i-1~i-5 13
c-nmr(150mhz)数据
[0053][0054]
通过理化常数和现代波谱学手段(ms、nmr、cd),鉴定了生物碱i-1~i-5的结构,如下式所示:
[0055][0056][0057]
实施例2
[0058]
药理实验
[0059]
(1)生物碱i-(+)-1~i-5抑制lps诱导的小鼠巨噬细胞raw264.7释放一氧化氮(no)活性测定
[0060]
仪器:酶标仪
[0061]
试剂:griess法no检测试剂盒(碧云天)
[0062]
实验步骤:
[0063]
采用griess法考察生物碱抑制lps诱导小鼠巨噬细胞raw 264.7(商品)释放no能力。
[0064]
取生长状态良好且处于对数生长期,浓度为1
×
106cell/ml的细胞100μl,接种于96孔板内,在37℃,5%co2培养箱中培养24h。24h后,每孔中加入100μl含有lps(终浓度0.5μg/ml)和不同药物(终浓度100μm,50μm,10μm,5μm,1μm)的dmem细胞培养基,同时设空白组和lps组,于37℃,5%co2培养36h。36h后,取培养基上清,按照no检测试剂盒说明书标准操作步骤,检测培养基上清中no含量,并计算。
[0065]
按上述方法步骤,对获得的生物碱i-(+)-1~i-5抑制lps诱导的小鼠巨噬细胞一氧化氮(no)生成的活性进行测试,结果见表3。
[0066]
表3生物碱i-1~i-5抑制lps诱导的小鼠巨噬细胞raw264.7释放一氧化氮活性
[0067][0068]
(2)生物碱i-4对lps诱导的小鼠巨噬细胞raw264.7释放炎症因子水平测定
[0069]
仪器:恒温孵育箱,酶标仪
[0070]
试剂:tnf-α,il-1β和il-6elsa试剂盒(proteintedh)
[0071]
实验步骤:
[0072]
取生长状态良好且处于对数生长期的小鼠巨噬细胞raw264.7,将2ml浓度为5
×
105cell/ml的细胞接种于6孔板内,在37℃,5%co2培养箱中培养24h。24h后,加入1ml含生物碱i-4的dmed培养基,使其终浓度分别为5μm和10μm,1h后,加入1ml含有lps(终浓度1μg/ml),同时设空白组和lps组,于37℃,5%co2培养36h。36h后,取培养基上清。随后按照试剂盒说明书标准操作步骤,检测生物碱i-4对lps诱导的小鼠巨噬细胞raw264.7释放炎症因子tnf-α,il-1β和il-6水平的影响,结果如图1所示,生物碱i-4在5μm和10μm浓度下均可显著抑制lps诱导的小鼠巨噬细胞raw264.7释放炎症因子tnf-α,il-1β和il-6的水平。
[0073]
(3)生物碱i-4对lps诱导的小鼠巨噬细胞raw264.7中inos,p-p65 nf-κb,p65 nf-κb,p-iκb-α,iκb-α,p-iκk和iκk蛋白表达水平的影响测定
[0074]
仪器:电泳仪、电转仪
[0075]
试剂:inos,p-p65 nf-κb,p65 nf-κb,p-iκb-α,iκb-α,p-iκk和iκk抗体及western blot法常规试剂
[0076]
实验步骤:
[0077]
取生长状态良好且处于对数生长期的小鼠巨噬细胞raw264.7,将2ml浓度为5
×
105cell/ml的细胞接种于6孔板内,在37℃,5%co2培养箱中培养24h。24h后,加入1ml含生物
碱i-4的dmed培养基,使其终浓度分别为5μm和10μm,1h后,加入1ml含有lps(终浓度1μg/ml),同时设空白组和lps组,于37℃,5%co2培养36h。36h后,弃去培养基上清,用预冷pbs缓冲液(ph=7.4)清洗细胞后,收集细胞,加入细胞裂解液、蛋白酶和磷酸酶抑制剂,提取蛋白并采用bca蛋白浓度测定试剂盒进行蛋白定量。根据常规western blot实验步骤,使用7.5%聚丙烯酰胺凝胶电泳凝胶(sds-page),以每孔30μg蛋白上样量进行电泳、转膜。使用5%bsa或5%脱脂奶粉对膜进行封闭,然后加入一抗(inos,p-p65 nf-κb,p65 nf-κb,p-iκb-α,iκb-α,p-iκk和iκk),在4℃条件下孵育12h后使用tbst缓冲液(ph=7.4)清洗3次,再加入过氧化物酶(hrp)标记的二抗室温下孵育1小时,最后用化学发光试剂盒进行发光检测。
[0078]
如图2所示,生物碱i-4在5μm和10μm浓度下均可显著抑制lps诱导的小鼠巨噬细胞raw264.7中inos,p-p65 nf-κb,p-iκb-α和p-iκk的表达,表明生物碱i-4可抑制nf-κb信号通路的激活,从而发挥其抗炎效果。还可通过抑制inos的表达来降低no的释放。
[0079]
(4)计算机模拟生物碱i-1~i-5与inos蛋白活性位点相互作用研究
[0080]
仪器:计算机,discovery studio 2016分子对接软件
[0081]
实验步骤:
[0082]
采用计算机模拟分子对接方法研究生物碱与inos蛋白活性位点相互作用情况。首先通过分子构象筛选,将生物碱i-(+)-1~i-5进行优化及构象搜索,获取不同构象。选取pdb数据库中inos晶体数据(pdb:3e6t),并对其进行去水和加氢处理,并以其共结晶的抑制剂为模板构建活性位点区域。采用discovery studio 2016分子对接软件中的"libdock"对接工具,将获取的各个生物碱的不同构象与活性位点区域进行虚拟对接,最终获得最优对接模式,如图3所示。生物碱i-(+)-1~i-5可通过多个氢键及π-π作用力,与inos蛋白活性位点中关键的氨基酸残基相互作用,表明生物碱i-(+)-1~i-5可作为inos抑制剂发挥其抑制inos催化no生成。
[0083]
(5)生物碱i-1~i-5镇痛活性研究
[0084]
实验步骤:
[0085]
采用醋酸扭体法考察生物碱i-1~i-5的镇痛活性。icr小鼠42只,雌雄各半,随机分成7组,分别为空白对照组、延胡索乙素组、生物碱i-1组,生物碱i-2组,生物碱i-3组,生物碱i-4组,生物碱i-5组,各组小鼠腹腔注射给药后1h,经腹腔注射0.6%冰醋酸0.2ml
·
20g-1
,记录15min内小鼠的扭体次数,计算扭体次数抑制率[扭体次数抑制率(%)=(空白对照组扭体次数-给药组扭体次数)/空白对照组扭体次数
×
100%],结果见表4,表明生物碱i-1~i-5具有镇痛活性。
[0086]
表4各组小鼠扭体反应比较
[0087]
[0088]
本发明的生物碱或生物碱盐(例如盐酸盐、醋酸盐),按照常规技术手段,与药学上可接受的载体、和/或赋形剂,制成适用于口服或注射等应用形式的制剂,如:片剂、胶囊剂、粉剂、糖浆剂、针剂等。上述制剂具有一氧化氮合酶抑制作用、或抗炎或镇痛作用。
[0089]
以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1