一种人白三烯受体CysLTR2mRNART-PCR检测用引物探针组和试剂盒的制作方法
一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组和试剂盒
技术领域
1.本发明涉及生物检测技术领域,具体涉及一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组和试剂盒。
背景技术:
2.白三烯是从花生四烯酸在白细胞中代谢产物分离得到的具有共轭三烯结构的二十碳不饱和酸。可由花生四烯酸经脂(肪)氧合酶(lipoxygenase)催化而制得。在体内含量虽然很低,但却具有很高的生理活性,是引发某些过敏反应、炎症以及心血管等疾病的化学介质。白三烯在上下呼吸道的炎症中起重要作用。在诱导鼻过敏反应方面,白三烯的作用比组织胺强1000多倍。在变应原诱导的鼻过敏反应中,无论是在速发反应还是迟发反应阶段,白三烯的数量都显着增加。半胱氨酰白三烯(cysteonyl leukotrienes,cyslts)是哮喘和过敏性鼻炎(ar)的病理生理中的炎症介质和调节因子,是关键的治疗靶点,cyslts可以调节造血祖细胞生成、嗜酸性粒细胞在炎症组织募集和存活、细胞因子和趋化因子的活性、呼出气no的数量、平滑肌的收缩和成纤维细胞的增殖。
3.cyslts的生物学作用取决于细胞表面白三烯受体的表达。cyslts受体有cysltr1和cysltr2两种,其中cysltr2为g蛋白偶联受体,主要表达于心脏、肺静脉、肾上腺髓质、肠肌层神经元等外周组织细胞中,在人脑中,cysltr2表达在血管平滑肌细胞及浸润的粒细胞上。cysltr2被白三烯激活后,将导致炎症、血管通透性增加和组织的纤维化,会增加过敏性哮喘的风险;与脑缺血损伤也密切相关。
4.在治疗的过程中,白三烯受体拮抗剂(ltra)可以在体内竞争性抑制白三烯与其受体的结合,阻断cyslts的活性,从而抑制炎性、过敏性反应,但其疗效具有明显的个体差异,并且其疗效与白三烯受体基因mrna表达水平有明确的正相关。现在已有报道的cyslt2受体拮抗剂包含hami 3379和bay u9773。hami 3379对急性和亚急性缺血性脑损伤具有保护作用,并减轻小胶质细胞相关的炎症。bay u9773对cyslt1和cyslt2有同等的亲和力,可与这两种受体结合,抑制支气管和静脉肌肉收缩。通过对cysltr2mrna表达水平的检测,可判断出患者是否因cysltr2途径导致的病症,采用cyslt2受体拮抗剂是否有效果及实现治疗效果的动态监测。
5.现在市场上对于cysltr2的检测仍使用酶联免疫吸附法(enzyme linked immunosorbent assay,elisa)试剂盒检测其在体液中的含量,尚未见检测cysltr2 mrna的商业化试剂盒。elisa方法在检测过程中存在着检测范围小和灵敏度低的问题,且其准确性也存在问题。
技术实现要素:
6.本发明的目的在于提供一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组和试剂盒。本发明针对人cysltr2建立的taqman实时荧光定量一步法rt
‑
pcr检测引物探
针组,为该蛋白的检出提供准确度高、检测范围广及灵敏度高的检测手段。
7.本发明提供了一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组,所述引物探针组包括引物cysltr2
‑
f、引物cysltr2
‑
r和探针c2
‑
probe,所述引物cysltr2
‑
f的核苷酸序列如seq id no.1所示,所述引物cysltr2
‑
r的核苷酸序列如seq id no.2所示,所述探针c2
‑
probe的核苷酸序列如seq id no.3所示。
8.优选的是,所述探针c2
‑
probe的5'端标记荧光报告基团,3'端标记淬灭基团。
9.优选的是,所述引物探针组还包括内参基因的引物gapdh
‑
f、引物gapdh
‑
r和探针g
‑
probe,所述引物gapdh
‑
f的核苷酸序列如seq id no.4所示,所述引物gapdh
‑
r的核苷酸序列如seq id no.5所示,所述探针g
‑
probe的核苷酸序列如seq id no.6所示。
10.优选的是,所述探针g
‑
probe的5'端标记荧光报告基团,3'端标记淬灭基团;探针g
‑
probe标记的荧光报告基团与探针c2
‑
probe标记的荧光报告基团不同。
11.优选的是,所述荧光报告基团包括fam或joe,所述淬灭基团包括bhq1。
12.本发明还提供了一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用试剂盒,所述试剂盒包括上述技术方案所述引物探针组、pcr反应液、酶混合液、cysltr2标准品、rox参比染料和无核酶水。
13.优选的是,所述pcr反应液包括dntp mix、mgcl2和缓冲液。
14.优选的是,所述酶混合液包括taq酶、逆转录酶、rna酶抑制剂和taq酶抗体。
15.本发明还提供了上述技术方案所述试剂盒的使用方法,包括以下步骤:将引物探针组、pcr反应液、酶混合液、标准品或待测样品、rox参比染料和无核酶水混合后,进行荧光定量扩增。
16.优选的是,以20μl计,所述试剂盒的反应体系包括:引物探针组2μl、pcr反应液10μl、酶混合液0.5μl、rox参比染料0.1μl、标准品或待测样品5μl和无核酶水2.4μl;所述荧光定量扩增的条件为:42℃30min;95℃1min;95℃5s,60℃31s,扩增40个循环。
17.本发明提供了一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组。与免疫学检测方法相比,本发明所述引物探针组用于检测时,灵敏度高,可以检测低浓度(10copies/μl)的临床样本,能够更灵敏地探测到cysltr2的含量变化,检测范围可跨越至少6个数量级,增加了检测结果的准确性,能在1小时之内完成至少80人份检测,从而更早期、更准确、更快速地对治疗效果进行动态监测和疗效评估。
附图说明
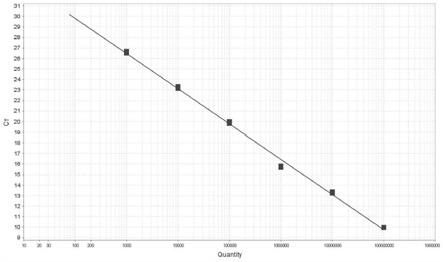
18.图1为本发明提供的cysltr2 mrna taqman实时荧光定量rt
‑
pcr标准曲线;
19.图2为本发明提供的精密度检测结果图,其中1:1.0
×
107copies/μl,2:1.0
×
104copies/μl;
20.图3为本发明提供的准确度检测结果图;
21.图4为本发明提供的灵敏度检测结果图;
22.图5为本发明提供的临床样本检测结果图,其中1:患者gapdh mrna;2:健康对照gapdh mrna;3:患者cysltr2 mrna;4:健康对照cysltr2 mrna;
23.图6为本发明提供的在非最佳设计引物、探针的情况下,低值精密度扩增曲线图;
24.图7本发明提供的采用非最佳配比的酶混合液(a)和最佳配比的酶混合液(b)扩增
结果。
具体实施方式
25.本发明提供了一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组,所述引物探针组包括引物cysltr2
‑
f、引物cysltr2
‑
r和探针c2
‑
probe,所述引物cysltr2
‑
f的核苷酸序列如seq id no.1所示:5'
‑
tctgctgatcattcgggtt
‑
3',所述引物cysltr2
‑
r的核苷酸序列如seq id no.2所示:5'
‑
tgatagggcaggaaacacaa
‑
3',所述探针c2
‑
probe的核苷酸序列如seq id no.3所示:5'
‑
tcacaggaaggcactgaccac
‑
3'。
26.在本发明中,所述探针c2
‑
probe的5'端标记荧光报告基团,3'端标记淬灭基团。在本发明中,所述荧光报告基团优选包括fam或joe,所述淬灭基团优选包括bhq1。在本发明实施例中,所述探针c2
‑
probe的5'端标记fam荧光报告基团,3'端标记bhq1淬灭基团。
27.在本发明中,所述引物探针组还包括内参基因的引物gapdh
‑
f、引物gapdh
‑
r和探针g
‑
probe,所述引物gapdh
‑
f的核苷酸序列如seq id no.4所示:5'
‑
gacaacagcctcaagatcatc
‑
3',所述引物gapdh
‑
r的核苷酸序列如seq id no.5所示:5'
‑
cgccacagtttcccggag
‑
3',所述探针g
‑
probe的核苷酸序列如seq id no.6所示:5'
‑
actcatgaccacagtccatgccat
‑
3'。在本发明中,所述探针g
‑
probe的5'端标记荧光报告基团,3'端标记淬灭基团;探针g
‑
probe标记的荧光报告基团与探针c2
‑
probe标记的荧光报告基团优选不同。在本发明中,所述荧光报告基团优选包括fam或joe,所述淬灭基团优选包括bhq1。在本发明实施例中,所述探针g
‑
probe的5'端标记joe荧光报告基团,3'端标记bhq1淬灭基团。
28.本发明还提供了一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用试剂盒,所述试剂盒包括上述技术方案所述引物探针组、pcr反应液、酶混合液、cysltr2标准品、rox参比染料和无核酶水。
29.在本发明中,所述pcr反应液包括dntp mix、mgcl2和缓冲液;所述dntp mix为脱氧核糖核苷三磷酸,包括datp,dctp,dgtp和dttp,本发明所述dntp mix优选购自thermofisher公司(货号:r0192),工作浓度优选为0.3~0.8mm。在本发明中,mgcl2的使用浓度优选为5~10mm;缓冲液优选为tris
‑
hcl缓冲液,更优选为10~50mm tris
‑
hcl缓冲液,所述tris
‑
hcl缓冲液的ph值优选为8.0。
30.在本发明中,所述酶混合液包括taq酶、逆转录酶、rna酶抑制剂和taq酶抗体。在本发明中,所述酶混合液中,taq酶、逆转录酶、rna酶抑制剂和taq酶抗体的体积比优选为12:4:3:1,此比例能够获得最佳的扩增效果。在本发明中,taq酶为耐热的taqdna聚合酶,利用其3'
→
5'聚合酶活性以dna为模板,将dntp中的脱氧单核苷酸逐个加到3
‑
oh末端;同时利用其5'
→
3'外切酶活性即能识别和消除错配的引物末端,与复制过程中校正功能有关,又可以从5'端水解核苷酸,还能经过几个核苷酸起作用,切除错配的核苷酸,由此在链延伸过程中实现链替换,并将被替换的探针切断;逆转录酶可将mrna逆转录成cdna以进行pcr反应;rna酶抑制剂用来抑制外源性rnase的活性;taq酶抗体是热启动pcr用抗taq抗体,其与taq酶结合后抑制dna聚合酶活性,能够在低温条件下有效抑制引物的非特异性退火及引物二聚体引起的非特异性扩增,taq酶抗体在pcr反应最初的dna变性步骤中变性,taq酶恢复活性,实现pcr扩增。在本发明中,所述cysltr2标准品优选为cysltr2的rna标准品,用于配制
定量曲线。
31.本发明还提供了上述技术方案所述试剂盒的使用方法,包括以下步骤:将引物探针组、pcr反应液、酶混合液、标准品或待测样品、rox参比染料和无核酶水混合后,进行荧光定量扩增。在本发明中,本发明所述试剂盒采用一步法rt
‑
pcr技术定量检测方法,能够检测人血液、鼻腔分泌物、支气管冲洗液、唾液、泪液样本中cysltr2 mrna的表达水平。
32.在本发明中,所述试剂盒的反应体系,以20μl计,优选包括:引物探针组2μl、pcr反应液10μl、酶混合液0.5μl、rox参比染料0.1μl、标准品或待测样品5μl和无核酶水2.4μl。在本发明中,所述荧光定量扩增的条件优选为:42℃30min(逆转录);95℃1min(预变性);95℃5s,60℃31s,扩增40个循环。
33.下面结合具体实施例对本发明所述的一种人白三烯受体cysltr2 mrna rt
‑
pcr检测用引物探针组和试剂盒做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
34.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到
35.实施例1
36.1.所涉及试剂及设备如下:
37.1.1试剂
38.1.1.1全血总rna试剂盒(杭州新景生物试剂开发有限公司,货号:5201050)
39.1.1.2 hiscribe t7 high yield rna synthesis kit(new england biolabs,货号:e2050s)
40.1.2主要仪器
41.1.2.1 applied biosystems
tm
7300荧光定量pcr仪:thermofisher,美国
42.1.2.2
‑
80℃低温冰箱:thermofisher,美国
43.1.2.3高速低温台式离心机:eppendorf,德国
44.1.2.4 qubit 3荧光计:thermofisher,美国
45.2.方法
46.2.1引物和探针设计
47.根据cysltr2和gapdh序列,利用primer 6.0软件,设计荧光定量引物和探针,经过系列效果验证,获得了cysltr2和gapdh的引物对cysltr2
‑
f、cysltr2
‑
r、gapdh
‑
f、gapdh
‑
r和探针e
‑
probe、g
‑
probe(见表1)。引物探针由上海桑尼生物科技有限公司合成。
48.表1 taqman实时荧光定量pcr引物探针
49.[0050][0051]
2.2标准品制备
[0052]
采用pgm
‑
t连接试剂盒[天根生化科技(北京)有限公司,货号:vt202
‑
01],以pgm
‑
t为载体构建cysltr2质粒dna(委托南京金斯瑞生物科技有限公司构建及合成),将cysltr2质粒dna用hiscribe t7 high yield rna synthesis kit(new england biolabs公司生产,货号:e2040s)体外转录成mrna。
[0053]
根据拷贝数计算公式:拷贝数=[6.02
×
10
23
×
rna浓度(ng/μl)
×
10
‑9]/[rna长度(bp)
×
340],计算rna初始拷贝数。用无核酶水稀释至1.0
×
10
10
copies/μl,即为cysltr1标准品。
[0054]
2.3全血rna提取及稀释:edta抗凝全血样本用全血总rna试剂盒提取全血总rna,采用qubit 3荧光计定量后,用无核酶水稀释至20ng/μl。
[0055]
2.4 taqman实时荧光定量pcr
[0056]
以标准品或全血rna为模板,配制20μl体系如表2所示:
[0057]
表2反应体系
[0058][0059]
扩增反应程序如表3所示:
[0060]
表3反应程序
[0061][0062]
2.5标准曲线的生成
[0063]
将cysltr1标准品按10倍梯度进行稀释,选择1.0
×
108~1.0
×
103copies/μl作为
模板,每个稀释度3个重复,进行taqman实时荧光定量rt
‑
pcr检测,生成标准曲线。稀释操作过程如图1所示,以50μl/管为例,每次稀释的过程,取5μl稀释前样品,加入到含有45μl水的新管中。
[0064]
2.6精密度检测
[0065]
选择1.0
×
107copies/μl、1.0
×
104copies/μl的标准品作为模板,每个浓度10个重复量,进行10次taqman实时荧光定量rt
‑
pcr检测,分别计算每个浓度对数值的变异系数进行统计学分析,分析该检测方法的精密度。
[0066]
2.7准确度检测
[0067]
选择1.0
×
106copies/μl标准品进行30倍稀释(2μl 1.0
×
106copies/μl标准品+58μl无核酶水)作为模板,3个重复量,进行3次taqman实时荧光定量rt
‑
pcr检测,计算每个浓度对数值的绝对偏差,分析该检测方法的准确度。
[0068]
2.8灵敏度检测
[0069]
选择10.0copies/μl标准品作为模板,25个重复量,进行25次taqman实时荧光定量rt
‑
pcr检测,查看是否有扩增抬头,分析该检测方法的灵敏度。
[0070]
2.9临床样本检测
[0071]
取阳性样本和健康对照全血样本按照2.3步骤进行全血rna提取和稀释,按照2.4步骤进行taqman实时荧光定量rt
‑
pcr检测。
[0072]
3.实验结果
[0073]
3.1标准曲线
[0074]
将cysltr2标准品按10倍梯度进行稀释,选择1.0
×
108~1.0
×
103copies/μl作为模板,每个稀释度3个重复,进行taqman实时荧光定量rt
‑
pcr检测,生成标准曲线,cysltr2 mrna taqman实时荧光定量rt
‑
pcr标准曲线如图1所示。以拷贝数对数值为横坐标,ct值为纵坐标,得到回归方程式:y=
‑
3.321x+35.602(r2=0.997),该回归方程的r2=0.997,线性范围为1.0
×
103~1.0
×
108copies/μl。说明标准方程的拷贝数对数值与ct值具有极高的相关性。
[0075]
3.2精密度检测
[0076]
选择1.0
×
107copies/μl、1.0
×
104copies/μl的标准品作为模板,每个浓度10个重复量,进行10次taqman实时荧光定量rt
‑
pcr检测,分别计算每个浓度对数值的变异系数进行统计学分析。精密度检测结果如图2和表4所示,结果显示,每个浓度对数值的变异系数分别为0.418%、0.382%,小于5%,表明本发明建立的taqman实时荧光定量rt
‑
pcr检测方法具有极好的精密度。
[0077]
表4精密度检测结果
[0078]
理论拷贝数拷贝数对数值均值sdc.v1.0
×
1076.9450.0290.418%1.0
×
1043.9730.0150.382%
[0079]
3.3准确度检测
[0080]
选择1.0
×
106copies/μl标准品进行30倍稀释(2μl 1.0
×
106copies/μl标准品+58μl无核酶水)作为模板,3个重复量,进行3次taqman实时荧光定量rt
‑
pcr检测,计算每个浓度对数值的绝对偏差。结果如图3和表5显示,每个浓度对数值的绝对偏差分别为0.142、
0.099、0.144,在
±
0.5范围内,表明本发明建立的taqman实时荧光定量rt
‑
pcr检测方法具有极好的准确度。
[0081]
表5准确度检测结果
[0082][0083]
3.4灵敏度检测
[0084]
选择10.0copies/μl标准品作为模板,25个重复量,进行25次taqman实时荧光定量rt
‑
pcr检测,查看是否有扩增抬头。灵敏度检测结果如图4和表6所示,结果显示,共计25次检测出结果,达100%,表明本发明建立的taqman实时荧光定量rt
‑
pcr检测方法具有很高的灵敏度,最低检出拷贝数<10copies/μl。
[0085]
表6灵敏度检测ct值结果
[0086]
33.02532.67833.31732.75932.85432.09632.90132.97432.42132.84033.09832.62532.87233.48132.31332.65232.44532.72932.05532.98033.43232.71732.27134.37532.580
[0087]
3.5临床样本检测
[0088]
本发明和国内某品牌半胱氨酰白三烯受体2(cysltr2)elisa试剂盒比对结果如表7和图5所示:
[0089]
表7比对结果
[0090]
[0091][0092]
本发明采用全血rna进行检测,国内某品牌半胱氨酰白三烯受体2(cysltr2)elisa试剂盒采用血清进行检测。
[0093]
对比例1
[0094]
采用其它非最佳引物、探针进行扩增的结果
[0095]
将实施例6中本发明所用体系中的引物、探针替换成其它非最佳引物、探针。扩增体系、程序与实施例1相同。结果如图6和表8,在采用非最佳的cysltr2引物、探针,如:
[0096]
cysltr2
‑
f:gcaccttcagcaataacaaca(seq id no.7);
[0097]
cysltr2
‑
r:gctgcaggaaaacatatatgg(seq id no.8);
[0098]
c2
‑
probe:(fam)
‑
caacccatttcccaagactccc(seq id no.9)
‑
(bhq1)。
[0099]
低值精密度的浓度对数值的变异系数结果超出5%,达7.815%。
[0100]
表8非最佳引物、探针进行扩增的结果
[0101]
理论拷贝数拷贝数对数值均值sdc.v1.0
×
1043.3810.2647.815%
[0102]
对比例2
[0103]
非最佳酶混合液的扩增结果
[0104]
用非最佳配比(taq酶、逆转录酶、rna酶抑制剂和taq酶抗体的体积比为10:5:4:1)的酶混合液对标准品进行扩增,扩增得到标准曲线1.0
×
103~1.0
×
106copies/μl4个梯度,扩增用引物和探针、扩增体系、程序与实施例1相同。采用非最佳酶混合液扩增结果如图7中的a所示。相比采用最佳酶混合液的标准曲线扩增结果(图7中的b),非最佳酶混合液的标准曲线扩增结果的相应浓度的ct往后推延10个循环数以上,且低浓度下的标准品(如1.0
×
103copies/μl)重复性相差较大,整体线性效果差,标准曲线不合格。可见非最佳酶混合液扩增效果不好。
[0105]
以上结果表明本发明建立的taqman实时荧光定量rt
‑
pcr检测方法具有比对试剂更好的灵敏度和特异性,同时可以有效监测治疗效果。
[0106]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1