基因转染及表达停止系统及方法
1.本技术属于细胞生物学技术领域,尤其涉及一种基因转染及表达停止系统及方法。
背景技术:
2.外源性基因转染是将体外合成的具有生物功能的基因(包括dna、反义寡核苷酸和rnai)递送到细胞内,并使基因在细胞内表达生物功能的过程。其中,递送基因进入细胞的载体是提高基因转染效率中极其关键的部分,现有基因转染使用的载体可分为病毒载体和非病毒载体。
3.病毒载体具有传递自身基因组进入细胞的能力,因此病毒载体的效率远高于非病毒载体。但病毒载体可能随机整合或激活原癌基因,导致异常或无控制的细胞增殖,引起机体的免疫反应,因此病毒载体的毒性及免疫原性大大限制了实验室中的基础研究。而人工合成的非病毒载体转染效率低,其生物相容性好、安全性高、成本低可大量生产制备,因此逐渐成为基础研究和临床应用的热点。非病毒载体包括脂质体、阳离子多聚物、纳米粒子和微泡等。然而目前用于基因转染的非病毒载体在进行转染过程中入胞效率较低,且无法有效控制目标转染的空间位置和区域大小,导致转染技术无法较好应用。
4.进一步的,在基因转染过程中,较难对基因转染总区域和总剂量进行控制,无法准确地在基因转染出现潜在风险的情况下,例如基因表达过多或者基因表达异常的情况下,无法灵活停止部分区域或整个区域的基因表达,影响基因治疗的临床安全性。
技术实现要素:
5.本技术的目的在于提供一种基因转染及表达停止系统及方法,旨在解决现有技术中基因转染无法有效控制目标转染的空间位置和区域大小且无法灵活停止基因表达,导致基因转染无法较好应用的问题。
6.为实现上述申请目的,本技术采用的技术方案如下:
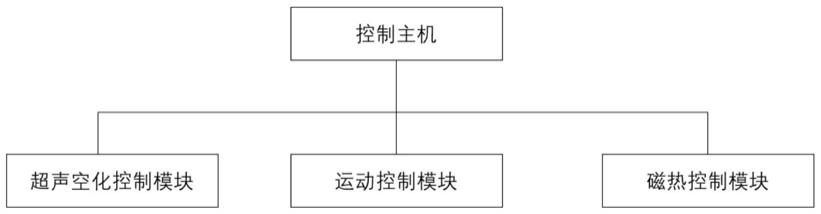
7.第一方面,本技术提供一种基因转染及表达停止系统,包括控制主机、超声空化控制模块、运动控制模块和磁热控制模块;
8.所述超声空化控制模块包括超声激励生成装置和超声空化检测装置,所述超声激励生成装置由所述控制主机控制用于释放超声信号并进行空化激励,所述超声空化检测装置与所述控制主机相连用于检测并收集超声回波;
9.所述磁热控制模块由所述控制主机控制用于产生高频交流磁场使磁纳米粒子因磁滞效应产热而使得基因停止表达;
10.所述运动控制系统包括三维运动控制器,所述三维运动控制器的一端分别通过连接件与所述超声空化控制模块及所述磁热控制模块连接,所述三维运动控制器的另一端与所述控制主机连接,由所述主机控制所述连接件的空间位置和位移轨迹。
11.第二方面,本技术提供一种基因转染及表达停止方法,包括如下步骤:
12.将目的基因
‑
微泡磁纳米粒子复合物注射至转染对象的目标区域并垂直放置于超声空化控制模块的超声空化探头激励范围区域内;
13.设置超声激励生成装置的参数,利用所述超声激励生成装置多次释放超声能量进行基因转染,并利用超声空化检测装置对所述目标区域的超声回波进行检测,确认目标区域发生空化,将所述目的基因转染至所述目标区域,得到转染产物;
14.对所述转染产物进行基因表达评估;
15.将所述转染产物的要被停止基因表达的目标区域垂直放置于磁热控制模块的磁热探头激励范围区域内并进行磁热处理,停止基因表达。
16.本技术第一方面提供的基因转染及表达停止系统,包括控制主机、超声空化控制模块、运动控制模块及磁热控制模块,通过超声空化控制模块进行超声处理,诱导形成细胞膜孔,提高基因和磁纳米粒子的入胞效率,从而实现外源性基因转染增效;同时协同磁热控制模块实现转染细胞的热杀死和基因表达停止,而不会对非转染细胞产生伤害。同时,可在时间和空间上进行控制,实现在基因表达一定时间并发挥特定临床效果后,选择性对特定区域停止基因表达;并且由运动控制模块准确控制运动轨迹,实现有效控制目标转染的空间位置和区域大小,该系统能够在空间上、时间上进行灵活控制基因转染,转染效率高,设备操作简单,可以实现工作量小,使用安全,有利于广泛应用。
17.本技术第二方面提供的基因转染及表达停止方法,该方法采用上述的基因转染及表达停止系统进行,采用设置超声激励生成装置的参数,利用所述超声激励生成装置多次释放超声能量,使外源性基因和磁纳米粒子同时通过膜孔扩散进入细胞,从而提高基因入胞效率以及实现转染增效;当外源性基因需要停止表达时,磁热控制模块产生高频交变磁场,与基因同时递送入细胞的磁纳米粒子因磁滞效应产热,杀死被转染的细胞,停止外源性目的基因表达。一方面,该方法可以可控地在空间上进行转染增效,也可以在时间上进行多次重复,从而实现目标空间位置处基因转染效果和磁纳米颗粒累积浓度的多次提高,提高转染效果;另一方面,可通过控制交变磁场地频率和分布,在空间上实现目标空间位置处全部或局部基因转染的停止,也可以在时间上进行控制,从而实现在基因表达一定时间并发挥特定临床效果后,选择性停止基因表达。
附图说明
18.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1是本技术实施例提供的基因转染及表达停止系统示意图。
20.图2是本技术实施例提供的基因转染及表达停止系统示意图。
21.图3是本技术实施例提供的基因转染及表达停止系统的详细图。
22.图4是本技术实施例提供的超声空化区域空间移位控制的示意图。
23.图5是本技术实施例提供的目的基因
‑
微泡磁纳米粒子复合物示意图。
24.图6是本技术实施例提供的基因转染过程中细胞膜孔的结果图。
25.图7是本技术实施例提供的小鼠荧光素酶报告基因转染及表达停止相关的荧光素
生物发光强度变化结果图。
具体实施方式
26.为了使本技术要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
27.本技术中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b的情况。其中a,b可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
28.本技术中,“至少一个”是指一个或者多个,“多个”是指两个或两个以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。例如,“a,b,或c中的至少一项(个)”,或,“a,b,和c中的至少一项(个)”,均可以表示:a,b,c,a
‑
b(即a和b),a
‑
c,b
‑
c,或a
‑
b
‑
c,其中a,b,c分别可以是单个,也可以是多个。
29.应理解,在本技术的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,部分或全部步骤可以并行执行或先后执行,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本技术实施例的实施过程构成任何限定。
30.在本技术实施例中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术实施例和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。
31.本技术实施例说明书中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本技术实施例说明书相关组分的含量按比例放大或缩小均在本技术实施例说明书公开的范围之内。具体地,本技术实施例说明书中所述的质量可以是μg、mg、g、kg等化工领域公知的质量单位。
32.术语“第一“、“第二”仅用于描述目的,用来将目的如物质彼此区分开,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。例如,在不脱离本技术实施例范围的情况下,第一xx也可以被称为第二xx,类似地,第二xx也可以被称为第一xx。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。
33.本技术实施例第一方面提供一种基因转染及表达停止系统,如图1和图2所示,包括控制主机、超声空化控制模块、运动控制模块及磁热控制模块;
34.如图3所示,超声空化控制模块包括超声激励生成装置和超声空化检测装置,超声激励生成装置由控制主机控制用于释放超声信号并进行空化激励,超声空化检测装置与控制主机相连用于收集并检测超声回波;
35.磁热控制模块由控制主机控制用于产生高频交流磁场使磁纳米粒子因磁滞效应产热而使得基因停止表达;
36.运动控制系统包括三维运动控制器,三维运动控制器的一端分别通过连接件与超声空化控制模块及磁热控制模块连接,三维运动控制器的另一端与控制主机连接,由主机控制连接件的空间位置和位移轨迹。本技术第一方面提供的基因转染及表达停止系统,包括控制主机、超声空化控制模块、运动控制模块及磁热控制模块,通过超声空化控制模块进行超声处理,诱导形成细胞膜孔,提高基因和磁纳米粒子的入胞效率,从而实现外源性基因
转染增效;同时协同磁热控制模块实现转染细胞的热杀死和基因表达停止,而不会对非转染细胞产生伤害,同时,可在时间和空间上进行控制,实现在基因表达一定时间并发挥特定临床效果后,选择性对特定区域停止基因表达;并且由运动控制模块准确控制运动轨迹,实现有效控制目标转染的空间位置和区域大小,该系统能够在空间上、时间上进行灵活控制基因转染,转染效率高,设备操作简单,可以实现工作量小,使用安全,有利于广泛应用。
37.具体的,如图3所示,基因转染及表达停止系统包括控制主机,其中,控制主机主要负责空化检测换能器电信号的处理和整个系统控制。一方面,空化检测换能器电信号的处理是指计算其频谱特征,定义稳态空化指数为其频谱中次谐波和超谐波成分的功率谱能量之和,定义惯性空化指数为其频谱中宽带噪声成分的功率谱能量之和,控制主机根据稳态空化指数和惯性空化指数设定空化强度算法以及计算空化强度。另一方面,控制主机对整个系统的控制是指,通过所得空化强度闭环控制超声激励生成装置包括信号发生器的电压和波形参数,以及输出指令给三维运动控制器来控制超声空化探头和磁热探头的空间位置和位移轨迹,控制在时间和空间上进行转染和停止转染地作用,同时,还有控制交流磁场发生装置和水冷却系统的工作。
38.具体的,如图3所示,基因转染及表达停止系统包括超声空化控制模块,其中,超声空化控制模块包括超声激励生成装置和超声空化检测装置,超声激励生成装置通过控制主机控制用于释放超声信号并进行信号刺激,超声空化检测装置与控制主机相连用于收集并检测超声回波。
39.在一些实施例中,超声激励生成装置包括空化激励换能器、功率放大器和信号发生器,其中,信号发生器与控制主机连接,通过控制主机产生第一电信号,功率放大器用于将第一电信号放大得到第一放大电信号,空化激励换能器用于将第一放大电信号转换超声信号并输出。
40.在一些实施例中,信号发生器为电信号发生器,且电信号发生器的电信号发生频率选自0.5~3兆赫兹。可以根据实验的对象选择电信号发生器的电信号发生频率,进而提高外源基因的转染效果。
41.在一些实施例中,功率放大器的放大倍数为50~200倍。由于电信号过小,不能满足超声换能器的高电压的需要,因此需要线性功率放大器将所生成电信号电压放大50
‑
200倍,放大后电信号通过连接线传递至空化激励换能器,有利于空化激励换能器接收信号并进行传递。
42.在一些实施例中,空化激励换能器产生的超声波强度为0.2~2瓦/cm2。空化激励换能器通过接收的电信号进行声信号的转换,产生超声波,进而通过超声波实现转染实验。
43.在一些实施例中,空化激励换能器为聚焦型超声换能器,且聚焦型超声换能器为环形。聚焦型超声换能产生的超声能量在声束横向聚焦于0.5~1.5毫米直径的圆形范围。此外,空化激励换能器采用环形中空超声换能器,其内环直径大于1厘米。保证在实验过程中能够对转染区域进行定位和控制。
44.在一些实施例中,超声空化检测装置包括空化检测转换器、信号放大器和数据采集卡,其中,空化检测转换器用于接收超声回波并转换为第二电信号,将第二电信号通过信号放大器得到第二放大电信号,将第二放大电信号通过数据采集卡采集并传导至控制主机确认目标区域发生空化。
45.在一些实施例中,空化激励换能器和空化检测转换器共同组成超声空化探头,形成的超声空化探头用于对准实验对象进行超声空化激励及检测。在一些实施例中,空化检测换能器被放置于空化激励换能器的环形中空区域,并且空化检测换能器与空化激励换能器中心轴对齐。
46.具体的,如图3所示,基因转染及表达停止系统包括磁热控制模块,其中,磁热控制模块包括交流磁场发生装置、水冷却装置和红外测温装置。
47.在一些实施例中,交流磁场发生装置包括整流电路、逆变器和谐振电路以及磁热线圈,且整流电路、逆变器、谐振电路和磁热线圈沿电流方向依次设置。其中,整流电路将50赫兹220伏的工频电源转变为直流电源,然后通过逆变器将直流电源转变为不同频率(100
‑
2000千赫兹),不同功率(200
‑
60千瓦)的交流电源,再利用lc谐振电路及交流电源驱动磁热线圈从而实现线圈的大功率驱动。
48.在一些实施例中,水冷却装置包括冷却水管路和水箱,冷却水管路与水箱连通,且与磁热线圈接触,且水箱与控制主机连接用于控制冷却水的循环;通过冷却水通路和磁热线圈结合,实现采用水流对磁热线圈的冷却处理。
49.在一些实施例中,磁热线圈和冷却水通路组成磁热探头,通过控制主机精确校准使要被停止基因表达的目标区域或部分目标区域处于高频交变磁场内并采用磁热探头进行对准进行处理,使基因停止表达。
50.在一些实施例中,红外测温装置包括光学透镜和红外图像传感器,磁热探头加热基因转染组织区域导致其温度升高和红外线辐射增强,红外前辐射状态通过光学透镜被红外图像传感器捕捉并转化为图像数据,图像数据进一步传给控制主机。其中,红外测温装置只能检测到实验对象的体表温度,需要监测的靶细胞的温度则需要根据实验对象的热传导系数推算得到其校正结果。
51.具体的,如图3所示,基因转染及表达停止系统包括运动控制系统,其中,运动控制系统包括三维运动控制器,三维运动控制器的一端分别通过连接件与超声空化控制模块磁热控制模块连接,三维运动控制器的另一端与控制主机连接,通过主机控制连接件的空间位置和位移轨迹。
52.在一些实施例中,三维运动控制器通过第一万向夹具连接超声空化探头,同时三维运动控制器可以通过软件编程控制超声空化探头的空间位置和位移轨迹。如图4(a)所示,超声空化探头位置的改变,将改变其中空化激励换能器声束焦点位置,从而可以在毫米级精度选择需要进行基因和磁纳米粒子递送的目标空间位置。如图4(b)所示,超声空化探头位移轨迹的设计,可以将空化激励换能器声束焦点在空间进行排列组合,从而可以控制基因和磁纳米粒子递送的目标空间位置大小,从而实现转染总区域的控制。三维运动控制器通过第二万向夹具连接磁热探头,同时三维运动控制器可以通过软件编程控制磁热探头的空间位置和位移轨迹。三磁场能量空间分布可以通过线圈形状和尺寸在0.6厘米精度进行调控,从而实现目标空间位置处全部或局部基因转染的停止。
53.本技术实施例第二方面提供一种基因转染及表达停止方法,基因转染及表达停止方法应用基因转染及表达停止系统,包括如下步骤:
54.s01.将目的基因
‑
微泡磁纳米粒子复合物注射至转染对象的目标区域并垂直放置于超声空化控制模块的超声空化探头激励范围区域内;
55.s02.设置超声激励生成装置的参数,利用超声激励生成装置多次释放超声能量进行基因转染处理,并利用超声空化检测装置对目标区域的超声回波进行检测,确认目标区域发生空化,将目的基因转染至目标区域,得到转染产物;
56.s03.对转染产物进行基因表达评估;
57.s04.将转染产物的要被停止基因表达的目标区域垂直放置于磁热控制模块的磁热探头激励范围区域内并进行磁热处理,停止基因表达。
58.本技术第二方面提供的基因转染及表达停止方法,该方法采用上述的基因转染及表达停止系统进行,采用设置超声激励生成装置的参数,利用超声激励生成装置多次释放超声能量,使外源性基因和磁纳米粒子同时通过膜孔扩散进入细胞,从而提高基因入胞效率以及实现转染增效;当外源性基因需要停止表达时,磁热控制模块产生高频交变磁场,与基因同时递送入细胞的磁纳米粒子因磁滞效应产热,杀死被转染的细胞以及停止外源性基因表达。一方面,该方法可以可控地在空间上进行转染增效,也可以在时间上进行多次重复,从而实现目标空间位置处基因转染效果和磁纳米颗粒累积浓度的多次提高,提高转染效果;另一方面,可通过控制交变磁场地频率和分布,在空间上实现目标空间位置处全部或局部基因转染的停止,也可以在时间上进行控制,从而实现在基因表达一定时间并发挥特定临床效果后,选择性停止基因表达。
59.具体的,步骤s01中,将目的基因
‑
微泡磁纳米粒子复合物注射至转染对象的目标区域并垂直放置于超声空化控制模块的超声空化探头激励范围区域内。
60.在一些实施例中,目的基因
‑
微泡磁纳米粒子复合物包括微泡基体以及连接在微泡基体表面的目的基因和磁纳米粒子。
61.在一些实施例中,目的基因
‑
微泡磁纳米粒子复合物的结构如图5(a)所示,目的基因和磁纳米粒子交替间隔连接于微泡基体表面,其中,带负电的基因和带负电的磁纳米粒子混合后与带正电的微泡静电吸附,从而基因和磁纳米粒子混合吸附于微泡表面。
62.进一步的,目的基因
‑
微泡磁纳米粒子复合物的结构如图5(a)所示,目的基因
‑
微泡磁纳米粒子复合物的制备方法包括如下步骤:
63.(1)激活微泡:使用高速振荡器将装有微泡膜材料脂质体溶液同时封闭c3f8气体的容器瓶振荡40~50秒,激活微泡悬浮液;
64.(2)合成复合物:混合微泡,基因及磁纳米粒子;将带负电的基因和带负电的磁纳米粒子混合后,加入带正电的微泡混合后静置5分钟,得到目的基因
‑
微泡磁纳米粒子复合物。
65.在另一些实施例中,目的基因
‑
微泡磁纳米粒子复合物的结构如图5(b)所示,目的基因一端与微泡基体表面连接,目的基因远离微泡基体的另一端与磁纳米粒子连接。其中,磁离子通过表面修饰(比如pei修饰)后带正电荷,带负电的基因先与带正电的磁纳米粒子静电吸附,形成基因
‑
磁纳米粒子复合物,随后基因
‑
磁纳米粒子复合物再与带正电的微泡相吸附。
66.进一步的,目的基因
‑
微泡磁纳米粒子复合物的结构如图5(b)所示,目的基因
‑
微泡磁纳米粒子复合物的制备方法包括如下步骤:
67.(1)激活微泡:使用高速振荡器将装有微泡膜材料脂质体溶液同时封闭c3f8气体的容器瓶振荡40~50秒,激活微泡悬浮液;
68.(2)合成复合物:混合微泡,基因及磁纳米粒子;将带负电的基因和经过修饰后带正电的磁纳米粒子充分混合后静置10分钟,加入带正电的微泡混合后静置5分钟,得到目的基因
‑
微泡磁纳米粒子复合物。
69.在一些实施例中,微泡基体的膜材料选自阳离子脂质和磷脂的混合物,且,微泡基体的填充气体为c3f8气体。提供的微泡基体的材料,有利于得到的目的基因
‑
微泡磁纳米粒子复合物进行基因转染。
70.在一些实施例中,微泡基体的直径为1~5微米。将微泡溶于溶液中,得到的每毫升溶液中含有107‑
109个微泡。
71.在一些实施例中,磁纳米粒子的直径为20~40纳米。若磁纳米粒子粒径过大,则不利于吸附于微泡基体的表面。在一些实施例中,磁纳米粒子选自磁性氧化铁纳米粒子或其他带磁性的纳米粒子。
72.在一些实施例中,转染对象选自实验动物或实验细胞。其中,转染对象需要进行前处理。
73.在一个实施例中,转染对象选自实验动物,则进行前处理的方法包括如下:对实验动物的目标区域进行脱毛处理,以避免实验动物体表的毛发对超声波造成不必要的干扰;其次,实验动物在实验前需进行麻醉处理,例如使用异氟烷做气体麻醉或腹腔注射氯胺酮等药物进行处理。
74.在另一个实施例中,转染对象选自实验细胞,则进行前处理的方法包括如下步骤:当使用实验细胞作为实验对象时,需将实验细胞按照合适浓度传代至实验细胞转染使用的孔板中,细胞培养液需添加过量以保证在盖上顶盖后,培养液完全贴合上壁,无气泡存在,再进行使用。
75.在一些实施例中,将目的基因
‑
微泡磁纳米粒子复合物注射至转染对象的目标区域并垂直放置于超声空化控制模块的超声空化探头视角范围区域内,其中,使用三维运动控制器的万向夹具1固定超声空化探头,使空化激励换能器声束焦点落在转染对象的目标区域。
76.在一个实施例中,当转染对象选自实验动物时,需在目标区域体表面涂抹足够的超声耦合剂后,通过控制主机编程控制三维运动控制器将超声空化探头贴合在实验动物的目标区域,确保超声空化探头与目标区域体表面之间由超声耦合剂充满,保证不存在任何气泡。
77.在另一个实施例中,当转染对象选自实验细胞时,在细胞培养皿顶面涂抹足够的超声耦合剂,通过控制主机编程控制三维运动控制器将超声空化探头贴合在细胞培养皿顶面。
78.步骤s02中,设置超声激励生成装置的参数,利用超声激励生成装置多次释放超声能量进行基因转染处理,并利用超声空化检测装置对目标区域的超声回波进行检测,确认目标区域发生空化,目的基因转染至目标区域,得到转染产物。
79.在一些实施例中,设置超声激励生成装置的参数的步骤中,包括:设置超声激励生成装置中信号发生器的电信号产生频率为0.5~3兆赫兹,通过功率放大器将电信号放大50~200倍,通过连接线将放大后的电信号传递至空化激励换能器,空化激励换能器产生强度为0.2~2瓦/cm2的超声波。
80.在一些实施例中,利用超声空化检测装置对目标区域的超声回波进行检测,确认完成目标区域发生空化,目的基因转染至目标区域,得到转染产物。控制主机对声空化检测装置接收到的超声回波信号处理,检验目标区域在超声能量的作用下是否产生空化,如未检测到空化效应,须检查超声发生装置及转染试剂是否可用或调整超声发生信号的参数后继续。
81.在一些实施例中,当目标区域大于空化激励换能器声束焦点范围,可通过控制主机移动超声空化探头多次施加超声能量,对目标区域进行全范围空化以实现最高效的转染。
82.步骤s03中,对转染产物进行基因表达评估。
83.在一些实施例中,对转染产物进行基因表达评估的步骤中,包括:对转染产物进行基因表达的治疗效果或elisa检测血清中转染蛋白的表达含量进行评估。通过进行基因表达效果进行评估,进而判断是否需要重复基因转染或停止基因表达。
84.步骤s04中,将转染产物的要被停止基因表达的目标区域垂直放置于磁热控制模块的磁热探头激励范围区域内并进行磁热处理,停止基因表达。
85.在一些实施例中,转染产物的要被停止基因表达的目标区域垂直放置在三维运动控制器的万向夹具2控制的磁热探头下,并通过控制主机精确校准使要被停止基因表达的目标区域或部分目标区域处于高频交变磁场内;进一步,开启磁热装置,并使用红外测温装置对高频交变磁场内的目标区域进行温度监测,待到温度上升至温度阈值进行磁热处理后,控制主机关闭磁热装置,停止基因表达。
86.在一些实施例中,通过elisa检测血清中转染蛋白的含量,判断已停止基因表达的目标区域是否继续表达目的基因,如停止效果不显著,可继续施加高频交变磁场破坏被转染的细胞。
87.下面结合具体实施例进行说明。
88.实施例1
89.基因转染及表达停止方法
90.使用六周龄的bala/c雌鼠作为实验对象,选其大腿肌肉作为转染部位,荧光素酶报告基因作为目的基因,并使用小动物生物发光成像来展示基因转染增效与表达停止的效果评估。
91.包括如下步骤:
92.(1)将目的基因
‑
微泡磁纳米粒子复合物注射至转染对象的目标区域并垂直放置于超声空化控制模块的超声空化探头视角范围区域内;
93.具体为:
①
制备目的基因
‑
微泡磁纳米粒子复合物:a)激活微泡:使用摇床将装有微泡的封闭小瓶摇晃40s左右,激活微泡悬浮液;b)合成复合物:混合微泡,基因及磁纳米粒子,将带负电的基因和带负电的磁纳米粒子混合后,加入带正电的微泡混合后静置5分钟,得到目的基因
‑
微泡磁纳米粒子复合物。
94.②
转染对象的前处理:由于实验动物为小鼠,首先对目标区域进行脱毛处理,以避免实验动物体表的毛发对超声波造成不必要的干扰;其次,实验动物在实验前需进行麻醉处理,如使用异氟烷做气体麻醉或腹腔注射氯胺酮等药物进行处理。
95.③
使用三维运动控制器的万向夹具1固定超声空化探头,并校准三维运动控制器
及超声空化探头的位置;在转染对象的目标区域注射转染试剂;将转染对象放置在三维运动控制器控制的超声空化探头下,并使用控制主机控制三维运动控制器控制,使空化激励换能器声束焦点落在转染对象的目标区域,其中,由于转染对象为实验动物,需在目标区域体表涂抹足够的超声耦合剂后编程控制三维运动控制器将超声空化探头贴合在实验动物的目标区域,确保超声空化探头与目标区域体表面之间由超声耦合剂充满,保证不存在任何气泡;
96.(2)设置超声激励生成装置的参数,利用超声激励生成装置多次释放超声能量进行基因转染处理,并利用超声空化检测装置对目标区域的超声回波进行检测,确认完成目标区域发生空化,目的基因转染至目标区域;
97.具体为:
①
设置超声激励生成装置的参数,包括:设置超声激励生成装置中信号发生器的电信号产生频率为0.5~3兆赫兹,通过功率放大器将电信号放大50~200倍,通过连接线将放大后的电信号传递至空化激励换能器,空化激励换能器产生强度为0.2~2瓦/cm2的超声波。
98.②
启动超声空化探头,使空化激励换能器释放超声能量,空化检测换能器监测目标区域的超声回波;
99.③
控制主机对声空化检测装置接收到的超声回波信号处理,检验目标区域在超声能量的作用下是否产生空化,如未检测到空化效应,须检查超声发生装置及转染试剂是否可用或调整超声发生信号的参数后继续;
100.④
当目标区域大于空化激励换能器声束焦点范围,可通过控制主机移动超声空化探头多次施加超声能量,对目标区域进行全范围空化以实现最高效的转染;
101.(3)对转染产物进行基因表达评估;
102.具体为:通过基因表达的治疗效果或elisa检测血清中转染蛋白的含量,以评估实验对象的基因表达效果,进而判断是否需要重复基因转染或停止基因表达;
103.(4)将转染产物的要被停止基因表达的目标区域垂直放置于磁热控制模块的磁热探头激励范围区域内并进行磁热处理,停止基因表达。
104.具体为:
①
将转染产物的目标区域放置在三维运动控制器的万向夹具2控制的磁热探头下,并通过控制主机精确校准使要被停止基因表达的目标区域或部分目标区域处于高频交变磁场内;
105.②
开启磁热装置,并使用红外测温装置对高频交变磁场内的目标区域进行温度监测,待到温度上升至温度阈值,关闭磁热装置;
106.③
通过elisa检测血清中转染蛋白的含量,判断已停止基因表达的目标区域是否继续表达目的基因,如停止效果不显著,可继续施加高频交变磁场破坏被转染的细胞。
107.性质测试及结果分析
108.(一)
109.在超声激励换能器输出超声能量的情况下,微泡发生空化效应,诱导形成细胞膜孔,目的基因
‑
微泡磁纳米粒子复合物通过细胞膜孔高效递送基因和磁纳米粒子进入细胞,利用共聚焦拍摄到的细胞膜孔图片如图6所示。这种细胞膜孔在0s时间产生,在20.7s修复完成,属于可修复细胞膜孔。
110.(二)
111.对基因转染前的小鼠及转染后的小鼠分别进行生物发光成像且进行分析:如图7所示,图7(a)为基因转染前的小鼠生物发光成像,图7(b)展示第一次生物发光素酶报告基因转染后小鼠的生物发光成像,此时从成像结果来看,小鼠生物发光强度有待提高,因此进行了第二次生物发光素酶报告基因转染,其成像结果见图7(c),经过重复转染,小鼠的生物发光强度有所增加,如有需要,基因转染过程可更多次重复以取得理想的基因表达效果。
112.此后对该小鼠进行磁致基因表达停止,经过第一次磁致基因停止后,小鼠生物发光强度明显下降,但并未完全停止表达,见图7(d),在此基础上第二次磁致基因停止,从图7(e)可看出小鼠已完全停止基因表达。与转染过程一样,基因停止表达的过程也可以多次重复,以实现最为理想的基因表达状态。
113.综上,本专利提出的声磁能量控制的外源性基因转染增效与表达停止技术,通过超声和微泡诱导可修复的细胞膜孔提高基因及磁纳米粒子的入胞效率,可在时间上和空间上多次重复增效转染和停止基因表达,同时可以在毫米级精准控制基因转染的空间位置、亚厘米精度调控停止基因表达的目标区域的空间位置,同时,基因转染过程和基因停止表达过程均可以多次重复,以维持最理想的基因表达效果的状态。
114.以上所述仅为本技术的较佳实施例而已,并不用以限制本技术,凡在本技术的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1