一类羟基吡啶酮类化合物及其作为克服细菌生物膜耐药的抗生素增敏剂的应用
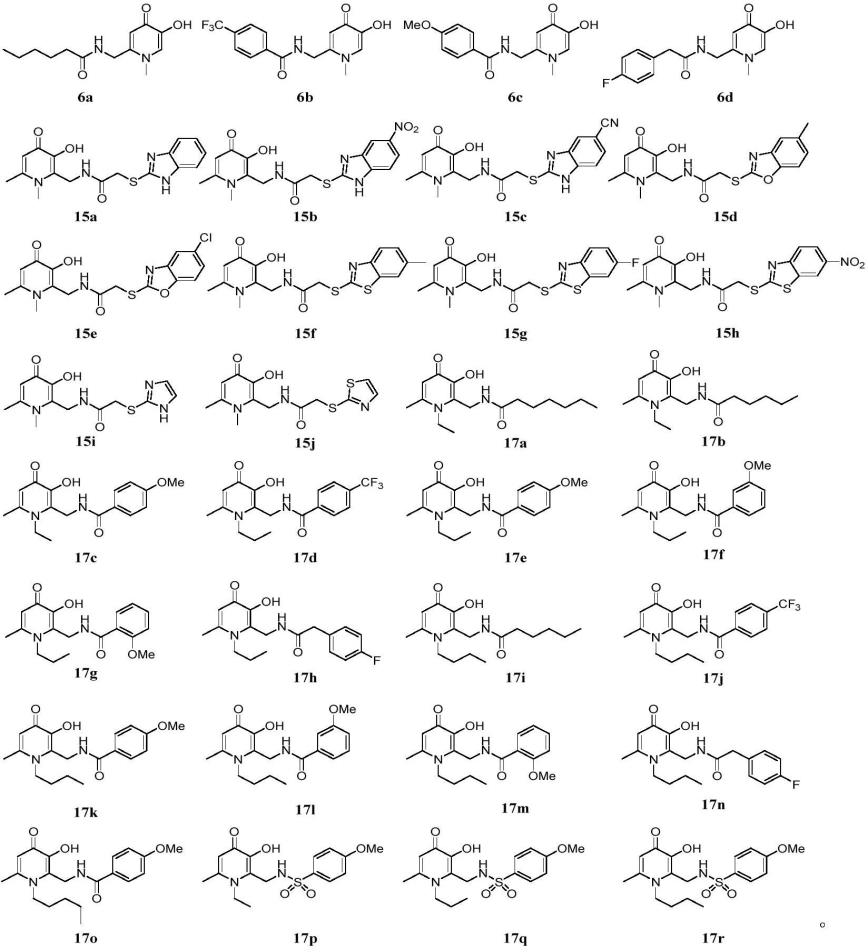
1.本发明属于医药领域,特别涉及一类羟基吡啶酮类化合物及其制备方法以及其作为克服细菌生物膜耐药的抗生素的增敏剂的应用。
背景技术:
2.全世界每年因细菌感染死亡的人数大约有1600万,而其中70%以上的难愈性慢性感染与细菌形成生物膜导致的耐药有关(biotechnol.adv.,2013,31:224-245)。生物膜是微生物分泌至胞外的多聚基质粘附于介质表面形成的用于将其自身包裹于内的膜样结构。当细菌形成生物膜时,膜内细菌由于受到生物膜的屏蔽作用不易被宿主免疫系统清除降低抗生素的抑菌效能,导致抗菌药物的耐受性显著上升。因此,抑制细菌生物膜形成,降低细菌耐药性,提升抗生素的抑菌效能,有望缓解细菌耐药及难愈性慢性感染问题。
3.细菌生物膜形成主要受细菌群体感应系统(quorum sensing,qs),gacs信号转导系统,以及3’,5
’‑
环二鸟苷(c-di-gmp)调控系统这三大系统调控(biomed res.int.,2015,1:759348)。其中细菌群体感应系统是依赖信号分子的一种细菌间相互交的通讯机制,主要包括相互关联的las、rhl、及pqs三大系统,其中las及rhl系统以n-酰基高丝氨酸内酯(ahls)为信号分子,pqs系统以2-庚基-3-羟基-4(1h)-喹诺酮(pqs)为信号分子。三大系统均通过相应的信号分子与相应的转录因子(lasr、rhlr及pqsr)结合形成复合物调控靶基因的表达,引起一系列基因表达水平的改变,从而实现细菌群体行为的调节,如毒力因子分泌、细菌运动能力调控、形成生物膜等。由于细菌群体感应系统的研究最为完善,目前基于细菌生物膜形成调控系统的生物膜抑制剂的研发主要集中于细菌群体感应系统(sajbiotechnol.,2014,1(1):1-9),包括利用信号分子ahls及pqs类似物竞争性地抑制相应转录因子(lasr、rhlr及pqsr)的激活作用,利用信号分子降解酶水解信号分子等策略。遗憾的是,目前尚无细菌群体感应抑制剂成功应用于临床,所以,开发新型针对细菌生物膜耐药的抗生素增敏剂非常必要和具有临床意义。
技术实现要素:
4.为了克服上述现有技术的缺点与不足,本发明的首要目的在于提供一种羟基吡啶酮类化合物,该化合物通过抑制细菌生物膜的形成,从而克服细菌对于抗生素的耐药性,具有作为新型抗菌剂药物的潜力。
5.本发明另一目的在于提供上述羟基吡啶酮类化合物的制备方法。
6.本发明再一目的在于提供上述羟基吡啶酮类化合物作为克服细菌生物膜耐药的抗生素增敏剂的应用。
7.本发明的目的通过下述方案实现:
8.一类羟基吡啶酮类衍生物,具有如式i所示的化学结构:
[0009][0010]
其中,r1为甲基、乙基、丙基、丁基、戊基的一种;r2为h,或者氨基甲基(-ch2nh-)、酰胺基甲基(-ch2nhco-)、磺酰胺基甲基(-ch2nhso
2-)中的一种与5-6碳原子直链烷基、取代芳烃基、杂环芳烃巯基结构中的一种相连的基团;r3为甲基,或者5-6个碳原子直链烷烃酰胺基甲基、取代芳烃酰胺基甲基中的一种。
[0011]
优选的,所述的羟基吡啶酮类衍生物,具有如下所示的化学结构:
[0012][0013]
一种上述羟基吡啶酮衍生物的制备方法,具体包括以下步骤:
[0014]
(1.1)将曲酸、氯化苄、氢氧化钠在溶剂中进行反应,反应结束后得到的反应液经纯化即得化合物1;
[0015]
(1.2)将化合物1、甲胺置于溶剂中反应,得到的反应液经纯化所得到化合物2;
[0016]
(1.3)将化合物2、三苯基膦、dead(偶氮二甲酸二乙酯)及邻苯二甲酰亚胺置于溶
剂中反应,得到的反应液经纯化所得到化合物3;
[0017]
(1.4)化合物3与水合肼在溶剂中加热回流反应,得到的反应液经纯化得到化合物4;
[0018]
(1.5)化合物4与酰氯(r4cocl)、吡啶在溶剂中反应,得到的反应液经纯化所得的化合物为化合物5a-5d;
[0019]
(1.6)化合物5a-5d与pd/c在溶剂中,氢气氛围下进行反应,所得的反应液经纯化后得到化合物6a-6d;
[0020]
此时的合成路线为:
[0021][0022]
步骤(1.1)所述的反应在溶剂中80℃回流反应24h;步骤(1.1)中所述的溶剂优选为甲醇;步骤(1.1)所述的纯化方法是指反应液减压浓缩后,加入水洗,析出固体,过滤得到产物1;
[0023]
步骤(1.2)中所述的反应是指在室温反应24h;步骤(1.2)中所述的溶剂优选为甲醇;步骤(1.2)所述的纯化方法是指反应液减压浓缩后,加入溶剂(乙酸乙酯)洗,析出固体,过滤得到产物2;
[0024]
步骤(1.3)中所述的溶剂为无水四氢呋喃;步骤(1.3)中所述的反应是指首先在0℃投料后,室温反应24h;步骤(1.3)所述的纯化方法是指反应液减压浓缩后,以二氯甲烷萃取,萃取得到的有机物经柱层析方法纯化得到化合物3;
[0025]
步骤(1.4)中所述的反应是指在溶剂中78℃回流反应3-4h;步骤(1.4)中所述的溶剂优选为乙醇;步骤(1.4)所述的纯化方法是指反应液减压浓缩后,溶于水中,10m氢氧化钠溶液调节ph为12-13,以溶剂萃取,萃取得到的有机物经柱层析方法纯化得到化合物4;
[0026]
步骤(1.5)中所述的酰氯r4cocl优选为己酰氯、对三氟甲基苯甲酰氯、对甲氧基苯甲酰氯、2-(4-氟苯基)乙酰氯中的一种;
[0027]
步骤(1.5)中所述的反应是指在溶剂中室温反应6h后纯化得到化合物5a-5d;步骤(1.5)中所述的溶剂优选为无水dmf(n,n-二甲基甲酰胺)。
[0028]
步骤(1.6)中所述的反应是指在溶剂中室温反应12h;步骤(1.6)中所述的溶剂优选为甲醇;步骤(1.6)所述的纯化方法是指反应液用硅藻土抽滤,减压浓缩,得到固体用溶剂重结晶得到化合物6a-6d;
[0029]
(2.1)将曲酸置于氯化亚砜中反应,粗产物继续与锌粉、浓盐酸进行反应,得到的反应液纯化即得化合物7;
[0030]
(2.2)将化合物7与甲醛在碱性条件下反应,将所得反应液纯化即得化合物8;
[0031]
(2.3)将化合物8与氯化苄、氢氧化钠水溶液在溶剂中进行反应,反应结束后得到的反应液经纯化即得化合物9;
[0032]
(2.4)将化合物9与3,4-二氢吡喃和对甲苯磺酸反应得到中间体,之后与甲胺置于溶剂中反应,纯化后得化合物10a;
[0033]
(2.5)将化合物10a、三苯基膦、diad(偶氮二甲酸二乙酯)及邻苯二甲酰亚胺置于溶剂中反应,得到化合物11a;
[0034]
(2.6)化合物11a与水合肼在溶剂中加热回流反应,得到化合物12a;
[0035]
(2.7)将化合物12a与氯乙酰氯、三乙胺在溶剂中反应,得化合物13;
[0036]
(2.8)将化合物13与三氯化硼置于溶剂中反应,得化合物14;
[0037]
(2.9)将化合物14与以及氢氧化钾在溶剂中反应,得到化合物15a-15j,其中对应的为化合物2-巯基苯并咪唑、5-硝基-2-巯基苯并咪唑、5-氰基-2-巯基苯并咪唑、2-巯基-5-甲基苯并恶唑、5-氯-2-巯基苯并恶唑、2-巯基-6-甲基苯并噻唑、6-氟-2-巯基苯并噻唑、2-巯基-6-硝基苯并噻唑、2-巯基咪唑或2-巯基噻唑。
[0038]
此时的合成路线为:
[0039][0040]
步骤(2.1)中所述的将曲酸置于氯化亚砜中反应是指在室温反应2h;所述的继续与锌粉、浓盐酸进行反应是指在70-80℃反应5h;重结晶得到产物7;
[0041]
步骤(2.2)中所述反应是指在室温反应过夜;步骤(2.2)所述的纯化方法是指缓慢加入浓盐酸调ph=1,析出大量固体,过滤得到产物7;
[0042]
步骤(2.3)中所述的反应是指在溶剂中80℃回流反应过夜,得到产物9;所述的溶剂优选为甲醇;
[0043]
步骤(2.4)中所述的化合物9、3,4-二氢吡喃和对甲苯磺酸反应是指在溶剂中常温反应3h;所述的之后与甲胺置于溶剂中反应是指在乙醇中75℃反应12h,再与2mol/l稀盐酸在乙醇中回流反应4h,得到产物10a;
[0044]
步骤(2.5)中所述的反应是指在无水四氢呋喃0℃投料后,室温反应24h,得化合物11a;
[0045]
步骤(2.6)中所述的反应是指在溶剂乙醇中78℃回流反应3-4h,得到化合物12a;
[0046]
步骤(2.7)中所述的反应是指在溶剂中室温反应3h,得到化合物13;所述的溶剂优选为无水dmf(n,n-二甲基甲酰胺);
[0047]
步骤(2.8)中所述的反应是指在溶剂中室温反应3h,得到化合物14;所述的溶剂优选为无水dcm(二氯甲烷);
[0048]
步骤(2.9)中所述的反应是指在溶剂中55℃反应过夜,得到化合物15a-15j;所述的溶剂优选为甲醇。
[0049]
(3.1)将化合物9与3,4-二氢吡喃和对甲苯磺酸反应得到中间体,之后与r1nh2(r1为甲基、乙基、丙基、丁基、戊基的一种)置于溶剂中反应,纯化后得化合物10b-10e;
[0050]
(3.2)将化合物10b-10e、三苯基膦、diad(偶氮二甲酸二乙酯)及邻苯二甲酰亚胺置于溶剂中反应,得到化合物11b-11e;
[0051]
(3.3)化合物11b-11e与水合肼在溶剂中加热回流反应,得到化合物12b-12e;
[0052]
(3.4)化合物12b-12e、酰氯(r5cocl)或磺酰氯(r5so2cl)、吡啶在无水dmf(n,n-二甲基甲酰胺)中反应,得到的反应液经纯化得化合物16a-16r;
[0053]
(3.5)化合物16a-16r与pd/c在溶剂中,氢气氛围下进行反应,所得的反应液经纯化后得到化合物17a-17r;
[0054]
此时的合成路线为:
[0055][0056]
步骤(3.1)中所述的化合物9与3,4-二氢吡喃和对甲苯磺酸反应是指在溶剂中常温反应3h;所述的之后与r1nh2在溶剂中反应是指在乙醇中75℃反应12h,再与2mol/l稀盐酸在乙醇中回流反应4h,得到产物10b-10e;
[0057]
步骤(3.2)中所述的反应是指在溶剂无水四氢呋喃0℃投料后,室温反应24h,得化合物11b-11e;
[0058]
步骤(3.3)中所述的反应是指在溶剂中78℃回流反应3-4h,得到化合物12b-12e;
[0059]
步骤(3.4)中所述的酰氯为庚酰氯、己酰氯、对甲氧基苯甲酰氯、对三氟甲基苯甲酰氯、对甲氧基苯甲酰氯、间甲氧基苯甲酰氯、邻甲氧基苯甲酰氯、2-(4-氟苯基)乙酰氯中的一种;步骤(3.4)中所述的磺酰氯为对甲氧基苯磺酰氯。
[0060]
步骤(3.4)中所述的反应是指在无水dmf中室温反应6h;步骤(3.1)所述的纯化方法是指反应液加入水中,以二氯甲烷萃取,萃取得到的有机物经柱层析方法纯化得到化合物16a-16r;
[0061]
步骤(3.5)中所述的反应是指在溶剂甲醇中,氢气氛围下,室温反应12h;步骤(3.2)所述的纯化方法是指反应液用硅藻土抽滤,减压浓缩,得到固体用甲醇重结晶得到化合物17a-17r。
[0062]
上述的羟基吡啶酮类化合物与临床常用治疗铜绿假单胞菌感染抗生素联用后均提升了抗生素对不同临床耐药菌株敏感性及抗菌能力,本发明的羟基吡啶酮类化合物主要是通过抑制细菌生物膜的形成,可用于制备细菌生物膜抑制剂,尤其是在制备铜绿假单胞菌抑制剂的增敏剂中的应用。
[0063]
所述的铜绿假单胞菌抑制剂可以为喹诺酮类抗生素(环丙沙星)、氨基糖苷类抗生素(妥布霉素)和粘菌素中的至少一种;
[0064]
所述的铜绿假单胞菌为铜绿假单胞菌pao1,铜绿假单胞菌1121,铜绿假单胞菌1167,铜绿假单胞菌fb,铜绿假单胞菌1129中的一种。
[0065]
前述的羟基吡啶酮类化合物铜绿假单胞菌抑制剂在浓度仅为20μm时与上述抗生素联用后可提升上述临床分离铜绿假单胞菌耐药菌株的敏感性。
[0066]
所述的药物组合物中的羟基吡啶酮类化合物还可以为羟基吡啶酮类化合物的药用盐或者溶剂化物。公知的,化合物的溶剂化形式与盐通常并不影响化合物自身的生物学活性。
[0067]
所述的药物组合物可含有一种或多种药学上可接受的载体或赋形剂。
[0068]
本发明相对于现有技术,具有如下的优点及有益效果:
[0069]
(1)本发明以羟基吡啶酮为先导化合物,对羟基吡啶酮n-1位,c-2位,c-6位进行修饰和改造,设计合成了一系列羟基吡啶酮类化合物,并应用于细菌生物膜抑制剂的开发中,其中17k,n-1位丁基取代、c-2位为对甲氧基苯环取代时,生物膜抑制活性优于阳性对照化合物阿奇霉素,是高效的新型生物膜抑制剂。
[0070]
(2)羟基吡啶酮类化合物中优秀生物膜抑制活性的15b,17e,17f,17i,17j,17k,17l,17m,17o,17r(mic》512μm)化合物在浓度为20μm时与临床常用抗生素(环丙沙星、、妥布霉素、粘菌素)联用时抑制铜绿假单胞菌标准菌株pao1和临床分离的铜绿假单胞菌耐药菌株(1121,1167,fb,1129),增强了抗生素对耐药菌的敏感性,提升了抗生素对不同临床耐药菌株的抗菌能力。
附图说明
[0071]
图1不同浓度化合物对斑马鱼感染模型的实验结果图。
具体实施方式
[0072]
下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0073]
实施例中所用试剂如无特殊说明均可从市场常规购得。
[0074]
实施例1:n-((5-(苄氧基)-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)己酰胺(5a)的制备
[0075]
以中间体化合物4(具体制备参考“j.med.chem.2004,47(25),6349-6362.”)(350mg,1.4mmol)置于25ml干燥的双口瓶中,氮气保护下加入8ml无水dmf,0℃下滴加己酰氯(0.3ml,2.1mmol),然后加无水吡啶(0.6ml,7.0mmol),室温反应6小时。反应完毕加入8ml水淬灭反应。二氯甲烷萃取三次,无水硫酸钠干燥,过滤,滤液减压浓缩,柱层析纯化,洗脱剂为二氯甲烷/甲醇=30/1,得5a为白色油状液体277mg,产率:57.9%。1h nmr(400mhz,cdcl3)δ8.35(t,j=4.4hz,1h),7.41
–
7.32(m,5h),6.95(s,1h),6.29(s,1h),5.07(s,2h),4.31(d,j=5.4hz,2h),3.55(s,3h),2.43
–
2.24(m,2h),1.66(p,j=7.4hz,2h),1.36
–
1.28(m,4h),0.88(t,j=6.7hz,3h).
13
c nmr(100mhz,cdcl3)δ14.0,22.4,25.3,31.6,36.1,40.0,41.0,72.0,117.6,127.8,128.4,128.7,129.6,136.3,146.5,147.6,172.6,173.9.
[0076]
实施例2:n-((5-(苄氧基)-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-(三氟甲基)苯甲酰胺(5b)的制备
[0077]
以中间体化合物4(400mg,1.6mmol)和对三氟甲基苯甲酰氯(0.4ml,2.4mmol)原料,合成方法同化合物5a,得5b为淡黄色油状液体264mg,产率:39.4%。1h nmr(400mhz,cdcl3)δ9.63(s,1h),8.31(d,j=7.8hz,2h),7.62(d,j=7.9hz,2h),7.23(s,5h),6.99(s,1h),6.25(s,1h),4.90(s,2h),4.51(d,j=4.2hz,2h),3.59(s,3h).
13
c nmr(100mhz,cdcl3)δ29.7,41.2,71.9,100.0,118.4,125.2(q,3j
c-f
=3.5hz),127.7,128.4,128.5,128.6,132.9(q,2j
c-f
=32.9hz),135.6,145.9,147.8,165.9,172.3.
[0078]
实施例3:n-((5-(苄氧基)-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(5c)的制备
[0079]
以中间体化合物4(300mg,1.2mmol)和对甲氧基苯甲酰氯(0.4ml,1.8mmol)原料,合成方法同化合物5a,得5c为白色油状液体454mg,产率:99.9%。1h nmr(400mhz,cdcl3)δ9.04(s,1h),8.15(d,j=8.8hz,2h),7.26(s,5h),6.94(s,1h),6.89(d,j=8.8hz,2h),6.31(s,1h),4.95(s,2h),4.50(d,j=5.0hz,2h),3.82(s,3h),3.56(s,3h).
13
c nmr(100mhz,cdcl3)δ29.7,41.1,55.3,72.0,113.6,118.3,125.7,127.8,128.3,128.6,129.7,136.1,162.3.
[0080]
实施例4:n-((5-(苄氧基)-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-2-(4-氟苯基)乙酰胺(5d)的制备
[0081]
以中间体化合物4(300mg,1.2mmol)和2-(4-氟苯基)乙酰氯(0.3ml,1.8mmol)原料,合成方法同化合物5a,得5d为白色油状液体264mg,产率:57.5%。1h nmr(400mhz,cdcl3)δ8.82(s,1h),7.40
–
7.29(m,7h),7.01
–
6.91(m,3h),6.31(s,1h),5.05(s,2h),4.28(d,j=5.3hz,2h),3.59(s,2h),3.52(s,3h).
13
c nmr(100mhz,cdcl3)δ40.1,41.2,42.0,72.0,115.2(d,2j
c-f
=21.4hz),115.4,127.8,128.5,128.7,129.4,130.8(d,3j
c-f
=7.9hz),131.2(d,4j
c-f
=3.1hz),136.0,146.6,160.7(d,1j
c-f
=245.7hz),171.5.
[0082]
实施例5:n-((5-羟基-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)己酰胺(6a)的制备
[0083]
将中间体化合物5a(277mg,0.81mmol)置于单口反应瓶中,用10ml甲醇溶解,加入27mg pd/c(l0%钯碳),抽真空,充氢气置换三次,室温反应12h。反应完毕,反应液用硅藻土过滤,收集滤液减压浓缩得到固体,固体用甲醇重结晶,得6a为白色固体182mg,产率:88.9%,纯度:98.69%,熔点:182.4-183.4℃。1h nmr(400mhz,dmso-d6)δ8.34(t,j=5.6hz,1h),7.42(s,1h),6.09(s,1h),4.21(d,j=5.7hz,2h),3.59(s,3h),2.17(t,j=7.4hz,2h),1.53(p,j=7.4hz,2h),1.36
–
1.15(m,4h),0.86(t,j=7.0hz,3h).
13
c nmr(100mhz,dmso-d6)δ14.3,22.3,25.4,31.4,35.6,39.2,112.3,124.8,145.8,147.2,170.8,172.8.hrms(esi):calcd for c
13h20
n2o3[m+h]
+
=253.1547,found[m+h]
+
=253.1549.
[0084]
实施例6:n-((5-羟基-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-(三氟甲基)苯甲酰胺(6b)的制备
[0085]
以中间体化合物5b,合成方法同化合物6a,得6b为白色固体152mg,产率:73.8%,纯度:99.40%,熔点:269.6-270.5℃。1h nmr(400mhz,dmso-d6)δ9.28(t,j=5.3hz,1h),8.12(d,j=8.1hz,2h),7.89(d,j=8.3hz,2h),7.46(s,1h),6.16(s,1h),4.46(d,j=
5.5hz,2h),3.67(s,3h).
13
c nmr(100mhz,dmso-d6)δ39.4,40.1,112.5,123.0,125.0,125.9(q,3j
c-f
=3.8hz),128.8,131.7,132.0(q,2j
c-f
=31.9hz),137.9,145.3,147.3,165.8,170.8.hrms(esi):calcd for c
15h13
f3n2o3[m+h]
+
=327.0951,found[m+h]
+
=327.0950.
[0086]
实施例7:n-((5-羟基-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(6c)的制备
[0087]
以中间体化合物5c,合成方法同化合物6a,得6c为白色固体226mg,产率:65.8%,纯度:99.05%,熔点:270.4-272.0℃。1h nmr(400mhz,dmso-d6)δ8.88(s,1h),7.90(d,j=8.7hz,2h),7.44(s,1h),7.03(d,j=8.8hz,2h),6.12(s,1h),4.40(d,j=5.4hz,2h),3.82(s,3h),3.66(s,3h).
13
c nmr(100mhz,dmso-d6)δ40.3,55.8,112.3,114.1,124.8,126.4,129.7,145.9,147.3,162.3,166.3,170.8.hrms(esi):calcd for c
15h16
n2o4[m+h]
+
=289.1183,found[m+h]
+
=289.1191.
[0088]
实施例8:2-(4-氟苯基)-n-((5-羟基-1-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)乙酰胺(6d)的制备
[0089]
以中间体化合物5d,合成方法同化合物6a,得6d为白色固体207mg,产率:78.9%,纯度:98.62%,熔点:204.4-204.9℃。1h nmr(400mhz,dmso-d6)δ8.60(t,j=5.3hz,1h),7.42(s,1h),7.31(dd,j=5.7,8.5hz,2h),7.13(t,j=8.9hz,2h),6.11(s,1h),4.23(d,j=5.6hz,2h),3.55(s,3h),3.52(s,2h).
13
c nmr(100mhz,dmso-d6)δ39.5,41.6,112.5,115.3(d,2j
c-f
=21.3hz),124.9,131.3,131.4(d,3j
c-f
=8.1hz),132.7(d,4j
c-f
=3.1hz),145.5,147.3,160.3,161.5(d,1j
c-f
=243.1hz),162.7,170.8.hrms(esi):calcd for c
15h15
fn2o3[m+h]
+
=291.1139,found[m+h]
+
=291.1127.
[0090]
实施例9:1,6-二甲基-2-氯乙酰胺基甲基-3-苄氧基-4-吡啶酮(13)的制备
[0091]
将中间体化合物12a(具体合成方法参考“j.med.chem.2004,47(25),6349-6362.”)(3g,11.6mmol)置于含有磁力搅拌子的100ml干燥的双口瓶,氮气保护下,加入30ml无水dmf,0℃下滴加氯乙酰氯(1.05ml,13.94mmol),然后逐滴加入无水三乙胺(1.93ml,13.94mmol),室温反应3小时,tlc监测反应结束后,大量白色粉末析出,抽滤,滤饼用乙酸乙酯洗涤三遍,收集滤饼,得化合物13为白色固体(3.67g,yield=94.50%);1h nmr(400mhz,cdcl3)δ7.37(d,j=10.1hz,1h),7.33
–
7.26(m,4h),7.26
–
7.25(m,1h),6.32(s,1h),5.18(s,2h),4.41(d,j=5.7hz,2h),3.99(d,j=4.7hz,2h),3.46(s,3h),2.24(s,3h).
13
c nmr(100mhz,cdcl3)δ173.04,166.42,147.52,146.26,140.12,137.03,128.92,128.59,128.40,118.74,73.16,42.36,36.37,35.34,20.97.
[0092]
实施例10:1,6-二甲基-2-氯乙酰胺基甲基-3-羟基-4-吡啶酮(14)的制备
[0093]
将化合物13(3.5g,0.01mol)置于含有磁力搅拌子的100ml干燥的双口瓶中,氮气保护下,加入30ml无水二氯甲烷,0℃下缓慢滴加三氯化硼的二氯甲烷溶液(30ml,0.03mol,1mol/l),自然升温至室温,搅拌3h。tlc监测反应结束,加入甲醇淬灭反应,将反应液减压浓缩得粗产物,粗产物用纯甲醇重结晶,得化合物14为白色固体(1.4g,yield=57.20%);1h nmr(400mhz,dmso-d6)δ9.01(s,1h),7.31(s,1h),4.66(d,j=5.2hz,1h),4.13(s,2h),3.88(s,3h),2.57(s,3h).
13
c nmr(100mhz,dmso-d6)δ166.98,160.00,148.86,143.38,139.70,113.16,42.77,35.39,21.08.
[0094]
实施例11:1,6-二甲基-2-((2-苯并咪唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶
酮(15a)的制备
[0095]
将化合物2-巯基苯并咪唑(96.13mg,0.67mmol)和氢氧化钾(52.18mg,0.93mmol)置于含有磁力搅拌子的25ml干燥的双口瓶中,氮气保护下,加入3ml无水甲醇,待其溶解后,加入中间体化合物14(150mg,0.61mmol),55℃搅拌6h。tlc监测反应结束后,固体析出,自然冷却至室温,过滤,得滤渣,粗产物用甲醇重结晶,得化合物15a为白色固体163mg,产率:74.50%,纯度:96.36%,熔点:264.3-265.6℃。1h nmr(400mhz,dmso-d6)δ9.02(s,1h),7.44-7.42(m,2h),7.17-7.14(m,1h),7.12(s,1h),4.63(d,j=5.4hz,2h),4.10(s,2h),3.74(s,3h),2.45(s,3h).
13
c nmr(100mhz,dmso-d6)δ168.21,161.29,150.11,148.45,143.73,138.46,122.30,113.06,38.91,35.25,35.14,20.94.hrms(esi)m/z calcd for c
17h18
n4o3s[m+h]
+
359.1172,found 359.1164.
[0096]
实施例12:1,6-二甲基-2-((5-硝基-2-苯并咪唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15b)的制备
[0097]
以中间体14(150mg,0.61mmol)和5-硝基-2-巯基苯并咪唑(130.98mg,0.67mmol)为原料,制备方法同化合物15a,得化合物15b为褐色固体140mg,产率:56.90%,纯度:95.13%,熔点:235.3-236.7℃。1h nmr(400mhz,dmso-d6)δ8.73(s,1h),8.25(d,j=2.1hz,1h),8.06(dd,j=8.8,2.2hz,1h),7.58(d,j=8.8hz,1h),6.14(s,1h),4.48(d,j=4.8hz,2h),4.13(s,2h),3.43(s,3h),2.24(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.34,167.49,146.69,146.13,142.58,129.53,119.41,118.00,112.96,105.19,36.15,35.13,35.06,20.72.hrms(esi)m/z calcd for c
17h17
n5o5s[m+h]
+
404.1023,found 404.1030.
[0098]
实施例13:1,6-二甲基-2-((5-氰基-2-苯并咪唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15c)的制备
[0099]
以中间体14(100mg,0.41mmol)和5-氰基-2-巯基苯并咪唑(92.86mg,0.53mmol)为原料,制备方法同化合物15a,得化合物15c为白色固体115mg,产率:73.10%,纯度:97.65%,熔点:266.8-267.7℃。1h nmr(400mhz,dmso-d6)δ8.72(t,j=4.9hz,1h),7.91(s,1h),7.53(dt,j=8.3,4.9hz,2h),6.13(s,1h),4.47(d,j=5.0hz,2h),4.10(s,2h),3.42(s,3h),2.24(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.84,167.52,146.53,146.29,128.83,125.76,120.47,112.89,103.75,35.92,35.08,35.03,20.71.hrms(esi)m/z calcd for c
18h17
n5o3s[m+h]
+
384.1125,found 384.1122.
[0100]
实施例14:1,6-二甲基-2-((5-甲基-2-苯并恶唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15d)的制备
[0101]
以中间体14(100mg,0.41mmol)和2-巯基-5-甲基苯并恶唑(98mg,0.53mmol)为原料,制备方法同化合物15a,得化合物15d为白色固体98mg,产率:64.00%,纯度:95.12%,熔点:246.4-247.8℃。1h nmr(400mhz,dmso-d6)δ8.27(s,1h),7.21(d,j=8.1hz,1h),7.10(s,1h),6.81(d,j=7.6hz,1h),6.15(s,1h),4.67(s,2h),3.57(s,3h),2.33(s,3h),2.30(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.99,162.53,146.83,146.75,146.30,143.49,133.23,128.37,121.50,116.54,112.93,108.58,38.33,36.13,21.56,20.74.hrms(esi)m/z calcd for c
18h19
n3o4s[m+h]
+
374.1169,found 374.1173.
[0102]
实施例15:1,6-二甲基-2-((5-氯-2-苯并恶唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15e)的制备
[0103]
以中间体14(100mg,0.41mmol)和5-氯-2-巯基苯并恶唑(98.94mg,0.53mmol)为原料,制备方法同化合物15a,得化合物15e为白色固体80mg,产率:49.50%,纯度:95.44%,熔点:217.3-219.7℃。1h nmr(400mhz,dmso-d6)δ8.77(s,1h),7.68(dd,j=10.0,5.1hz,2h),7.36(dd,j=8.6,1.7hz,1h),6.14(s,1h),4.49(d,j=4.6hz,2h),4.17(s,2h),3.46(s,3h),2.27(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.87(s),166.57(s),166.46(s),150.54(s),146.57(s),146.34(s),142.96(s),129.42(s),128.70(s),124.73(s),118.38(s),112.93(s),111.96(s),35.95(s),35.80(s),35.15(s),20.75(s).hrms(esi)m/z calcd for c
17h16
cln3o4s[m+h]
+
394.0623,found 394.0625.
[0104]
实施例16:1,6-二甲基-2-((6-甲基-2-苯并噻唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15f)的制备
[0105]
以中间体14(100mg,0.41mmol)和2-巯基-6-甲基苯并噻唑(96.62mg,0.53mmol)为原料,制备方法同化合物15a,得化合物15f为白色固体93mg,产率:58.20%,纯度:95.15%,熔点:253.1-254.7℃。1h nmr(400mhz,dmso-d6)δ8.74(t,j=5.0hz,1h),7.79(s,1h),7.64(d,j=8.3hz,1h),7.26(d,j=8.3hz,1h),6.14(s,1h),4.49(d,j=5.0hz,2h),4.14(s,2h),3.42(s,3h),2.40(s,3h),2.23(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.85,167.02,165.16,151.14,146.54,146.33,135.36,134.67,128.81,128.18,121.91,121.03,112.93,36.77,35.95,35.0,21.40,20.72.hrms(esi)m/z calcd for c
18h19
n3o3s2[m+h]
+
390.0941,found390.0940.
[0106]
实施例17:1,6-二甲基-2-((6-氟-2-苯并噻唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15g)的制备
[0107]
以中间体14(100mg,0.41mmol)和6-氟-2-巯基苯并噻唑(113.92mg,0.62mmol)为原料,制备方法同化合物15a,得化合物15g为白色固体88mg,产率:54.60%,纯度:95.34%,熔点:241.4-243.2℃。1h nmr(400mhz,dmso-d6)δ8.73(t,j=4.8hz,1h),7.95(dd,j=8.7,2.6hz,1h),7.77(dd,j=8.9,4.9hz,1h),7.32(td,j=9.0,2.7hz,1h),6.13(s,1h),4.49(d,j=5.0hz,2h),4.15(s,2h),3.44(s,3h),2.24(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.87,166.94,159.60(d,1j
c-f
=241hz),146.44(d,2j
c-f
=25hz),136.49(d,4j
c-f
=12hz),128.72,122.52(d,5j
c-f
=9hz),115.10,114.94,112.89,108.95(d,3j
c-f
=17hz),36.85,35.95,35.13,20.73.hrms(esi)m/z calcd for c
17h16
fn3o3s2[m+h]
+
394.0690,found 394.0692.
[0108]
实施例18:1,6-二甲基-2-((6-硝基-2-苯并噻唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15h)的制备
[0109]
以中间体14(100mg,0.41mmol)和2-巯基-6-硝基苯并噻唑(194.2mg,0.62mmol)为原料,制备方法同化合物15a,得化合物15h为黄色固体121mg,产率:70.20%,纯度:95.07%,熔点:235.9-237.4℃。1h nmr(400mhz,dmso-d6)δ9.07(d,j=2.3hz,1h),8.82(t,j=4.6hz,1h),8.27(dd,j=9.0,2.3hz,1h),7.91(d,j=9.0hz,1h),6.24(s,1h),4.51(d,j=4.8hz,2h),4.25(s,2h),3.51(s,3h),2.29(s,3h).
13
c nmr(100mhz,dmso-d6)δ174.80,168.99,166.70,156.84,146.79,146.07,144.04,143.78,135.9,129.76,123.46,122.46,121.51,119.32,118.27,113.37,112.99,37.02,36.32,35.22,20.80.hrms(esi)m/z calcd for c
17h16
n4o5s2[m+h]
+
421.0635,found 421.0632.
[0110]
实施例19:1,6-二甲基-2-((2-咪唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15i)的制备
[0111]
以中间体14(100mg,0.41mmol)和2-巯基咪唑(61.58mg,0.62mmol)为原料,制备方法同化合物15a,得化合物15i为粉色固体96mg,产率:75.90%,纯度:95.13%,熔点:251.7-253.9℃。1h nmr(400mhz,dmso-d6)δ8.59(s,1h),7.01(s,2h),6.12(s,1h),4.44(d,j=3.8hz,2h),3.72(s,2h),3.41(s,3h),2.27(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.83,168.46,146.57,146.23,138.85,128.85,112.87,36.91,35.94,34.87,20.75.hrms(esi)m/z calcd for c
13h16
n4o3s[m+h]
+
309.1016,found 309.1007.
[0112]
实施例20:1,6-二甲基-2-((2-噻唑基)-硫代乙酰胺基甲基)-3-羟基-4-吡啶酮(15j)的制备
[0113]
以中间体14(100mg,0.41mmol)和2-巯基噻唑(72.07mg,0.62mmol)为原料,制备方法同化合物15a,得化合物15j为白色固体93mg,产率:69.70%,纯度:95.99%,熔点:217.3-219.4℃。1h nmr(400mhz,dmso-d6)δ8.64(t,j=4.9hz,1h),7.67(dd,j=17.5,3.4hz,2h),6.13(s,1h),4.46(d,j=5.0hz,2h),3.99(s,2h),3.44(s,3h),2.28(s,3h).
13
c nmr(100mhz,dmso-d6)δ169.82,167.23,163.67,146.58,146.29,143.12,128.77,121.06,112.90,37.46,35.95,35.02,20.77.hrms(esi)m/z calcd for c
13h15
n3o3s2[m+h]
+
326.0628,found 326.0628.
[0114]
实施例21:3-(苄氧基)-1-乙基-2-(羟甲基)-6-甲基吡啶-4(1h)-酮(10b)的制备
[0115]
将化合物9(j.med.chem.2004,47(25),6349-6362.具体合成方法已有报道)(6.00g,24mmol)置于250ml双口瓶中,加入100ml无水二氯甲烷溶解,随后加入对甲苯磺酸(172mg,1mmol),缓慢滴加3,4-二氢-2h-吡喃(4.50ml,1mmol),室温反应3小时。反应完毕,加入5%碳酸钠溶液淬灭反应,二氯甲烷萃取三次,无水硫酸钠干燥,过滤,滤液减压浓缩,得到黄色液体。黄色液体溶于40ml乙醇中,加入20ml乙胺,封管75℃反应12h。反应完毕,反应液减压浓缩,得到棕色液体。棕色液体溶于50ml乙醇中,加入19ml 2m盐酸,回流反应4小时。反应完毕,旋干乙醇,加入40ml水,用40ml乙醚洗涤,保留水层,水层用10m氢氧化钠溶液,调节ph=13,用二氯甲烷萃取三次,无水硫酸钠干燥,过滤,滤液减压浓缩,得到固体用二氯甲烷重结晶,得到棕色晶体2.40g。产率:36.1%。1h nmr(400mhz,dmso-d6)δ7.50
–
7.27(m,5h),6.17(s,1h),5.47(t,j=5.3hz,1h),5.03(s,2h),4.50(d,j=5.3hz,2h),4.10(q,j=7.1hz,2h),2.34(s,3h),1.24(t,j=7.1hz,3h).
13
c nmr(100mhz,dmso-d6)δ15.9,19.6,43.0,54.0,73.1,118.5,128.2,128.6,128.8,138.2,142.9,145.5,147.5,172.8.
[0116]
实施例22:3-(苄氧基)-2-(羟甲基)-6-甲基-1-丙基吡啶-4(1h)-酮(10c)的制备
[0117]
以中间体化合物9,合成方法同化合物10b,得10c为棕色晶体2.34g,产率:32.0%。1h nmr(400mhz,dmso-d6)δ7.46
–
7.28(m,5h),6.16(s,1h),5.47(t,j=5.3hz,1h),5.03(s,2h),4.49(d,j=5.2hz,2h),4.03
–
3.88(m,2h),3.34(s,3h),2.33(s,3h),1.62(dq,j=7.4,14.9hz,2h),0.89(t,j=7.4hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.3,19.7,23.9,49.4,54.1,73.1,118.4,128.2,128.6,128.8,138.2,143.0,145.3,147.6,172.8.
[0118]
实施例23:3-(苄氧基)-1-丁基-2-(羟甲基)-6-甲基吡啶-4(1h)-酮(10d)的制备
[0119]
以中间体化合物9,合成方法同化合物10b,得10d为棕色晶体2.10g,产率:28.8%。1h nmr(400mhz,dmso-d6)δ7.46
–
7.29(m,5h),6.16(s,1h),5.48(t,j=5.2hz,1h),5.03(s,
2h),4.49(d,j=4.7hz,2h),4.11
–
3.94(m,2h),2.33(s,3h),1.58(p,j=8.2hz,2h),1.32(h,j=7.3hz,2h),0.92(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.9,19.9,32.5,47.7,54.1,73.1,118.5,128.2,128.6,128.8,138.2,143.0,145.4,147.6,172.8.
[0120]
实施例24:3-(苄氧基)-2-(羟甲基)-6-甲基-1-戊基吡啶-4(1h)-酮(10e)的制备
[0121]
以中间体化合物9,合成方法同化合物10b,得10e为白色固体1.20g,产率:15.8%。1h nmr(400mhz,dmso-d6)δ7.47
–
7.29(m,5h),6.17(s,1h),5.52(s,1h),5.03(s,2h),4.49(s,2h),4.05
–
3.95(m,2h),2.33(s,3h),1.60(p,j=7.3hz,2h),1.31(td,j=5.5,13.7,14.5hz,4h),0.88(t,j=6.9hz,3h).
13
c nmr(100mhz,dmso-d6)δ14.3,19.7,22.1,28.8,30.2,47.9,54.1,73.1,118.5,128.2,128.6,128.8,138.1,143.0,145.3,147.6,172.8.
[0122]
实施例25:2-((3-(苄氧基)-1-乙基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)异吲哚-1,3-二酮(11b)的制备
[0123]
将化合物10b(2.40g,9mmol),邻苯二甲酰亚胺(2.77g,11mmol),三苯基氧膦(1.56g,11mmol)置于干燥的250ml的双口瓶中,氮气保护下,加入40ml无水四氢呋喃中。0℃下搅拌30分钟后,缓慢滴加偶氮二甲酸二异丙酯(1.67ml,11mmol),滴加完后缓慢升至室温,搅拌24h。反应完毕,减压浓缩,旋干四氢呋喃,残余液体加入50ml水后,100ml二氯甲烷萃取三次,无水硫酸钠干燥,过滤,滤液减压浓缩,柱层析纯化,洗脱剂为二氯甲烷/甲醇=15/1,得到黄色固体4.51g,产率:81.8%。1h nmr(400mhz,dmso-d6)δ7.84(s,4h),7.34(dd,j=1.7,7.6hz,2h),7.26(dd,j=3.6,9.0hz,3h),6.21(s,1h),5.13(s,2h),4.85(s,2h),4.09(q,j=7.0hz,2h),3.35(s,3h),2.35(s,3h),1.16(t,j=7.1hz,3h).
13
c nmr(100mhz,dmso-d6)δ15.7,19.9,34.7,43.8,71.4,100.0,118.9,123.6,128.1,128.4,128.8,131.9,135.0,138.0,146.7,147.2,167.8,172.2.
[0124]
实施例26:2-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)异吲哚-1,3-二酮(11c)的制备
[0125]
以中间体化合物10c,合成方法同化合物11b,得11c为黄色固体3.41g,产率:99.6%。1h nmr(400mhz,dmso-d6)δ7.84(d,j=1.7hz,4h),7.35(d,j=7.5hz,2h),7.30
–
7.19(m,3h),6.20(s,1h),5.15(s,2h),4.82(s,2h),4.08
–
3.80(m,2h),3.36(s,3h),2.34(s,3h),1.62
–
1.47(m,2h),0.84(t,j=7.2hz,3h).
13
c nmr(100mhz,dmso-d6)δ10.9,20.1,23.8,34.8,49.9,71.4,118.9,123.6,128.1,128.4,128.9,131.9,135.0,137.9,138.0,146.6,147.3,167.9,172.3.
[0126]
实施例27:2-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)异吲哚-1,3-二酮(11d)的制备
[0127]
以中间体化合物10d,合成方法同化合物11b,得11d为黄色固体4.04g,产率:95.2%。1h nmr(400mhz,dmso-d6)δ7.84(s,4h),7.39
–
7.33(m,2h),7.31
–
7.22(m,3h),6.21(s,1h),5.16(s,2h),4.83(s,2h),4.09
–
3.84(m,2h),2.34(s,3h),1.47(p,j=8.1hz,2h),1.25(h,j=7.3hz,2h),0.80(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.9,19.6,20.1,32.5,34.7,48.5,71.4,118.9,123.6,128.1,128.4,131.9,135.1,138.0,146.7,147.3,167.9,172.3.
[0128]
实施例28:2-((3-(苄氧基)-6-甲基-4-氧代-1-戊基-1,4-二氢吡啶-2-基)甲基)异吲哚-1,3-二酮(11e)的制备
[0129]
以中间体化合物10e,合成方法同化合物11b,得11e为黄色固体2.02g,产率:94.2%。1h nmr(400mhz,cdcl3)δ7.77(dd,j=3.0,5.6hz,2h),7.70(dd,j=3.0,5.6hz,2h),7.47(dd,j=1.5,7.8hz,2h),7.30
–
7.19(m,3h),6.35(s,1h),5.39(s,2h),4.67(s,2h),4.09
–
3.94(m,2h),2.33(s,3h),1.56
–
1.41(m,2h),1.33
–
1.17(m,4h),0.94
–
0.81(m,3h).
13
c nmr(100mhz,cdcl3)δ13.8,20.5,22.3,28.5,30.7,34.4,48.7,72.1,119.7,123.4,127.9,128.0,129.6,131.8,134.2,137.1,137.2,145.9,146.8,167.6,173.3.
[0130]
实施例29:2-(氨基甲基)-3-(苄氧基)-1-乙基-6-甲基吡啶-4(1h)-酮(12b)的制备
[0131]
将化合物11b(4.51g,11mmol)溶于26ml乙醇中,加入8.6ml 5.5%水合肼,加热回流4小时,反应后减压浓缩,残渣加入25ml水中,10m naoh调节溶液ph=12,二氯甲烷萃取三次,无水硫酸钠干燥,过滤,滤液减压浓缩,柱层析纯化,洗脱剂为二氯甲烷/甲醇=20/1,得到白色固体2.11g,产率:70.7%。1h nmr(400mhz,dmso-d6)δ7.48
–
7.28(m,5h),6.16(s,1h),5.08(s,2h),4.09(q,j=7.1hz,2h),3.68(s,2h),2.32(s,3h),1.20(t,j=7.1hz,3h).
13
c nmr(100mhz,dmso-d6)δ16.0,19.7,36.5,42.7,72.5,118.4,128.3,128.7,128.9,138.3,144.6,145.0,147.1,172.7.
[0132]
实施例30:2-(氨基甲基)-3-(苄氧基)-6-甲基-1-丙基吡啶-4(1h)-酮(12c)的制备
[0133]
以中间体化合物11c,合成方法同化合物12a,得12c为黄色固体2.80g,产率:57.8%。1h nmr(400mhz,dmso-d6)δ7.45
–
7.28(m,5h),6.15(s,1h),5.09(s,2h),4.01
–
3.91(m,2h),3.67(s,2h),2.31(s,3h),1.58(dq,j=7.4,14.9hz,2h),0.88(t,j=7.4hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.2,19.9,24.0,36.7,49.1,72.5,118.3,128.3,128.7,129.0,138.2,144.8,147.3,172.7.
[0134]
实施例31:2-(氨基甲基)-3-(苄氧基)-1-丁基-6-甲基吡啶-4(1h)-酮(12d)的制备
[0135]
以中间体化合物11d,合成方法同化合物12a,得12d为黄色固体1.84g,产率:65.5%。1h nmr(400mhz,dmso-d6)δ7.45
–
7.28(m,5h),6.14(s,1h),5.09(s,2h),4.07
–
3.90(m,2h),3.66(s,2h),2.32(s,3h),1.55(dt,j=8.4,15.8hz,2h),1.32(h,j=7.3hz,2h),0.91(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.9,19.8,19.9,32.6,36.7,47.4,72.5,118.3,128.3,128.7,129.0,138.2,144.8,147.2,172.6.
[0136]
实施例32:2-(氨基甲基)-3-(苄氧基)-6-甲基-1-戊基吡啶-4(1h)-酮(12e)的制备
[0137]
以中间体化合物11e,合成方法同化合物12a,得12e为黄色固体2.15g,产率:98.6%。1h nmr(400mhz,cdcl3)δ7.30
–
7.15(m,5h),6.22(s,1h),5.16(s,2h),3.90
–
3.80(m,2h),3.57(s,2h),2.19(s,3h),1.45(p,j=7.5hz,2h),1.21(pd,j=4.3,5.3,7.9hz,4h),0.79(t,j=6.9hz,3h).
13
c nmr(100mhz,cdcl3)δ13.8,20.1,22.1,28.6,30.5,36.7,47.9,72.7,119.0,128.1,128.3,129.3,137.4,143.3,144.8,146.3,173.4.
[0138]
实施例33:n-((3-(苄氧基)-1-乙基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)庚酰胺(16a)的制备
[0139]
以中间体化合物12b(400mg,1.5mmol)置于25ml干燥的双口瓶中,氮气保护下加入
8ml无水dmf,0℃下滴加庚酰氯(0.3ml,2.3mmol),然后加无水吡啶(0.6ml,7.0mmol),室温反应6小时。反应完毕加入8ml水淬灭反应。二氯甲烷萃取三次,无水硫酸钠干燥,过滤,滤液减压浓缩,柱层析纯化,洗脱剂为二氯甲烷/甲醇=30/1,得16a为白色油状液体455mg,产率:57.9%。1h nmr(400mhz,cdcl3)δ7.30(s,5h),6.27(s,2h),5.18(s,2h),4.28(d,j=5.8hz,2h),4.02
–
3.80(m,2h),2.26(s,3h),2.10
–
1.90(m,2h),1.49(q,j=7.1hz,3h),1.31
–
1.11(m,9h),0.83(t,j=6.7hz,3h).
13
c nmr(100mhz,cdcl3)δ14.1,15.7,20.1,22.5,25.4,29.0,31.5,34.2,36.0,43.6,72.8,119.3,128.4,128.5,129.2,137.2,140.6,146.1,146.5,173.2.
[0140]
实施例34:n-((3-(苄氧基)-1-乙基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)己酰胺(16b)的制备
[0141]
以中间体化合物12b(400mg,1.5mmol)和己酰氯(0.4ml,2.3mmol)原料,合成方法同化合物16a,得16b为淡黄色油状液体333mg,产率:60.0%。1h nmr(400mhz,cdcl3)δ7.34(s,5h),6.32(s,1h),5.24(s,2h),4.30(d,j=5.8hz,2h),3.96(d,j=5.6hz,2h),2.37
–
2.13(m,3h),2.01(t,j=7.5hz,2h),1.52(p,j=7.6hz,2h),1.24(dq,j=6.2,6.6,14.2hz,7h),0.87(d,j=11.6hz,3h).
13
c nmr(100mhz,cdcl3)δ13.9,15.7,20.0,22.4,25.1,31.4,34.2,36.1,43.6,72.8,119.4,128.6,129.3,137.3,140.6,146.3,173.2.
[0142]
实施例35:n-((3-(苄基氧基)-1-乙基-6-甲基-4-氧基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(16c)的制备
[0143]
以中间体化合物12b(400mg,1.5mmol)和对甲氧基苯甲酰氯(0.3ml,2.3mmol)原料,合成方法同化合物16a,得16c为淡黄色油状液体601mg,产率:93.3%。1h nmr(400mhz,cdcl3)δ7.68(dd,j=6.9,8.7hz,2h),7.47
–
7.19(m,5h),6.88(d,j=7.9hz,2h),6.35(t,j=6.8hz,1h),5.30(d,j=6.6hz,2h),4.54(d,j=5.3hz,2h),4.07(d,j=7.0hz,2h),3.84(s,3h),2.30(s,3h),1.27(t,j=6.9hz,3h).
13
c nmr(100mhz,cdcl3)δ15.8,20.1,35.0,43.7,55.4,73.1,113.6,119.5,125.7,128.5,129.2,137.3,140.4,146.3,162.4,166.8,173.1.
[0144]
实施例36:n-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-4-(三氟甲基)苯甲酰胺(16d)的制备
[0145]
以中间体化合物12c(300mg,1.3mmol)和对三氟甲基苯甲酰氯(0.3ml,2.0mmol)原料,合成方法同化合物16a,得16d为淡黄色油状液体420mg,产率:70.0%。1h nmr(400mhz,dmso-d6)δ9.02(s,1h),8.07(d,j=8.1hz,2h),7.84(d,j=8.3hz,2h),7.47
–
7.23(m,5h),6.24(s,1h),5.14(s,2h),4.57(d,j=4.6hz,2h),3.86
–
3.74(m,2h),2.34(s,3h),1.59(dq,j=7.0,14.6hz,2h),0.83(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso)δ11.1,19.9,23.9,35.5,49.8,72.6,118.7,125.7(q,3j
c-f
=3.7hz),128.3,128.6,128.9,138.1,139.8,146.6,147.7,165.7,172.5.
[0146]
实施例37:n-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(16e)的制备
[0147]
以中间体化合物12c(350mg,1.3mmol)和对甲氧基苯甲酰氯(0.3ml,2.0mmol)原料,合成方法同化合物16a,得16e为淡黄色油状液体311mg,产率:56.9%。1h nmr(300mhz,cdcl3)δ7.66(d,j=8.7hz,2h),7.33(dd,j=7.9,21.0hz,5h),6.88(d,j=8.7hz,2h),6.69
(s,1h),6.38(s,1h),5.31(s,2h),4.52(d,j=5.6hz,2h),3.97
–
3.87(m,2h),3.85(d,j=6.0hz,3h),2.30(s,3h),1.71
–
1.48(m,2h),0.95(t,j=7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ10.8,20.3,24.3,35.1,50.1,55.4,73.1,113.7,119.4,125.7,128.4,128.6,129.1,137.2,140.8,146.2,146.6,162.4,166.7,173.0.
[0148]
实施例38:n-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-3-甲氧基苯甲酰胺(16f)的制备
[0149]
以中间体化合物12c(350mg,1.2mmol)和间甲氧基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16f为白色油状液体377mg,产率:74.7%。1h nmr(400mhz,cdcl3)δ7.41
–
7.17(m,8h),7.03(d,j=8.6hz,1h),6.32(s,1h),5.39
–
5.20(m,2h),4.53(d,j=5.8hz,2h),3.83(s,3h),2.29(d,j=3.2hz,3h),1.62(h,j=7.3hz,2h),0.96(t,j=7.3hz,3h).
13
c nmr(100mhz,cdcl3)δ10.8,20.2,24.3,35.2,50.0,55.5,73.0,112.5,118.1,119.4,128.4,128.5,129.0,129.4,134.9,137.2,140.3,146.4,159.7,167.1,173.1.
[0150]
实施例39:n-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-2-甲氧基苯甲酰胺(16g)的制备
[0151]
以中间体化合物12c(350mg,1.2mmol)和邻甲氧基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16g为白色油状液体377mg,产率:74.7%。1h nmr(400mhz,cdcl3)δ8.41(s,1h),8.10(d,j=9.4hz,1h),7.37(ddt,j=6.7,13.2,46.5hz,5h),7.02(t,j=7.5hz,1h),6.88(d,j=8.3hz,1h),6.36(s,1h),5.37(s,2h),4.56(s,2h),4.09(s,2h),3.66(s,3h),2.31(s,3h),1.83
–
1.56(m,2h),0.99(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso)δ6.1,15.6,19.7,30.5,45.4,51.0,68.3,106.6,115.0,115.9,116.3,123.4,123.7,124.1,127.3,128.5,132.8,136.4,141.2,141.9,152.8,160.4,168.6.
[0152]
实施例40:n-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-2-(4-氟苯基)乙酰胺(16h)的制备
[0153]
以中间体化合物12c(350mg,1.3mmol)和2-(4-氟苯基)乙酰氯(0.3ml,2.0mmol)原料,合成方法同化合物16a,得16h为淡黄色油状液体413mg,产率:75.4%。1h nmr(400mhz,cdcl3)δ7.36
–
7.26(m,5h),7.23(dd,j=5.4,8.5hz,2h),6.96(d,j=17.3hz,2h),6.28(s,1h),5.18(s,2h),4.32(d,j=5.7hz,2h),3.86
–
3.72(m,2h),3.46(s,2h),2.25(s,3h),1.54(dt,j=7.5,16.1hz,2h),0.89(t,j=7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ10.7,20.2,24.2,34.8,42.1,50.0,72.9,115.3(d,2j
c-f
=21.5hz),119.3,128.3,128.5,128.9,130.7(d,3j
c-f
=7.8hz),137.3,140.5,146.5,160.7(d,1j
c-f
=246.3hz),170.8,173.1.
[0154]
实施例41:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)己酰胺(16i)的制备
[0155]
以中间体化合物12d(350mg,1.2mmol)和己酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16i为淡黄色油状液体385mg,产率:80.0%。1h nmr(300mhz,cdcl3)δ7.35(s,5h),6.33(s,1h),5.27(s,2h),4.27(s,2h),4.00
–
3.74(m,2h),2.29(s,3h),2.04
–
1.93(m,2h),1.51(dq,j=7.0,7.5,14.4hz,4h),1.41
–
1.17(m,6h),0.90(dt,j=7.2,18.2hz,6h).
13
c nmr(75mhz,cdcl3)δ13.7,13.9,19.7,20.2,22.3,25.2,31.4,33.0,34.4,36.2,48.4,72.8,119.5,128.4,128.6,129.4,137.4,140.7,146.0,146.3,173.0,173.1.
[0156]
实施例42:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-(三氟甲基)苯甲酰胺(16j)的制备
[0157]
以中间体化合物12d(350mg,1.2mmol)和对三氟甲基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16j为淡黄色油状液体391mg,产率:69.2%1h nmr(400mhz,cdcl3)δ8.52(s,1h),8.10(d,j=7.2hz,2h),7.64(d,j=7.4hz,2h),7.24(d,j=6.9hz,5h),6.17(s,1h),5.07(s,2h),4.58(s,2h),4.04
–
3.70(m,2h),2.24(s,3h),1.57(s,2h),1.33(d,j=7.3hz,2h),0.89(t,j=7.2hz,3h).
13
c nmr(100mhz,cdcl3)δ13.6,19.8,20.0,32.9,35.5,48.7,73.1,119.1,125.3(q,3j
c-f
=3.8hz),128.0,128.2,128.3,128.4,137.0,140.3,146.7,166.1,173.0.
[0158]
实施例43:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(16k)的制备
[0159]
以中间体化合物12d(350mg,1.2mmol)和对甲氧基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16k为淡黄色油状液体313mg,产率:60.0%。1h nmr(300mhz,cdcl3)δ7.66(d,j=8.8hz,2h),7.42
–
7.23(m,5h),6.88(d,j=8.8hz,2h),6.68(s,1h),6.35(s,1h),5.31(s,2h),4.52(d,j=5.7hz,2h),4.01
–
3.91(m,2h),3.84(s,3h),2.30(s,3h),1.56(p,j=7.7,8.4hz,2h),1.38(dt,j=7.3,15.0hz,2h),0.92(t,j=7.3hz,3h).
13
c nmr(75mhz,cdcl3)δ13.7,19.8,20.2,33.1,35.2,48.6,55.4,73.1,113.6,119.4,125.7,128.4,128.6,129.1,129.1,137.2,140.7,146.3,146.5,162.4,166.7,173.0.
[0160]
实施例44:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-3-甲氧基苯甲酰胺(16l)的制备
[0161]
以中间体化合物12d(350mg,1.2mmol)和间甲氧基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16l为白色油状液体385mg,产率:88.6%。1h nmr(400mhz,cdcl3)δ7.44(s,1h),7.35
–
7.22(m,7h),7.02(dt,j=2.0,7.4hz,1h),6.27(s,1h),5.23(s,2h),4.54(d,j=5.6hz,2h),3.97
–
3.87(m,2h),3.82(s,3h),2.25(s,3h),1.55(p,j=7.9,8.5hz,2h),1.36(dt,j=7.4,15.0hz,2h),0.90(t,j=7.3hz,3h).
13
c nmr(100mhz,cdcl3)δ13.7,19.8,20.2,33.0,35.3,48.6,55.5,73.0,112.4,118.1,119.4,128.3,128.5,129.0,129.4,134.9,137.2,140.3,146.4,159.7,167.1,173.1.
[0162]
实施例45:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-2-甲氧基苯甲酰胺(16m)的制备
[0163]
以中间体化合物12d(350mg,1.2mmol)和邻甲氧基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16m为白色油状液体374mg,产率:71.7%。1h nmr(400mhz,cdcl3)δ8.42(t,j=5.9hz,1h),8.12(dd,j=1.8,7.8hz,1h),7.53
–
7.22(m,6h),7.04(t,j=7.4hz,1h),6.90(d,j=8.3hz,1h),6.39(s,1h),5.40(s,2h),4.58(d,j=5.6hz,2h),4.15(s,2h),3.68(s,3h),2.33(s,3h),1.60(p,j=7.7,8.2hz,2h),1.44(h,j=7.3hz,2h),0.97(t,j=7.3hz,3h).
13
c nmr(100mhz,cdcl3)δ13.8,19.8,20.4,33.3,35.3,48.7,55.8,73.0,111.3,119.8,120.6,121.1,128.1,128.4,128.8,132.0,133.2,137.6,141.1,145.9,146.7,157.6,165.2,173.3.
[0164]
实施例46:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-2-(4-氟苯基)乙酰胺(16n)的制备
[0165]
以中间体化合物12d(350mg,1.3mmol)和2-(4-氟苯基)乙酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16n为淡黄色油状液体413mg,产率:75.4%。1h nmr(300mhz,cdcl3)δ7.37
–
7.26(m,5h),7.26
–
7.18(m,2h),6.96(t,j=8.7hz,2h),6.88(s,1h),6.28(s,1h),5.18(s,2h),4.31(d,j=5.7hz,2h),3.90
–
3.74(m,2h),3.45(s,2h),2.25(s,3h),1.49(p,j=8.3,9.0hz,2h),1.39
–
1.27(m,2h),0.91(t,j=7.2hz,3h).
13
c nmr(75mhz,cdcl3)δ13.6,19.7,20.2,33.0,34.9,42.1,48.5,73.0,115.3(d,2j
c-f
=21.5hz),119.4,128.3,128.5,128.9,128.9,130.7(d,3j
c-f
=8.9hz),137.3,140.6,146.5,160.7(d,1j
c-f
=246.3hz),170.8,173.0.
[0166]
实施例47:n-((3-(苄氧基)-6-甲基-4-氧代-1-戊基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(16o)的制备
[0167]
以中间体化合物12d(350mg,1.3mmol)和对甲氧基苯甲酰氯(0.3ml,1.8mmol)原料,合成方法同化合物16a,得16o为淡黄色油状液体320mg,产率:54.9%。1h nmr(400mhz,cdcl3)δ7.67(d,j=8.7hz,2h),7.31(ddd,j=7.0,17.4,24.9hz,5h),6.88(d,j=8.8hz,2h),6.33(s,1h),5.30(s,2h),4.52(d,j=5.7hz,2h),4.02
–
3.89(m,2h),3.84(s,3h),2.29(s,3h),1.62
–
1.50(m,2h),1.38
–
1.23(m,4h),0.87(t,j=6.7hz,3h).
13
c nmr(100mhz,cdcl3)δ13.9,20.3,22.3,28.6,30.8,35.2,48.7,55.4,73.0,113.6,119.5,125.7,128.4,128.5,129.1,129.2,137.3,140.6,146.3,162.4,166.7,173.1.
[0168]
实施例48:n-((3-(苄氧基)-1-乙基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯磺酰胺(16p)的制备
[0169]
以中间体化合物12b(300mg,1.1mmol)和对甲氧基苯磺酰氯(372mg,1.7mmol)原料,合成方法同化合物16a,得16p为白色油状液体221mg,产率:43.3%。1h nmr(400mhz,cdcl3)δ7.77(d,j=8.8hz,2h),7.36(t,j=7.3hz,1h),7.31
–
7.21(m,3h),7.06(dd,j=8.0,23.3hz,4h),6.33(s,1h),5.15(s,2h),4.03(q,j=7.0hz,2h),3.94(s,3h),3.85(d,j=6.8hz,2h),2.30(s,3h),1.32
–
1.23(m,3h).
13
c nmr(100mhz,cdcl3)δ15.6,20.0,38.5,43.1,55.7,72.7,114.3,119.5,128.6,129.4,130.5,136.8,137.8,146.9,163.2.
[0170]
实施例49:n-((3-(苄氧基)-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯磺酰胺(16q)的制备
[0171]
以中间体化合物12c(350mg,1.2mmol)和对甲氧基苯磺酰氯(372mg,1.7mmol)原料,合成方法同化合物16a,得16q为白色油状液体275mg,产率:60.2%。1h nmr(400mhz,cdcl3)δ7.81
–
7.70(m,2h),7.37(t,j=7.4hz,1h),7.31
–
7.23(m,2h),7.14
–
6.98(m,4h),6.40(s,1h),5.18(s,2h),3.94(s,3h),3.92
–
3.82(m,4h),2.32(s,3h),1.60(q,j=7.7hz,2h),0.98(t,j=7.4hz,3h).
13
c nmr(100mhz,cdcl3)δ10.7,20.2,24.1,38.6,49.6,55.7,72.8,114.3,128.6,128.6,129.3,129.4,130.5,136.8,150.4,163.1.
[0172]
实施例50:n-((3-(苄氧基)-1-丁基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯磺酰胺(16r)的制备
[0173]
以中间体化合物12d(350mg,1.2mmol)和对甲氧基苯磺酰氯(372mg,1.8mmol)原料,合成方法同化合物16a,得16r为白色油状液体305mg,产率:66.8%。1h nmr(400mhz,cdcl3)δ7.81(d,j=8.9hz,2h),7.35
–
7.22(m,4h),7.04(dd,j=8.0,24.1hz,4h),6.27(s,1h),5.09(s,2h),3.92(s,5h),3.85(s,2h),2.25(s,3h),1.57
–
1.34(m,4h),0.96(t,j=
7.3hz,3h).
13
c nmr(100mhz,cdcl3)δ13.7,19.7,20.1,32.8,38.6,47.9,55.7,72.7,114.2,119.3,128.5,129.2,129.4,130.7,136.9,137.9,146.9,163.0,172.9.
[0174]
实施例51:n-((1-乙基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)庚酰胺(17a)的制备
[0175]
将中间体化合物16a(455mg,0.81mmol)置于单口反应瓶中,用10ml甲醇溶解,加入45.5mg pd/c(l0%钯碳),抽真空,充氢气置换三次,室温反应12h。反应完毕,反应液用硅藻土过滤,收集滤液减压浓缩得到固体,固体用甲醇重结晶,得17a为白色固体249mg,产率:70.6%,纯度:99.82%,熔点:145.3-146.0℃。1h nmr(400mhz,cdcl3)δ6.29(s,1h),4.63(s,2h),4.24(s,2h),2.37(s,3h),2.21(t,j=7.6hz,2h),1.77
–
1.47(m,2h),1.27(s,9h),0.86(t,j=5.9hz,3h).
13
c nmr(100mhz,cdcl3)δ14.1,15.9,20.3,22.5,25.5,28.9,31.5,34.5,36.4,43.8,114.5,130.2,144.5,146.9,169.7,173.5.hrms(esi):calcd for c
16h26
n2o3[m+h]
+
=295.2016,found[m+h]
+
=295.2016.
[0176]
实施例52:n-((1-乙基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)己酰胺(17b)的制备
[0177]
以中间体化合物16b,合成方法同化合物17a,得17b为白色固体90mg,产率:52.6%,纯度:99.89%,熔点:151.5-152.1℃。1h nmr(300mhz,dmso-d6)δ8.20(s,1h),6.13(s,1h),4.40(d,j=5.1hz,2h),3.95(q,j=7.0hz,2h),2.34(s,3h),2.10(t,j=7.4hz,2h),1.49(p,j=7.4hz,2h),1.23(dt,j=6.8,14.0hz,7h),0.85(t,j=7.0hz,3h).
13
c nmr(100mhz,dmso-d6)δ14.3,15.8,19.9,22.3,25.3,31.4,34.1,35.4,43.1,113.5,128.7,145.6,146.6,169.9,172.8.hrms(esi):calcd for c
15h24
n2o3[m+h]
+
=281.1860,found[m+h]
+
=281.1868.
[0178]
实施例53:n-((1-乙基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(17c)的制备
[0179]
以中间体化合物16c,合成方法同化合物17a,得17c为白色固体321mg,产率:72.5%,纯度:96.92%,熔点:231.7-232.6℃。1h nmr(400mhz,dmso-d6)δ8.65(s,1h),7.89(d,j=8.2hz,2h),6.97(d,j=8.2hz,2h),6.14(s,1h),4.62(d,j=4.4hz,2h),4.01(q,j=6.8hz,2h),3.80(s,3h),2.35(s,3h),1.22(t,j=6.9hz,3h).
13
c nmr(100mhz,dmso-d6)δ15.9,19.9,35.1,43.3,55.8,113.4,113.9,126.5,128.4,129.8,145.7,146.8,162.2,166.3,169.9.hrms(esi):calcd for c
17h20
n2o4[m+h]
+
=317.1496,found[m+h]
+
=317.1494.
[0180]
实施例54:n-((3-羟基-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-4-(三氟甲基)苯甲酰胺(17d)的制备
[0181]
以中间体化合物16d,合成方法同化合物17a,得17d为白色固体284mg,产率:84.6%,纯度:96.18%,熔点:256.4-257.5℃。1h nmr(400mhz,dmso-d6)δ9.06(s,1h),8.10(d,j=8.1hz,2h),7.83(d,j=8.3hz,2h),6.15(s,1h),4.67(d,j=4.8hz,2h),3.97
–
3.77(m,2h),2.35(s,3h),1.64(dq,j=7.3,14.9hz,2h),0.87(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.2,20.0,23.9,35.3,49.6,113.4,125.7(q,3j
c-f
=3.8hz),128.0,128.9,138.1,145.9,146.9,165.7,169.9.hrms(esi):calcd for c
18h19
f3n2o3[m+h]
+
=369.1421,found[m+h]
+
=369.1416.
[0182]
实施例55:n-((3-羟基-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(17e)的制备
[0183]
以中间体化合物16e,合成方法同化合物17a,得17e为白色固体284mg,产率:84.6%,纯度:97.28%,熔点:246.6-246.9℃。1h nmr(400mhz,dmso-d6)δ8.67(t,j=4.7hz,1h),7.90(d,j=8.9hz,2h),6.97(d,j=8.9hz,2h),6.14(s,1h),4.64(d,j=4.8hz,2h),3.90
–
3.83(m,2h),3.80(s,3h),2.34(s,3h),1.62(dq,j=7.2,14.9hz,2h),0.85(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.2,20.0,24.0,35.0,49.6,55.8,113.4,113.9,126.5,128.6,129.8,145.8,146.7,162.1,166.3,169.9.hrms(esi):calcd for c
18h22
n2o4[m+h]
+
=331.1652,found[m+h]
+
=331.1649.
[0184]
实施例56:n-((3-羟基-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-3-甲氧基苯甲酰胺(17f)的制备
[0185]
以中间体化合物16f,合成方法同化合物17a,得17f为白色固体190mg,产率:64.5%,纯度:99.89%,熔点:208.1-209.2℃。1h nmr(400mhz,dmso-d6)δ8.84(t,j=4.8hz,1h),7.54
–
7.44(m,2h),7.36(t,j=7.9hz,1h),7.09(dd,j=1.9,8.2hz,1h),6.14(s,1h),4.65(d,j=4.9hz,2h),3.91
–
3.83(m,2h),3.79(s,3h),2.34(s,3h),1.63(dq,j=7.3,15.0hz,2h),0.86(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.2,20.0,23.9,35.1,49.6,55.8,112.9,113.4,117.8,120.3,128.4,129.8,135.6,145.9,146.8,159.6,166.5,169.9.hrms(esi):calcd for c
18h22
n2o4[m+h]
+
=331.1652,found[m+h]
+
=331.1654.
[0186]
实施例57:n-((3-羟基-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-2-甲氧基苯甲酰胺(17g)的制备
[0187]
以中间体化合物16g,合成方法同化合物17a,得17g为白色固体211mg,产率:71.8%,纯度:98.89%,熔点:200.9-202.2℃。1h nmr(400mhz,dmso-d6)δ8.69(t,j=5.5hz,1h),7.81(dd,j=1.8,7.7hz,1h),7.48(ddd,j=1.8,7.4,9.1hz,1h),7.13(d,j=8.3hz,1h),7.04(t,j=7.1hz,1h),6.13(s,1h),4.65(d,j=5.6hz,2h),4.08
–
3.96(m,2h),3.88(s,3h),2.34(s,3h),1.66(dq,j=7.3,14.9hz,2h),0.94(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.2,20.2,23.9,35.0,49.6,56.5,112.6,113.8,121.1,122.5,129.6,131.0,133.1,145.6,146.7,157.5,165.2,169.8.hrms(esi):calcd for c
18h22
n2o4[m+h]
+
=331.1652,found[m+h]
+
=331.1650.
[0188]
实施例58:2-(4-氟苯基)-n-((3-羟基-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)乙酰胺(17h)的制备
[0189]
以中间体化合物16h,合成方法同化合物17a,得17h为白色固体274mg,产率:84.1%,纯度:99.84%,熔点:200.5-201.2℃。1h nmr(400mhz,dmso-d6)δ8.52(s,1h),7.29(dd,j=5.6,8.7hz,2h),7.12(t,j=8.9hz,2h),6.13(s,1h),4.41(d,j=5.1hz,2h),3.82
–
3.71(m,2h),3.45(s,2h),2.32(s,3h),1.55(dq,j=7.4,15.0hz,2h),0.80(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.1,20.0,23.9,34.4,41.4,49.4,113.5,115.2(d,2j
c-f
=21.2hz),128.7,131.2(d,3j
c-f
=8.1hz),132.8(d,4j
c-f
=3.0hz),145.8,146.7,160.3(d,1j
c-f
=242.8hz),169.9,170.6.hrms(esi):calcd for c
18h21
fn2o3[m+h]
+
=333.1609,found[m+h]
+
=333.1606.
[0190]
实施例59:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)己酰
胺(17i)的制备
[0191]
以中间体化合物16i,合成方法同化合物17a,得17i为白色固体242mg,产率:81.9%,纯度:99.56%,熔点:214.7-215.8℃。1h nmr(400mhz,dmso-d6)δ8.17(t,j=4.9hz,1h),6.12(s,1h),4.39(s,2h),3.90
–
3.73(m,2h),2.33(s,3h),2.10(t,j=7.4hz,2h),1.53(ddt,j=7.4,14.6,29.6hz,4h),1.41
–
1.15(m,6h),0.92(t,j=7.3hz,3h),0.85(t,j=7.0hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.9,14.3,19.8,20.0,22.3,25.3,31.4,32.6,34.1,35.4,47.8,113.4,128.7,145.8,146.6,169.9,172.8.hrms(esi):calcd for c
17h28
n2o3[m+h]
+
=309.2173,found[m+h]
+
=309.2171.
[0192]
实施例60:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-(三氟甲基)苯甲酰胺(17j)的制备
[0193]
以中间体化合物16j,合成方法同化合物17a,得17j为白色固体233mg,产率:73.5%,纯度:99.80%,熔点:252.1-253.1℃。1h nmr(400mhz,dmso-d6)δ9.07(s,1h),8.10(d,j=8.1hz,2h),7.84(d,j=8.3hz,2h),6.15(s,1h),4.68(d,j=4.7hz,2h),4.04
–
3.72(m,2h),2.35(s,3h),1.59(p,j=8.6hz,2h),1.29(h,j=7.4hz,2h),0.83(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.8,19.8,32.6,35.3,48.1,113.4,123.0,125.6(q,3j
c-f
=3.6hz),125.7,128.0,128.9,131.6(q,2j
c-f
=32.2hz),138.0,145.9,146.9,165.7,169.9.hrms(esi):calcd for c
19h21
f3n2o3[m+h]
+
=383.1577,found[m+h]
+
=383.1571.
[0194]
实施例61:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(17k)的制备
[0195]
以中间体化合物16k,合成方法同化合物17a,得17k为白色固体240mg,产率:76.8%,纯度:96.01%,熔点:254.6-253.8℃。1h nmr(400mhz,dmso-d6)δ8.66(t,j=4.5hz,1h),7.90(d,j=8.8hz,2h),6.97(d,j=8.8hz,2h),6.14(s,1h),4.64(d,j=4.7hz,2h),3.97
–
3.85(m,2h),3.80(s,3h),2.34(s,3h),1.57(p,j=8.3,8.8hz,2h),1.28(dt,j=7.4,14.8hz,2h),0.81(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.8,19.8,20.0,32.6,35.0,48.0,55.8,113.4,113.8,126.4,128.5,129.8,145.8,146.8,162.1,166.2,169.9.hrms(esi):calcd for c
19h24
n2o4[m+h]
+
=345.1809,found[m+h]
+
=345.1805.
[0196]
实施例62:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-3-甲氧基苯甲酰胺(17l)的制备
[0197]
以中间体化合物16l,合成方法同化合物17a,得17l为白色固体257mg,产率:84.8%,纯度:98.27%,熔点:213.0-214.3℃。1h nmr(400mhz,dmso-d6)δ8.84(t,j=4.7hz,1h),7.53
–
7.45(m,2h),7.36(t,j=7.9hz,1h),7.09(dd,j=2.9,7.8hz,1h),6.14(s,1h),4.65(d,j=4.8hz,2h),3.96
–
3.83(m,2h),3.79(s,3h),2.34(s,3h),1.65
–
1.47(m,2h),1.28(h,j=7.4hz,2h),0.82(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.8,19.8,20.0,32.6,35.2,48.1,55.8,112.9,113.4,117.8,120.3,128.3,129.8,135.6,145.8,146.8,159.6,166.5,169.9.hrms(esi):calcd for c
19h24
n2o4[m+h]
+
=345.1809,found[m+h]
+
=345.1805.
[0198]
实施例63:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-2-甲氧基苯甲酰胺(17m)的制备
[0199]
以中间体化合物16m,合成方法同化合物17a,得17m为白色固体257mg,产率:
84.8%,纯度:98.03%,熔点:185.6-187.4℃。1h nmr(400mhz,dmso-d6)δ8.68(s,1h),7.82(dd,j=1.8,7.7hz,1h),7.52
–
7.45(m,1h),7.13(d,j=8.2hz,1h),7.04(t,j=7.8hz,1h),6.14(s,1h),4.66(d,j=5.6hz,2h),4.14
–
3.99(m,2h),3.88(s,3h),2.34(s,3h),1.61(p,j=8.5hz,2h),1.37(h,j=7.3hz,2h),0.92(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.9,19.8,20.1,32.5,35.0,48.1,56.5,112.6,113.9,121.1,122.4,129.6,131.0,133.1,145.5,146.7,157.5,165.2,169.8.hrms(esi):calcd for c
19h24
n2o4[m+h]
+
=345.1809,found[m+h]
+
=345.1805.
[0200]
实施例64:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-2-(4-氟苯基)乙酰胺(17n)的制备
[0201]
以中间体化合物16n,合成方法同化合物17a,得17n为白色固体285mg,产率:84.8%,纯度:99.03%,熔点:191.7-192.7℃。1h nmr(400mhz,dmso-d6)δ8.50(s,1h),7.34
–
7.24(m,2h),7.17
–
7.07(m,2h),6.13(s,1h),4.39(s,2h),3.94
–
3.73(m,2h),3.45(s,2h),2.33(s,3h),1.53(p,j=7.6,8.1hz,2h),1.26(h,j=7.4hz,2h),0.86(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.8,19.7,20.0,32.5,34.4,41.4,47.8,113.5,115.2(d,2j
c-f
=21.2hz),128.6,131.3(d,3j
c-f
=8.1hz),132.8(d,4j
c-f
=3.0hz),145.8,146.7,160.3(d,1j
c-f
=242.9hz),169.9,170.6.hrms(esi):calcd for c
19h23
fn2o3[m+h]
+
=347.1765,found[m+h]
+
=347.1762.
[0202]
实施例65:n-((3-羟基-6-甲基-4-氧代-1-戊基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯甲酰胺(17o)的制备
[0203]
以中间体化合物16o,合成方法同化合物17a,得17o为白色固体183mg,产率:72.9%,纯度:95.26%,熔点:182.3-183.6℃。1h nmr(400mhz,dmso-d6)δ8.67(s,1h),7.90(d,j=8.8hz,2h),6.97(d,j=8.8hz,2h),6.14(s,1h),4.64(d,j=4.6hz,2h),3.80(s,3h),2.34(s,3h),1.58(s,2h),1.21(s,4h),0.78(t,j=6.8hz,3h).
13
c nmr(100mhz,dmso-d6)δ14.3,20.0,22.1,28.7,30.4,35.0,48.2,55.8,113.4,113.8,126.4,128.5,129.8,145.8,146.8,162.1,166.2,169.9.hrms(esi):calcd for c
20h26
n2o4[m+h]
+
=359.1965,found[m+h]
+
=359.1955.
[0204]
实施例66:n-((1-乙基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯磺酰胺(17p)的制备
[0205]
以中间体化合物16p,合成方法同化合物17a,得17p为白色固体131mg,产率:77.6%,纯度:99.87%,熔点:222.1-223.1℃。1h nmr(400mhz,dmso-d6)δ7.80(d,j=8.8hz,2h),7.15(d,j=8.8hz,2h),6.10(s,1h),4.05(s,4h),3.86(s,3h),2.33(s,3h),1.21(t,j=6.5hz,3h).
13
c nmr(100mhz,dmso-d6)δ15.7,19.8,38.0,42.7,56.1,113.5,114.9,126.3,129.4,131.6,146.0,146.6,162.8,169.8.hrms(esi):calcd for c
16h20
n2o5s[m+h]
+
=353.1166,found[m+h]
+
=353.1162.
[0206]
实施例67:n-((3-羟基-6-甲基-4-氧代-1-丙基-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯磺酰胺(17q)的制备
[0207]
以中间体化合物16q,合成方法同化合物17a,得17q为白色固体173mg,产率:78.6%,纯度:95.17%,熔点:184.4-185.9℃。1h nmr(400mhz,dmso-d6)δ7.80(d,j=8.9hz,2h),7.15(d,j=8.9hz,2h),6.09(s,1h),4.02(s,2h),3.95
–
3.88(m,2h),3.86(s,3h),2.32
(s,3h),1.61(dq,j=7.2,14.9hz,2h),0.88(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ11.0,19.9,23.7,38.1,49.0,56.1,113.4,114.9,126.3,129.4,131.6,146.2,146.6,162.8,169.8.hrms(esi):calcd for c
17h22
n2o5s[m+h]
+
=367.1322,found[m+h]
+
=367.1320.
[0208]
实施例68:n-((1-丁基-3-羟基-6-甲基-4-氧代-1,4-二氢吡啶-2-基)甲基)-4-甲氧基苯磺酰胺(17r)的制备
[0209]
以中间体化合物16r,合成方法同化合物17a,得17r为白色固体225mg,产率:73.8%,纯度:96.59%,熔点:167.3-168.9℃。1h nmr(400mhz,dmso-d6)δ7.80(d,j=8.8hz,2h),7.15(d,j=8.9hz,2h),6.09(s,1h),4.02(s,2h),3.98
–
3.90(m,2h),3.86(s,3h),2.32(s,3h),1.56(p,j=8.6hz,2h),1.28(dt,j=9.1,18.1hz,2h),0.91(t,j=7.3hz,3h).
13
c nmr(100mhz,dmso-d6)δ13.9,19.7,19.9,32.4,38.1,47.5,56.1,113.4,114.9,126.3,129.4,131.6,146.1,146.6,162.8,169.8.hrms(esi):calcd for c
18h24
n2o5s[m+h]
+
=381.1479,found[m+h]
+
=381.1474.
[0210]
实施例69:化合物的抗生物膜活性测定
[0211]
实验方法:先用细胞级的dmso配制化合物母液(100mm),再用abtgc培养基((b培养基(0.1%mgcl2,0.1%cacl2,0.1%fecl3)中添加10%a10,0.2%葡萄糖,0.2%bd酪蛋白氨基酸))将待测母液化合物稀释到一定浓度备用;取过夜培养的细菌,并测定过夜细菌的od
600
,将细菌稀释od
600
为0.05后加入到96孔板中,设置加药组、blank组(只加培养基)、control组(只加细菌以及阳性对照组),96孔板周边用200μl的液体培养基封边以防挥发导致的边缘效应,每组数据设置6个复孔;种好的细菌板,采用保鲜膜的方式将96孔板包好,防止培养液挥发,放置于37℃培养箱中静置培养24小时;取出96孔板,每孔用移液枪将菌液吸出;每孔用150μl的pbs清洗洗涤3次,再晾干;晾干后的96孔板,每孔加入150μl甲醇室温固定30min;吸走甲醇,晾干,每孔加入150μl的0.1%结晶紫染色15min;吸出结晶紫,用200μl的pbs缓冲溶液洗涤,直至没有紫色为止;晾干后,每孔加入150μl 33%冰醋酸溶解结晶紫,并放置于微量摇床上震荡摇匀后测od
570
;利用spss数据分析软件对数据进行分析,并计算其抗生物膜活性。实验结果:抗生物膜活性结果见表1。
[0212]
表1实施例制备的羟基吡啶酮衍生物和阳性对照阿奇霉素的抗生物膜抑制活性
[0213][0214]
从表1中发现了10个具有生物膜抑制活性的15b,17e,17f,17i,17j,17k,17l,17m,17o,17r衍生物,其中17k呈现最优的生物膜抑制活性(ic
50
=4.53μm),且抗生物膜活性优于阳性对照阿奇霉素。
[0215]
实施例70:细菌最小抑菌浓度(mic)实验检测
[0216]
实验方法:首先用细胞级的dmso配制化合物母液(100mm),再用abtgc培养基(b培养基(0.1%mgcl2,0.1%cacl2,0.1%fecl3)中添加10%a10,0.2%葡萄糖,0.2%bd酪蛋白氨基酸.)将待测母液化合物稀释到一定浓度备用;取过夜培养的细菌,并测定过夜细菌的od
600
,将细菌稀释od
600
为0.05后加入到96孔板中,设置加药组、blank组(只加培养基)、control组(只加细菌以及阳性对照组),每组数据设置6个复孔,放置于37℃培养箱中静置培养24小时,将96孔板从培养箱中取出,用酶标仪测定每孔细菌的od
600
,检测化合物的杀菌能力。
[0217]
实验结果:为了进一步探讨该系列衍生物与抗生素联用是否具有协同作用,我们首先检测了该系列衍生物的mic,具体如表1所示,从表1中发现该系列衍生物的mic均》512μm,验证了该系列衍生物在低于512μm时没有杀菌能力。
[0218]
实施例71:抗生素联用mic检测
[0219]
实验方法:首先以细胞级的dmso配制化合物母液(100mm),再用abtgc培养基(b培养基(0.1%mgcl2,0.1%cacl2,0.1%fecl3)中添加10%a10,0.2%葡萄糖,0.2%bd酪蛋白氨基酸.)将待测母液化合物稀释到40μm备用;取过夜培养的细菌,并测定过夜细菌的od
600
,将细菌稀释od
600
为0.05后加入到96孔板中,其中含药物的细菌培养液为100μl(浓度为40μm),已经稀释的细菌100μl,同时设置blank组(只加培养基)、control组(只加细菌)以及实验组(不同的抗生素浓度),每组数据设置6个复孔,放置于37℃培养箱中静置培养24小时;
将96孔板从培养箱中取出,用酶标仪测定每孔细菌的od
600
,检测化合物的杀菌能力。
[0220]
实验结果:为了进一步验证该系列衍生物与抗生素联用可以提升抗生素的敏感性,我们以生物膜抑制活性最优的10个化合物15b,17e,17f,17i,17j,17k,17l,17m,17o,17r与临床治疗铜绿假单胞菌常用抗生素以及铜绿假单胞菌标准模式菌株pao1(atcc 15692)、暨南大学附属医院临床分离的铜绿假单胞菌耐药菌株(1121,1167,fb,1129)(铜绿假单胞菌1121、铜绿假单胞菌1167、铜绿假单胞菌fb、铜绿假单胞菌1129均在文献“liu j,hou j s,li y b,et al.novel 2-substituted3-hydroxy-1,6-dimethylpyridin-4(1h)-ones as dual-acting biofilm inhibitors of pseudomonas aeruginosa[j].journal of medicinal chemistry,2020,(63):10921-10945.”中公开)联用,所有实验结果如表2所示,该系列衍生物15b,17e,17f,17i,17j,17k,17l,17m,17o,17r在浓度为20μm与临床常用的铜绿假单胞感染类抗菌剂喹诺酮类抗生素(环丙沙星)、氨基糖苷类抗生素(妥布霉素)和粘菌素等联合用药,增强抗生素对于耐药菌的敏感性,提升了抗生素对不同临床耐药菌株的抗菌能力。
[0221]
表2实施例制备的羟基吡啶酮衍生物15b,17e,17f,17i,17j,17k,17l,17m,17o,17r(20μm)与抗生素环丙沙星、妥布霉素和粘菌素联用的mic
[0222]
[0223][0224]
/:仅加抗生素的对照
[0225]
实施例72:斑马鱼细菌感染模型检测
[0226]
实验方法:
[0227]
美蓝液(1g/ml):称取10.0g,溶解于10ml斑马鱼饲养净水系统水;斑马鱼胚胎培养水(egg water):斑马鱼饲养净水系统水100ml添加1ml美蓝液(1g/ml)混合,配制斑马鱼胚胎培养水(egg water);苯基硫脲(ptu)(3%):称取0.30g,溶解于10ml斑马鱼饲养净水系统水。使用浓度为0.003%,用斑马鱼胚胎培养水稀释;三卡因(10mg/ml):称取1.0g,溶解于10ml斑马鱼饲养净水系统水。使用浓度为0.1mg/ml,用斑马鱼胚胎培养水稀释。使用ab野生型斑马鱼进行实验,并在水温为28℃条件下斑马鱼培养。细菌培养物在37℃振荡(200rpm)下生长24小时。铜绿假单胞菌培养物生长到od
600
=1.2后,将细菌稀释至接种密度为od
600
=0.1,加入不同浓度的苗头化合物17k(10μm和20μm)与细菌培养物在37℃振荡(200rpm)生长24小时。第二天,细菌以3000rpm的速度离心10分钟,并以所需的浓度重新悬浮在鱼水中。将3天龄(dpf)的胚胎斑马鱼,首先浸泡在含40μg/ml三卡因的ptu胚胎培养液中。5min后胚胎鱼进入麻醉状态。此时将鱼移至载玻片上摆好,用无菌锋利的手术刀片在鱼尾部切断鱼尾。断尾的幼鱼迅速放回无三卡因的ptu胚胎液中清洗3次(目的是除去麻醉残液)并继续在ptu胚胎液中培养。将20个受伤胚胎立即浸入含有细菌悬浮液(鱼水作为对照)的培养皿中,然后将其分配到6孔板(corning/costar,ny,美国)中。记录不同培养时间的生存率并在leica荧光显微镜下观察并拍照。
[0228]
实验结果:化合物17k对斑马鱼细菌感染模型实验结果如图1所示,化合物17k在浓度为20μm时有效提升了斑马鱼的存活率,进一步验证了17k具有进一步成药性的优势。
[0229]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1