一种针对VEGF和TGF-β的双功能蛋白及其应用的制作方法
一种针对vegf和tgf
‑
β
的双功能蛋白及其应用
技术领域
1.本发明涉及生物医药技术领域,特别涉及一种针对vegf和tgf
‑
β的双功能蛋白及其应用。
背景技术:
2.随着生物医药的不断发展,抗pd
‑
1/pd
‑
l1单克隆抗体的免疫疗法在癌症治疗领域取得了重大突破,例如转移性黑色素瘤、膀胱癌和非小细胞肺癌等在内的超过15种癌症均得到了更有效的治疗。然而,抗pd
‑
1/pd
‑
l1单克隆抗体也只对20
‑
30%的癌症病人有效,而且很多病人即使最开始对治疗有响应,也会很快发展出耐药性。同时,越来越多的证据表明,很多癌症都能发展出多种策略来逃避治疗,因而需要开发针对癌症的新型免疫治疗手段。
3.研究表明,肿瘤微环境是免疫治疗的关键因素,转化生长因子tgf
‑
β是肿瘤微环境中的一个重要细胞因子,作为一个多功能的细胞因子,tgf
‑
β不但在细胞的生长、分化及迁移等生理活动中都起着重要作用,而且在癌症的发展中也有着多重功能。在肿瘤发生阶段,tgf
‑
β能抑制肿瘤细胞的繁殖并促进它们的分化与凋亡,随着肿瘤进展,由于tgf
‑
β受体表达的缺失或下游信号分子的突变,肿瘤对tgf
‑
β变得不敏感,这时tgf
‑
β的作用转变为促进肿瘤的进展。通过文献记载,在大部分癌症中,tgf
‑
β呈过表达状态,它不但能促进肿瘤细胞的表皮间质转换(emt)、浸润及转移,还在调节适应性免疫系统中起着关键作用。tgf
‑
β不但能抑制ifn
‑
γ的表达、限制th1细胞的分化、减弱cd8+效应t细胞和nk细胞的激活与细胞毒性、抑制中央记忆型t细胞的发育,更重要的是,tgf
‑
β能诱导treg(一种免疫抑制性cd4+t细胞细胞,在多种癌症中都是较差预后的一个指标)的分化,此外还有文献记载,血清中高水平的tgf
‑
β与较差的预后正相关;而对pd
‑
1/pd
‑
l1抑制剂不应答的首要原因就是肿瘤微环境中高水平的tgf
‑
β。
4.目前,针对tgf
‑
β靶点的药物开发主要分为三类:1)阻碍tgf
‑
β与其受体的结合;2)阻断tgf
‑
β信号通路;3)干扰tgf
‑
β的生成。但是,现有的靶向tgf
‑
β信号通路的抑制剂是通过作用于tgf
‑
βi型受体激酶或同时抑制三个异构体的活性带来了心脏病毒性,且在临床可接受的剂量上未表现出临床有效性,所以针对靶向tgf
‑
β信号通路的抗体药物仍然在不断的研究中。
5.血管内皮细胞生长因子vegf是肿瘤血管生成过程中的一个主要调节器,也是另一个在肿瘤微环境中起重要作用的蛋白分子,它和tgf
‑
β在肿瘤微环境环境中有很多共同点,例如促进血管生成、促进转移、抑制免疫应答、其高水平表达与较差预后正相关等。靶向vegf的药物主要有贝伐珠单抗(bevacizumab)和阿柏西普(vegf trap),其中贝伐珠单抗最早被fda批准,并被广泛应用于结直肠癌、肺癌及肾癌的临床治疗。然而,贝伐珠单抗适用症较少,副作用较大,疗效存在争议且容易引起耐药性,因而有很大的改进空间。研究发现:对vegf靶向抗体贝伐珠单抗无应答的胶质母细胞瘤和her2阴性的乳腺癌病人,肿瘤中tgf
‑
β水平更高;在临床前模型及一些临床实验中,联用vegf和tgf
‑
β抑制剂,效果比单用更好。
6.在肿瘤微环境中,包括t细胞和nk细胞在内的多种免疫细胞,以及包括vegf和tgf
‑
β在内的多种信号因子都参与了对肿瘤的应答。被肿瘤细胞利用于逃避的机制从来都不是单一的,所以针对单一靶标的治疗往往效果有限,而联用针对多个靶标的治疗通常能取得更好的疗效。在机制上,vegf和tgf
‑
β都有促进肿瘤血管生成及抑制免疫应答的作用,而通常认为,tgf
‑
β信号通路能促进vegf的表达;然而,也有一些研究表明,vegf也能通过pi3k/akt信号通路调节tgf
‑
β1的表达。因而,tgf
‑
β和vegf能通过多种通路互相调节,如果能同时封闭这两个信号因子,就可能更有利于肿瘤微环境向抑瘤方向改变。在国内,很多企业研发的针对pd
‑
l1和tgf
‑
β的双功能蛋白、针对pd
‑
1和tgf
‑
β的双功能蛋白已进入临床阶段,但仍没有公开针对vegf和tgf
‑
β的双功能蛋白药物进入临床阶段的消息,所以为了满足更多癌症患者的需求,急需研发一种针对vegf和tgf
‑
β的双功能蛋白药物。
技术实现要素:
7.为了解决现有技术中存在的上述问题,本发明提供了一种通过抗vegf单克隆抗体部分靶向vegf高表达的肿瘤微环境,同时引入tgf
‑
β受体部分,同时中和肿瘤微环境中的vegf和tgf
‑
β,抑制肿瘤血管生成,解除免疫抑制,从而实现更好的抑瘤效果的针对vegf和tgf
‑
β的双功能蛋白药物。
8.本发明具体技术方案如下:
9.本发明提供了一种针对vegf和tgf
‑
β的双功能蛋白,包括能够与vegf抗原特异性结合的抗vegf单克隆抗体、连接肽linker和tgf
‑
βrii胞外结构域多肽,所述抗vegf单克隆抗体通过所述连接肽linker与所述tgf
‑
βrii胞外结构域多肽连接。
10.进一步的,所述抗vegf单克隆抗体包括两条重链和两条轻链,所述tgf
‑
βrii胞外结构域多肽通过所述连接肽linker与所述抗vegf单克隆抗体的两条所述重链或两条所述轻链的c末端或n末端连接。
11.进一步的,所述重链的氨基酸序列为seq id no:1,所述轻链的氨基酸序列为seq id no:2;所述tgf
‑
βrii胞外结构域多肽的氨基酸序列为seq id no:3。
12.进一步的,所述连接肽linker的通式为(ggggs)n;
13.其中,所述n为1
‑
6的整数;
14.优选的,所述n为4。
15.进一步的,所述双功能蛋白选自以下任意一种:
16.蛋白eb
‑
1,其由所述tgf
‑
βrii胞外结构域多肽通过所述连接肽linker与抗vegf单克隆抗体的两条所述重链的c末端连接构成,所述蛋白eb
‑
1的重链的氨基酸序列为seq id no:4,其轻链的氨基酸序列为seq id no:2;
17.蛋白eb
‑
2,其由所述tgf
‑
βrii胞外结构域多肽通过所述连接肽linker与抗vegf单克隆抗体的两条所述重链的n末端连接构成,所述蛋白eb
‑
2的重链的氨基酸序列为seq id no:5,其轻链的氨基酸序列为seq id no:2;
18.蛋白eb
‑
3,其由所述tgf
‑
βrii胞外结构域多肽通过所述连接肽linker与抗vegf单克隆抗体的两条所述轻链的c末端连接构成,所述蛋白eb
‑
3的重链的氨基酸序列为seq id no:1,其轻链的氨基酸序列为seq id no:6;
19.蛋白eb
‑
4,其由所述tgf
‑
βrii胞外结构域多肽通过所述连接肽linker与抗vegf单
克隆抗体的两条所述轻链的n末端连接构成,所述蛋白eb
‑
4的重链的氨基酸序列为seq id no:1,其轻链的氨基酸序列为seq id no:7。
20.本发明还提供了一种核苷酸分子,所述核苷酸分子编码权利要求1
‑
5任一项所述的针对vegf和tgf
‑
β的双功能蛋白。
21.本发明还提供了一种重组dna表达载体,所述重组dna表达载体包含权利要求7所述的核苷酸分子。
22.本发明还提供了一种转染所述的重组dna表达载体的宿主细胞,所述宿主细胞包括原核、酵母或哺乳动物细胞。
23.本发明还提供了所述的针对vegf和tgf
‑
β的双功能蛋白在制备治疗肿瘤疾病或纤维化疾病药物中的应用;
24.所述肿瘤疾病选自结直肠癌、非小细胞肺癌、乳腺癌、胰腺癌、肾癌、胃癌、肝癌、卵巢癌、黑色素瘤或神经胶质瘤;
25.所述纤维化疾病包括肝纤维化和肺纤维化。
26.本发明还提供了所述的针对vegf和tgf
‑
β的双功能蛋白和免疫调节药物或抗炎症因子药物联合用于制备治疗肿瘤疾病药物中的应用;所述免疫调节药物选自抗pd
‑
1单克隆抗体、抗pd
‑
l1单克隆抗体、抗ctla4单克隆抗体、抗4
‑
1bb单克隆抗体、抗ox
‑
40单克隆抗体、抗pd
‑
l2单克隆抗体、抗lag
‑
3单克隆抗体、抗tigit单克隆抗体、抗gitr单克隆抗体、抗icos单克隆抗体、抗pvr单克隆抗体、抗pvrig单克隆抗体、抗vista单克隆抗体或抗tims单克隆抗体;
27.所述抗炎症因子药物选自:抗tnfa单克隆抗体、抗il
‑
1β单克隆抗体或il
‑
1受体拮抗剂、抗il
‑
6r单克隆抗体、抗il
‑
8单克隆抗体、重组il
‑
15或il
‑
15激动剂;
28.优选的,所述肿瘤疾病选自结直肠癌、非小细胞肺癌、乳腺癌、胰腺癌、肾癌、胃癌、肝癌、卵巢癌、黑色素瘤或神经胶质瘤。
29.本发明的有益效果如下:本发明提供的抗vegf和抗tgf
‑
β双特异性抗体能够靶向vegf高表达的肿瘤微环境的同时,减少tgf
‑
β抑制剂的副作用,该双特异性抗体不但可以单用,还可以联用现有的免疫治疗药物如pd
‑
1/pd
‑
l1抑制剂,均能够有效提高肿瘤疾病治疗效果,肿瘤疾病包括但不局限于下列:结直肠癌,非小细胞肺癌、乳腺癌、胰腺癌、肾癌、胃癌、肝癌、卵巢癌、黑色素瘤或神经胶质瘤等实体瘤。
附图说明
30.图1为本发明实施例2中一种针对vegf和tgf
‑
β的双功能蛋白的构型图一;
31.图2为本发明实施例2中一种针对vegf和tgf
‑
β的双功能蛋白的构型图二;
32.图3为本发明实施例2中一种针对vegf和tgf
‑
β的双功能蛋白的构型图三;
33.图4为本发明实施例2中一种针对vegf和tgf
‑
β的双功能蛋白的构型图四;
34.图5为本发明实施例4中ptse载体的质粒图谱;
35.图6为本发明实施例5中针对vegf和tgf
‑
β的双功能蛋白分子与vegf结合能力图;
36.图7为本发明实施例5中针对vegf和tgf
‑
β的双功能蛋白分子与tgf
‑
β1结合能力图;
37.图8为本发明实施例5中针对vegf和tgf
‑
β的双功能蛋白分子与tgf
‑
β3结合能力
图;
38.图9为本发明实施例5中针对vegf和tgf
‑
β的双功能蛋白分子与tgf
‑
β2结合能力图;
39.图10为本发明实施例6中针对vegf和tgf
‑
β的双功能蛋白分子对vegf促增殖作用的抑制图;
40.图11为本发明实施例7中针对vegf和tgf
‑
β的双功能蛋白分子抑制vegf对细胞迁移的影响图;
41.图12为本发明实施例8中针对vegf和tgf
‑
β的双功能蛋白分子抑制细胞表面tgf
‑
β1的释放情况图;
42.图13为本发明实施例9中针对vegf和tgf
‑
β的双功能蛋白分子(单独给药)在小鼠结肠癌模型中的抑瘤效果图;
43.图14为本发明实施例10中针对vegf和tgf
‑
β的双功能蛋白分子(联合抗pd
‑
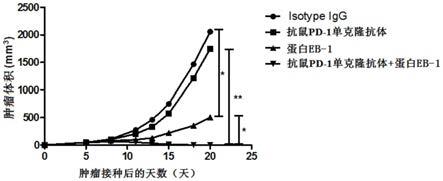
1抗体给药)在小鼠结肠癌模型中的抑瘤效果图。
具体实施方式
44.为了更加容易理解本发明,描述实施例之前,先对本发明某些技术和科学术语作以下说明:
45.本文所使用的术语“tgf
‑
β(transforming growth factor
‑
β)”,即转化生长因子
‑
β,其是属于一组新近发现的调节细胞生长和分化的tgf
‑
β超家族。
46.本文所使用的术语“vegf(vascular endothelial growth factor)”,即血管内皮生长因子,早期亦称作血管通透因子(英文:vascular permeability factor,简称:vpf),是血管内皮细胞特异性的肝素结合生长因子(heparin
‑
binding growth factor),可在体内诱导血管新生(induce angiogenesis in vivo)。该因子能有效的促进血管再生,对医疗研究有重要作用。
47.本文所使用的术语“tgf
‑
βrii胞外结构域多肽”,即tgf
‑
β的ii型受体的胞外结构域。
48.本文所使用的术语“抗体”,包含全抗体及其任一抗原结合片段,抗体包括鼠源抗体、人源化抗体、双特异抗体或嵌合抗体,抗体也可以是fab、f(ab)2、fv或scfv(单链抗体),抗体可以是天然存在的抗体也可以是通过改变(例如突变、缺失、置换等)的抗体。
49.本文所使用的术语“可变区”和“恒定区”,即为抗体重链和轻链靠近n段的序列区为可变区(v区),靠近c段的其余氨基酸序列相对稳定,为恒定区(c区),可变区包括3个互补性决定区(cdr)和4个框架区(fr),每条轻链可变区和重链可变区均有3个cdr区和4个fr区组成,重链的3个cdr区分别通过hcdr1、hcdr2和hcdr3表示,轻链的3个cdr区分别通过lcdr1、lcdr2和lcdr3表示。
50.术语“cho细胞”为中国仓鼠卵巢细胞(chinese hamster ovary cell);术语“hek293细胞”为人胚肾293e细胞(human embryonic kidney 293e cell),术语“ns0细胞”为小鼠ns0胸腺瘤细胞。
51.下面结合以下实施例对本发明作进一步详细说明。
52.实施例1
53.本发明实施例1构建了一种针对vegf和tgf
‑
β的双功能蛋白,包括能够与vegf抗原特异性结合的抗vegf单克隆抗体、连接肽linker和tgf
‑
βrii胞外结构域多肽,抗vegf单克隆抗体通过连接肽linker与tgf
‑
βrii胞外结构域多肽连接。抗vegf单克隆抗体包括两条重链和两条轻链,tgf
‑
βrii胞外结构域多肽通过连接肽linker与抗vegf单克隆抗体的两条重链或两条轻链的c末端或n末端连接。
54.实施例2
55.本发明实施例2在实施例1的基础上,进一步的限定了抗vegf单克隆抗体,这里限定的抗vegf单克隆抗体为以vegf为靶点的单克隆抗体,本发明优选为贝伐珠单抗,其重链的氨基酸序列为seq id no:1,轻链的氨基酸序列为seq id no:2;tgf
‑
βrii胞外结构域多肽的氨基酸序列为seq id no:3。
56.所述连接肽linker的通式为(ggggs)n;所述n为4。
57.双特异性抗体选自以下任意一种:
58.蛋白eb
‑
1,其由tgf
‑
βrii胞外结构域多肽通过连接肽linker与抗vegf单克隆抗体的两条重链的c末端连接构成,蛋白eb
‑
1的重链的氨基酸序列为seq id no:4,其轻链的氨基酸序列为seq id no:2,构型如图1所示;
59.蛋白eb
‑
2,其由tgf
‑
βrii胞外结构域多肽通过连接肽linker与抗vegf单克隆抗体的两条重链的n末端连接构成,蛋白eb
‑
2的重链的氨基酸序列为seq id no:5,其轻链的氨基酸序列为seq id no:2,构型如图2所示;
60.蛋白eb
‑
3,其由tgf
‑
βrii胞外结构域多肽通过连接肽linker与抗vegf单克隆抗体的两条轻链的c末端连接构成,蛋白eb
‑
3的重链的氨基酸序列为seq id no:1,其轻链的氨基酸序列为seq id no:6,构型如图3所示;
61.蛋白eb
‑
4,其由tgf
‑
βrii胞外结构域多肽通过连接肽linker与抗vegf单克隆抗体的两条轻链的n末端连接构成,蛋白eb
‑
4的重链的氨基酸序列为seq id no:1,其轻链的氨基酸序列为seq id no:7,构型如图4所示。
62.具体序列如下:
63.seq id no:1(抗vegf单克隆抗体的重链的氨基酸序列)
64.evqlvesggglvqpggslrlscaasgytftnygmnwvrqapgkglewvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyycakyphyygsshwyfdvwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk;
65.seq id no:2(抗vegf单克隆抗体的轻链的氨基酸序列)
66.diqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapkvliyftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec;
67.seq id no:3(tgf
‑
βrii胞外结构域多肽的氨基酸序列)
68.gipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrk
ndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd;
69.seq id no:4(蛋白eb
‑
1的重链的氨基酸序列)
70.evqlvesggglvqpggslrlscaasgytftnygmnwvrqapgkglewvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyycakyphyygsshwyfdvwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgaggggsggggsggggsggggsgipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd;
71.seq id no:5(蛋白eb
‑
2的重链的氨基酸序列)
72.gipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpdggggsggggsggggsggggsevqlvesggglvqpggslrlscaasgytftnygmnwvrqapgkglewvgwintytgeptyaadfkrrftfsldtskstaylqmnslraedtavyycakyphyygsshwyfdvwgqgtlvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk;
73.seq id no:6(蛋白eb
‑
3的轻链的氨基酸序列)
74.diqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapkvliyftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgecggggsggggsggggsggggsgipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd;
75.seq id no:7(蛋白eb
‑
4的轻链的氨基酸序列)
76.gipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpdggggsggggsggggsggggsdiqmtqspsslsasvgdrvtitcsasqdisnylnwyqqkpgkapkvliyftsslhsgvpsrfsgsgsgtdftltisslqpedfatyycqqystvpwtfgqgtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
77.实施例3
78.本发明实施例3提供了一种核苷酸分子,核苷酸分子编码针对vegf和tgf
‑
β的双功能蛋白。
79.本发明还提供了一种重组dna表达载体,重组dna表达载体包含上述的核苷酸分子。
80.本发明还提供了一种转染重组dna表达载体的宿主细胞,宿主细胞包括原核、酵母
或哺乳动物细胞。
81.本发明还提供了针对vegf和tgf
‑
β的双功能蛋白在制备治疗肿瘤疾病或纤维化疾病药物中的应用;
82.肿瘤疾病选自结直肠癌、非小细胞肺癌、乳腺癌、胰腺癌、肾癌、胃癌、肝癌、卵巢癌、黑色素瘤或神经胶质瘤;
83.纤维化疾病包括肝纤维化和肺纤维化。
84.本发明还提供了针对vegf和tgf
‑
β的双功能蛋白和免疫调节药物或抗炎症因子药物联合用于制备治疗肿瘤疾病药物中的应用;免疫调节药物选自抗pd
‑
1单克隆抗体、抗pd
‑
l1单克隆抗体、抗ctla4单克隆抗体、抗4
‑
1bb单克隆抗体、抗ox
‑
40单克隆抗体、抗pd
‑
l2单克隆抗体、抗lag
‑
3单克隆抗体、抗tigit单克隆抗体、抗gitr单克隆抗体、抗icos单克隆抗体、抗pvr单克隆抗体、抗pvrig单克隆抗体、抗vista单克隆抗体或抗tims单克隆抗体;
85.优选的,免疫调节药物为抗pd
‑
1单克隆抗体,抗pd
‑
1单克隆抗体选自nivolumab、pembrolizumab、特瑞普利单抗、信迪利单抗、替雷利珠单抗、卡瑞利珠单抗或专利号为zl201510312910.8,专利名称为一种抗pd
‑
1的单克隆抗体及其获得方法的专利文件中公开的dfpd1
‑
9、dfpd1
‑
10、dfpd1
‑
11、dfpd1
‑
12或dfpd1
‑
13,这里不仅限于上述对抗pd
‑
1单克隆抗体的限定,还可以为其他商业化用于实验中的抗pd
‑
1单克隆抗体,只要靶点为pd
‑
1的单克隆抗体均可以,在此不具体限定其他的抗pd
‑
1单克隆抗体。
86.本发明中,抗pd
‑
1单克隆抗体优选为专利号为zl201510312910.8,专利名称为一种抗pd
‑
1的单克隆抗体及其获得方法的专利文件中公开的dfpd1
‑
9、dfpd1
‑
10、dfpd1
‑
11、dfpd1
‑
12或dfpd1
‑
13。
87.抗炎症因子药物选自:抗tnfa单克隆抗体、抗il
‑
1β单克隆抗体或il
‑
1受体拮抗剂、抗il
‑
6r单克隆抗体、抗il
‑
8单克隆抗体、重组il
‑
15或il
‑
15激动剂;
88.优选的,所述肿瘤疾病选自结直肠癌、非小细胞肺癌、乳腺癌、胰腺癌、肾癌、胃癌、肝癌、卵巢癌、黑色素瘤或神经胶质瘤。
89.实施例4针对vegf和tgf
‑
β的双功能蛋白分子表达载体的构建
90.(1)按照实施例1并参考图1
‑
4中双功能蛋白的结构形式设计相应的基因序列,例如实施例2,选择ptse作为表达载体,将抗vegf单克隆抗体工程细胞株中扩增出的重链(seq id no:1)和轻链(seq id no:2)的编码基因分别克隆至载体ptse载体(结构如图5所示,其制备过程参见cn103525868a说明书第3页第[0019]段),然后将tgf
‑
βrii胞外结构域多肽的编码基因(由南京金斯瑞生物科技有限公司合成)通过同源重组的方式加上连接肽linker克隆到抗vegf单克隆抗体工程细胞株的重链或轻链的一端,转化到top感受态(汇天东方,货号ht702
‑
03),测序正确后得到能表达的4种表达载体,质粒分别命名为蛋白eb
‑
1、蛋白eb
‑
2、蛋白eb
‑
3或蛋白eb
‑
4的载体,同时,将tgf
‑
βrii胞外结构域多肽的编码基因通过同源重组的方式加上连接肽linker克隆至装有igg1型的fc段的表达载体(同样选择ptse作为表达载体)的c端,得到能表达一个对照分子的载体,命名为052trap,052trap的序列如seq id no:8所示。利用无内毒素大提试剂盒(购买于康为世纪生物科技有限公司,cw2104)进行质粒大提,具体操作步骤按照试剂盒提供的说明书进行操作,最终测定质粒浓度后,于
‑
20℃保存质粒。
[0091]
seq id no:8(052trap的氨基酸序列)
[0092]
gaasepkssdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgaggggsggggsggggsggggsgipphvqksvnndmivtdnngavkfpqlckfcdvrfstcdnqkscmsncsitsicekpqevcvavwrkndenitletvchdpklpyhdfiledaaspkcimkekkkpgetffmcscssdecndniifseeyntsnpd;
[0093]
(2)按实施例2中的结构搭配,瞬时转染hek293e细胞(购自中国医学科学院基础医学研究所,货号为gnhu43),进行双功能蛋白表达;同时表达两个对照分子贝伐珠单抗和052trap。使用akta仪器通过protein a亲和柱纯化获得4个双功能蛋白(命名为蛋白eb
‑
1、蛋白eb
‑
2、蛋白eb
‑
3和蛋白eb
‑
4)和两个对照分子(命名为贝伐珠单抗和052trap),同时使用bca试剂盒(购买自:北京汇天东方科技有限公司,货号:bca0020)进行蛋白浓度测定,结果显示蛋白eb
‑
3和蛋白eb
‑
4产量很低(<1mg/l)。
[0094]
实施例5针对vegf和tgf
‑
β的双功能蛋白分子与vegf或tgf
‑
β1/2/3的结合实验
[0095]
用ph9.6的碳酸盐缓冲液包被vegf、tgf
‑
β1、tgf
‑
β2或tgf
‑
β3,100ng/孔/100μl,在4℃的温度条件下过夜包被。用300μl/孔pbst洗涤五次,再加入1%bsa
‑
pbst在室温下封闭1h,加入5倍梯度稀释的蛋白eb
‑
1或蛋白eb
‑
2的双功能蛋白,并加入对照分子052trap或贝伐珠单抗作为对照,室温孵育1h。用300μl/孔pbst洗涤五次,再加入用1%bsa
‑
pbst 1:10000稀释的anti
‑
human fc
‑
hrp,在室温孵育1h。洗涤后tmb显色试剂盒显色,100μl/孔,室温显色8min,然后用2mh2so4终止显色。在450nm/630nm下读数,采用graphpad prism 5.0作图软件做出抗原
‑
抗体结合曲线图,如图6
‑
图8所示,并计算对应的ec50值,具体数据如下(所有分子与tgf
‑
β2均无结合,图略):
[0096][0097]
为了进一步检测双功能蛋白分子与tgf
‑
β2的结合情况,用ph9.6的碳酸盐缓冲液包被蛋白eb
‑
1、蛋白eb
‑
2、052trap或贝伐珠单抗,1μg/孔/100μl,在4℃的温度条件下过夜包被。用300μl/孔pbst洗涤五次,再加入1%bsa
‑
pbst在室温下封闭1h,加入5倍梯度稀释的tgf
‑
β2分子,室温孵育1h。用300μl/孔pbst洗涤五次,再加入用1%bsa
‑
pbst 1:1000稀释的生物素标记的tgf
‑
β2抗体,室温孵育1h。用300μl/孔pbst洗涤五次,再加入用1%bsa
‑
pbst 1:5000稀释的streptavidin
‑
hrp,室温孵育30min。洗涤后tmb显色试剂盒显色,100μl/孔,室温显色8min,然后用2mh2so4终止显色。在450nm/630nm下读数,采用graphpad prism 5.0作图软件做出抗原抗体结合曲线图,如图9所示,并计算对应的ec50值,具体数据如下:
[0098]
克隆052trap贝伐珠单抗蛋白eb
‑
1蛋白eb
‑
2ec50(ng/ml)11.7na21.126.0
[0099]
实验结果显示,tgf
‑
βrii胞外结构域多肽与包被在elisa板上的tgf
‑
β2无结合,但能与溶液中的tgf
‑
β2相结合。蛋白eb
‑
1和蛋白eb
‑
2与三个tgf
‑
β都能很好的结合,其ec50值
与阳性对照分子052trap基本一致。蛋白eb
‑
1和蛋白eb
‑
2与vegf也能很好地结合,其中蛋白eb
‑
1与贝伐珠单抗的ec50值基本一致,都要低于蛋白eb
‑
2的ec50值。说明tgf
‑
βrii胞外结构域多肽在双功能蛋白分子上的位置对同tgf
‑
β的亲和力影响不大,但不同的位置对同vegf的亲和力有一定影响:当tgf
‑
βrii胞外结构域多肽在双功能蛋白分子重链的n端、即与vegf结合区域相连时,可能影响到了双功能蛋白分子与vegf的结合,造成抗体eb
‑
2的亲和力低于抗体eb
‑
1和贝伐珠单抗。
[0100]
实施例6针对vegf和tgf
‑
β的双功能蛋白分子抑制vegf对细胞增殖的影响
[0101]
将huvec细胞用胰酶消化后,用基础培养基(ecm)重悬并计数,调整浓度为2
×
105cell/ml。向细胞悬液中加入vegf至终浓度为0.1μg/ml,50μl/孔加入提前包被的96孔板中。蛋白eb
‑
1、蛋白eb
‑
2、阴性对照分子052trap和阳性对照抗体贝伐珠单抗的起始作用浓度为2μg/ml,配制浓度为4μg/ml,2倍梯度稀释,共十个梯度,50μl/孔加入96孔板中,轻轻混匀。96孔板置37℃,5%co2培养箱中孵育72h。孵育结束后,加入cck
‑
8显色液,10μl/孔,置于37℃、5%co2的培养箱中孵育2
‑
4h。取出96孔细胞培养板,用酶标仪在450nm波长处读取各孔吸光度值。采用graphpad prism 5.0作图软件做出抑制曲线图,如图10所示,并计算对应的ic50值,具体数据如下:
[0102]
克隆052trap贝伐珠单抗蛋白eb
‑
1蛋白eb
‑
2ic50(μg/ml)na3.4543.1515.160
[0103]
结果显示,蛋白eb
‑
1和蛋白eb
‑
2都能抑制vegf对huvec细胞增殖的影响,蛋白eb
‑
2的抑制效果略弱于蛋白eb
‑
1。
[0104]
实施例7针对vegf和tgf
‑
β的双功能蛋白分子抑制vegf对细胞迁移的影响
[0105]
1)实验前用0.2%明胶处理cell cultrue inset套件,杯内杯外均需用明胶提前处理,37℃放置2h以上;所有样品用ecm培养基稀释。各组加样如下表所示:
[0106]
实验分组空白组实验组对照组huvec+++vegf+++抗体
‑
+
‑
对照
‑‑
+
[0107]
2)将vegf稀释至终浓度100ng/ml,将阴性对照分子052trap、阳性对照分子贝伐珠单抗和蛋白eb
‑
1、蛋白eb
‑
2分别做梯度稀释,使其终浓度分别为:3000μg/ml,30μg/ml和3μg/ml。
[0108]
3)消化并收集huvec细胞,离心后将细胞密度调整至3x105个/ml,在套件内加入150μl细胞悬液,将套件置于24孔培养板中,套件外侧加入300μlecm培养基,置于细胞培养箱中,培养2h。
[0109]
4)待细胞贴壁后,按照分组在套件外加入750μl已稀释的样品和vegf稀释液,置于37℃培养箱中培养19h。
[0110]
5)培养完成后,将24孔板从温箱中取出,吸尽杯内外培养基,每孔杯外侧加入500μl 2ug/ml的calcein
‑
am稀释液,置于37℃温箱中放置约70min后,将酶标仪激发光设置为485nm,读取530nm处的荧光值。
[0111]
6)数据处理。按下列公式进行相对迁移率的计算,使用graphpad.prism.v5.01软
件画出细胞迁移率与药物浓度间的柱状关系图。
[0112]
相对迁移率=(不同浓度抗体作用下插件外侧荧光强度值
‑
空白插件外侧荧光强度值)/(无抗体作用插件外侧荧光强度值
‑
空白插件外侧荧光强度值)
[0113]
采用graphpad prism 5.0作图软件做出抑制曲线图,如图11所示,并计算对应的ic50值,具体数据如下:
[0114]
克隆052trap贝伐珠单抗蛋白eb
‑
1蛋白eb
‑
2ic50(μg/ml)na3.4543.1515.160
[0115]
结果显示,蛋白eb
‑
1和蛋白eb
‑
2都能抑制vegf对huvec细胞迁移的影响,蛋白eb
‑
1的抑制效果强于蛋白eb
‑
2,且剂量效应明显。
[0116]
实施例8针对vegf和tgf
‑
β的双功能蛋白分子抑制细胞表面tgf
‑
β1的释放
[0117]
提前一天接种过表达tgf
‑
β1的细胞株50μl(1x106个细胞/ml)于96孔板中,并加入一系列浓度梯度稀释的蛋白eb
‑
1、蛋白eb
‑
2、阳性对照分子052trap或阴性对照分子贝伐珠单抗,各50μl孵育过夜,起始浓度均为20μg/ml,然后3倍浓度梯度稀释,每种分子均设置共7个浓度梯度。第二天加入50μl(1x106个细胞/ml)的稳定表达pai
‑
luc的mv.1.lu水貂肺上皮细胞(购买自中国医学科学院基础医学研究所细胞资源中心,货号:3111c0001ccc000195),细胞培养箱孵育6小时后测试荧光素酶活性。并采用graphpad prism 5.0作图软件做出抗体抑制tgfβ1的释放的抑制曲线,如图12所示,并计算对应的ic50值,具体数据如下:
[0118]
克隆052trap贝伐珠单抗蛋白eb
‑
1蛋白eb
‑
2ic50(ng/ml)22.12na61.5576.79
[0119]
通过时上述数据及图12表明,蛋白eb
‑
1和蛋白eb
‑
2都能有效抑制细胞表面tgfβ1的释放。
[0120]
实施例9体内抑瘤实验
[0121]
1、实验动物:
[0122]
种属品系:balb/c,雌性,小鼠;
[0123]
周龄:6
‑
8周;
[0124]
实验动物提供商:北京华阜康生物科技股份有限公司。
[0125]
2、实验方法:
[0126]
每只小鼠右侧背部皮下接种3*105个ct26肿瘤细胞(购买自atcc货号:crl
‑
2638),成瘤后动物随机分若干组,每组10只,3天后进行腹腔注射本发明中提供的蛋白eb
‑
1(10mg/kg),同时设置多个对照组:同型igg、贝伐珠单抗、052trap及贝伐珠单抗联合052trap,各蛋白用量和蛋白eb
‑
1相同。每周给药两次,每周测三次瘤体积并一周测一次体重,观察记录瘤生长情况,瘤体积超过2000mm3,断颈法处死小鼠,用手术剪镊小心分离出各个肿瘤,称重,结果见图13所示。
[0127]
通过图13可见,和同型igg对照组相比,052trap组中肿瘤生长未得到抑制,而其他各组中肿瘤体积都显著缩小。贝伐珠单抗联合052trap时,肿瘤体积比单用贝伐珠单抗时更小;而蛋白eb
‑
1的使用,使肿瘤体积比贝伐珠单抗联合052trap时更小,而与单用贝伐珠单抗时相比更是显著缩小。可见同时抑制vegf及tgf
‑
β两个靶点,能显著提高对ct26肿瘤生长的抑制,而双功能蛋白eb
‑
1的使用比贝伐珠单抗联合052trap对肿瘤的抑制效果更佳。
[0128]
实施例10体内抑瘤实验(联合抗pd
‑
1抗体)
[0129]
1、实验动物:
[0130]
种属品系:balb/c,雌性,小鼠;
[0131]
周龄:6
‑
8周;
[0132]
实验动物提供商:北京华阜康生物科技股份有限公司。
[0133]
2、设置不同给药组,具体如下:
[0134]
抗鼠pd
‑
1单克隆抗体(购买自bio x cell,货号be0146)单独给药组(10mg/kg)、蛋白eb
‑
1单独给药组(10mg/kg)、蛋白eb
‑
1联合抗鼠pd
‑
1单克隆抗体给药组(各10mg/kg)和同型igg对照组(10mg/kg);
[0135]
每只小鼠右侧背部皮下接种5*105个ct26肿瘤细胞,成瘤后动物随机分若干组,每组10只,进行腹腔注射上述给药组,每周给药两次,每周测三次瘤体积并一周测一次体重,观察记录瘤生长情况,瘤体积超过3000mm3,断颈法处死小鼠,用手术剪镊小心分离出各个肿瘤,称重。结果见图14所示。
[0136]
通过图14可见,抗鼠pd
‑
1单克隆抗体单独给药组和对照组相比,基本没有体现出抑瘤效果。蛋白eb
‑
1联合抗鼠pd
‑
1单克隆抗体给药组与抗鼠pd
‑
1单克隆抗体单独给药组和蛋白eb
‑
1单独给药组相比体现出了显著的抑瘤效果,18天时小鼠肿瘤完全消失,体现了蛋白eb
‑
1联合抗鼠pd
‑
1单克隆抗体协同作用的优越性。
[0137]
本发明不局限于上述最佳实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是具有与本技术相同或相近似的技术方案,均落在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1