家禽病原菌的检测方法与流程
1.本发明关于检测家禽病原菌的方法,特别是关于使用寡核苷酸检测家禽病原菌的方法。
背景技术:
2.家禽是世界上最大的牲畜种群。家禽生产是重要且多样化的组成部分,因为蛋和禽肉是世界上许多人口饮食的一部分。禽类疾病,特别是禽流感,不仅对亚洲经济造成很大的影响,也对人类健康构成威胁。疾病可能发生在生产周期的早期和后期,发生在生产周期的后期的话,相对对经济影响的后果更大。能够诊断并采取必要措施避免大量死亡是关键,本发明能够快速提供这种诊断。
技术实现要素:
3.本发明内容涉及用于检测家禽病原菌的寡核苷酸对。
4.于一方面,本发明涉及一种用于检测禽病原菌的寡核苷酸对,包含一第一引物与一第二引物。
5.在某些实施方案中,所述病原菌为禽白血病病毒(alv)。所述第一引物的序列如seq id no:1所示,所述第二引物的序列如seq id no:6所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽白血病病毒(alv)的完整基因组序列(genbank accession no.ku254611.1)的第5373至第5422个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:11所示。
6.在某些实施方案中,所述病原菌为禽白血病病毒(alv)。所述第一引物的序列如seq id no:2所示,所述第二引物的序列如seq id no:7所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽白血病病毒(alv)的完整基因组序列(genbank accession no.ku254611.1)的第5563至第5594个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:12所示。
7.在某些实施方案中,所述病原菌为禽白血病病毒(alv)。所述第一引物的序列如seq id no:3所示,所述第二引物的序列如seq id no:8所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽白血病病毒(alv)的完整基因组序列(genbank accession no.ku254611.1)的第6479至第6511个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:13所示。
8.在某些实施方案中,所述病原菌为禽白血病病毒(alv)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:4与seq id no:9、seq id no:4与seq id no:10、seq id no:5与seq id no:9,以及seq id no:5与seq id no:10。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽白血病病毒(alv)的完整基因组序列(genbank accession no.ku254611.1)的第6295至第6325个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:14所示。
9.在某些实施方案中,所述病原菌为新城疫病毒(ndv)。所述第一引物的序列如seq id no:15所示,所述第二引物的序列如seq id no:20所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述新城疫病毒(ndv)的完整基因组序列(genbank accession no.kc542894.1)的第7043至第7075个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:25所示。
10.在某些实施方案中,所述病原菌为新城疫病毒(ndv)。所述第一引物的序列如seq id no:16所示,所述第二引物的序列如seq id no:21所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述新城疫病毒(ndv)的完整基因组序列(genbank accession no.kc542894.1)的第14325至第14353个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:26所示。
11.在某些实施方案中,所述病原菌为新城疫病毒(ndv)。所述第一引物的序列如seq id no:17所示,所述第二引物的序列如seq id no:22所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述新城疫病毒(ndv)的完整基因组序列(genbank accession no.kc542894.1)的第14358至第14411个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:27所示。
12.在某些实施方案中,所述病原菌为新城疫病毒(ndv)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:18与seq id no:23、seq id no:18与seq id no:24、seq id no:19与seq id no:23,以及seq id no:19与seq id no:24。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述新城疫病毒(ndv)的完整基因组序列(genbank accession no.kc542894.1)的第4169至第4199个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:28所示。
13.在某些实施方案中,所述病原菌为传染性支气管炎病毒(ibv)。所述第一引物的序列如seq id no:29所示,所述第二引物的序列如seq id no:34所示。在某些实施方案中,所
no.jn022553.1)的第1204至第1243个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:54所示。
19.在某些实施方案中,所述病原菌为传染性支气管炎病毒-qx株(ibvqx)。所述第一引物的序列如seq id no:45所示,所述第二引物的序列如seq id no:50所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述传染性支气管炎病毒-qx株(ibvqx)的完整基因组序列(genbank accession no.jn022553.1)的第2619至第2668个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:55所示。
20.在某些实施方案中,所述病原菌为传染性支气管炎病毒-qx株(ibvqx)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:46与seq id no:51,以及seq id no:46与seq id no:52。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述传染性支气管炎病毒-qx株(ibvqx)的完整基因组序列(genbank accession no.jn022553.1)的第2179至第2232个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:56所示。
21.在某些实施方案中,所述病原菌为传染性支气管炎病毒-qx株(ibvqx)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:47与seq id no:51,以及seq id no:47与seq id no:52。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述传染性支气管炎病毒-qx株(ibvqx)的完整基因组序列(genbank accession no.jn022553.1)的第2204至第2232个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:56所示。
22.在某些实施方案中,所述病原菌为鸡败血支原体(mg)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:57与seq id no:62,以及seq id no:57与seq id no:65。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡败血支原体(mg)的细胞粘着素(mgc2)基因序列(genbank accession no.kj019171.1)的第172至第202个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:66所示。
23.在某些实施方案中,所述病原菌为鸡败血支原体(mg)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:61与seq id no:62,以及seq id no:61与seq id no:65。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸
探针包含一介于所述鸡败血支原体(mg)的细胞粘着素(mgc2)基因序列(genbank accession no.kj019171.1)的第151至第202个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:66所示。
24.在某些实施方案中,所述病原菌为鸡败血支原体(mg)。所述第一引物的序列如seq id no:58所示,所述第二引物的序列如seq id no:63所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡败血支原体(mg)的细胞粘着素(mgc2)基因序列(genbank accession no.kj019171.1)的第79至第114个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:67所示。
25.在某些实施方案中,所述病原菌为鸡败血支原体(mg)。所述第一引物的序列如seq id no:59所示,所述第二引物的序列如seq id no:64所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡败血支原体(mg)的细胞粘着素(mgc2)基因序列(genbank accession no.kj019171.1)的第85至第117个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:68所示。
26.在某些实施方案中,所述病原菌为鸡败血支原体(mg)。所述第一引物的序列如seq id no:60所示,所述第二引物的序列如seq id no:64所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡败血支原体(mg)的细胞粘着素(mgc2)基因序列(genbank accession no.kj019171.1)的第82至第117个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:69所示。
27.在某些实施方案中,所述病原菌为鸡滑液囊支原体(ms)。所述第一引物的序列如seq id no:70所示,所述第二引物的序列如seq id no:77所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡滑液囊支原体(ms)的可变血凝素(vlha)基因序列(genbank accession no.af035624.1)的第178至第271个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:83所示。
28.在某些实施方案中,所述病原菌为鸡滑液囊支原体(ms)。所述第一引物的序列如seq id no:71所示,所述第二引物的序列如seq id no:78所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡滑液囊支原体(ms)的可变血凝素(vlha)基因序列(genbank accession no.af035624.1)的第257至第281个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优
选实施方案中,所述寡核苷酸探针的序列如seq id no:84所示。
29.在某些实施方案中,所述病原菌为鸡滑液囊支原体(ms)。所述第一引物的序列如seq id no:72所示,所述第二引物的序列如seq id no:79所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡滑液囊支原体(ms)的可变血凝素(vlha)基因序列(genbank accession no.af035624.1)的第276至第308个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:85所示。
30.在某些实施方案中,所述病原菌为鸡滑液囊支原体(ms)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:73与seq id no:80、seq id no:74与seq id no:80,以及seq id no:75与seq id no:80。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡滑液囊支原体(ms)的可变血凝素(vlha)基因序列(genbank accession no.af035624.1)的第263至第309个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:86所示。
31.在某些实施方案中,所述病原菌为鸡滑液囊支原体(ms)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:73与seq id no:81,seq id no:74与seq id no:81,以及seq id no:75与seq id no:81。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡滑液囊支原体(ms)的可变血凝素(vlha)基因序列(genbank accession no.af035624.1)的第263至第299个核苷酸之间的13至25个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:86所示。
32.在某些实施方案中,所述病原菌为鸡滑液囊支原体(ms)。所述第一引物的序列如seq id no:76所示,所述第二引物的序列如seq id no:82所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述鸡滑液囊支原体(ms)的16s核糖体rna基因序列(genbank accessionno.mh539137.1)的第1165至第1209个核苷酸之间的13至40个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:87所示。
33.在某些实施方案中,所述病原菌为马立克氏病病毒(mdv)。所述第一引物的序列如seq id no:88所示,所述第二引物的序列如seq id no:92所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病病毒(mdv)的meq基因序列(genbank accessionno.af493555.1)的第46至第101个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:96所示。
34.在某些实施方案中,所述病原菌为马立克氏病病毒(mdv)。所述第一引物的序列如
seq id no:89所示,所述第二引物的序列如seq id no:93所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病病毒(mdv)的meq基因序列(genbank accession no.af493555.1)的第179至第211个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:97所示。
35.在某些实施方案中,所述病原菌为马立克氏病病毒(mdv)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:90与seq id no:94,以及seq id no:91与seq id no:94。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病病毒(mdv)的meq基因序列(genbank accession no.af493555.1)的第385至第430个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:98所示。
36.在某些实施方案中,所述病原菌为马立克氏病病毒(mdv)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:90与seq id no:95,以及seq id no:91与seq id no:95。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病病毒(mdv)的meq基因序列(genbank accession no.af493555.1)的第385至第420个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:98所示。
37.在某些实施方案中,所述病原菌为马立克氏病毒株sb-1(mdvsb)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:99与seq id no:104,以及seq id no:99与seq id no:107。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病毒株sb-1(mdvsb)的完整基因组序列(genbank accession no.hq840738.1)的第96099至第96140个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:109所示。
38.在某些实施方案中,所述病原菌为马立克氏病毒株sb-1(mdvsb)。所述第一引物的序列如seq id no:99所示,所述第二引物的序列如seq id no:108所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病毒株sb-1(mdvsb)的完整基因组序列(genbank accession no.hq840738.1)的第96099至第96161个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:109所示。
39.在某些实施方案中,所述病原菌为马立克氏病毒株 sb-1(mdvsb)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:102与seq id no:104、seq id no:
102与seq id no:107、seq id no:103与seq id no:104,以及seq id no:103与seq id no:107。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病毒株sb-1(mdvsb)的完整基因组序列(genbank accession no.hq840738.1)的第96108至第96140个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:109所示。
40.在某些实施方案中,所述病原菌为马立克氏病毒株sb-1(mdvsb)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:102与seq id no:108,以及seq id no:103与seq id no:108。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病毒株 sb-1(mdvsb)的完整基因组序列(genbank accession no.hq840738.1)的第96108至第96161个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:109所示。
41.在某些实施方案中,所述病原菌为马立克氏病毒株 sb-1(mdvsb)。所述第一引物的序列如seq id no:100所示,所述第二引物的序列如seq id no:105所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病毒株sb-1(mdvsb)的完整基因组序列(genbank accession no.hq840738.1)的第96129至第96168个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:110所示。
42.在某些实施方案中,所述病原菌为马立克氏病毒株sb-1(mdvsb)。所述第一引物的序列如seq id no:101所示,所述第二引物的序列如seq id no:106所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述马立克氏病毒株sb-1(mdvsb)的完整基因组序列(genbank accession no.hq840738.1)的第96460至第96499个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:111所示。
43.在某些实施方案中,所述病原菌为吐绶鸡疱疹病毒(hvt)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:112与seq id no:116,以及seq id no:112与seq id no:119。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述吐绶鸡疱疹病毒(hvt)的完整基因组序列(genbank accession no.af291866.1)的第117055至第117104个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:121所示。
44.在某些实施方案中,所述病原菌为吐绶鸡疱疹病毒(hvt)。所述第一引物的序列如seq id no:113所示,所述第二引物的序列如seq id no:117所示。在某些实施方案中,所述
寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述吐绶鸡疱疹病毒(hvt)的完整基因组序列(genbank accession no.af291866.1)的第116932至第116992个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:122所示。
45.在某些实施方案中,所述病原菌为吐绶鸡疱疹病毒(hvt)。所述第一引物的序列如seq id no:113所示,所述第二引物的序列如seq id no:120所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述吐绶鸡疱疹病毒(hvt)的完整基因组序列(genbank accession no.af291866.1)的第116932至第116980个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:122所示。
46.在某些实施方案中,所述病原菌为吐绶鸡疱疹病毒(hvt)。所述第一引物的序列如seq id no:115所示,所述第二引物的序列如seq id no:117所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述吐绶鸡疱疹病毒(hvt)的完整基因组序列(genbank accession no.af291866.1)的第116943至第116992个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:122所示。
47.在某些实施方案中,所述病原菌为吐绶鸡疱疹病毒(hvt)。所述第一引物的序列如seq id no:115所示,所述第二引物的序列如seq id no:120所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述吐绶鸡疱疹病毒(hvt)的完整基因组序列(genbank accession no.af291866.1)的第116943至第116980个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:122所示。
48.在某些实施方案中,所述病原菌为吐绶鸡疱疹病毒(hvt)。所述第一引物的序列如seq id no:114所示,所述第二引物的序列如seq id no:118所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述吐绶鸡疱疹病毒(hvt)的完整基因组序列(genbank accession no.af291866.1)的第116862至第116910个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:123所示。
49.在某些实施方案中,所述病原菌为禽流感病毒h5亚型(aiv-h5)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:124与seq id no:127、seq id no:125与seq id no:128、seq id no:125与seq id no:129、seq id no:125与seq id no:130、seq id no:126与seq id no:128、seq id no:126与seq id no:129,以及seq id no:126与seq id no:130。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽流感病毒h5亚型(aiv-h5)的血凝素(hemagglutinin,ha)基因序
列(genbank accession no.cy080507)的第1614至第1643个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列选自seq id no:131、seq id no:132、seq id no:133、seq id no:134、seq id no:135、seq id no:136,以及seq id no:137。
50.在某些实施方案中,所述病原菌为禽流感病毒h7亚型(aiv-h7)。所述第一引物的序列如seq id no:138所示,所述第二引物的序列如seq id no:142所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽流感病毒h7亚型(aiv-h7)的血凝素(ha)基因序列(genbank accession no.ky056290)的第1577至第1610个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:146所示。
51.在某些实施方案中,所述病原菌为禽流感病毒h7亚型(aiv-h7)。所述第一引物的序列如seq id no:139所示,所述第二引物的序列如seq id no:143所示。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽流感病毒h7亚型(aiv-h7)的血凝素(ha)基因序列(genbank accession no.ky056290)的第1533至第1568个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:147所示。
52.在某些实施方案中,所述病原菌为禽流感病毒h7亚型(aiv-h7)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:140与seq id no:144,以及seq id no:141与seq id no:144。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽流感病毒h7亚型(aiv-h7)的血凝素(ha)基因序列(genbank accession no.ky056290)的第1592至第1629个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:148所示。
53.在某些实施方案中,所述病原菌为禽流感病毒h7亚型(aiv-h7)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:140与seq id no:145,以及seq id no:141与seq id no:145。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽流感病毒h7亚型(aiv-h7)的血凝素(ha)基因序列(genbank accession no.ky056290)的第1592至第1647个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列如seq id no:148所示。
54.在某些实施方案中,所述病原菌为禽流感病毒h9亚型(aiv-h9)。所述第一引物与所述第二引物的序列组合选自以下组合:seq id no:149与seq id no:152、seq id no:150与seq id no:152,以及seq id no:151与seq id no:152。在某些实施方案中,所述寡核苷酸对进一步包含一寡核苷酸探针,所述寡核苷酸探针包含一介于所述禽流感病毒h9亚型
(aiv-h9)的血凝素(ha)基因序列(genbank accession no.mk559860.1)的第1518至第1558个核苷酸之间的13至30个碱基对的寡核苷酸、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子。在某些优选实施方案中,所述寡核苷酸探针的序列选自seq id no:153、seq id no:154、seq id no:155、seq id no:156以及seq id no:157。
附图说明
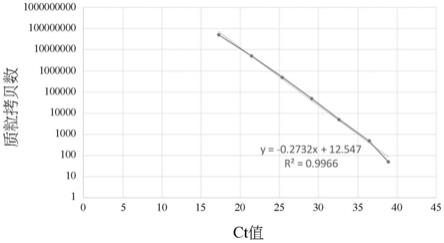
55.图1所示为使用引物alv-f4与alv-r4以及探针alv-p4进行实时pcr检测禽白血病病毒(alv)的结果。
56.图2所示为使用引物ndv-f4与ndv-r4以及探针ndv-p4进行实时pcr检测新城疫病毒(ndv)的结果。
57.图3所示为使用引物ibv-f4与ibv-r4以及探针ibv-p4进行实时pcr检测传染性支气管炎病毒(ibv)的结果。
58.图4所示为使用引物ibvqx-f4与ibvqx-r4以及探针ibvqx-p4进行实时pcr检测传染性支气管炎病毒-qx株(ibvqx)的结果。
59.图5所示为使用引物mg-f1与mg-r1以及探针mg-p1进行实时pcr检测鸡败血支原体(mg)的结果。
60.图6所示为使用引物ms-f4与ms-r4以及探针ms-p4进行实时pcr检测鸡滑液囊支原体(ms)的结果。
61.图7所示为使用引物mdv1-f3与mdv1-r3以及探针mdv1-p3进行实时pcr检测马立克氏病病毒(mdv)的结果。
62.图8所示为使用引物mdvsb-f4与mdvsb-r4以及探针mdvsb-p1进行实时pcr检测马立克氏病毒株sb-1(mdvsb)的结果。
63.图9所示为使用引物hvt-f1与hvt-r1以及探针hvt-p1进行实时pcr(real-time pcr)检测吐绶鸡疱疹病毒(hvt)的结果。
64.图10所示为使用引物aivh7-f4与aivh7-r4以及探针aivh7-p3进行实时pcr检测禽流感病毒h7亚型(aiv-h7)的结果。
65.图11所示为使用引物aivh9-df1与aivh9-r1以及探针aivh9-dp2进行实时pcr检测禽流感病毒h9亚型(aiv-h9)的结果。
具体实施方式
66.于一方面,本发明涉及一种家禽病原菌检测方法。在某些实施方案中,所述方法为聚合酶链反应(polymerase chain reaction,pcr)。在某些实施方案中,所述方法为反转录聚合酶链反应(reverse-transcription polymerase chain reaction,rt-pcr)。在某些实施方案中,所述方法为热对流聚合酶链反应(convective polymerase chain reaction,cpcr)。在某些实施方案中,所述方法为实时聚合酶链反应(real-time polymerase chain reaction,real-time pcr)。
67.于一方面,本发明涉及一种家禽病原菌检测方法,包含:
68.提供一可能含有家禽病原菌的一或多个核苷酸序列的样本;
69.提供一寡核苷酸引物对,所述寡核苷酸引物对定义在所述病原菌的一或多个核苷酸序列上一双链目标序列的两条互补链的5’端;
70.提供一聚合酶;
71.在一容器中混合所述样本、所述寡核苷酸引物对、所述聚合酶、去氧腺苷三磷酸(datps)、去氧胞核苷三磷酸(dctps)、去氧鸟苷三磷酸(dgtps),以及去氧胸苷三磷酸(dttps),以形成一聚合酶链反应(pcr)混合物;
72.通过在一固定温度下加热所述容器的底部,使所述pcr混合物进行热对流聚合酶链反应(cpcr),以形成一pcr产物;以及
73.检测所述pcr产物以辨识所述双链目标序列。
74.于另一方面,本发明涉及一种家禽病原菌检测方法,包含:
75.提供一可能含有家禽病原菌的一或多个核苷酸序列的样本;
76.提供一寡核苷酸引物对,所述寡核苷酸引物对定义在所述病原菌的一或多个核苷酸序列上一双链目标序列的两条互补链的5’端;
77.提供一寡核苷酸探针,所述寡核苷酸探针包含一与所述双链目标序列的一区段互补的序列、一附加于所述寡核苷酸探针上的一第一位置的荧光分子,以及一附加于所述寡核苷酸探针上的一第二位置的荧光抑制分子,当所述寡核苷酸探针未杂交于所述双链目标序列的所述区段时,所述荧光抑制分子大体上抑制所述荧光分子,且当所述寡核苷酸探针杂交于所述双链目标序列的所述区段时,所述荧光分子大体上未被抑制;
78.提供一聚合酶;
79.在一容器中混合所述样本、所述寡核苷酸引物对、所述寡核苷酸探针、所述聚合酶、去氧腺苷三磷酸(datps)、去氧胞核苷三磷酸(dctps)、去氧鸟苷三磷酸(dgtps),以及去氧胸苷三磷酸(dttps),以形成一聚合酶链反应(pcr)混合物;
80.通过在一固定温度下加热所述容器的底部,使所述pcr混合物进行热对流聚合酶链反应(cpcr),以形成一pcr产物;以及
81.检测所述pcr产物以辨识所述双链目标序列。
82.于又一方面,本发明涉及一种用于检测家禽病原菌的寡核苷酸对。
83.于再一方面,本发明涉及一种用于检测家禽病原菌的寡核苷酸对与寡核苷酸探针。
84.应当进一步理解的是,在某些实施方案中,本文揭露的寡核苷酸对和/或寡核苷酸探针可用于各种基础pcr技术的变异,例如,但不限于,反转录聚合酶链反应(rt-pcr)、热对流聚合酶链反应(cpcr)、实时聚合酶链反应(real-time pcr)、巢式聚合酶链反应(nested pcr),以及热不对称性交错聚合酶链反应(thermal asymmetric interlaced pcr,tail-pcr)。如本文所用,术语“家禽”是指人类为了它们的蛋、它们的肉或它们的羽毛而饲养的家禽。家禽包括但不限于鸡、鸭、鹅、火鸡、鹌鹑和其他家禽。
85.如本文所用,术语“家禽病原菌”是指在家禽中发现的病毒、细菌和寄生性病原菌。家禽病原菌的例子如,但不限于:禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)和禽流感病毒(aiv)。
86.如本文所用,术语“热对流聚合酶链反应(cpcr)”是指一种聚合酶链反应,其中,将
一装有一pcr样品的管状容器底部嵌入一稳定热源中,并控制所述pcr的参数,包括所述pcr样品的总体积、黏度、表面温度,以及所述管状容器的内径,使得所述pcr样品的底部到顶部的温度梯度下降,诱导热对流并且使得pcr样品的变性、黏合、聚合在所述管状容器的不同区域中依序且重复发生。热对流聚合酶链反应(cpcr)的详细描述请参见如美国专利号8,187,813,其以引用的方式将其整体并入本文。用于cpcr的试剂包括,但不限于2x一步法rt-pcr缓冲液iii(takara,日本)以及takara ex taq hs和primescript rt酶(takara,日本),以及premix ex taq(2x)(probe qpcr)(takara,日本)。合适的试剂可基于样品中病原菌的目标核酸的特性而变化。
87.如本文所用,术语“荧光分子”意指一物质或其一部份,其是能够在可检测的范围内显示荧光。如本文所用,术语“荧光抑制分子”意指一物质或其一部份,其是能够抑制当由一光源激发时由所述荧光分子所发射的荧光。在某些实施方案中,术语“荧光分子”与“荧光抑制分子”为taqman
tm
分析试剂盒(applied biosystems inc.,加州,美国)的荧光分子与荧光抑制分子。taqman
tm
分析试剂盒的详细描述请参见如,holland等人,proc.natl.acad.sci,usa(1991)88:7276-7280;美国专利号5,538,848、5,723,591、5,876,930,以及7,413,708,皆以引用的方式将其整体并入本文。
88.所述荧光分子的例子包括,但不限于,3-(ε-羧)-3'-乙基-5,5'-二甲基己羰花青(3-(ε-carboxypentyl)-3'-ethyl-5,5'-dimethyloxa-carbocyanine,cya)、6-羧基荧光素(6-carboxyfluorescein,fam)、5,6-羧基罗丹明-110(5,6-carboxyrhodamine-110,r110)、6羧基罗丹明-6g(6-carboxyrhodamine-6g,r6g)、n',n',n',n'-四甲基-6-羧基罗丹明(n',n',n',n'-tetramethyl-6-carboxyrhodamine,tamra)、6-羧基-x-罗丹明(6-carboxy-x-rhodamine,rox)、2',4',5',7'-四氯4-7-二氯荧光素(2',4',5',7'-tetrachloro-4-7-dichlorofluorescein,tet)、2',7-二甲氧基-4',5'-6羧基罗丹明(2',7-dimethoxy-4',5'-6carboxyrhodamine,joe)、6-羧基-2',4,4',5',7,7'-六氯荧光素(6-carboxy-2',4,4',5',7,7'-hexachlorofluorescein,hex)、alexa荧光、cy3荧光与cy5荧光。所述荧光抑制分子的例子包括,但不限于,4-(4'-二甲基氨基-苯偶氮基)苯甲酸(4-(4'-dimethylamino-phenylazo)-benzoic acid,dabcyl)、黑洞荧光抑制剂1(black hole quencher 1,bhq1)、黑洞荧光抑制剂2(black hole quencher 2,bhq2)、黑洞荧光抑制剂3(black hole quencher 3,bhq3)、二氢环吡咯并吲哚三肽小沟结合物(dihydro cyclo pyrrolo indole tripeptide minor groove binder,mgb)、四甲基罗丹明(tetramethylrhodamine,tamra)。在某些实施方案中,所述荧光分子为6-羧基荧光素(fam),且所述荧光抑制分子为二氢环吡咯并吲哚三肽小沟结合物(mgb)。在某些实施方案中,所述荧光分子为6-羧基荧光素(fam),且所述荧光抑制分子为黑洞荧光抑制剂1(bhq1)。
89.除非本文另有定义,否则用以与本文结合的科学与技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,单数术语应包括复数,并且复数术语应包括单数。本发明的方法与技术一般可根据本领域已知的常规方法进行。一般而言,本文所描述的用以连结以下技术的命名法,以及生物化学、酵素学、分子及细胞生物学、微生物学、遗传学与蛋白质及核酸化学及杂交反应的技术皆为本领域已知且经常使用者。除非另有说明,本发明的方法与技术一般可根据本领域已知的常规方法进行,且被描述于在本说明书中被引用且讨论的各种一般及更具体的参考文献中。
90.本发明进一步透过以下的实施例阐释,其不应以任何方式被解释为进一步的限缩。本技术案中引用的所有引用文件(包括参考文献、核准的专利、公开的专利申请,以及一同在申请中的专利申请案)的整体内容,在此透过引用的方式明确地并入本案中。
91.实施例
92.实施例1病原菌禽白血病病毒(alv)的检测
93.将禽白血病病毒(alv)j亚型的包膜基因(genbank登录号ku254611.1)插入克隆载体,得到palv质粒。克隆载体包括但不限于puc57和pgem-t。
94.1.传统聚合酶链反应
95.进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的palv质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
96.传统pcr的结果如表1所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测禽白血病病毒(alv)的存在。
97.表1各引物对进行传统pcr的结果
98.正向引物反向引物合成片段大小(bp)alv-f1(seq id no:1)alv-r1(seq id no:6)89alv-f2(seq id no:2)alv-r2(seq id no:7)76alv-f3(seq id no:3)alv-r3(seq id no:8)76alv-f4(seq id no:4)alv-r4(seq id no:9)80alv-f4(seq id no:4)alv-r5(seq id no:10)89alv-f5(seq id no:5)alv-r4(seq id no:9)75alv-f5(seq id no:5)alv-r5(seq id no:10)84
99.2.热对流聚合酶链反应(cpcr)
100.50μl的pcr混合物含有5μl禽白血病病毒(alv)包膜基因的rna(分别为102,103,104,105,106个拷贝数/μl)或palv质粒(分别为102,103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
101.敏感度测试的结果如表2所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的禽白血病病毒(alv)rna或102个拷贝数的pal质粒,其敏感度可达102个拷贝数/μl。
102.表2各引物对与探针组合的敏感度测试结果(n=8)
[0103][0104]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表3所示,各引物对与探针的组合皆可正确检测到含有禽白血病病毒(alv)的样品,而检测不到含有新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0105]
表3各引物对与探针组合的专一性测试结果
[0106]
[0107][0108]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0109]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0110]
以稀释的palv质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl palv质粒、0.01-2μm正向引物alv-f4(seq id no:4)、0.01-2μm反向引物alv-r4(seq id no:9)、0.01-2μm探针alv-p4(seq id no:14;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0111]
如图1所示,计算连续稀释(10倍)的palv质粒的实时pcr分析的标准曲线。至少10个拷贝数的palv质粒可被检测到。所述标准曲线的r2值为0.9966,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0112]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测禽白血病病毒(alv)的存在,并且具有高度敏感度及专一性。
[0113]
实施例2病原菌新城疫病毒(ndv)的检测
[0114]
将新城疫病毒(ndv)的血凝素-神经氨酸酶(hemagglutinin-neuraminidase,hn)、大聚合酶蛋白(large polymerase protein,lp)和基质蛋白(matrix protein,m)基因(genbank登录号kc542894.1)分别插入克隆载体中,分别得到pndv-hn、pndv-lp和pndv-m质粒。克隆载体包括但不限于puc57和pgem-t。
[0115]
1.传统聚合酶链反应
[0116]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pndv-hn、pndv-lp或pndv-m质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0117]
传统pcr的结果如表4所示,各引物对扩增了各目标序列的正确大小的片段,而在
负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测新城疫病毒(ndv)的存在。
[0118]
表4各引物对进行传统pcr的结果
[0119]
正向引物反向引物合成片段大小(bp)ndv-f1(seq id no:15)ndv-r1(seq id no:20)83ndv-f2(seq id no:16)ndv-r2(seq id no:21)75ndv-f3(seq id no:17)ndv-r3(seq id no:22)102ndv-f4(seq id no:18)ndv-r4(seq id no:23)83ndv-f4(seq id no:18)ndv-r5(seq id no:24)86ndv-f5(seq id no:19)ndv-r4(seq id no:23)77ndv-f5(seq id no:19)ndv-r5(seq id no:24)80
[0120]
2.热对流聚合酶链反应(cpcr)
[0121]
50μl的pcr混合物含有5μl新城疫病毒(ndv)的血凝素-神经氨酸酶(hn)、大聚合酶蛋白(lp)或基质蛋白(m)基因的rna(分别为102,103,104,105,106个拷贝数/μl)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taqdna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0122]
敏感度测试的结果如表5所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的新城疫病毒(ndv)rna,其敏感度可达102个拷贝数/μl。
[0123]
表5各引物对与探针组合的敏感度测试结果(n=8)
[0124]
[0125][0126]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表6所示,各引物对与探针的组合皆可正确检测到含有新城疫病毒(ndv)的样品,而检测不到含有禽白血病病毒(alv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0127]
表6各引物对与探针组合的专一性测试结果
[0128]
[0129][0130]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0131]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0132]
以稀释的pndv-m质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pndv-m质粒、0.01-2μm正向引物ndv-f4(seq id no:18)、0.01-2μm反向引物ndv-r4(seq id no:23)、0.01-2μm探针ndv-p4(seq id no:28;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧
光测量的结果。
[0133]
如图2所示,计算连续稀释(10倍)的pndv-m质粒的实时pcr分析的标准曲线。至少10个拷贝数的pndv-m质粒可被检测到。所述标准曲线的r2值为1,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0134]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测新城疫病毒(ndv)的存在,并且具有高度敏感度及专一性。
[0135]
实施例3病原菌传染性支气管炎病毒(ibv)的检测
[0136]
将传染性支气管炎病毒(ibv)(genbank登录号kf696629.1)的lab多蛋白(l)、核衣壳蛋白(nucleocapsid protein,nc)和3'非翻译区(3’untranslation region,3'utr)基因插入克隆载体中,分别获得pibv-l、pibv-nc和pibv-3'utr质粒。克隆载体包括但不限于puc57和pgem-t。
[0137]
1.传统聚合酶链反应
[0138]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pibv-l、pibv-nc或pibv-3'utr质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0139]
传统pcr的结果如表7所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测传染性支气管炎病毒(ibv)的存在。
[0140]
表7各引物对进行传统pcr的结果
[0141]
正向引物反向引物合成片段大小(bp)ibv-f1(seq id no:29)ibv-r1(seq id no:34)89ibv-f2(seq id no:30)ibv-r2(seq id no:35)73ibv-f3(seq id no:31)ibv-r3(seq id no:36)71ibv-f4(seq id no:32)ibv-r4(seq id no:37)72ibv-f4(seq id no:32)ibv-r5(seq id no:38)85ibv-f5(seq id no:33)ibv-r4(seq id no:37)87ibv-f5(seq id no:33)ibv-r5(seq id no:38)100
[0142]
2.热对流聚合酶链反应(cpcr)
[0143]
50μl的pcr混合物含有5μl传染性支气管炎病毒(ibv)的lab多蛋白(l)、核衣壳蛋白(nc)或3'非翻译区(3'utr)基因的rna(分别为102,103,104,105,106个拷贝数/μl)或pibv-l、pibv-nc或pibv-3'utr质粒(分别为102,103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧
光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0144]
敏感度测试的结果如表8所示,各引物对与探针的组合皆可100%正确检测到样品中含有103个拷贝数/μl的传染性支气管炎病毒(ibv)rna或102个拷贝数的pibv-l、pibv-nc或pibv-3'utr质粒,其敏感度可达102个拷贝数。
[0145]
表8各引物对与探针组合的敏感度测试结果(n=8)
[0146][0147]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表9所示,各引物对与探针的组合皆可正确检测到含有传染性支气管炎病毒(ibv)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0148]
表9各引物对与探针组合的专一性测试结果
[0149]
[0150][0151]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0152]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0153]
以稀释的pibv-3’utr质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pibv-3’utr质粒、0.01-2μm正向引物ibv-f4(seq id no:32)、0.01-2μm反向引物ibv-r4(seq id no:37)、0.01-2μm探针ibv-p4(seq id no:42;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcrkit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0154]
如图3所示,计算连续稀释(10倍)的pibv-3’utr质粒的实时pcr分析的标准曲线。至少102个拷贝数的pibv-3’utr质粒可被检测到。所述标准曲线的r2值为0.9991,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0155]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测传染性支气管炎病毒(ibv)的存在,并且具有高度敏感度及专一性。
[0156]
实施例4病原菌传染性支气管炎病毒-qx株(ibvqx)的检测
[0157]
将传染性支气管炎病毒-qx株(ibvqx)的刺突糖蛋白基因(genbank登录号jn022553.1)插入克隆载体,得到pibvqx质粒。克隆载体包括但不限于puc57和pgem-t。
[0158]
1.传统聚合酶链反应
[0159]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pibvqx质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以
15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0160]
传统pcr的结果如表10所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测传染性支气管炎病毒-qx株(ibvqx)的存在。
[0161]
表10各引物对进行传统pcr的结果
[0162]
正向引物反向引物合成片段大小(bp)ibvqx-f1(seq id no:43)ibvqx-r1(seq id no:48)75ibvqx-f2(seq id no:44)ibvqx-r2(seq id no:49)91ibvqx-f3(seq id no:45)ibvqx-r3(seq id no:50)97ibvqx-f4(seq id no:46)ibvqx-r4(seq id no:51)98ibvqx-f4(seq id no:46)ibvqx-r5(seq id no:52)101ibvqx-f5(seq id no:47)ibvqx-r4(seq id no:51)77ibvqx-f5(seq id no:47)ibvqx-r5(seq id no:52)80
[0163]
2.热对流聚合酶链反应(cpcr)
[0164]
50μl的pcr混合物含有5μl传染性支气管炎病毒-qx株(ibvqx)的刺突糖蛋白基因的rna(分别为102,103,104,105,106个拷贝数/μl)或pibvqx质粒(分别为102,103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0165]
敏感度测试的结果如表11所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的传染性支气管炎病毒-qx株(ibvqx)rna或102个拷贝数的pibvqx质粒,其敏感度可达102个拷贝数/μl。
[0166]
表11各引物对与探针组合的敏感度测试结果(n=8)
[0167]
[0168][0169]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表12所示,各引物对与探针的组合皆可正确检测到含有传染性支气管炎病毒-qx株(ibvqx)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0170]
表12各引物对与探针组合的专一性测试结果
[0171]
[0172][0173]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0174]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0175]
以稀释的pibvqx质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pibvqx质粒、0.01-2μm正向引物ibvqx-f4(seq id no:46)、0.01-2μm反向引物ibvqx-r4(seq id no:51)、0.01-2μm探针ibvqx-p4(seq id no:56;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0176]
如图4所示,计算连续稀释(10倍)的pibvqx质粒的实时pcr分析的标准曲线。至少103个拷贝数的pibvqx质粒可被检测到。所述标准曲线的r2值为0.9889,表示本发明的引物
对与探针可以被用于实时pcr,并产生可信的结果。
[0177]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测传染性支气管炎病毒-qx株(ibvqx)的存在,并且具有高度敏感度及专一性。
[0178]
实施例5病原菌鸡败血支原体(mg)的检测
[0179]
将鸡毒支原体(mg)的细胞粘着素(mgc2)基因(genbank登录号kj019171.1)插入克隆载体中,得到pmg质粒。克隆载体包括但不限于puc57和pgem-t。
[0180]
1.传统聚合酶链反应
[0181]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pmg质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0182]
传统pcr的结果如表13所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测鸡败血支原体(mg)的存在。
[0183]
表13各引物对进行传统pcr的结果
[0184]
正向引物反向引物合成片段大小(bp)mg-f1(seq id no:57)mg-r1(seq id no:62)79mg-f1(seq id no:57)mg-r5(seq id no:65)81mg-f5(seq id no:61)mg-r1(seq id no:62)101mg-f5(seq id no:61)mg-r5(seq id no:65)103mg-f2(seq id no:58)mg-r2(seq id no:63)79mg-f3(seq id no:59)mg-r3(seq id no:64)79mg-f4(seq id no:60)mg-r3(seq id no:64)80
[0185]
2.热对流聚合酶链反应(cpcr)
[0186]
50μl的pcr混合物含有5μl鸡毒支原体(mg)的细胞粘着素(mgc2)基因的rna(分别为102,103,104,105,106个拷贝数/μl)或pmg质粒(分别为102,103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0187]
敏感度测试的结果如表14所示,各引物对与探针的组合皆可100%正确检测到样品中含有103个拷贝数/μl的鸡败血支原体(mg)rna或103个拷贝数的pmg质粒,其敏感度可达103个拷贝数/μl。
[0188]
表14各引物对与探针组合的敏感度测试结果(n=8)
[0189][0190]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表15所示,各引物对与探针的组合皆可正确检测到含有鸡败血支原体(mg)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0191]
表15各引物对与探针组合的专一性测试结果
[0192]
[0193][0194]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0195]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0196]
以稀释的pmg质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pmg质粒、0.01-2μm正向引物mg-f1(seq id no:57)、0.01-2μm反向引物mg-r1(seq id no:62)、0.01-2μm探针mg-p1(seq id no:66;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcrkit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0197]
如图5所示,计算连续稀释(10倍)的pmg质粒的实时pcr分析的标准曲线。至少102个拷贝数的pmg质粒可被检测到。所述标准曲线的r2值为0.9892,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0198]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测鸡败血支原体(mg)的存在,并且具有高度敏感度及专一性。
[0199]
实施例6病原菌鸡滑液囊支原体(ms)的检测
[0200]
将鸡滑液囊支原体(ms)的可变血凝素(vlha)基因(genbank登录号af035624.1)和鸡滑液囊支原体(ms)16s rrna基因(genbank登录号mh539137.1)分别插入克隆载体中,分别获得pms-vlha和pms-16s质粒。克隆载体包括但不限于puc57和pgem-t。
[0201]
1.传统聚合酶链反应
[0202]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pms-vlha或pms-16s质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0203]
传统pcr的结果如表16所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测鸡滑液囊支原体(ms)的存在。
[0204]
表16各引物对进行传统pcr的结果
[0205]
正向引物反向引物合成片段大小(bp)
ms-f1(seq id no:70)ms-r1(seq id no:77)138ms-f2(seq id no:71)ms-r2(seq id no:78)70ms-f3(seq id no:72)ms-r3(seq id no:79)82ms-f4(seq id no:73)ms-r4(seq id no:80)103ms-f4(seq id no:73)ms-r5(seq id no:81)89ms-f5(seq id no:74)ms-r4(seq id no:80)99ms-f5(seq id no:74)ms-r5(seq id no:81)85ms-f6(seq id no:75)ms-r4(seq id no:80)97ms-f6(seq id no:75)ms-r5(seq id no:81)83ms-f7(seq id no:76)ms-r7(seq id no:82)66
[0206]
2.热对流聚合酶链反应(cpcr)
[0207]
50μl的pcr混合物含有5μl鸡滑液囊支原体(ms)的可变血凝素(vlha)基因或鸡滑液囊支原体(ms)16s rrna基因的rna(分别为102,103,104,105,106个拷贝数/μl)或pms-vlha或pms-16s质粒(分别为103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0208]
敏感度测试的结果如表17所示,各引物对与探针的组合皆可100%正确检测到样品中含有103个拷贝数/μl的鸡滑液囊支原体(ms)的rna或103个拷贝数的pms-vlha或pms-16s质粒,其敏感度可达103个拷贝数/μl。
[0209]
表17各引物对与探针组合的敏感度测试结果(n=8)
[0210]
[0211][0212]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表18所示,各引物对与探针的组合皆可正确检测到含有鸡滑液囊支原体(ms)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0213]
表18各引物对与探针组合的专一性测试结果
[0214]
[0215][0216]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0217]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0218]
以稀释的pms-vlha质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pms-vlha质粒、0.01-2μm正向引物ms-f4(seq id no:73)、0.01-2μm反向引物ms-r4(seq id no:80)、0.01-2μm探针ms-p4(seq id no:86;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0219]
如图6所示,计算连续稀释(10倍)的pms-vlha质粒的实时pcr分析的标准曲线。至少102个拷贝数的pms-vlha质粒可被检测到。所述标准曲线的r2值为0.9982,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0220]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测鸡滑液囊支原体(ms)的存在,并且具有高度敏感度及专一性。
[0221]
实施例7病原菌马立克氏病病毒(mdv)的检测
[0222]
将马立克氏病病毒(mdv)的meq基因(genbank登录号af493555.1)插入克隆载体中,得到pmdv-meq质粒。克隆载体包括但不限于puc57和pgem-t。
[0223]
1.传统聚合酶链反应
[0224]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pmdv-meq质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0225]
传统pcr的结果如表19所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测马立克氏病病毒(mdv)的存在。
[0226]
表19各引物对进行传统pcr的结果
[0227]
正向引物反向引物合成片段大小(bp)mdv1-f1(seq id no:88)mdv1-r1(seq id no:92)96mdv1-f2(seq id no:89)mdv1-r2(seq id no:93)76mdv1-f3(seq id no:90)mdv1-r3(seq id no:94)92mdv1-f3(seq id no:90)mdv1-r4(seq id no:95)80mdv1-f4(seq id no:91)mdv1-r3(seq id no:94)86mdv1-f4(seq id no:91)mdv1-r4(seq id no:95)74
[0228]
2.热对流聚合酶链反应(cpcr)
[0229]
50μl的pcr混合物含有5μl马立克氏病病毒(mdv)的meq基因的rna(分别为102,103,104,105,106个拷贝数/μl)或pmdv-meq质粒(分别为102,103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0230]
敏感度测试的结果如表20所示,各引物对与探针的组合皆可100%正确检测到样品中含有103个拷贝数/μl的马立克氏病病毒(mdv)rna或103个拷贝数的pmdv-meq质粒,其敏感度可达103个拷贝数/μl。
[0231]
表20各引物对与探针组合的敏感度测试结果(n=8)
[0232][0233]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表21所示,各引物对与探针的组合皆可正确检测到含有马立克氏病病毒(mdv)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0234]
表21各引物对与探针组合的专一性测试结果
[0235]
[0236][0237]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0238]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0239]
以稀释的pmdv-meq质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pmdv-meq质粒、0.01-2μm正向引物mdv1-f3(seq id no:90)、0.01-2μm反向引物mdv1-r3(seq id no:94)、0.01-2μm探针mdv1-p4(seq id no:98;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。
实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0240]
如图7所示,计算连续稀释(10倍)的pmdv-meq质粒的实时pcr分析的标准曲线。至少102个拷贝数的pmdv-meq质粒可被检测到。所述标准曲线的r2值为0.9983,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0241]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测马立克氏病病毒(mdv)的存在,并且具有高度敏感度及专一性。
[0242]
实施例8病原菌马立克氏病毒株sb-1(mdvsb)的检测
[0243]
将马立克氏病病毒株sb-1(mdvsb)的ul42蛋白基因(genbank登录号hq840738.1)插入克隆载体中,得到pmdvsb质粒。克隆载体包括但不限于puc57和pgem-t。
[0244]
1.传统聚合酶链反应
[0245]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的pmdvsb质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0246]
传统pcr的结果如表22所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测马立克氏病毒株sb-1(mdvsb)的存在。
[0247]
表22各引物对进行传统pcr的结果
[0248][0249][0250]
2.热对流聚合酶链反应(cpcr)
[0251]
50μl的pcr混合物含有5μl马立克氏病病毒株sb-1(mdvsb)的ul42蛋白基因的rna(分别为102,103,104,105,106个拷贝数/μl)或pmdvsb质粒(分别为103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚
合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0252]
敏感度测试的结果如表23所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的马立克氏病毒株sb-1(mdvsb)rna或103个拷贝数的pmdvsb质粒,其敏感度可达102个拷贝数/μl。
[0253]
表23各引物对与探针组合的敏感度测试结果(n=8)
[0254]
[0255][0256]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表24所示,各引物对与探针的组合皆可正确检测到含有马立克氏病毒株sb-1(mdvsb)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0257]
表24各引物对与探针组合的专一性测试结果
[0258]
[0259]
[0260][0261]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0262]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0263]
以稀释的pmdvsb质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl pmdvsb质粒、0.01-2μm正向引物mdvsb-f4(seq id no:102)、0.01-2μm反向引物mdvsb-r4(seq id no:107)、0.01-2μm探针mdvsb-p1(seq id no:109;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcrkit;takarabio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0264]
如图8所示,计算连续稀释(10倍)的pmdvsb质粒的实时pcr分析的标准曲线。至少10个拷贝数的pmdvsb质粒可被检测到。所述标准曲线的r2值为0.9997,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0265]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测马立克氏病毒株sb-1(mdvsb)的存在,并且具有高度敏感度及专一性。
[0266]
实施例9病原菌吐绶鸡疱疹病毒(hvt)的检测
[0267]
将吐绶鸡疱疹病毒(hvt)的hvt070基因(genbank登录号af291866.1)插入克隆载
体中,得到phvt质粒。克隆载体包括但不限于puc57和pgem-t。
[0268]
1.传统聚合酶链反应
[0269]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的phvt质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidiumbromide)染色显现。
[0270]
传统pcr的结果如表25所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测吐绶鸡疱疹病毒(hvt)的存在。
[0271]
表25各引物对进行传统pcr的结果
[0272]
正向引物反向引物合成片段大小(bp)hvt-f1(seq id no:112)hvt-r1(seq id no:116)90hvt-f1(seq id no:112)hvt-r4(seq id no:119)97hvt-f2(seq id no:113)hvt-r2(seq id no:117)97hvt-f2(seq id no:113)hvt-r5(seq id no:120)87hvt-f5(seq id no:115)hvt-r2(seq id no:117)82hvt-f5(seq id no:115)hvt-r5(seq id no:120)72hvt-f3(seq id no:114)hvt-r3(seq id no:118)89
[0273]
2.热对流聚合酶链反应(cpcr)
[0274]
50μl的pcr混合物含有5μl吐绶鸡疱疹病毒(hvt)的hvt070基因的rna(分别为102,103,104,105,106个拷贝数/μl)或phvt质粒(分别为103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0275]
敏感度测试的结果如表26所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的吐绶鸡疱疹病毒(hvt)rna或103个拷贝数的phvt质粒,其敏感度可达102个拷贝数/μl。
[0276]
表26各引物对与探针组合的敏感度测试结果(n=8)
[0277][0278]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表27所示,各引物对与探针的组合皆可正确检测到含有吐绶鸡疱疹病毒(hvt)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0279]
表27各引物对与探针组合的专一性测试结果
[0280]
[0281][0282]
[0283]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0284]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0285]
以稀释的phvt质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl phvt质粒、0.01-2μm正向引物hvt-f1(seq id no:112)、0.01-2μm反向引物hvt-r1(seq id no:116)、0.01-2μm探针hvt-p1(seq id no:121;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0286]
如图9所示,计算连续稀释(10倍)的phvt质粒的实时pcr分析的标准曲线。至少10个拷贝数的phvt质粒可被检测到。所述标准曲线的r2值为0.9946,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0287]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测吐绶鸡疱疹病毒(hvt)的存在,并且具有高度敏感度及专一性。
[0288]
实施例10病原菌禽流感病毒h5亚型(aiv-h5)的检测
[0289]
将禽流感病毒h5亚型(aiv-h5)的血凝素(ha)基因(genbank登录号cy080507)插入克隆载体,得到paiv-h5质粒。克隆载体包括但不限于puc57和pgem-t。
[0290]
1.传统聚合酶链反应
[0291]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的paiv-h5质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0292]
传统pcr的结果如表28所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测禽流感病毒h5亚型(aiv-h5)的存在。
[0293]
表28各引物对进行传统pcr的结果
[0294]
正向引物反向引物合成片段大小(bp)aivh5-f1(seq id no:124)aivh5-r1(seq id no:127)80aivh5-f2(seq id no:125)aivh5-r2(seq id no:128)80aivh5-f2(seq id no:125)aivh5-dr1(seq id no:129)**80aivh5-f2(seq id no:125)aivh5-dr2(seq id no:130)80aivh5-df1(seq id no:126)*aivh5-r2(seq id no:128)80aivh5-df1(seq id no:126)*aivh5-dr1(seq id no:129)**80aivh5-df1(seq id no:126)*aivh5-dr2(seq id no:130)***80
[0295]
*seq id no:126的序列是5
’‑
tcaatytayt caacagtggc gag-3’,其中y表示是t、u或c。
[0296]
**seq id no:129的序列是5
’‑
ccattggagc acatccanaa agata-3’,其中n表示是a、c、g或t。
[0297]
***seq id no:130的序列是5
’‑
ccattggayc acatccanaa agata-3’,其中y表示是t、u或c,其中n表示是a、c、g或t。
[0298]
2.热对流聚合酶链反应(cpcr)
[0299]
50μl的pcr混合物含有5μl禽流感病毒h5亚型(aiv-h5)的血凝素(ha)的rna(分别为102,103,104,105,106个拷贝数/μl)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验7次(n=7)以评估各引物对与探针的敏感度。
[0300]
敏感度测试的结果如表29所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的禽流感病毒h5亚型(aiv-h5)rna,其敏感度可达102个拷贝数/μl。
[0301]
表29各引物对与探针组合的敏感度测试结果(n=7)
[0302]
[0303]
[0304]
[0305][0306]
*seq id no:133的序列是5
’‑
tagtrctggc aatcat-3’,其中r表示是g或a。
[0307]
**seq id no:134的序列是5
’‑
tagyrctggc aatcat-3’,其中y表示是t、u或c,其中r表示是g或a。
[0308]
***seq id no:135的序列是5
’‑
tagyrytggc aatcat-3’,其中y表示是t、u或c,其中r表示是g或a。
[0309]
seq id no:136的序列是5
’‑
ccctagyrct ggcaatcatn rtagctg-3’,其中y表示是t、u或c,其中r表示是g或a,其中n表示是a、c、g或t。
[0310]
seq id no:137的序列是5
’‑
taryrctggc aatcat-3’,其中y表示是t、u或c,其中r表示是g或a。
[0311]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表30所示,各引物对与探针的组合皆可正确检测到含有禽流感病毒h5亚型(aiv-h5)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液
囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h7亚型(aiv-h7)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0312]
表30各引物对与探针组合的专一性测试结果
[0313]
[0314]
[0315]
[0316]
[0317]
[0318][0319]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0320]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测禽流感病毒h5亚型(aiv-h5)的存在,并且具有高度敏感度及专一性。
[0321]
实施例11病原菌禽流感病毒h7亚型(aiv-h7)的检测
[0322]
将禽流感病毒h7亚型(aiv-h7)的血凝素(ha)基因(genbank登录号ky056290)插入克隆载体,得到paiv-h7质粒。克隆载体包括但不限于puc57和pgem-t。
[0323]
1.传统聚合酶链反应
[0324]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的paiv-h7质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0325]
传统pcr的结果如表31所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测禽流感病毒h7亚型(aiv-h7)的存在。
[0326]
表31各引物对进行传统pcr的结果
[0327]
正向引物反向引物合成片段大小(bp)aivh7-f1(seq id no:138)aivh7-r1(seq id no:142)79
aivh7-f2(seq id no:139)aivh7-r2(seq id no:143)86aivh7-f3(seq id no:140)aivh7-r3(seq id no:144)85aivh7-f3(seq id no:140)aivh7-r4(seq id no:145)99aivh7-f4(seq id no:141)aivh7-r3(seq id no:144)87aivh7-f4(seq id no:141)aivh7-r4(seq id no:145)101
[0328]
2.热对流聚合酶链反应(cpcr)
[0329]
50μl的pcr混合物含有5μl禽流感病毒h7亚型(aiv-h7)的血凝素(ha)基因的rna(分别为102,103,104,105,106个拷贝数/μl)或paiv-h7质粒(分别为102,103,104,105,106个拷贝数)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验8次(n=8)以评估各引物对与探针的敏感度。
[0330]
敏感度测试的结果如表32所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的禽流感病毒h7亚型(aiv-h7)rna或102个拷贝数的paiv-h7质粒,其敏感度可达102个拷贝数/μl。
[0331]
表32各引物对与探针组合的敏感度测试结果(n=8)
[0332]
[0333][0334]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表33所示,各引物对与探针的组合皆可正确检测到含有禽流感病毒h7亚型(aiv-h7)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h9亚型(aiv-h9)的样品。所述结果显示各引物对与探针组合具有专一性。
[0335]
表33各引物对与探针组合的专一性测试结果
[0336]
[0337][0338]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0339]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0340]
以稀释的paiv-h7质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加州,美国)中进行实时pcr分析。以含有2μl paiv-h7质粒、0.01-2μm正向引物aivh7-f4(seq id no:141)、0.01-2μm反向引物aivh7-r4(seq id no:145)、0.01-2μm探针aivh7-p3(seq id no:148;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子二氢环吡咯并吲哚三肽小沟结合物(mgb))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0341]
如图10所示,计算连续稀释(10倍)的paiv-h7质粒的实时pcr分析的标准曲线。至少102个拷贝数的paiv-h7质粒可被检测到。所述标准曲线的r2值为0.9974,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0342]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测禽流感病毒h7亚型(aiv-h7)的存在,并且具有高度敏感度及专一性。
[0343]
实施例12病原菌禽流感病毒h9亚型(aiv-h9)的检测
[0344]
将禽流感病毒h9亚型(aiv-h9)的血凝素(ha)基因(genbank登录号mk559860.1)插入克隆载体,得到paiv-h9质粒。克隆载体包括但不限于puc57和pgem-t。
[0345]
1.传统聚合酶链反应
[0346]
进行传统pcr所用的50μl pcr混合物含有:106个拷贝数的paiv-h9质粒、0.01-2μm正向引物、0.01-2μm反向引物、0.2μm dntp以及1.25u taq dna聚合酶。在一热循环仪(例如,但不限于pc818,astec co.ltd.,日本)中进行扩增反应,且包含一个变性的初始循环94℃持续3分钟,以及35个循环的94℃30秒、60℃30秒以及72℃延展30秒。扩增的产物接着以15%聚丙烯醯胺凝胶(polyacrylamide gel)在tae缓冲液(40mm tris,20mm acetic acid,1mm edta)中分析,并且以溴化乙锭(ethidium bromide)染色显现。
[0347]
传统pcr的结果如表34所示,各引物对扩增了各目标序列的正确大小的片段,而在负对照组中则无目标序列被扩增(结果未显示)。所述结果表明,各引物对可用于传统pcr扩增反应以检测禽流感病毒h9亚型(aiv-h9)的存在。
[0348]
表34各引物对进行传统pcr的结果
[0349]
正向引物反向引物合成片段大小(bp)aivh9-f1(seq id no:149)aivh9-r1(seq id no:152)85aivh9-f2(seq id no:150)aivh9-r1(seq id no:152)86aivh9-df1(seq id no:151)*aivh9-r1(seq id no:152)85
[0350]
*seq id no:151的序列是5
’‑
ctggaatctg aagraactta caaaat-3’,其中r表示是g或a。
[0351]
2.热对流聚合酶链反应(cpcr)
[0352]
50μl的pcr混合物含有5μl禽流感病毒h9亚型(aiv-h9)的血凝素(ha)基因的rna(分别为102,103,104,105,106个拷贝数/μl)、0.01-2μm正向引物、0.01-2μm反向引物、0.01-2μm探针(各探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1)/二氢环吡咯并吲哚三肽小沟结合物(mgb))、1
×
cpcr缓冲液、1-5u反转录酶,以及1-5u taq dna聚合酶。将pcr混合物加入一反应试管中,并置于一热对流聚合酶链反应(cpcr)仪中一段指定的时间(约30~45分钟)。以所述cpcr仪检测每个样本中的fam荧光。重复上述cpcr分析试验7次(n= 7)以评估各引物对与探针的敏感度。
[0353]
敏感度测试的结果如表35所示,各引物对与探针的组合皆可100%正确检测到样品中含有102个拷贝数/μl的禽流感病毒h9亚型(aiv-h9)rna,其敏感度可达102个拷贝数/μl。
[0354]
表35各引物对与探针组合的敏感度测试结果(n=7)
[0355]
[0356][0357]
*seq id no:154的序列是 5
’‑
ttcgactgty gcctcatctc ttgtgm-3’,其中y表示是t、u或c,其中m表示是a或c。
[0358]
**seq id no:155的序列是 5
’‑
ttcgactgty gcctcatctc ttgtnm-3’,其中y表示是t、u或c,其中n表示是a、c、g或t,其中m表示是a或c。
[0359]
***seq id no:156的序列是 5
’‑
gcctcatctc ttgtgmtt-3’,其中m表示是a或c。
[0360]
seq id no:157的序列是5
’‑
gcctcatctc ttgtnmtt-3’,其中n表示是a、c、g或t,其中m表示是a或c。
[0361]
此外,以不同的家禽病原菌基因质粒(106拷贝数/μl)作为cpcr模板分析上述各引物对及探针组合的专一性。cpcr方法如上所述。专一性测试的结果如表36所示,各引物对与探针的组合皆可正确检测到含有禽流感病毒h9亚型(aiv-h9)的样品,而检测不到含有禽白血病病毒(alv)、新城疫病毒(ndv)、传染性支气管炎病毒(ibv)、鸡败血支原体(mg)、鸡滑液囊支原体(ms)、马立克氏病病毒(mdv)、吐绶鸡疱疹病毒(hvt)、禽流感病毒h5亚型(aiv-h5)、禽流感病毒h7亚型(aiv-h7)的样品。所述结果显示各引物对与探针组合具有专一性。
[0362]
表36各引物对与探针组合的专一性测试结果
[0363]
[0364]
[0365][0366]“+”表示在所述样本中检测到荧光讯号,而
“‑”
表示在所述样本中未检测到荧光讯号。
[0367]
3.实时聚合酶链反应(real-time pcr,qpcr)
[0368]
以稀释的paiv-h9质粒(分别为101,102,103,104,105,106,107个拷贝数)在一实时pcr仪(例如,但不限于abi steponeplustm;applied biosystem,life technologies,加
州,美国)中进行实时pcr分析。以含有2μl paiv-h9质粒、0.01-2μm正向引物aivh9-df1(seq id no:151)、0.01-2μm反向引物aivh9-r1(seq id no:152)、0.01-2μm探针aivh9-dp2(seq id no:155;探针序列的5'端及3'端分别接合一荧光分子6-羧基荧光素(fam)以及一荧光抑制分子黑洞荧光抑制剂1(bhq1))总体积为20μl的商用rt-pcr试剂盒(例如,但不限于,onestep primescripttm rt-pcr kit;takara bio inc.,日本)进行实时pcr分析。实时pcr的程序为42℃5分钟、94℃10秒,以及40个循环的94℃10秒以及60℃30分钟。在60℃的步骤中记录荧光测量的结果。
[0369]
如图11所示,计算连续稀释(10倍)的paiv-h9质粒的实时pcr分析的标准曲线。至少10个拷贝数的paiv-h9质粒可被检测到。所述标准曲线的r2值为0.9985,表示本发明的引物对与探针可以被用于实时pcr,并产生可信的结果。
[0370]
上述结果表明,本发明的引物对与探针可用于cpcr扩增反应以检测禽流感病毒h9亚型(aiv-h9)的存在,并且具有高度敏感度及专一性。
[0371]
上列详细说明系针对本发明之一可行实施例的具体说明,惟该实施例并非用以限制本发明的专利范围,凡未脱离本发明技艺精神所为的等效实施或变更,均应包含于本案的专利范围中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1