含邻氨基吡啶炔基的化合物的盐及其制备方法和应用
1.本发明属于药物化学领域,具体涉及一种含邻氨基吡啶炔基的化合物的盐及其制备方法和应用。
背景技术:
2.受体酪氨酸激酶(receptor tyrosine kinase,rtks)是一类跨膜酶联受体,它们的过度表达或过度激活与肿瘤的发生发展密切相关。其中,成纤维生长因子受体(fibroblast growth factor receptors,fgfrs)和ret(rearranged during transfection)原癌基因编码的ret蛋白就是rtk超家族的重要成员,是肿瘤治疗的重要靶标。
3.fgfr主要包括fgfr1/2/3/4四种亚型,它们通过基因扩增、突变、融合或配体诱导等方式过度表达或过度激活,对肿瘤细胞增殖、侵袭和迁移及肿瘤血管的生成具有重要作用。研究发现,fgfrs在多种肿瘤如非小细胞肺癌、乳腺癌、胃癌、膀胱癌、子宫内膜癌、胃食管结合部癌、前列腺癌、宫颈癌、结直肠癌、食管癌、胶质母细胞瘤、骨髓瘤、横纹肌肉瘤等中均表现出过度表达或过度激活。
4.ret的正常生理功能包含肾发育、神经系统的发育、精子干细胞的维持更新、髓单核细胞分化、淋巴组织的形成等,在人肠神经节细胞、神经母细胞瘤、嗜铬细胞瘤、甲状腺髓样癌、甲状腺c细胞和黑色素瘤等细胞中表达。近年来,通过对ret深入研究,发现在肿瘤中ret的过度激活对多种肿瘤的增殖、存活、侵袭、转移及肿瘤炎症等均有显著促进作用,ret在甲状腺癌(例如,甲状腺髓样癌、乳头状甲状腺癌)、腺癌、结直肠癌、胰腺癌、乳腺癌、急性白血病、软组织肉瘤中均表现出过度表达。
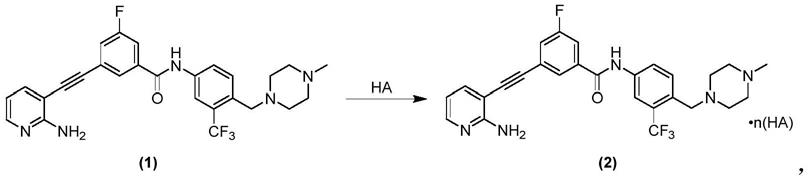
5.化合物1,
[0006][0007]
化学名为3-(2-氨基吡啶-3-乙炔基)-5-氟-n-(4-((4-甲基哌嗪-1-基)亚甲基)-3-(三氟甲基)苯基)苯甲酰胺,是一种具有fgfr和ret抑制活性的多靶点抑制剂,其类似物(例如,wo2018149382a1中的化合物hufgfr267和hufgfr293)对v804突变型ret激酶依然具有很好的抑制活性,相对而言,化合物1及其类似物对血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,vegfr2,也称为kdr)抑制作用较弱。一方面,相对选择性强且具有克服耐药突变潜力的ret抑制剂鲜见报道,另一方面,已上市的具有fgfr和ret抑制活性的多靶点抑制剂药物,例如瑞戈非尼(regorafenib),其主靶为kdr,研究表明,对kdr有较强的抑制作用可致使癌症患者产生较强的心血管副作用,如充血性心衰、凝血障碍等。
[0008]
目前已有两个ret抑制剂相继获批上市,即塞尔帕替尼(selpercatinib)和普拉替尼(pralsetinib),分别于2020年5月和2020年9月获得fda首次批准上市,前者用于治疗晚期ret融合性非小细胞肺癌和ret突变型/融合阳性甲状腺髓样癌,最初由loxo oncology发现,后者用于治疗ret融合性非小细胞肺癌,最初由blueprint medicines发现。一方面,两个药物的获批适应症较窄,其它适应症的研究尚处于临床研究阶段,且疗效尚不明确。因此,开发具有新型结构且兼具良好fgfr和ret抑制活性的化合物,并拓展其适应症范围,有希望将靶向ret抗肿瘤作用的应用和临床疗效最大化,填补国内自主研发的空白。
[0009]
wo2018149382a1中涉及作为fgfr和ret抑制剂的含邻氨基吡啶炔基的化合物,记载了化合物1及其类似物、制备方法和医药用途,未对其中记载的具体化合物的盐型进行研究和制备。
[0010]
本发明人发现,化合物1水溶性较差,且不稳定,例如,与水混合后会发生转晶现象,其成药性受到严重影响,因此,有必要对化合物1的成药性进行改进,使其满足药品生产、储存和使用的需求。
技术实现要素:
[0011]
为解决上述问题,本发明人对式1所示的含邻氨基吡啶炔基的化合物的盐进行了研究,以期找到溶解性好、吸湿性低、稳定性好、满足用药需求的药物形式。
[0012]
一方面,本发明提供了一种如式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物:
[0013][0014]
其中,ha是酸,选自:盐酸、硫酸、磷酸、乙酸、马来酸、l-酒石酸、富马酸、柠檬酸、l-苹果酸、琥珀酸、己二酸或抗坏血酸;优选为盐酸、硫酸、磷酸、乙酸、l-酒石酸、富马酸、柠檬酸或己二酸;进一步优选为盐酸、富马酸、l-酒石酸或己二酸;进一步优选为盐酸、富马酸或己二酸;更进一步优选为盐酸或己二酸;
[0015]
n为1/2-4的整数或半整数;优选为1/2-3的整数或半整数。
[0016]
本发明的一些方案中,所述含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物,其特征在于,所述盐为式3所示的盐酸盐:
[0017][0018]
n为1-4的整数;优选为1-3的整数;进一步优选为1;
[0019]
优选地,所述盐为式3-1、3-2或3-3所示的盐酸盐:
[0020][0021]
进一步优选地,所述盐为式3-1所示的单盐酸盐。
[0022]
本发明的一些方案中,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:18.7
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
;
[0023]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:18.7
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
、23.1
±
0.2
°
;
[0024]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:17.8
±
0.2
°
、18.7
±
0.2
°
、19.6
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
、23.1
±
0.2
°
;
[0025]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.6
±
0.2
°
、17.8
±
0.2
°
、18.7
±
0.2
°
、19.6
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
、23.1
±
0.2
°
、26.0
±
0.2
°
;
[0026]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.6
±
0.2
°
、17.8
±
0.2
°
、18.1
±
0.2
°
、18.7
±
0.2
°
、19.6
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
、23.1
±
0.2
°
、26.0
±
0.2
°
;
[0027]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:7.8
±
0.2
°
、11.6
±
0.2
°
、17.8
±
0.2
°
、18.1
±
0.2
°
、18.7
±
0.2
°
、19.6
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
、23.1
±
0.2
°
、26.0
±
0.2
°
、28.8
±
0.2
°
;
[0028]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:7.8
±
0.2
°
、11.2
±
0.2
°
、11.6
±
0.2
°
、17.8
±
0.2
°
、18.1
±
0.2
°
、18.7
±
0.2
°
、19.6
±
0.2
°
、20.6
±
0.2
°
、21.3
±
0.2
°
、22.0
±
0.2
°
、22.7
±
0.2
°
、23.1
±
0.2
°
、26.0
±
0.2
°
、28.8
±
0.2
°
,29.5
±
0.2
°
;
[0029]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,其x-射线衍射图谱的特征衍射峰数据如表1所示:
[0030]
表1式3-1所示的单盐酸盐的特征衍射峰数据表(
±
0.2
°
)
[0031][0032][0033]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,其x-射线衍射图谱解析数据如表2所示:
[0034]
表2式3-1所示的单盐酸盐的xrpd解析数据(
±
0.2
°
)
[0035][0036]
或者,所述式3-1所示的单盐酸盐使用cu-kα光源,具有基本上如图1所示的x-射线粉末衍射图谱。
[0037]
本发明的一些方案中,所述式3-1所示的单盐酸盐的单晶使用mo-kα光源,所得单晶属单斜晶系,p21/n空间群,其单胞参数为:/n空间群,其单胞参数为:
[0038]
本发明的一些方案中,所述式3-1所示的单盐酸盐,其差示扫描量热曲线在258.95
±
3℃有一个吸热峰的起始点;
[0039]
本发明的一些方案中,所述式3-1所示的单盐酸盐,其差示扫描量热曲线在260.41
±
3℃有吸热峰;
[0040]
或者,所述式3-1所示的单盐酸盐,其dsc图谱基本上如图4所示。
[0041]
本发明的一些方案中,所述式3-1所示的单盐酸盐,热重分析曲线显示其在260
±
3℃左右开始分解;
[0042]
或者,所述式3-1所示的单盐酸盐,其tga图谱基本上如图5所示。
[0043]
本发明的一些方案中,所述式3-1所示的单盐酸盐,其红外光谱包括在3406.87,3316.33,3179.21,2212.47,1670.88和1117.83cm-1
±
4cm-1
处的特征峰。
[0044]
或者,所述式3-1所示的单盐酸盐,其具有基本上如图7所示的红外光谱。
[0045]
本发明的一些方案中,所述式3-1所示的单盐酸盐,其拉曼光谱包括在3083.50,2217.53,1564.38,1254.30和1129.02cm-1
±
4cm-1
处的特征峰。
[0046]
或者,所述式3-1所示的单盐酸盐,其具有基本上如图8所示的拉曼光谱。
[0047]
本发明的一些方案中,所述含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物,其特征在于,所述盐为式4所示的富马酸盐:
[0048][0049]
n为1/2或1;
[0050]
优选地,所述盐为式4-1所示的富马酸盐:
[0051][0052]
本发明的一些方案中,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.0
±
0.2
°
、15.9
±
0.2
°
、20.4
±
0.2
°
、22.1
±
0.2
°
、28.7
±
0.2
°
;
[0053]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.0
±
0.2
°
、11.2
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、20.4
±
0.2
°
、22.1
±
0.2
°
、28.7
±
0.2
°
;
[0054]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.0
±
0.2
°
、11.2
±
0.2
°
、13.7
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、20.4
±
0.2
°
、22.1
±
0.2
°
、28.7
±
0.2
°
;
[0055]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.0
±
0.2
°
、11.2
±
0.2
°
、13.7
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、20.4
±
0.2
°
、20.8
±
0.2
°
、22.1
±
0.2
°
、26.7
±
0.2
°
、28.7
±
0.2
°
;
[0056]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.0
±
0.2
°
、11.2
±
0.2
°
、13.7
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、20.4
±
0.2
°
、20.8
±
0.2
°
、21.3
±
0.2
°
、22.1
±
0.2
°
、26.7
±
0.2
°
、28.7
±
0.2
°
、29.4
±
0.2
°
;
[0057]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:11.0
±
0.2
°
、11.2
±
0.2
°
、13.7
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、17.5
±
0.2
°
、20.4
±
0.2
°
、20.8
±
0.2
°
、21.3
±
0.2
°
、21.8
±
0.2
°
、22.1
±
0.2
°
、26.7
±
0.2
°
、27.7
±
0.2
°
、28.7
±
0.2
°
、29.4
±
0.2
°
;
[0058]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:10.4
±
0.2
°
、11.0
±
0.2
°
、11.2
±
0.2
°
、13.7
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、17.5
±
0.2
°
、20.4
±
0.2
°
、20.8
±
0.2
°
、21.3
±
0.2
°
、22.1
±
0.2
°
、26.7
±
0.2
°
、27.7
±
0.2
°
、28.7
±
0.2
°
、29.4
±
0.2
°
;
[0059]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:10.4
±
0.2
°
、11.0
±
0.2
°
、11.2
±
0.2
°
、13.7
±
0.2
°
、15.9
±
0.2
°
、16.4
±
0.2
°
、17.5
±
0.2
°
、19.1
±
0.2
°
、20.4
±
0.2
°
、20.8
±
0.2
°
、21.3
±
0.2
°
、22.1
±
0.2
°
、26.7
±
0.2
°
、27.7
±
0.2
°
、28.7
±
0.2
°
、29.4
±
0.2
°
;
[0060]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,其x-射线衍射图谱的特征衍射峰数据如表3所示:
[0061]
表3式4-1所示的富马酸盐的特征衍射峰数据表(
±
0.2
°
)
[0062]
峰位置2θ角(
°
)峰位置2θ角(
°
)峰位置2θ角(
°
)7.216.422.710.417.525.111.019.126.511.220.426.713.020.827.713.721.328.715.521.829.415.922.1 [0063]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,其x-射线衍射图谱解析数据如表4所示:
[0064]
表4式4-1所示的富马酸盐的xrpd解析数据(
±
0.2
°
)
[0065][0066]
或者,所述式4-1所示的富马酸盐使用cu-kα光源,具有基本上如图9所示的x-射线粉末衍射图谱。
[0067]
本发明的一些方案中,所述式4-1所示的富马酸盐,其差示扫描量热曲线在139.58
±
3℃有一个吸热峰的起始点;
[0068]
本发明的一些方案中,所述式4-1所示的富马酸盐,其差示扫描量热曲线在148.05
±
3℃有吸热峰;
[0069]
或者,所述式4-1所示的富马酸盐,其dsc图谱基本上如图10所示。
[0070]
本发明的一些方案中,所述式4-1所示的富马酸盐,热重分析曲线显示其在160
±
3℃左右开始分解;
[0071]
或者,所述式4-1所示的富马酸盐,其tga图谱基本上如图11所示。
[0072]
本发明的一些方案中,所述式4-1所示的富马酸盐,其红外光谱包括在3480.36,3386.77,3160.45,2205.36,1678.20,1256.81和1104.94cm-1
±
4cm-1
处的特征峰。
[0073]
或者,所述式4-1所示的富马酸盐,其具有基本上如图13所示的红外光谱。
[0074]
本发明的一些方案中,所述式4-1所示的富马酸盐,其拉曼光谱包括在3094.82,2209.05,1570.31,1262.55,1119.82和881.52cm-1
±
4cm-1
处的特征峰。
[0075]
或者,所述式4-1所示的富马酸盐,其具有基本上如图14所示的拉曼光谱。
[0076]
本发明的一些方案中,所述含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物,其特征在于,所述盐为式5所示的l-酒石酸盐:
[0077][0078]
n为1/2或1;
[0079]
优选地,所述盐为式5-1所示的l-酒石酸盐:
[0080][0081]
本发明的一些方案中,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、34.0
±
0.2
°
;
[0082]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、24.0
±
0.2
°
、25.1
±
0.2
°
、34.0
±
0.2
°
;
[0083]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、24.0
±
0.2
°
、25.1
±
0.2
°
、29.1
±
0.2
°
、34.0
±
0.2
°
;
[0084]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、24.0
±
0.2
°
、24.3
±
0.2
°
、25.1
±
0.2
°
、29.1
±
0.2
°
、34.0
±
0.2
°
;
[0085]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、20.4
±
0.2
°
、24.0
±
0.2
°
、24.3
±
0.2
°
、25.1
±
0.2
°
、29.1
±
0.2
°
、34.0
±
0.2
°
;
[0086]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、5.9
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、20.4
±
0.2
°
、24.0
±
0.2
°
、24.3
±
0.2
°
、25.1
±
0.2
°
、29.1
±
0.2
°
、34.0
±
0.2
°
;
[0087]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:4.7
±
0.2
°
、5.9
±
0.2
°
、11.9
±
0.2
°
、14.3
±
0.2
°
、16.0
±
0.2
°
、18.8
±
0.2
°
、20.4
±
0.2
°
、24.0
±
0.2
°
、24.3
±
0.2
°
、25.1
±
0.2
°
、25.8
±
0.2
°
、29.1
±
0.2
°
、34.0
±
0.2
°
;
[0088]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,其x-射线衍射图谱解析数据如表5所示:
[0089]
表5式5-1所示的l-酒石酸盐的xrpd解析数据(
±
0.2
°
)
[0090]
峰位置2θ角(
°
)相对峰强度%峰位置2θ角(
°
)相对峰强度%4.777.220.418.85.913.221.68.87.210.024.030.811.982.724.329.814.3100.025.131.016.095.525.810.916.810.129.128.518.811.734.051.3
19.310.2
ꢀꢀ
[0091]
或者,所述式5-1所示的l-酒石酸盐使用cu-kα光源,具有基本上如图15所示的x-射线粉末衍射图谱。
[0092]
本发明的一些方案中,所述式5-1所示的l-酒石酸盐,其差示扫描量热曲线在132.60
±
3℃有一个吸热峰的起始点;
[0093]
本发明的一些方案中,所述式5-1所示的l-酒石酸盐,其差示扫描量热曲线在137.39
±
3℃处有吸热峰;
[0094]
或者,所述式5-1所示的l-酒石酸盐,其dsc图谱基本上如图16所示。
[0095]
本发明的一些方案中,所述式5-1所示的l-酒石酸盐,热重分析曲线显示其在180
±
3℃左右开始分解;
[0096]
或者,所述式5-1所示的l-酒石酸盐,其tga图谱基本上如图17所示。
[0097]
本发明的一些方案中,所述式5-1所示的l-酒石酸盐,其红外光谱包括在3418.82,3109.27,2212.42,1667.13,1193.47和1115.28cm-1
±
4cm-1
处的特征峰。
[0098]
或者,所述式5-1所示的l-酒石酸盐,其具有基本上如图19所示的红外光谱。
[0099]
本发明的一些方案中,所述式5-1所示的l-酒石酸盐,其拉曼光谱包括在3106.41,2220.02,1569.42,1253.83,1125.92和884.44cm-1
±
4cm-1
处的特征峰。
[0100]
或者,所述式5-1所示的l-酒石酸盐,其具有基本上如图20所示的拉曼光谱。
[0101]
本发明的一些方案中,所述含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物,其特征在于,所述盐为式6所示的己二酸盐:
[0102][0103]
n为1/2或1;
[0104]
优选地,所述盐为式6-1所示的己二酸盐:
[0105][0106]
本发明的一些方案中,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
;
[0107]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
、22.4
±
0.2
°
;
[0108]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线
衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、9.2
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、16.0
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
、22.4
±
0.2
°
;
[0109]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、9.2
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、16.0
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
、22.4
±
0.2
°
、26.6
±
0.2
°
;
[0110]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、9.2
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、16.0
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
、22.4
±
0.2
°
、23.9
±
0.2
°
、25.1
±
0.2
°
、26.6
±
0.2
°
;
[0111]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、9.2
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、16.0
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
、22.1
±
0.2
°
、22.4
±
0.2
°
;
[0112]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,以2θ角度(
°
)表示的粉末x-射线衍射图谱在以下位置有特征衍射峰:5.9
±
0.2
°
、9.2
±
0.2
°
、11.9
±
0.2
°
、13.2
±
0.2
°
、16.0
±
0.2
°
、18.4
±
0.2
°
、20.6
±
0.2
°
、22.1
±
0.2
°
、22.4
±
0.2
°
、22.7
±
0.2
°
、26.6
±
0.2
°
;
[0113]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,其x-射线衍射图谱的特征衍射峰数据如表6所示:
[0114]
表6式6-1所示的己二酸盐的特征衍射峰数据表(
±
0.2
°
)
[0115]
峰位置2θ角(
°
)峰位置2θ角(
°
)4.618.45.920.69.222.110.322.411.922.713.223.914.825.116.026.6
[0116]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,其x-射线衍射图谱解析数据如表7所示:
[0117]
表7式6-1所示的己二酸盐的xrpd解析数据(
±
0.2
°
)
[0118]
[0119][0120]
或者,所述式6-1所示的己二酸盐使用cu-kα光源,具有基本上如图21所示的x-射线粉末衍射图谱。
[0121]
本发明的一些方案中,所述式6-1所示的己二酸盐,其差示扫描量热曲线在94.40
±
3℃有一个吸热峰的起始点;
[0122]
本发明的一些方案中,所述式6-1所示的己二酸盐,其差示扫描量热曲线在104.63
±
3℃处有吸热峰;
[0123]
或者,所述式6-1所示的己二酸盐,其dsc图谱基本上如图22所示。
[0124]
本发明的一些方案中,所述式6-1所示的己二酸盐,热重分析曲线显示其在200
±
3℃左右开始分解;
[0125]
或者,所述式6-1所示的己二酸盐,其tga图谱基本上如图23所示。
[0126]
本发明的一些方案中,所述式6-1所示的己二酸盐,其红外光谱包括在3466.14,3390.78,2208.27,1681.15,1321.60,1162.35和1122.38cm-1
±
4cm-1
处的特征峰。
[0127]
或者,所述式6-1所示的己二酸盐,其具有基本上如图25所示的红外光谱。
[0128]
本发明的一些方案中,所述式6-1所示的己二酸盐,其拉曼光谱包括在3164.37,3071.63,2209.84,1568.57和1125.77cm-1
±
4cm-1
处的特征峰。
[0129]
或者,所述式6-1所示的己二酸盐,其具有基本上如图26所示的拉曼光谱。
[0130]
另一方面,本发明提供了一种药物组合物,其包含前述如式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物:
[0131][0132]
其中,ha是酸,选自:盐酸、硫酸、磷酸、乙酸、马来酸、l-酒石酸、富马酸、柠檬酸、l-苹果酸、琥珀酸、己二酸或抗坏血酸;优选为盐酸、硫酸、磷酸、乙酸、l-酒石酸、富马酸、柠檬酸或己二酸;进一步优选为盐酸、富马酸、l-酒石酸或己二酸;进一步优选为盐酸、富马酸或己二酸;更进一步优选为盐酸或己二酸;
[0133]
n为1/2-4的整数或半整数;优选为1/2-3的整数或半整数。
[0134]
本发明的一些方案中,本发明的药物组合物包含前述如式3所示的盐酸盐、其溶剂合物或水合物。
[0135]
本发明的一些方案中,本发明的药物组合物包含前述如式3-1所示的单盐酸盐、其溶剂合物或水合物。
[0136]
本发明的一些方案中,本发明的药物组合物包含前述式4-1所示的富马酸盐、其溶剂合物或水合物。
[0137]
本发明的一些方案中,本发明的药物组合物包含前述式5-1所示的l-酒石酸盐、其溶剂合物或水合物。
[0138]
本发明的一些方案中,本发明的药物组合物包含前述式6-1所示的己二酸盐、其溶剂合物或水合物。
[0139]
本发明的一些方案中,前述药物组合物进一步包含一种或多种可药用的载体。
[0140]
又一方面,本发明提供了前述式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物或药物组合物用于制备作为受体酪氨酸激酶抑制剂药物的用途,所述受体酪氨酸激酶,优选为fgfr、ret和/或它们的突变体中的一种或多种。优选地,所述药物用于治疗涉及fgfr基因、fgfr蛋白、或它们的表达、活性或水平失调的疾病;优选地,所述药物用于治疗涉及ret基因、ret蛋白、或它们的表达、活性或水平失调的疾病;进一步优选地,所述疾病为细胞增殖性疾病;优选地,所述细胞增殖性疾病为肿瘤。
[0141]
本发明还提供了前述式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物或药物组合物在制备抗肿瘤药物中的用途。
[0142]
优选地,前述肿瘤包括非小细胞肺癌、乳腺癌、甲状腺癌、胃癌、食管癌、膀胱癌、子宫内膜癌、前列腺癌、宫颈癌、结直肠癌、胶质母细胞瘤、骨髓瘤、横纹肌肉瘤、急性白血病、肝癌、腺癌、胰腺癌、软组织肉瘤或胃食管结合部癌;其中,所述甲状腺癌包括甲状腺髓样癌和乳头状甲状腺癌;进一步优选地,所述非小细胞肺癌是ret融合性非小细胞肺癌,所述甲状腺髓样癌是ret突变型/融合阳性甲状腺髓样癌。
[0143]
又一方面,本发明还提供了前述式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物或药物组合物,其用于治疗受体酪氨酸激酶介导的相关疾病;优选地,所述受体酪氨酸激酶为fgfr、ret和/或它们的突变体;进一步优选地,所述疾病涉及fgfr基因、fgfr蛋白、或它们的表达、活性或水平失调;进一步优选地,所述疾病涉及ret基因、ret蛋白、或它们的表达、活性或水平失调;进一步优选地,所述疾病为细胞增殖性疾病;更进一步优选地,所述细胞增殖性疾病为肿瘤。
[0144]
本发明还提供了前述式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物或药物组合物,其用于治疗肿瘤。
[0145]
优选地,前述肿瘤包括非小细胞肺癌、乳腺癌、甲状腺癌、胃癌、食管癌、膀胱癌、子宫内膜癌、前列腺癌、宫颈癌、结直肠癌、胶质母细胞瘤、骨髓瘤、横纹肌肉瘤、急性白血病、肝癌、腺癌、胰腺癌、软组织肉瘤或胃食管结合部癌;其中,所述甲状腺癌包括甲状腺髓样癌和乳头状甲状腺癌;优选地,所述非小细胞肺癌是ret融合性非小细胞肺癌,所述甲状腺髓样癌是ret突变型/融合阳性甲状腺髓样癌。
[0146]
又一方面,本发明还提供了一种治疗患者病症的方法,其包括向患者施用治疗有效量的前述式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物或药物组合物,所述患者的病症为受体酪氨酸激酶介导的相关疾病,优选为fgfr、ret和/或它们的突变体介导的相关疾病。优选地,所述疾病涉及fgfr基因、fgfr蛋白、或它们的表达、活性或水平
失调;进一步优选地,所述疾病涉及ret基因、ret蛋白、或它们的表达、活性或水平失调;进一步优选地,所述疾病为细胞增殖性疾病;更进一步优选地,所述细胞增殖性疾病为肿瘤。
[0147]
本发明还提供了一种治疗患者肿瘤疾病的方法,其包括向患者施用治疗有效量的前述式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物或药物组合物。
[0148]
优选地,前述肿瘤或患者的肿瘤疾病包括非小细胞肺癌、乳腺癌、甲状腺癌、胃癌、食管癌、膀胱癌、子宫内膜癌、前列腺癌、宫颈癌、结直肠癌、胶质母细胞瘤、骨髓瘤、横纹肌肉瘤、急性白血病、肝癌、腺癌、胰腺癌、软组织肉瘤或胃食管结合部癌;其中,所述甲状腺癌包括甲状腺髓样癌和乳头状甲状腺癌;优选地,所述非小细胞肺癌是ret融合性非小细胞肺癌,所述甲状腺髓样癌是ret突变型/融合阳性甲状腺髓样癌。
[0149]
又一方面,本发明提供了一种式2所示的含邻氨基吡啶炔基的化合物的盐的制备方法,包括将式1所示的含邻氨基吡啶炔基的化合物与酸在适宜溶剂中进行反应,分离得到式2所示的含邻氨基吡啶炔基的化合物的盐:
[0150][0151]
其中,
[0152]
ha是酸;
[0153]
n为1/2-4的整数或半整数;优选为1/2-3的整数或半整数。
[0154]
根据本发明的制备方法,所述式1所示的含邻氨基吡啶炔基的化合物与酸的摩尔比为1~2:0.5~3,优选为1~2:0.5~2,进一步优选为1~2:0.5~1。
[0155]
根据本发明的制备方法,反应温度为0-70℃,优选20-60℃,更优选为25-60℃。
[0156]
根据本发明的制备方法,反应溶剂选自醇类、酮类、腈类、水或杂环烷烃类溶剂中的一种或者两种的组合;优选为低级醇类、低级酮类、低级腈类、水或低级杂环烷烃类溶剂;进一步优选为甲醇、乙醇、丙酮、乙腈、水或四氢呋喃;优选为腈类溶剂,或腈类和水的混合溶剂;更优选为:乙腈或乙腈-水;有机溶剂与水的用量体积比为1~10:0~10,优选为1~9:0~5,优选为1~9:0~1,所述有机溶剂为前述除水之外的其它溶剂。
[0157]
根据本发明的制备方法,所述反应进行完毕,降温至0~30℃,静置析晶0.5~24h,分离固体,干燥,得式2所示的含邻氨基吡啶炔基的化合物的盐。优选地,析晶温度为室温,析晶时间为1~12h。
[0158]
根据本发明的制备方法,所述分离步骤包括采用过滤、离心等适宜的方法将所得式2所示的含邻氨基吡啶炔基的化合物的盐从结晶液中分离出来。
[0159]
根据本发明的制备方法,所述干燥方法可采用任何适宜的已知方法,优选为室温挥干。具体的干燥条件是,例如,干燥时间优选为1~50h,更优选为5~24h。无论采用何种干燥手段,都以所得产品中溶剂残留量符合质量标准为宜。
[0160]
式1所示的含邻氨基吡啶炔基的化合物可参照现有技术公开方法,如wo2018149382a1记载方法进行制备,上述文献内容在此引入作为参考。
[0161]
有益效果
[0162]
本发明提供式2所示的含邻氨基吡啶炔基的化合物的盐、其溶剂合物或水合物,尤其是盐酸盐、富马酸盐、l-酒石酸盐和己二酸盐,该些盐可以制备成固体,并进一步制备成晶型,特别是式3-1所示的单盐酸盐、式4-1所示的富马酸盐、式5-1所示的l-酒石酸盐和式6-1所示的己二酸盐,相对于式1所示的含邻氨基吡啶炔基的化合物的水中溶解度有显著改善,且具备结晶度良好、能够稳定存在和纯度高的特点,进一步地,式3-1所示的单盐酸盐、式4-1所示的富马酸盐和式6-1所示的己二酸盐还具备引湿性低的特点。综上所述,本发明提供的几种式2所示化合物的盐、其溶剂合物或水合物,相对于式1所示的含邻氨基吡啶炔基的化合物或其他盐更易于成药。
附图说明
[0163]
图1:实施例1所得化合物1的单盐酸盐的xrpd谱图。
[0164]
图2:实施例1所得化合物1的单盐酸盐的不对称单晶示意图。
[0165]
图3:实施例1所得化合物1的单盐酸盐的单晶xrpd模拟图。
[0166]
图4:实施例1所得化合物1的单盐酸盐的差示扫描量热分析(dsc)图。
[0167]
图5:实施例1所得化合物1的单盐酸盐的热失重分析(tga)图。
[0168]
图6:实施例1所得化合物1的单盐酸盐的吸湿性分析(dvs)图。
[0169]
图7:实施例1所得化合物1的单盐酸盐的红外光谱(ir)图。
[0170]
图8:实施例1所得化合物1的单盐酸盐的拉曼光谱(raman)图。
[0171]
图9:实施例2所得化合物1的富马酸盐的xrpd谱图。
[0172]
图10:实施例2所得化合物1的富马酸盐的差示扫描量热分析(dsc)图。
[0173]
图11:实施例2所得化合物1的富马酸盐的热失重分析(tga)图。
[0174]
图12:实施例2所得化合物1的富马酸盐的吸湿性分析(dvs)图。
[0175]
图13:实施例2所得化合物1的富马酸盐的红外光谱(ir)图。
[0176]
图14:实施例2所得化合物1的富马酸盐的拉曼光谱(raman)图。
[0177]
图15:实施例3所得化合物1的l-酒石酸盐的xrpd谱图。
[0178]
图16:实施例3所得化合物1的l-酒石酸盐的差示扫描量热分析(dsc)图。
[0179]
图17:实施例3所得化合物1的l-酒石酸盐的热失重分析(tga)图。
[0180]
图18:实施例3所得化合物1的l-酒石酸盐的吸湿性分析(dvs)图。
[0181]
图19:实施例3所得化合物1的l-酒石酸盐的红外光谱(ir)图。
[0182]
图20:实施例3所得化合物1的l-酒石酸盐的拉曼光谱(raman)图。
[0183]
图21:实施例4所得化合物1的己二酸盐的xrpd谱图。
[0184]
图22:实施例4所得化合物1的己二酸盐的差示扫描量热分析(dsc)图。
[0185]
图23:实施例4所得化合物1的己二酸盐的热失重分析(tga)图。
[0186]
图24:实施例4所得化合物1的己二酸盐的吸湿性分析(dvs)图。
[0187]
图25:实施例4所得化合物1的己二酸盐的红外光谱(ir)图。
[0188]
图26:实施例4所得化合物1的己二酸盐的拉曼光谱(raman)图。
[0189]
图27:实施例4所得化合物1的己二酸盐的核磁氢谱(1h-nmr)图。
[0190]
图28:制备例1所得化合物1(重结晶)的吸湿性分析(dvs)图。
[0191]
图29:对比例3中化合物1与盐酸反应(当量比为1:2)后所得产物的xrpd谱图。
[0192]
图30:对比例3中化合物1与盐酸反应(当量比为1:3)后所得产物的xrpd谱图。
具体实施方式
[0193]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0194]
定义和说明
[0195]
除非另有说明,本文所用的下列术语和短语旨在含有下列含义。一个特定的短语或术语在没有特别定义的情况下不应该被认为是不确定的或不清楚的,而应该按照普通的含义去理解。当本文出现商品名时,旨在指代其对应的商品或其活性成分。
[0196]
在本文中,术语“患者”包括动物界的所有成员,包含但不限于,哺乳动物(例如,小鼠、大鼠、猫、猴子、狗、猪等)和人。
[0197]
在本文中,术语“基本上如图
……
所示”是指x-射线粉末衍射图谱、dsc图谱、tga图谱、ir图谱或raman图谱中至少50%,或至少60%,或至少70%,或至少80%,或至少90%,或至少95%,或至少96%,或至少97%,或至少98%,或至少99%的峰显示在该图中。
[0198]
在本文中,术语“低级醇、低级酮、低级腈或低级杂环烷烃”是指含有1-6个碳原子的醇类、酮类、腈类或杂环烷烃类(直链或支链)有机溶剂。
[0199]
在本文中,所述的“突变体”或“激酶突变体”是指因发生了基因融合、扩增、重排、突变或高表达,而产生的表达、活性或水平失调的蛋白或激酶,例如,基因融合型fgfr2、基因融合型ret、突变型ret等,优选为基因融合、扩增或突变,更优选为基因融合或突变。
[0200]
本发明中的化合物可以通过本领域技术人员所熟知的多种合成方法来制备,包括下面列举的具体实施方式、其与其它化学合成方法的结合所形成的实施方式以及本领域技术人员所熟知的等同替换方式,优选的实施方式包括但不限于本发明的实施例。
[0201]
本发明具体实施方式的化学反应是在合适的溶剂中完成的,所述的溶剂须适合于本发明的化学变化及其所需的试剂或物料。为了获得本发明的化合物,有时需要本领域技术人员在已有实施方式的基础上对合成步骤或者反应流程进行修改或选择。
[0202]
实施例
[0203]
下面会通过实施例具体描述本发明,这些实施例并不意味着对本发明的任何限制。
[0204]
本发明所使用的所有溶剂均是市售的,无需进一步纯化即可使用。
[0205]
本发明采用下述缩略词:acn:乙腈;meoh:甲醇;thf:四氢呋喃;h2o:水;tfa:三氟乙酸;dmso:二甲基亚砜。
[0206]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0207]
以下实施例中,分析检测条件如下:
[0208]
1、含量
[0209]
检测仪器:agilent 1260(lc1260-3-dad)高效液相色谱仪
[0210]
柱子:c18 4.6*150mm,5μm
[0211]
测试条件:波长280nm;柱温30℃;
[0212]
流动相:a:0.1%tfa水溶液;b:meoh
[0213]
采用化合物1标准品,按外标法以峰面积计算样品中化合物1的含量。
[0214]
2、引湿性
[0215]
检测仪器:sms dvs advantage动态蒸汽吸附仪
[0216]
测试条件:取样品(10~20mg)置于dvs样品盘内进行测试。
[0217]
详细的dvs参数如下:
[0218]
温度:25℃
[0219]
平衡:dm/dt=0.01%/min(最短:10min,最长:180min)
[0220]
干燥:0%rh下干燥120min
[0221]
rh(%)测试梯级:5%
[0222]
rh(%)测试范围:5%~95%
[0223]
引湿性特征描述与引湿性增重的界定:
[0224][0225][0226]
3、溶解度
[0227]
检测仪器:agilent 1260(lc1260-3-dad)高效液相色谱仪
[0228]
检测介质:纯化水、ph 2.0磷酸-磷酸氢二钠缓冲液
[0229]
样品制备:将过量的化合物1及各种盐与1ml检测介质混合搅拌,制成饱和溶液,记录加入量,保证溶液中有过量固体存在,室温搅拌24小时,每个实验平行两份;离心,取上清液,过滤,加溶剂稀释至一定体积,用hplc测定含量。
[0230]
对照品溶液制备:取式1化合物对照品适量,精密称定,加溶剂使其完全溶解,使用hplc测定对照品溶液中化合物1的含量。
[0231]
计算方法:外标一点法。
[0232]
计算公式:w=a*w0/a0,其中w为待检测样品的溶解质量,a为待检测样品的hplc含量,w0为对照品的溶解质量,a0为对照品的hplc含量。
[0233]
4、x-射线粉末衍射(x-ray powder diffraction,xrpd)
[0234]
检测仪器:bruker d8 advance diffractometer型粉末x-射线衍射仪
[0235]
测试条件:
[0236]
光管类型:cu靶,金属陶瓷x光管;
[0237]
x-射线波长:cukα,k:1.5418;
[0238]
电压电流:40kv,40ma;
[0239]
扫描范围:3~40
°
2θ或4~40
°
2θ;
[0240]
扫描速度:0.5秒/步;
[0241]
样品用量:3mg
[0242]
采集软件:diffrac plus xrd commander
[0243]
分析软件:mdi jade 6.0
[0244]
5、差示扫描量热分析(differential scanning calorimetry,dsc)
[0245]
检测仪器:ta q2000差示扫描量热仪
[0246]
仪器控制软件:thermal advantage
[0247]
分析软件:universal analysis
[0248]
测试方法:称取样品5mg,置于dsc铝锅内进行测试,在20ml/min干燥氮气的条件下,以10℃/min的升温速率,加热样品从室温至300℃。
[0249]
6、热重分析(thermogravimetric analysis,tga)
[0250]
检测仪器:耐驰tg209f3热重分析仪
[0251]
测试方法:称取样品5mg,置于tga铂金锅内进行测试,在40ml/min干燥氮气的条件下,以10℃/min的升温速率,加热样品从室温至400℃。
[0252]
仪器控制软件:netzsch-proteus-6
[0253]
分析软件:proteus analysis
[0254]
7、红外光谱(infrared spectroscopy,ir)
[0255]
检测仪器:nicolet-magna ft-ir 750红外光谱分析仪
[0256]
测试方法:称取样品3mg,用kbr稀释压片,室温下进行监测,具体参数为:检测范围:4000-350cm-1
波数,分辨率:4cm-1
。
[0257]
8、拉曼光谱(raman spectroscopy)
[0258]
检测仪器:thermo scientific dxr激光显微拉曼光谱仪
[0259]
测试方法:称取样品约2mg平铺于玻璃板,室温下进行监测,具体参数为:激光波长:780nm;扫描范围:3500-50cm-1
波数,分辨率:2cm-1
。
[0260]
9、核磁共振波谱(nuclear magnetic resonance spectroscopy,nmrs)
[0261]
检测仪器:varian mercury 400型超导核磁共振谱仪
[0262]
内容及测试溶剂:1h-nmr,测试溶剂为dmso-d6。
[0263]
10、单晶
[0264]
单晶衍射数据使用bruker apex-ii ccd diffractometer(mo-ka radiation,)型单晶衍射仪在173k温度下收集。
[0265]
制备例1:化合物1的制备
[0266][0267]
参考专利文献wo 2018149382a1中实施例7所记载的方法,制备得到式1所示化合物。对该化合物进行重结晶(乙醇),得白色固体。ir(kbr,cm-1
):3464.05,3290.26,3134.16,2206.72,1663.59,1115.48。raman(cm-1
):3097.45,2212.28,1569.73,1256.15,1120.38。
[0268]
实施例1:化合物1的单盐酸盐的制备
[0269][0270]
称取制备例1所得的化合物1(重结晶样品,下同)(204mg,0.4mmol)于茄型瓶中,加入定量乙腈溶剂,配制成10ml 0.04m的溶液,加入0.04m配制好的盐酸乙腈溶液(10ml),将反应相在60℃条件下混悬1小时后,冷却至室温,静置12h。过滤得到固体,用少量乙腈洗涤3次,所得固体在室温进行挥干,得盐酸盐白色固体196.7mg。ir(kbr,cm-1
):3406.87,3316.33,3179.21,2212.47,1670.88,1117.83。raman(cm-1
):3083.50,2217.53,1564.38,1254.30,1129.02。所得单盐酸盐呈现良好的结晶性,其xrpd表征谱图如图1所示。
[0271]
单晶制备:称取上述制备所得的盐酸盐(10mg)于茄型瓶中,加入甲醇溶剂(10ml)使其溶解,室温敞口挥干溶剂,得到化合物1的盐酸盐的单晶。使用mo-kα光源,所得单晶属单斜晶系,p21/n空间群,其单胞参数为:/n空间群,其单胞参数为:
[0272]
根据单晶衍射确定盐酸与化合物1的比例,推定分子式为cl
·c27h26
f4n5o,分子量为547.98,化合物1的盐酸盐的不对称单晶示意图如图2所示,预测得到的该单晶的xrpd解析数据如表8所示,xrpd模拟图如图3所示。因此,可以推断得到该盐酸盐的碱/酸比为1:1。
[0273]
表8式3-1所示单盐酸盐单晶的模拟xrpd解析数据
[0274][0275]
本实施例中所得化合物1的单盐酸盐的差示扫描量热分析(dsc)图、热失重分析(tga)图、吸湿性分析(dvs)图、红外光谱图、拉曼光谱图分别如图4至图8所示。
[0276]
实施例2:化合物1的富马酸盐的制备
[0277][0278]
称取制备例1所得的化合物1(204mg,0.4mmol)于茄型瓶中,加入定量乙腈溶剂,配制成10ml 0.04m的溶液,加入富马酸(23.2mg),将反应相在60℃条件下混悬1小时后,冷却至室温,静置12h。过滤得到固体,用少量乙腈洗涤3次,所得固体在室温进行挥干,得富马酸盐白色固体204mg。ir(kbr,cm-1
):3480.36,3386.77,3160.45,2205.36,1678.20,1256.81,1104.94。raman(cm-1
):3094.82,2209.05,1570.31,1262.55,1119.82,881.52。所得富马酸盐呈现良好的结晶性,其xrpd表征谱图如图9所示。
[0279]
通过hplc计算自由碱含量(见下表),可以推断得到该富马酸盐的碱/酸比为2:1。
[0280][0281]
本实施例中所得化合物1的富马酸盐的差示扫描量热分析(dsc)图、热失重分析(tga)图、吸湿性分析(dvs)图、红外光谱图、拉曼光谱图分别如图10至图14所示。
[0282]
实施例3:化合物1的l-酒石酸盐的制备
[0283][0284]
称取制备例1所得的化合物1(204mg,0.4mmol)于茄型瓶中,加入定量乙腈溶剂,配制成10ml 0.04m的溶液,加入0.04m配制好的l-酒石酸乙腈溶液(5ml),将反应相在60℃条件下混悬1小时后,冷却至室温,静置12h。过滤得到固体,用少量乙腈洗涤3次,所得固体在室温进行挥干,得l-酒石酸盐白色固体210.5mg。ir(kbr,cm-1
):3418.82,3109.27,2212.42,1667.13,1193.47,1115.28。raman(cm-1
):3106.41,2220.02,1569.42,1253.83,1125.92,884.44。所得l-酒石酸盐呈现良好的结晶性,其xrpd表征谱图如图15所示。
[0285]
通过hplc计算自由碱含量(见下表),可以推断得到该l-酒石酸盐的碱/酸比为2:1。
[0286][0287]
本实施例中所得化合物1的l-酒石酸盐的差示扫描量热分析(dsc)图、热失重分析(tga)图、吸湿性分析(dvs)图、红外光谱图、拉曼光谱图分别如图16至图20所示。
[0288]
实施例4:化合物1的己二酸盐的制备
[0289][0290]
称取制备例1所得的化合物1(204mg,0.4mmol)于茄型瓶中,加入定量乙腈溶剂,配制成10ml 0.04m的溶液,加入0.04m配制好的己二酸乙腈溶液(10ml),将反应相在60℃条件下混悬1小时后,冷却至室温,静置24h。过滤得到固体,用少量乙腈洗涤3次,所得固体在室温进行挥干,得己二酸盐白色固体236mg。ir(kbr,cm-1
):3466.14,3390.78,2208.27,1681.15,1321.60,1162.35,1122.38。raman(cm-1
):3164.37,3071.63,2209.84,1568.57,1125.77。所得己二酸盐呈现良好的结晶性,其xrpd表征谱图如图21所示。
[0291]
本实施例中所得化合物1的己二酸盐的差示扫描量热分析(dsc)图、热失重分析(tga)图、吸湿性分析(dvs)图、红外光谱图、拉曼光谱图分别如图22至图26所示。
[0292]
通过hplc计算自由碱含量,再结合核磁共振中1h-nmr中氢的比例(图27),可以推断得到该己二酸盐的碱/酸比为1:1。
[0293][0294]a:n-甲基哌嗪环所连接的亚甲基与己二酸3位或4位亚甲基氢原子数的比例对比例1:马来酸盐、琥珀酸盐、l-苹果酸盐、抗坏血酸盐和甲磺酸盐的制备
[0295]
取40份制备例1所得的样品于2ml的玻璃瓶中,每份样品约10.2mg,按照下表分别加入1.0ml的八种不同溶剂,尽量使其溶解。按下表加入等量的四种酸溶液,然后在超声中完全混合,之后在60℃的烘箱中加热1小时,观察反应现象,如下表9所示。
[0296]
表9成盐反应结果
[0297] 马来酸l-苹果酸琥珀酸抗坏血酸甲磺酸meoh
×××××
丙酮
×××××
acn
×××××
thf
×××××
meoh/h2o=9/1
×××××
丙酮/h2o=9/1
×××××
acn/h2o=9/1
×××××
thf/h2o=9/1
×××××
[0298]
√代表溶液有固体析出;
×
代表溶液澄清,无变化
[0299]
结果:反应体系中均未见固体析出。进一步将化合物1与五种酸(马来酸、琥珀酸、l-苹果酸、抗坏血酸和甲磺酸)在各种反应液中室温挥干发现,这五种酸反应后所得的盐均为油状物,再次进行重结晶,发现得到的盐仍为玻璃态固体或油状物。
[0300]
对比例2:柠檬酸盐、乙酸盐、硫酸盐以及磷酸盐的制备
[0301]
取4份制备例1所得的样品于25ml的玻璃瓶中,每份样品约100mg,分别加入10.0ml的乙腈,尽量使其溶解。加入等量的四种酸(柠檬酸、乙酸、硫酸以及磷酸)溶液,然后在超声中完全混合,之后在60℃的烘箱中加热1小时,观察反应现象。
[0302]
结果:化合物1与柠檬酸、乙酸、硫酸以及磷酸反应后的固体性状(流动性、结晶度等)差,经过进一步结晶处理后(挥发或反溶剂结晶)得到的样品基本为无定型。
[0303]
对比例3:不同比例盐酸盐的制备
[0304][0305]
调整化合物1(投料量200mg)与盐酸的反应当量比(1:2或1:3),反应操作方法同实施例1,分别得到式3-2所示化合物和式3-3所示化合物,对产物性状进行观测,对化合物1/盐酸的化学计量比进行检测,结果如下表10所示:
[0306]
表10不同比例盐酸盐的反应产物结果
[0307]
化合物1与盐酸的当量比实测氯离子含量理论氯离子含量产物性状1:212.8%10.8%固体,结晶度较差1:317.5%15.33%固体,结晶度较差
[0308]
此外,对不同比例反应产物进行x-射线粉末衍射检测,式3-2所示化合物(1:2反应产物)的xrpd图如图29所示,其xrpd解析数据如下表11所示。
[0309]
表11式3-2所示的化合物1的二盐酸盐的xrpd解析数据
[0310]
峰位置2θ角(
°
)相对峰强度%4.528.27.825.09.625.011.617.915.027.615.719.216.018.617.819.918.810019.727.621.367.922.054.522.762.224.317.326.843.6
[0311]
式3-3所示化合物(1:3反应产物)的xrpd图如图30所示,其xrpd解析数据如下表12所示。
[0312]
表12式3-3所示的化合物1的三盐酸盐的xrpd解析数据
[0313]
峰位置2θ角(
°
)相对峰强度%4.568.37.250.09.545.015.055.022.760.024.945.026.5100.0
[0314]
结果:经过检测,式3-2所示的化合物1的二盐酸盐(当量比为1:2的产物)的结晶度变差,式3-3所示的化合物1的三盐酸盐(当量比为1:3的产物)基本为无定型。以上结果说明,在不同反应比例所得盐酸盐中,单盐酸盐(当量比为1:1的产物)的结晶度最好。
[0315]
测试例1:dsc及tga测试
[0316]
取制备例1与实施例1-4所得盐样品适量,进行dsc和tga测试,测试结果如下表13所示:
[0317]
表13不同样品的dsc和tga结果
[0318][0319]
测试例2:溶解度测试
[0320]
将制备例1与实施例1-4所得盐在介质中进行溶解度测试,测试结果如下表14所示:
[0321]
表14不同样品的溶解度结果
[0322][0323]
结果:同制备例1(重结晶样品)相比,四种盐的水中溶解度至少提高9倍,其中,己二酸盐的溶解度最好;另外,经检测发现,制备例1(重结晶样品)在水中未溶解的固体发生晶型转变;在酸性体系(ph 2.0缓冲液)中,制备例1的溶解度最好,单盐酸盐和己二酸盐也具有良好的溶解性能,富马酸盐和l-酒石酸盐次之,较水中溶解度均有明显提升。
[0324]
测试例3:加速稳定性测试
[0325]
取制备例1与实施例1-4所得盐样品适量,在40
±
2℃;75%
±
5%rh,聚乙烯膜封口放置10天,进行加速试验,结果如下表15所示:
[0326]
表15不同样品的稳定性结果及晶型检测结果
[0327][0328][0329]
取对比例2所得二盐酸盐和三盐酸盐样品适量,在40
±
2℃;75%
±
5%rh,无包装敞口放置10天,进行加速试验,结果如下表16所示:
[0330]
表16不同样品的稳定性结果及晶型检测结果
[0331][0332]
测试例4:吸湿性测试
[0333]
取制备例1与实施例1-4所得盐样品适量,进行dvs测试,在25
±
1℃,相对湿度范围为80%
±
2%时,各样品的吸湿性结果如下表17所示:
[0334]
表17不同样品的引湿性结果
[0335][0336]
单盐酸盐、富马酸盐和己二酸盐均为略有引湿性,l-酒石酸盐有一定引湿性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1