一种提取细菌质粒DNA的菌体裂解液、试剂盒及方法与流程
一种提取细菌质粒dna的菌体裂解液、试剂盒及方法
技术领域
1.本发明涉及生物技术领域,尤其涉及一种提取细菌质粒dna的菌体裂解液、试剂盒及方法。
背景技术:
2.质粒是染色体外可以自主复制的遗传单位,包括真核生物细胞器和细菌染色体以外的dna分子。绝大多数的细菌质粒dna都是双链闭合环状的dna分子,常带有抗生素抗性基因,例如抗氨苄青霉素抗性和抗氯霉素抗性等。
3.质粒dna是一种基因运载工具,广泛的应用于分子生物学研究中,涉及到基因克隆、基因序列分析、基因疫苗和基因编辑等各个领域。从细菌中提取质粒dna分子是分子生物学实验中最基本的操作。同时质粒dna分子提取的效率、纯度和质量直接关系到后续各类分子生物学实验的进行,如影响酶切连接、转化、转染、扩增和测序等实验的成败。质粒dna提取的主要步骤包括细菌的培养、细菌的收集和裂解以及质粒dna的分离纯化。从裂解方式来讲,常见的质粒提取方法有碱裂解法和煮沸法。碱裂解法是目前实验室中最常用和经典的方法,其中碱裂解步骤需要三种溶液处理:溶液i主要成分是tris
‑
hcl(三羟甲基氨基甲烷盐酸盐)和edta(乙二胺四乙酸),用于将菌体沉淀充分悬浮起来;溶液ii主要成分是naoh和sds(十二烷基硫酸钠),主要作用是细胞裂解和破坏细胞膜的结构,同时使染色体dna氢键断裂,sds可以增强碱性,同时sds结合蛋白质,产生沉淀;溶液iii主要成分是醋酸和醋酸钾,作用是中和溶液ii中的氢氧化钠,恢复溶液体系至中性,质粒dna的两条互补链复性迅速而准确,而染色体dna较难复性形成缠绕的网状结构,与蛋白质
‑
sds复合物等杂质通过离心沉淀。碱裂解法提取的质粒纯度高,得率高,但该方法操作相对繁琐,所需操作时间较长。煮沸法相对较为传统和粗放,要求在100℃的条件下进行裂解,条件过于剧烈,易导致质粒发生断裂,且在实验操作中难以控制。
4.目前大多数市售的质粒dna的提取试剂盒,均是以碱裂解法为基础结合纯化柱来分离纯化质粒dna。现有技术中也存在一步法提取质粒方法的报道,但所用试剂盒的裂解试剂组分成分偏多,且均是需要溶菌酶协同增加裂解效果,以及rnasea酶参与去除rna对于质粒提取的干扰。然而溶菌酶和rnasea的加入会增加试剂成本,同时对于试剂的保存和运输条件也有较高要求。
技术实现要素:
5.本发明的目的在于提供一种提取细菌质粒dna的菌体裂解液、试剂盒及方法,该方法实现了一步法裂解菌体即上柱,操作简单,操作时间短,且菌体裂解液的组分简单,成本低,使用该菌体裂解液的试剂盒提取质粒dna的提取效率高,在生物研究实验中具有一定优势。
6.为实现以上目的,本技术采用以下技术方案:
7.一种提取细菌质粒dna的菌体裂解液,所述菌体裂解液的组成为:4
‑
5m蛋白质变性
剂、100
‑
500mm氯化钠、2
‑
3wt%表面活性剂、38
‑
62mm ph缓冲剂和余量的水;所述蛋白质变性剂包括异硫氰酸胍和盐酸胍中的至少一种。
8.在一些实施方式中,所述表面活性剂包括triton x
‑
100和tween
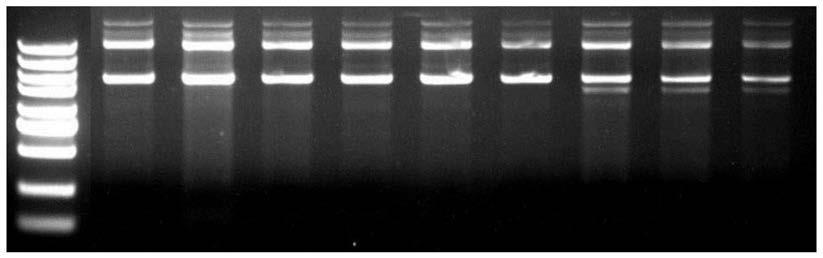
‑
20中的至少一种;
9.在一些实施方式中,所述ph缓冲剂包括柠檬酸、柠檬酸钠、醋酸和醋酸钠中的至少一种。
10.本技术还提供了一种提取细菌质粒dna的试剂盒,其所述试剂盒包括菌体裂解液、洗涤液和洗脱液;所述菌体裂解液为上述的菌体裂解液。
11.在一些实施方式中,所述洗涤液包括洗涤液a和洗涤液b;
12.所述洗涤液a的组成为:0.5
‑
3m盐酸胍、30
‑
70wt%异丙醇和余量的水;
13.所述洗涤液b的组成为:40
‑
80mm tris
‑
hcl和40
‑
80wt%乙醇,所述洗涤液b的ph为6.5
‑
8.5。
14.在一些实施方式中,所述洗脱液的组成为:2
‑
10mm tris
‑
hcl;所述洗脱液的ph为6.5
‑
8.5。
15.在一些实施方式中,所述试剂盒还包括硅胶膜吸附柱。
16.本技术还提供了一种提取细菌质粒dna的方法,采用上述的提取细菌质粒dna的试剂盒提取得到。
17.在一些实施方式中,所述方法包括:
18.将带有质粒的菌株进行扩增培养得到菌液,将所述菌液进行离心分离,收集菌体沉淀物;
19.使用所述菌体裂解液对所述菌体沉淀物进行菌体裂解,得到菌体裂解物;
20.使用所述洗涤液和洗脱液对所述菌体裂解物进行分离纯化处理。
21.在一些实施方式中,所述扩增培养的过程包括:在含有抗生素的lb培养基中接种带有质粒的菌株培养;
22.优选地,所述培养的温度为30
‑
37℃,时间为12
‑
16h;
23.在一些实施方式中,使用所述菌体裂解液对所述菌体沉淀物进行菌体裂解的过程包括:将所述菌体沉淀物和所述菌体裂解液混合均匀,然后静置。
24.在一些实施方式中,所述分离纯化处理的过程包括:将所述菌体裂解物转移至硅胶膜吸附柱中,静置后进行离心分离,弃液体,然后加入洗涤液,静置后离心分离,弃液体;再加入洗脱液,静置后离心分离,得到质粒dna溶液。
25.本发明的有益效果:
26.本技术的提取细菌质粒dna的菌体裂解液中组成成分包含蛋白质变性剂、氯化钠、表面活性剂和ph缓冲剂,主要利用表面活性剂和蛋白质变性剂(异硫氰酸胍和盐酸胍中的至少一种)协同作用对菌体细胞进行裂解;通过ph缓冲剂和氯化钠调节菌体裂解液的ph在3
‑
4之间,能够将gdna、质粒dna和rna进行很好的区分,同时使得质粒dna与硅胶吸附膜在此条件下能够更好的结合;该菌体裂解液的组成成分简单,成本低,不含有溶菌酶和rnasea酶,可在室温下长期稳定保存且对后续实验无影响;使用该菌体裂解液的试剂盒提取质粒dna的提取效率高,速度快,可以满足多种生物实验需求。
附图说明
27.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对本发明范围的限定。
28.图1为实施例1
‑
3的试剂盒提取高拷贝质粒dna(puc57)的琼脂糖凝胶电泳结果图;
29.图2为实施例1、实施例4和实施例5的试剂盒提取高拷贝质粒dna(puc57)的琼脂糖凝胶电泳结果图;
30.图3为实施例5放入试剂盒和市售的试剂盒提取高拷贝质粒dna(puc57)的琼脂糖凝胶电泳结果图;
31.图4为实施例5和对比例1的试剂盒提取高拷贝质粒dna(puc57)的琼脂糖凝胶电泳结果图;
32.图5为对比例2、对比例3和实施例5的试剂盒提取高拷贝质粒dna(puc57)的琼脂糖凝胶电泳结果图;
33.图6为实施例5的试剂盒提取低拷贝质粒dna(8k)的琼脂糖凝胶电泳结果图。
具体实施方式
34.如本文所用之术语:
[0035]“由
……
制备”与“包含”同义。本文中所用的术语“包含”、“包括”、“具有”、“含有”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
[0036]
连接词“由
……
组成”排除任何未指出的要素、步骤或组分。如果用于权利要求中,此短语将使权利要求为封闭式,使其不包含除那些描述的材料以外的材料,但与其相关的常规杂质除外。当短语“由
……
组成”出现在权利要求主体的子句中而不是紧接在主题之后时,其仅限定在该子句中描述的要素;其它要素并不被排除在作为整体的所述权利要求之外。
[0037]
当量、浓度、或者其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“1~5”时,所描述的范围应被解释为包括范围“1~4”、“1~3”、“1~2”、“1~2和4~5”、“1~3和5”等。当数值范围在本文中被描述时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。
[0038]
在这些实施例中,除非另有指明,所述的份和百分比均按质量计。
[0039]“质量份”指表示多个组分的质量比例关系的基本计量单位,1份可表示任意的单位质量,如可以表示为1g,也可表示2.689g等。假如我们说a组分的质量份为a份,b组分的质量份为b份,则表示a组分的质量和b组分的质量之比a:b。或者,表示a组分的质量为ak,b组分的质量为bk(k为任意数,表示倍数因子)。不可误解的是,与质量份数不同的是,所有组分的质量份之和并不受限于100份之限制。
[0040]“和/或”用于表示所说明的情况的一者或两者均可能发生,例如,a和/或b包括(a
和b)和(a或b)。
[0041]
本技术提供一种提取细菌质粒dna的菌体裂解液,所述菌体裂解液的组成为:4
‑
5m蛋白质变性剂、100
‑
500mm氯化钠、2
‑
3wt%表面活性剂、38
‑
62mm ph缓冲剂和余量的水。
[0042]
所述蛋白质变性剂包括异硫氰酸胍和盐酸胍中的至少一种;蛋白质变性剂能迅速溶解蛋白质,导致细胞结构破碎,核蛋白由于其二级结构的破坏消失而迅速与核酸分离;蛋白质变性剂优选异硫氰酸胍,可以使多数蛋白质转换成随机的曲卷状态,能够迅速破碎细胞。
[0043]
在一些实施方式中,所述表面活性剂包括triton x
‑
100和tween
‑
20中的至少一种;该表面活性剂可以溶解细胞膜、细胞核膜、细胞器膜上的脂质,增加细胞膜的通透性;可调节dna在水中的溶解度且不破坏其结构。
[0044]
在一些实施方式中,所述ph缓冲剂包括柠檬酸、柠檬酸钠、醋酸和醋酸钠中的至少一种;优选地,所述ph缓冲剂为柠檬酸和柠檬酸钠按照(27
‑
39):(11
‑
23)的混合物。柠檬酸钠是一种弱酸强碱盐,与柠檬酸配伍可组成较强的ph缓冲剂,可以小范围进行ph调节;另外,柠檬酸钠还具有优良的缓凝性能及稳定性能。
[0045]
本技术的提取细菌质粒dna的菌体裂解液中组成成分包含蛋白质变性剂、氯化钠、表面活性剂和ph缓冲剂,主要利用表面活性剂和蛋白质变性剂(异硫氰酸胍和盐酸胍中的至少一种)协同作用对菌体细胞进行裂解;通过ph缓冲剂和氯化钠调节裂解液的ph在3
‑
4之间,能够将gdna、质粒dna和rna进行很好的区分,同时使得质粒dna与硅胶吸附膜在此条件下能够更好的结合;该菌体裂解液的组成成分简单,成本低,不含有溶菌酶和rnasea酶,可在室温下长期稳定保存且对后续实验无影响。
[0046]
本技术还提供了一种提取细菌质粒dna的试剂盒,其所述试剂盒包括菌体裂解液、洗涤液和洗脱液;所述菌体裂解液为上述的菌体裂解液;使用该菌体裂解液的试剂盒配制方便,且使用该试剂盒提取质粒dna的提取效率高,速度快,可以满足多种生物实验需求。
[0047]
在一些实施方式中,所述洗涤液包括洗涤液a和洗涤液b;所述洗涤液a的组成为:0.5
‑
3m盐酸胍、30
‑
70wt%异丙醇和余量的水;所述洗涤液b的组成为:40
‑
80mm tris
‑
hcl和40
‑
80wt%乙醇,所述洗涤液b的ph为6.5
‑
8.5。
[0048]
需要说明的是,上述洗涤液a主要作用是去除蛋白,洗涤液b主要作用是去除盐离子杂质。
[0049]
在一些实施方式中,所述洗脱液的组成为:2
‑
10mm tris
‑
hcl;所述洗脱液的ph为6.5
‑
8.5。
[0050]
在一些实施方式中,所述试剂盒还包括硅胶膜吸附柱。
[0051]
本技术还提供了一种提取细菌质粒dna的方法,采用上述的提取细菌质粒dna的试剂盒提取得到。
[0052]
在一些实施方式中,所述方法包括:
[0053]
s10、将带有质粒的菌株进行扩增培养得到菌液,将所述菌液进行离心分离,收集菌体沉淀物。
[0054]
在一些实施方式中,所述扩增培养的过程包括:在含有抗生素的lb培养基中接种带有质粒的菌株培养;优选地,所述菌株按照与所述lb培养基的体积比为1:(100
‑
200)的比例接种在所述lb培养基中;所述培养的温度为30
‑
37℃,时间为12
‑
16h。
[0055]
需要说明的是,上述抗生素的选择与所要提取的质粒dna有关,若提取的质粒dna是抗氨苄青霉素的,就在lb培养基中加氨苄青霉素;若提取的质粒dna是抗卡那霉素的,就在lb培养基中加卡那霉素。
[0056]
优选地,所述离心分离的转速为10000
‑
12000rpm,时间为2
‑
3min。
[0057]
s20、使用所述菌体裂解液对所述菌体沉淀物进行菌体裂解,得到菌体裂解物。
[0058]
在一些实施方式中,上述菌体裂解液对所述菌体沉淀物进行菌体裂解的过程包括:将所述菌体沉淀物和所述菌体裂解液混合均匀,然后静置;所述菌体裂解液的用量为(500
‑
700)ul/(0.5
‑
1.5)ml菌体沉淀物;上述静置时间约5
‑
15min。
[0059]
s30、使用所述洗涤液和洗脱液对所述菌体裂解物进行分离纯化处理。
[0060]
在一些实施方式中,上述分离纯化处理的过程包括:
[0061]
s301、将所述菌体裂解物全部转移入硅胶膜吸附柱上,然后将该硅胶膜吸附柱置于收集管中,室温静置1
‑
2min后,于10000
‑
12000rpm的转速下离心1
‑
2min,取出硅胶膜吸附柱倒掉收集管中的液体,再将硅胶膜吸附柱放入该收集管中;
[0062]
s302:向硅胶膜吸附柱中加入洗涤液a,于10000
‑
12000rpm的转速下离心1
‑
2min,取出硅胶膜吸附柱倒掉收集管中的液体,再将硅胶膜吸附柱放入该收集管中;每向硅胶膜吸附柱中加入洗涤液a离心洗涤一次,洗涤液a的用量为(500
‑
700)ul/(0.5
‑
1.5)ml菌体裂解物;
[0063]
s303:向硅胶膜吸附柱中加入500
‑
700ul洗涤液b,于10000
‑
12000rpm的转速下离心1
‑
2min,取出硅胶膜吸附柱倒掉收集管中的液体,再将硅胶膜吸附柱放入该收集管中;每向硅胶膜吸附柱中加入洗涤液b离心洗涤一次,洗涤液b的用量为(500
‑
700)ul/(0.5
‑
1.5)ml菌体裂解物;
[0064]
s305:将收集管放入离心机,于10000
‑
12000rpm的转速下离心2min,以除去硅胶膜吸附柱上残留的洗涤液,尤其是进一步去除硅胶膜吸附柱上残留的乙醇,避免对后续的洗脱纯化步骤造成影响;
[0065]
s306:待乙醇挥发干净,将硅胶膜吸附柱放入干净的离心管中,向硅胶膜吸附柱中加入洗脱液,室温静置2
‑
3min,于10000
‑
12000rpm的转速下离心1
‑
2min,取出硅胶膜吸附柱,收集离心管中的上清液即质粒dna溶液;所述洗脱液的用量为(50
‑
100)ul/(0.5
‑
1.5)ml菌体裂解物。
[0066]
下面将结合具体实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0067]
实施例1
[0068]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0069]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、250mm氯化钠、3%triton x
‑
100和4m异硫氰酸胍;
[0070]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0071]
洗涤液b组成为:50mmtris
‑
hcl和80%乙醇,ph为7.0;
[0072]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0073]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0074]
实施例2
[0075]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0076]
菌体裂解液组成为:27mm柠檬酸、23mm柠檬酸钠、250mm氯化钠、2%triton x
‑
100和4m异硫氰酸胍;
[0077]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0078]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0079]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0080]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0081]
实施例3
[0082]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0083]
菌体裂解液组成为:39mm柠檬酸、11mm柠檬酸钠、250mm氯化钠、2%triton x
‑
100和4m异硫氰酸胍;
[0084]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0085]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0086]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0087]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0088]
实施例4
[0089]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0090]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、250mm氯化钠、3%triton x
‑
100和4.5m异硫氰酸胍;
[0091]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0092]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0093]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0094]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0095]
实施例5
[0096]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0097]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、250mm氯化钠、3%triton x
‑
100和5m异硫氰酸胍;
[0098]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0099]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0100]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0101]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0102]
实施例6
[0103]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0104]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、500mm氯化钠、3%triton x
‑
100和4.5m异硫氰酸胍;
[0105]
洗涤液a组成为:0.5m盐酸胍和70%异丙醇;
[0106]
洗涤液b组成为:80mmtris
‑
hcl和40%乙醇,ph为8.0;
[0107]
洗脱液组成为:10mm tris
‑
hcl,ph为6.5;
[0108]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0109]
实施例7
[0110]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0111]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、100mm氯化钠、3%triton x
‑
100和4.5m异硫氰酸胍;
[0112]
洗涤液a组成为:3m盐酸胍和30%异丙醇;
[0113]
洗涤液b组成为:40mm tris
‑
hcl和80%乙醇,ph为6.5;
[0114]
洗脱液组成为:6mm tris
‑
hcl,ph为7.5;
[0115]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0116]
对比例1
[0117]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0118]
菌体裂解液组成为:300mm氯化钠、3%triton x
‑
100和4m异硫氰酸胍;
[0119]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0120]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0121]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0122]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0123]
对比例2
[0124]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0125]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、250mm氯化钠、3%triton x
‑
100;
[0126]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0127]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0128]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0129]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0130]
对比例3
[0131]
一种提取细菌质粒dna的试剂盒,包括菌体裂解液、洗涤液a、洗涤液b、洗脱液和硅胶膜吸附柱;其中:
[0132]
菌体裂解液组成为:33mm柠檬酸、17mm柠檬酸钠、250mm氯化钠、3%triton x
‑
100和2m异硫氰酸胍;
[0133]
洗涤液a组成为:1m盐酸胍和50%异丙醇;
[0134]
洗涤液b组成为:50mm tris
‑
hcl和80%乙醇,ph为7.0;
[0135]
洗脱液组成为:2.5mm tris
‑
hcl,ph为8.0;
[0136]
吸附柱:生工生物工程(上海)股份有限公司核酸纯化吸附柱(包含收集管)。
[0137]
实施例8
[0138]
一种提取细菌质粒dna的方法,包括:
[0139]
(1)在含有合适抗生素的lb培养基中接种将带有质粒的e.coli菌株,于37℃摇床充分振荡培养15h;取1ml培养后菌液,10000rpm离心3min收集菌体,倒尽或吸干培养基,收集菌体沉淀物。
[0140]
(2)在上述收集的菌体沉淀物中加入菌体裂解液700ul,混合均匀使菌体沉淀物悬浮,室温放置5min,得到菌体裂解液。
[0141]
(3)将上述菌体裂解液全部转移入硅胶膜吸附柱上,室温放置1min,12000rpm离心2min,取出硅胶膜吸附柱倒掉收集管中的液体,再将硅胶膜吸附柱放入该收集管中。
[0142]
(4)向硅胶膜吸附柱中加入500ul洗涤液a,10000rpm离心2min,取出硅胶膜吸附柱倒掉收集管中的液体,再将硅胶膜吸附柱放入该收集管中。
[0143]
(5)向硅胶膜吸附柱中加入500ul洗涤液b,10000rpm离心2min,取出硅胶膜吸附柱倒掉收集管中的液体,再将硅胶膜吸附柱放入该收集管中。
[0144]
(6)重复上述步骤(5)一次。
[0145]
(7)将收集管放入离心机,12000rpm离心2min。
[0146]
(8)待乙醇挥发干净,将硅胶膜吸附柱放入干净的1.5ml离心管中,在硅胶膜吸附柱膜中央加入50ul洗脱液,室温放置2min,12000rpm离心2min,取出硅胶膜吸附柱,收集离心管中的上清液即质粒dna溶液,置于
‑
20℃保存或用于后续实验中。
[0147]
试验例1
[0148]
菌株选择:选择带有高拷贝质粒puc57的e.coli菌株进行试验。
[0149]
试剂盒选择:采用实施例1
‑
3的试剂盒进行细菌质粒dna的提取。
[0150]
细菌质粒dna提取方法:采用实施例8的方法进行细菌质粒dna的提取。
[0151]
对采用实施例1
‑
3的试剂盒提取得到的质粒dna分别进行琼脂糖凝胶电泳检测,共3组(分别对应实施例1的试剂盒、实施例2的试剂盒和实施例3的试剂盒,每组分别做3个平行),结果如图1所示,其中泳道1对应的样品为脱氧核糖核酸分子量标准(从上到下为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp),泳道2
‑
4为采用实施例1的试剂盒提取的质粒dna的结果,泳道5
‑
7为实施例2试剂盒提取的质粒dna的结果,泳道8
‑
10为实施例3试剂盒提取的质粒dna的结果。
[0152]
结果显示:采用本技术实施例1
‑
3的试剂盒提取的质粒dna的得率高;相比实施例2和实施例3的试剂盒提取的质粒dna的得率,实施例1的试剂盒提取的质粒dna的得率更高;另外,本技术从大肠杆菌培养物中提取质粒puc57的裂解过程仅耗时5min,大大节省了实验时间,提高了实验效率。
[0153]
试验例2
[0154]
菌株选择:选择带有高拷贝质粒puc57的e.coli菌株进行试验。
[0155]
试剂盒选择:采用实施例1、实施例4和实施例5的试剂盒进行细菌质粒dna的提取。
[0156]
细菌质粒dna提取:采用实施例8的方法进行细菌质粒dna的提取。
[0157]
对采用实施例1、实施例4和实施例5的试剂盒提取得到的质粒dna分别进行琼脂糖凝胶电泳检测,共3组(分别对应实施例1的试剂盒、实施例4的试剂盒和实施例5的试剂盒,每组分别做3个平行),结果如图2所示,其中泳道1对应的样品为脱氧核糖核酸分子量标准(从上到下为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp),泳道2
‑
4为采用实施例1的试剂盒提取的质粒dna的结果,泳道5
‑
7为采用实施例4的试剂盒提取的质粒dna的结果,泳道8
‑
10为实施例5试剂盒提取的质粒dna的结果。
[0158]
结果显示:采用实施例4和实施例5的试剂盒提取的质粒dna的得率更高,且实施例4和实施例5的得率相当;同时,本技术从大肠杆菌培养物中提取质粒puc57的裂解过程仅耗时5min,大大节省了实验时间,提高了实验效率。
[0159]
另外,需要说明的是,采用上述实施例6和实施例7的试剂盒提取的质粒dna的得率同实施例4的试剂盒提取的质粒dna的得率相当。
[0160]
试验例3
[0161]
菌株选择:选择带有高拷贝质粒puc57的e.coli菌株进行试验。
[0162]
试剂盒选择:采用实施例5的试剂盒与市售的一步法提取细菌质粒dna的试剂盒(北京百奥莱博btn70903)对比进行细菌质粒dna的提取。
[0163]
细菌质粒dna提取:采用实施例8的方法进行细菌质粒dna的提取。
[0164]
对采用上述市售的试剂盒与实施例5的试剂盒提取得到的质粒dna分别进行琼脂糖凝胶电泳检测,共2组(分别对应市售的试剂盒和实施例5的试剂盒,每组分别做3个平行),结果如图3所示,其中泳道1对应的样品为脱氧核糖核酸分子量标准(从上到下为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp),泳道2
‑
4为市售的试剂盒提取的质粒dna的结果,泳道5
‑
7为实施例5的试剂盒提取的质粒dna的结果。
[0165]
结果显示:采用实施例4的试剂盒提取的细菌质粒dna与市售的试剂盒提取的细菌质粒dna的得率相当,但采用实施例4的试剂盒提取的细菌质粒dna的纯度更优,裂解过程耗时更短。
[0166]
试验例4
[0167]
菌株选择:选择带有高拷贝质粒puc57的e.coli菌株进行试验。
[0168]
试剂盒选择:采用实施例5和对比例1的试剂盒进行细菌质粒dna的提取。
[0169]
细菌质粒dna提取:采用实施例8的方法进行细菌质粒dna的提取。
[0170]
对采用实施例5和对比例1的试剂盒提取得到的质粒dna分别进行琼脂糖凝胶电泳检测,共2组(分别对应实施例4的试剂盒和对比例1的试剂盒,每组分别做3个平行),结果如图4所示,其中泳道1对应的样品为脱氧核糖核酸分子量标准(从上到下为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp),泳道2
‑
4为采用实施例5的试剂盒提取的质粒dna的结果,泳道5
‑
7为采用对比例1的试剂盒提取的质粒dna的结果。
[0171]
结果显示:缺少了ph缓冲剂的裂解液,裂解液的ph条件不在合适的调节下,不能有效的提取出质粒dna。
[0172]
试验例5
[0173]
菌株选择:选择带有高拷贝质粒puc57的e.coli菌株进行试验。
[0174]
试剂盒选择:采用对比例2、对比例3和实施例5的试剂盒进行细菌质粒dna的提取。
[0175]
细菌质粒dna提取:采用实施例8的方法进行细菌质粒dna的提取。
[0176]
对提取得到的质粒dna分别进行琼脂糖凝胶电泳检测,共3组(分别对应对比例2、对比例3和实施例5的试剂盒,每组分别做3个平行),结果如图5所示,其中泳道1对应的样品为脱氧核糖核酸分子量标准(从上到下为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp),泳道2
‑
4为采用对比例2的试剂盒提取的质粒dna的结果,泳道5
‑
7为采用对比例3的试剂盒提取的质粒dna的结果,泳道8
‑
10采用实施例5的试剂盒提取的质粒dna的结果。
[0177]
结果显示:缺少了异硫氰酸胍组分的裂解液无法有效提取出质粒;过低浓度(小于4m)的异硫氰酸胍组分的裂解液不能充分裂解,提取质粒dna的得率明显偏低。
[0178]
试验例6
[0179]
菌株选择:选择带有低拷贝自制大分子量8kb质粒(命名为8k)的e.coli菌株进行试验。
[0180]
试剂盒选择:采用实施例5的试剂盒进行细菌质粒dna的提取。
[0181]
细菌质粒dna提取:采用实施例8的方法进行细菌质粒dna的提取。
[0182]
对采用实施例5的试剂盒提取得到的质粒dna进行琼脂糖凝胶电泳检测,结果如图6所示,其中泳道1对应的样品为脱氧核糖核酸分子量标准(从上到下为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp),泳道2
‑
4为实施例5的试剂盒提取的8k质粒dna的结果。
[0183]
结果显示:采用实施例5的试剂盒提取低拷贝且大分子量质粒dna与上述采用实施例5的试剂盒提取高拷贝质粒dna的得率和纯度以及裂解过程耗时相当,同样效果优良,说明本技术的试剂盒对大分子量且低拷贝数的质粒同样适用。
[0184]
需要说明的是,上述选择带有高拷贝质粒puc57的e.coli菌株及选择带有低拷贝自制大分子量8kb质粒(命名为8k)的e.coli菌株进行试验时,对应的抗生素均选择氨苄青霉素添加到lb培养基中,且抗生素在lb培养基中的浓度为50ug/ml。
[0185]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
[0186]
此外,本领域的技术人员能够理解,尽管在此的一些实施例包括其它实施例中所包括的某些特征而不是其它特征,但是不同实施例的特征的组合意味着处于本发明的范围之内并且形成不同的实施例。例如,在上面的权利要求书中,所要求保护的实施例的任意之一都可以以任意的组合方式来使用。公开于该背景技术部分的信息仅仅旨在加深对本发明的总体背景技术的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域技术人员所公知的现有技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1