分离纯化带有至少两个组氨酸标签的蛋白质的方法
1.本发明涉及分离纯化带有至少两个组氨酸标签的蛋白质的方法,特别是涉及在溶液中通过使用阳离子来分离纯化带有至少两个组氨酸标签的蛋白质的方法。
背景技术:
2.蛋白质的分离纯化是生物技术领域重要的基本操作。现有技术中已经有多种蛋白质分离纯化技术,整体可以大致分为例如层析法和沉淀法两大类。
3.常用的层析法包括固定化金属离子亲和层析法(imac)、免疫亲和层析法(iac)、离子交换层析法(iec)、疏水相互作用层析(hic)、凝胶过滤层析法(gfc)等。其中,金属离子亲和层析法(imac)是一种在实验室和工业中重要的蛋白质分离纯化技术,其原理是利用金属离子和不同蛋白质在不同ph下结合强度的不同,实现蛋白质的分离。组氨酸标签和咪唑的使用使得imac变得成熟,在实验室中能够较为简单快速地得到纯度较高(》90%)的目标蛋白。但是,imac的缺陷是固定相载体昂贵,所使用的过渡金属离子对环境和目标蛋白有较大污染。因此,imac通常用于实验室规模的蛋白质纯化或者用于高附加值蛋白质(例如免疫球蛋白)的纯化。
4.常用的沉淀法是蛋白质盐析沉淀,例如硫铵盐析沉淀。盐析沉淀是通过向蛋白质溶液中加入大量中性盐(例如硫酸铵,盐析体系中硫铵浓度高达约2mol/l或更高),使蛋白质发生沉淀。这种方法的特点是成本低廉,沉淀状态的蛋白质稳定性更好,利于储存和运输,但得到的蛋白质纯度不理想,且沉淀中夹杂大量盐,可能影响后续使用。含高浓度氨氮的废水对环境也有不利影响。
5.迄今为止,硫铵沉淀和imac仍是两种主要的蛋白纯化方法,但各自存在不足。本领域研究者们一直在尝试寻找能够结合二者优势的更为理想的纯化方式。
技术实现要素:
6.本技术的发明人经过大量研究发现,带有至少两个组氨酸标签的蛋白质(本文中也称为目标蛋白)在与非常低浓度的阳离子在含水溶解中接触时,能够发生选择性沉淀,沉淀物主要包含所述目标蛋白,而杂蛋白大部分保留在上清液中。
7.此外,本技术的发明人还出人意料地发现,被选择性沉淀的目标蛋白在与特定浓度的阳离子在含水溶液中接触时,能够重新恢复溶解状态,而被沉淀下来的杂蛋白溶解相对较少。
8.同时,本技术的发明人还出人意料地发现,当将包含目标蛋白与杂蛋白的混合物与一定浓度的阳离子在含水溶液中接触时,相对于目标蛋白,杂蛋白能够被选择性地沉淀出来。
9.也就是说,通过选择合适的阳离子及其浓度,能够使得目标蛋白发生选择性沉淀和选择性溶解,从而达到目标蛋白的分离与纯化。
10.本发明方法的优点是不需要昂贵的载体以及复杂的操作条件,使用非常低浓度的
阳离子,对环境友好,操作简单,成本非常低,蛋白纯化效果非常好(与imac的纯化效果相当或更好,但是成本远低于imac)。
附图说明
11.图1a示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同na
+
浓度下在nacl体系中的溶解性。
12.图1b示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同na
+
浓度下在na2so4体系中的溶解性。
13.图1c示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同li
+
浓度下在体系中的溶解性。
14.图1d示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同k
+
浓度下在体系中的溶解性。
15.图1e示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同nh
4+
浓度下在nh4cl体系中的溶解性。
16.图1f示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同nh
4+
浓度下在(nh4)2so4体系中的溶解性。
17.图1g示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同赖氨酸浓度下在体系中的溶解性。
18.图1h示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同咪唑浓度下在体系中的溶解性。
19.图1i示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同盐酸胍浓度下在体系中的溶解性。
20.图1j示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同脲浓度下在体系中的溶解性。
21.图2a示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同mg
2+
浓度下在mgcl2体系中的溶解性。
22.图2b示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同mg
2+
浓度下在mgso4体系中的溶解性。
23.图2c示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同ca
2+
浓度下在体系中的溶解性。
24.图2d示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同mn
2+
浓度下在体系中的溶解性。
25.图2e示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同ni
2+
浓度下在体系中的溶解性。
26.图2f示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同zn
2+
浓度下在体系中的溶解性。
27.图2g示出了带有组氨酸标签和没有组氨酸标签的红色荧光蛋白在不同cu
2+
浓度下在体系中的溶解性。
28.图3a示出了带有组氨酸标签的红色荧光蛋白在2mm的不同二价阳离子处理时的沉
淀结果照片。
29.图3b示出了带有组氨酸标签的红色荧光蛋白在2mm的不同二价阳离子处理时的沉淀和上清样品的蛋白电泳结果。
30.图4示出了用不同浓度的mg
2+
将包含带有组氨酸标签的红色荧光蛋白的沉淀物进行复溶的结果。
31.图5示出了带有组氨酸标签的l-苏氨酸醛缩酶在不同浓度的镁离子处理时的沉淀和上清样品的蛋白电泳结果。
32.图6示出了用mg
2+
对带有组氨酸标签的l-苏氨酸醛缩酶进行沉淀、复溶和再沉淀的操作结果。
33.图7示出了用mg
2+
对带有组氨酸标签的甲酸脱氢酶进行沉淀、复溶和再沉淀的操作结果。
34.图8示出了用mg
2+
对带有组氨酸标签的l-亮氨酸脱氢酶进行沉淀、复溶和再沉淀的操作结果。
35.图9示出了带有组氨酸标签的氨基酸酯酰基转移酶的沉淀、复溶和再沉淀的操作结果。
36.图10示出了nd在不同ph的磷酸钠缓冲液处理后的上清及沉淀样品蛋白电泳图。
37.图11示出了nd在不同总蛋白浓度下的mg
2+
处理后的上清荧光结果。
38.图12示出了带有不同组氨酸标签的绿色荧光蛋白在10mm浓度下的镁离子处理后的上清和沉淀结果。
39.图13示出了带有2个组氨酸标签的焦磷酸硫胺素激酶在100mm浓度下的钾、钠、铵离子处理后的上清和沉淀结果。
40.图14示出了带有2个组氨酸标签的多聚磷酸钠激酶在100mm浓度下的钾、钠、铵离子处理后的上清和沉淀结果。
41.图15示出了带有组氨酸标签的l-亮氨酸脱氢酶经镁、钠、铵离子沉淀法纯化及imac法纯化后的蛋白电泳结果。
42.图16示出了带有组氨酸标签的红色荧光蛋白经镁、钠、铵离子沉淀法纯化及imac法纯化后的蛋白电泳结果。
43.图17示出了带有组氨酸标签的l-苏氨酸醛缩酶经镁、钠、铵离子沉淀法纯化及imac法纯化后的蛋白电泳结果。
44.图18为nd用不同的离子进行沉淀及重悬的电泳结果。
具体实施方式
45.除非另外定义,本文中使用的所有技术和科学术语具有本发明所属领域普通技术人员通常所理解的同样含义。在抵触的情况下,以本说明书包括定义为准。
46.当以范围、优选范围、或者优选或示例的数值的形式表述某个量、浓度或其它值或参数的时候,应当理解相当于具体公开了通过将任意一对范围上限或下限或优选或示例数值结合起来的任何范围。除非另外指出,本文所列出的数值范围旨在包括范围的端点,和该范围之内的所有整数和分数。
47.除非有另外的说明,本发明的材料、方法和实施例仅仅是示例性的,而非限制性
的。
48.当使用术语“约”描述值或范围的端点时,应当被理解为包括具体的值或所涉及的端点的
±
5%,优选
±
3%,更优选
±
1%范围内。在本发明中,除非另有说明,提到的数值都应当被视为用“约”修饰。
49.定义
50.在本文中,术语“组氨酸标签”是指是由一串连续的组氨酸残基组成的短肽,例如是由3-15个连续组氨酸残基组成的短肽,尤其是由3个、4个、5个、6个、8个、9个、10个或12个连续组氨酸残基组成的短肽。
51.表述“带有至少两个组氨酸标签”是指在蛋白质上带有至少两个不直接相连的上述“组氨酸标签”,也就是说,带有两个由一串连续的组氨酸残基组成的短肽且这两个短肽没有直接相连。
52.在蛋白质由单个蛋白亚基组成(在本文中也称为单亚基蛋白质或单亚基蛋白)时,可以在蛋白亚基的两个端各自带有一个“组氨酸标签”。在蛋白质由两个以上的相同蛋白亚基组成(在本文中也称为多亚基蛋白质或多亚基蛋白)时,可以在每个蛋白亚基的一端或两端带有“组氨酸标签”。
53.在本文中,表述“带有至少两个组氨酸标签的蛋白质”与术语“目标蛋白”具有相同意思,并可以替换使用。
54.本文中的“带有至少两个组氨酸标签的蛋白质”可以采用本领域常规的方法获得,例如通过重组基因表达。
55.在本文中,术语“含水溶液”是指溶剂主要为水的溶液体系,在该溶液体系中可以包含原料中不可避免的其它溶剂。所述“主要为水”是指总溶剂量的95重量%的溶剂为水,优选97重量%的溶剂为水,更优选99重量%的溶剂为水。优选地,所述“含水溶液”是指溶剂为水的溶液体系。
56.在本文中,术语“非h
+
的一价阳离子”是指不包括h
+
在内的一价阳离子,优选选自nh
4+
,na
+
,k
+
和有机含氮阳离子中的一种或多种。
57.在本文中,术语“有机含氮阳离子”是其中氮呈四价态且与n连接的至少一个基团为有机基团的那些阳离子。优选地,所述“有机含氮阳离子”源自含有-nh2,-nh-和/或=n-基团的有机分子,优选有机小分子。所述“有机小分子”是指在分子中不存在重复聚合单元的有机分子。更优选地,所述有机含氮阳离子源自咪唑、氨基葡萄糖、盐酸胍、赖氨酸、精氨酸和组氨酸。
58.在本文中,术语“杂蛋白”是指不同于目标蛋白的蛋白质。
59.以下描述本发明方法的具体实施方式。
60.在本发明的第一方面,提供了一种分离纯化带有至少两个组氨酸标签的蛋白质的方法,所述方法包括:使处于溶解状态的所述蛋白质与阳离子在含水溶液中接触,得到包含所述蛋白质的沉淀物;
61.其中,所述含水溶液的ph值在小于等于7.2的范围内,优选5.0-7.0,更优选在6.0-7.0的范围内;
62.所述阳离子选自以下中一种或多种:非h
+
的一价阳离子,mg
2+
,ca
2+
,mn
2+
,fe
2+
,和co
2+
;
63.当所述阳离子选自非h
+
的一价阳离子时,所述阳离子在所述含水溶液中的浓度为10-400mmol/l,优选15-300mmol/l,更优选30-200mmol/l;
64.当所述阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述阳离子的所述含水溶液中的浓度为1-80mmol/l,优选1.5-40mmol/l,更优选3-30mmol/l;
65.在第一方面的方法中,表述“使处于溶解状态的所述蛋白质与阳离子在含水溶液中接触”可以例如通过以下方法来实施:
[0066]-将包含目标蛋白的混合物溶于水中形成粗蛋白质溶液,然后向该粗蛋白质溶液中加入包含所述阳离子的水溶性盐(固体或水溶液形式);
[0067]-将包含所述阳离子的水溶性盐溶于水中形成盐溶液,然后将包含目标蛋白的混合物(固体或水溶液形式)加入所述盐溶液中;和/或
[0068]-将包含所述阳离子的水溶性盐溶于水中形成盐溶液,将包含目标蛋白的菌体悬浮于所述盐溶液中,然后使盐溶液中的菌体破碎并释放所述目标蛋白到所述盐溶液中。
[0069]
上述实施方法仅仅是示例性,本领域技术人员可以根据实验需要,采用其它的方式使得处于溶解状态的目标蛋白与阳离子在含水溶液中接触。
[0070]
在第一方面的方法中,所述含水溶液的ph值应该保持在小于等于7.2的范围内。当体系(可以指代含水溶液)ph大于7.2时,不能有效地将目标蛋白沉淀。从更好地选择性沉淀目标蛋白的角度,优选将体系ph值设定为不低于5.0。例如,ph值可以设定为6.9,6.8,6.7,6.6,6.5,6.4,6.3,6.2,6.1,6.0,5.9,5.8,5.7,5.6,5.5,5.4,5.3,5.2,5.1。
[0071]
在第一方面的方法中,所述阳离子选自以下中一种或多种:非h
+
的一价阳离子,mg
2+
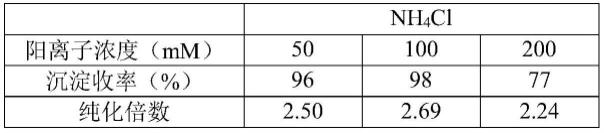
,ca
2+
,mn
2+
,fe
2+
,和co
2+
。所述阳离子可以仅使用一种,也可以两种或更多种混合使用。从工业可用性,降低成本或者减少污染角度考虑,可以优选使用选自nh
4+
,na
+
,k
+
,mg
2+
和ca
2+
的阳离子。
[0072]
在imac的现有技术中,通过使待分离蛋白与固定在载体上金属离子的结合,然后再洗脱来实现蛋白的纯化。imac的纯化原理教导了待分离蛋白与载体上金属离子的结合,但是在载体上的结合并不能必然推知使用金属离子能够将待分离蛋白从溶液中沉淀出来。也就是说,在载体上进行结合与从溶液中直接沉淀分离是两个不同的概念。
[0073]
此外,通常用于imac的镍离子,铜离子和锌离子虽然可以在含水溶液体系中实现目标蛋白沉淀,但是,同时也几乎无差别地将杂蛋白沉淀出来。因此,诸如镍离子,铜离子和锌离子的阳离子不能实现目标蛋白的选择性沉淀。另外,imac不使用一价阳离子进行分离。
[0074]
在第一方面的方法中,当所述阳离子选自非h
+
的一价阳离子时,所述阳离子在所述含水溶液中的浓度为10-400mmol/l,优选15-300mmol/l,更优选30-200mmol/l,例如12,13,14,15,16,17,18,19,20,21,22,23,24,25,30,40,55,60,70,85,90,100,110,125,130,140,150,160,170,180,190,200,210,220,230,240,255,260,270,280,290,300,310,320,330,340,350,360,370,380,390mmol/l;当所述阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述阳离子的所述含水溶液中的浓度为1-80mmol/l,优选1.5-40mmol/l,更优选3-30mmol/l例如2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,44,45,46,47,48,49,50,52,55,57,58,60,63,65,67,70,72,75,78mmol/l;
[0075]
盐析沉淀法例如硫铵沉淀法通常在溶液中使用大约2mol/l或更高的硫铵浓度,因
此,与盐析法相比,本发明的方法采用浓度低得多的盐浓度,就可以实现目标蛋白的沉淀。而且,本发明方法的上述浓度能够实现目标蛋白的选择性沉淀。
[0076]
此外,总蛋白浓度对于本发明的方法基本没有影响。
[0077]
在第一发明的方法中,主要通过选择所述阳离子的种类和浓度并结合特定的ph,实现了目标蛋白的选择性沉淀。
[0078]
如上所述,本技术的发明人还出人意料地发现,被选择性沉淀的目标蛋白在与特定浓度的阳离子在含水溶液中接触时,能够重新恢复溶解状态,而被沉淀下来的杂蛋白溶解相对较少。也就是说,被沉淀的目标蛋白能够被选择性溶解。
[0079]
因此,在本发明的第二方面,提供了一种分离纯化带有至少两个组氨酸标签的蛋白质的方法,所述方法包括:
[0080]
a)使处于溶解状态的所述蛋白质与第一浓度的阳离子在含水溶液中接触,得到包含所述蛋白质的沉淀物;
[0081]
b)将所述沉淀物与上清液分离;
[0082]
c)将分离的所述沉淀物与第二浓度的阳离子在含水溶液中接触,使得包含在所述沉淀物中的至少一部分所述蛋白质重新溶解;
[0083]
其中,步骤a)和步骤c)中所述含水溶液的ph值各自独立地在小于等于7.2的范围内,优选5.0-7.0,更优选在6.0-7.0的范围内;
[0084]
步骤a)和步骤c)中的所述阳离子各自独立地选自以下中一种或多种:非h
+
的一价阳离子,mg
2+
,ca
2+
,mn
2+
,fe
2+
,和co
2+
;
[0085]
在步骤a)中,当所述阳离子选自非h
+
的一价阳离子时,所述第一浓度为15-300mmol/l,优选30-200mmol/l,更优选80-120mmol/l,例如,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,105,110,115,120,125,130,135,140,145,150,155,160,165,170,175,180,185,190,195,200,210,220,230,240,250,260,270,280,290mmol/l;当所述阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述第一浓度为1.5-40mmol/l,更优选3-30mmol/l,例如2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40mmol/l;
[0086]
在步骤c)中,当所述阳离子选自非h
+
的一价阳离子时,所述第二浓度为大于等于250mmol/l,优选大于等于400mmol/l,更优选大于等于600mmol/l,但是不超过1000mmol/l,更优选不超过800mmol/l,例如251,260,270,280,290,300,320,340,360,380,400,420,440,460,480,500,520,540,560,580,600,620,640,660,680,700,720,740,760,780,800,820,840,860,880,900,820,940,960mmol/l,或者,所述第二浓度为小于等于30mmol/l,优选小于等于20mmol/l,更优选小于等于10mmol/l,例如29,28,26,24,22,20,18,16,14,12,10,8,6,4,2,0mmol/l;
[0087]
在步骤c)中,当阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述第二浓度为大于等于35mmol/l,优选大于等于50mmol/l,更优选大于等于100mmol/l,但是不超过250mmol/l,更优选不超过200mmol/l,例如36,38,40,45,50,55,60,65,70,75,80,85,90,95,100,105,110,115,120,125,130,135,140,145,150,155,160,165,170,175,180,185,190,195,200,205,210,215,220,225,230,235,240mmol/l;或者,所述第二浓度为小于等于2mmol/l,优选小于等于1mmol/l,例如1.9,1.8,1.7,1.6,1.5,1.4,1.3,1.2,1.1,1.0,0.9,0.8,0.7,0.6,
0.5,0.4,0.3,0.2,0.1,0mmol/l。
[0088]
在第二方面的方法中,对于步骤a)中的表述“使处于溶解状态的所述蛋白质与第一浓度的阳离子在含水溶液中接触”的实施方式的示例可以参照适用前面针对第一方面的方法的表述“使处于溶解状态的所述蛋白质与阳离子在含水溶液中接触”的示例实施方式。同样地,这些实施方法仅仅是示例性,本领域技术人员可以根据实验需要,采用其它的方式使得处于溶解状态的目标蛋白与第一浓度的阳离子在含水溶液中接触。
[0089]
对于第二方面的方法中步骤a)和c)中的ph的限定,可以参照适用第一方面的方法中ph的表述。
[0090]
在第二方面的方法中步骤a)和c)中阳离子种类选择,可以类似适用第一方面的方法中关于阳离子种类选择的表述。
[0091]
实际上,目标蛋白在含水溶液中的浓度与阳离子在含水溶液中的浓度的关系在以目标蛋白浓度为纵坐标y且以阳离子浓度做横坐标x的x_y坐标系中呈类似u型曲线变化。也就是说,含水溶液中的目标蛋白浓度在第一阶段(即u型曲线的最低点的左侧)随着阳离子浓度的增加不断降低,目标蛋白不断沉淀出来,在阳离子某一浓度时,达到u型曲线的最低点(即沉淀出最大量的目标蛋白),之后,随着阳离子浓度的增加,目标蛋白开始溶解,直至阳离子某一浓度之后,目标蛋白完全溶解。
[0092]
在发生目标蛋白沉淀的步骤a)中,能够使得目标蛋白发生沉淀的阳离子浓度包括在u型曲线内横坐标上的绝大部分阳离子浓度,区别仅在于目标蛋白沉淀量的多少。但是,从工业操作经济性和实用性的教导考虑,优选在步骤a)中尽可能多地将目标蛋白沉淀出来,因此,在步骤a)中,当所述阳离子选自非h
+
的一价阳离子时,所述第一浓度为15-300mmol/l,优选30-200mmol/l,更优选80-120mmol/l;当所述阳离子选自mg
2+
,ca
2+
,fe
2+
,mn
2+
和co
2+
时,所述第一浓度为1.5-40mmol/l,更优选3-30mmol/l。
[0093]
对于第二方面的方法中步骤b),将所述沉淀物与上清液分离,可以采用常规的固液分离方法,没有特别的限制,例如离心分离。
[0094]
对于第二方面的方法中步骤c),对于“将分离的所述沉淀物与第二浓度的阳离子在含水溶液中接触”,可以通过任何合适的方式进行,例如将所述沉淀物加入到含有阳离子的水溶液中或者将阳离子水溶液加入到所述沉淀物中以使得最终阳离子在含水溶液中的浓度落入所述第二浓度范围内。
[0095]
在使得沉淀物中的目标蛋白进行溶解的步骤c)中,根据溶解度u型曲线,只要在u型曲线最低点左侧或右侧,就可以实现复溶沉淀的目标蛋白的目的。但是从工艺操作经济性而言,优选在步骤c)中,当所述阳离子选自非h
+
的一价阳离子时,所述第二浓度为大于等于250mmol/l,优选大于等于400mmol/l,更优选大于等于600mmol/l,但是不超过1000mmol/l,更优选不超过800mmol/l,或者,所述第二浓度为小于等于30mmol/l,优选小于等于20mmol/l,更优选小于等于10mmol/l;在步骤c)中,当阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述第二浓度为大于等于35mmol/l,优选大于等于50mmol/l,更优选大于等于100mmol/l,但是不超过250mmol/l,更优选不超过200mmol/l,或者,所述第二浓度为小于等于2mmol/l,优选小于等于1mmol/l。第二浓度可以为0mmol/l。
[0096]
在步骤c)中,用于进行重新溶解的阳离子浓度不宜过大,因为当太大时,会导致蛋白质发生盐析沉淀。如前所述,在沉淀物与第二浓度的阳离子接触之后,其中的目标蛋白能
够被重新溶解,而杂蛋白溶解相对较少。因此,可以使得目标蛋白经历沉淀-复溶-再沉淀的步骤,从而不断被进一步纯化。根据实际需要,沉淀-复溶的步骤可以重复多次,直到获得所需的目标蛋白纯度。
[0097]
因此,本技术第二方面的方法还可以包括步骤d):将步骤c)得到的上清液分离并将其中阳离子浓度调节到所述第一浓度范围内,使得上清液中至少一部分所述蛋白质再次沉淀。
[0098]
如前所述,当将包含目标蛋白与杂蛋白的混合物与一定浓度的阳离子在含水溶液中接触时,相对于目标蛋白,杂蛋白能够被选择性地沉淀出来。
[0099]
因此,在本发明的第三方面,提供了一种分离纯化带有至少两个组氨酸标签的蛋白质的方法,所述方法包括:
[0100]
a)使处于溶解状态的所述蛋白质和杂蛋白的混合物与第三浓度的阳离子在含水溶液中接触,得到包含所述杂蛋白的沉淀物和包含所述蛋白质的上清液;
[0101]
b)将所述沉淀物与所述上清液分离;和
[0102]
c)将分离的所述上清液稀释至第四浓度的阳离子,使得包含在所述上清液中的至少一部分所述蛋白质沉淀;
[0103]
其中,步骤a)和步骤c)中所述含水溶液的ph值各自独立地在小于等于7.2的范围内,优选5.0-7.0,更优选在6.0-7.0的范围内;
[0104]
步骤a)和步骤c)中的所述阳离子各自独立地选自以下中一种或多种:非h
+
的一价阳离子,mg
2+
,ca
2+
,mn
2+
,fe
2+
,和co
2+
;
[0105]
在步骤a)中,当所述阳离子选自非h
+
的一价阳离子时,所述第三浓度为大于等于250mmol/l,优选大于等于400mmol/l,更优选大于等于600mmol/l,但是不超过1000mmol/l,更优选不超过800mmol/l,例如251,260,270,280,290,300,320,340,360,380,400,420,440,460,480,500,520,540,560,580,600,620,640,660,680,700,720,740,760,780,800,820,840,860,880,900,820,940,960mmol/l;当阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述第三浓度为大于等于35mmol/l,优选大于等于50mmol/l,更优选大于等于100mmol/l,但是不超过250mmol/l,更优选不超过200mmol/l,例如36,38,40,45,50,55,60,65,70,75,80,85,90,95,100,105,110,115,120,125,130,135,140,145,150,155,160,165,170,175,180,185,190,195,200,205,210,215,220,225,230,235,240mmol/l。
[0106]
在步骤c)中,当所述阳离子选自非h
+
的一价阳离子时,所述第四浓度为15-300mmol/l,优选30-200mmol/l,更优选80-120mmol/l,例如16,17,18,19,20,21,22,23,24,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,105,110,115,120,125,130,135,140,145,150,155,160,165,170,175,180,185,190,195,200,210,220,230,240,250,260,270,280,290mmol/l;当所述阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述第四浓度为1.5-40mmol/l,更优选3-30mmol/l,例如2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40mmol/l。
[0107]
在第三方面的方法中,步骤a)的“在含水溶液中接触”方式参照适用第一方面的方法中的“接触”方式。
[0108]
在第三方面的方法中,步骤a)和c)中的ph的限定可以参照适用第一方面的方法中ph的表述。
[0109]
在第三方面的方法中,步骤a)和c)中阳离子的种类的限定可以参照适用第一方面的方法中阳离子种类的选择的表述。
[0110]
在第三方面的方法中,步骤a)的意义在于使用高于最佳沉淀点的阳离子浓度,使得杂蛋白能够被选择性沉淀出来,从而至少部分地纯化了上清液中的目标蛋白。
[0111]
对于第三方面的方法中步骤b),将所述沉淀物与上清液分离,可以采用常规的固液分离方法,没有特别的限制,例如离心分离。
[0112]
在第三方面的方法中,步骤c)是针对上清液被至少部分地纯化了的目标蛋白,通过降低阳离子浓度将目标蛋白沉淀出来。只要步骤c)中的第四浓度低于所述第三浓度,就可以使至少一部分目标蛋白沉淀出来,当将阳离子浓度降低为u型曲线的最下端的浓度时,获得最多的目标蛋白沉淀。但是,从工业操作经济性和实用性的教导考虑,优选在步骤c)中,当所述阳离子选自非h
+
的一价阳离子时,所述第四浓度为15-300mmol/l,优选30-200mmol/l,更优选80-120mmol/l;当所述阳离子选自mg
2+
,ca
2+
,mn
2+
,fe
2+
和co
2+
时,所述第四浓度为1.5-40mmol/l,更优选3-30mmol/l。
[0113]
在第三方面的方法中,在步骤c)之后,还可以进一步包括步骤d):将步骤c)得到的沉淀物分离并与第二浓度的阳离子在含水溶液中接触,使得包含在所述沉淀物中的至少一部分所述蛋白质重新溶解;此处所述第二浓度参照适用第二方面的方法中描述的第二浓度。
[0114]
对于第三方面的方法中步骤d)的具体方式参照适用在第二方面的方法中步骤c)的表述。
[0115]
对于第三方面的方法,从目标蛋白被沉淀之后,根据实际需要,可以经历复溶-再沉淀的多次重复步骤,直到获得所需的目标蛋白纯度。
[0116]
实施例下面结合具体实施例对本发明的技术方案进一步描述,但是本发明不仅限于以下的实施例。
[0117]
所使用的材料
[0118]-带有组氨酸标签的红色荧光蛋白(4个亚基,4个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端带有组氨酸标签(6个组氨酸残基)的红色荧光蛋白(n-his-dsred,简称nd)。红色荧光蛋白一共4个亚基,因此一共带有4个组氨酸标签。
[0119]-无标签的红色荧光蛋白(4个亚基,0个标签)用大肠杆菌pet28a质粒为载体克隆表达未融合组氨酸标签的红色荧光蛋白(wild-typedsred,简称wd)。
[0120]-带有组氨酸标签的l-亮氨酸脱氢酶(8个亚基,8个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端带有组氨酸标签(6个组氨酸残基)的l-亮氨酸脱氢酶。l-亮氨酸脱氢酶一共8个亚基,因此一共带有8个组氨酸标签。
[0121]-带有组氨酸标签的甲酸脱氢酶(2个亚基,2个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端带有组氨酸标签(6个组氨酸残基)的甲酸脱氢酶。甲酸脱氢酶一共2个亚基,因此一共带有2个组氨酸标签。
[0122]-带有组氨酸标签的氨基酸酯酰基转移酶(2个亚基,2个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端带有组氨酸标签(6个组氨酸残基)的氨基酸酯酰基转移酶。氨基酸酯酰基转移酶一共2个亚基,因此一共带有2个组氨酸标签。
[0123]-带有组氨酸标签的l-苏氨酸醛缩酶(4个亚基,4个标签)用大肠杆菌pet28a质粒
为载体克隆表达蛋白亚基的n端带有组氨酸标签(6个组氨酸残基)的l-苏氨酸醛缩酶。l-苏氨酸醛缩酶一共4个亚基,因此一共带有4个组氨酸标签。
[0124]-带有两个组氨酸标签的绿色荧光蛋白(单亚基,2个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端和c端分别带有组氨酸标签(6个组氨酸残基)的绿色荧光蛋白(double-his-gfp,简称dg)。绿色荧光蛋白只有1个亚基,但带有2个组氨酸标签。
[0125]-带有单个组氨酸标签的绿色荧光蛋白(单亚基,1个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端或c端带有组氨酸标签(6个组氨酸残基)的绿色荧光蛋白(n-his-gfp或c-his-gfp,简称ng或cg)。绿色荧光蛋白只有1个亚基,带有1个组氨酸标签。
[0126]-无标签的绿色荧光蛋白(单亚基,0个标签)用大肠杆菌pet28a质粒为载体克隆表达未融合组氨酸标签的绿色荧光蛋白(wildtype gfp,简称wg)。
[0127]-带有两个组氨酸标签的焦磷酸硫胺素激酶(单亚基,2个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端和c端分别带有组氨酸标签(6个组氨酸残基)的焦磷酸硫胺素激酶。焦磷酸硫胺素激酶只有1个亚基,但带有2个组氨酸标签。
[0128]-带有两个组氨酸标签的多聚磷酸钠激酶(单亚基,2个标签)用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基的n端和c端分别带有组氨酸标签(6个组氨酸残基)的多聚磷酸钠激酶。多聚磷酸钠激酶只有1个亚基,但带有2个组氨酸标签。
[0129]
涉及到的操作方法
[0130]
1.菌种培养
[0131]
于lb液体培养基(蛋白胨10g/l,酵母粉5g/l,nacl 10g/l)中接种1
‰
体积的卡那霉素和1%体积的甘油菌,37℃、200rpm培养14h,按培养基体积2.5%接种菌液到含1
‰
卡那霉素的液体培养基(蛋白胨10g/l,酵母粉5g/l,na2hpo4 8.95g/l,kh2po
4 3.4g/l,nh4cl2.67g/l,na2so
4 0.7g/l,mgso
4 0.24g/l,甘油5g/l,葡萄糖0.5g/l,乳糖2g/l)中,28℃、200rpm培养24h,离心收获菌体。
[0132]
2.总蛋白浓度测定
[0133]
总蛋白浓度测定采用bca显色法,按照北京索莱宝科技有限公司的bca蛋白浓度测定试剂盒的说明书进行操作。
[0134]
3.红色荧光蛋白荧光测定
[0135]
(1)将样品稀释至合适浓度,
[0136]
(2)吸取100μl酶液于96孔板中,随后用酶标仪在554nm激发波长下检测591nm下荧光吸收。
[0137]
4.绿色荧光蛋白荧光测定
[0138]
(1)将样品稀释至合适浓度,
[0139]
(2)吸取100μl酶液于96孔板中,随后用酶标仪在488nm激发波长下检测520nm下荧光吸收。
[0140]
5.l-亮氨酸脱氢酶酶活测定
[0141]
(1)配制底物溶液:用900mm ph=9.5的nh
3-nh4cl缓冲液配制浓度为4.5mm 2-丁酮酸和0.204mm nadh的底物溶液。
[0142]
(2)取20μl酶液于96孔板中,迅速加入180μl的底物并混匀,随后立刻检测340nm下吸光度随时间变化值。
[0143]
(3)根据吸光度计算得到nadh浓度变化值,根据nadh浓度变化值和时间计算酶活。酶活定义:每分钟催化消耗1μmol nadh所需的酶量定义为1u。
[0144]
6.l-苏氨酸醛缩酶酶活测定
[0145]
(1)配制底物溶液:用去离子水配制含40mm dl-苯丝氨酸、40μm的磷酸吡哆醛(plp)的溶液,最后调节ph至8.5。
[0146]
(2)取10μl酶液于离心管中,加入190μl的去离子水和200μl底物并混匀,30℃反应10min,加入400μl的1.7%磷酸终止液进行终止。随后检测290nm下吸光度值。
[0147]
(3)根据吸光度和标准曲线计算得到产物苯甲醛浓度变化值,根据苯甲醛浓度变化值和时间计算酶活。酶活定义:每分钟催化产生1μmol苯甲醛所需的酶量定义为1u。
[0148]
7.甲酸脱氢酶酶活测定
[0149]
(1)配制底物溶液:用0.1m ph=7.5磷酸缓冲液配制含167mm甲酸钠,100mmβ-巯基乙醇,1.67mm nad+的溶液。
[0150]
(2)取20μl酶液于96孔板中,迅速加入180μl的底物并混匀,随后立刻检测340nm下吸光度随时间变化值。
[0151]
(3)根据吸光度和标准曲线计算得到nadh浓度变化值,根据nadh浓度变化值和时间计算酶活。酶活定义:每分钟催化生成1μmol nadh所需的酶量定义为1u。
[0152]
实施例1:使用一价阳离子选择性沉淀带组氨酸标签的红色荧光蛋白
[0153]
用大肠杆菌pet28a质粒为载体克隆表达蛋白亚基n端带有组氨酸标签(6个组氨酸残基)的四亚基红色荧光蛋白(nd)(一共带有4个组氨酸标签),将得到的菌体用去离子水重悬,破碎菌体后得到粗蛋白液1。
[0154]
用大肠杆菌pet28a质粒为载体克隆表达不带有组氨酸标签的四亚基红色荧光蛋白(wd),将得到的菌体用去离子水重悬,破碎菌体后得到粗蛋白液2。
[0155]
分别取500μl粗蛋白液1,分别向其中加入不同体积的2mol/l的nacl水溶液和去离子水,使得体系总体积为1ml,且体系中最终na
+
浓度分别为0,0.1,0.3,0.5,0.7,0.9,1,2,3,4,5,6,7,8,9,10,20,30,40,50,60,70,80,90,100,200,400,600,800和1000mmol/l,混合样品ph值为6.2。4℃静置1小时,然后12000rpm离心2min,通过酶标仪检测上清液在554nm激发波长下的591nm下荧光吸收,检测溶液中残留的荧光比例。通过对比测得的上清液中的残留荧光比例,可以确定残留在上清液中的红色荧光蛋白的比例。
[0156]
平行于上述粗蛋白液1的操作,用上述粗蛋白液2(wd,对照)进行类似操作。
[0157]
所得结果,以上清液中残留荧光相对于原始样品荧光的比例为纵坐标,以体系中na
+
浓度(mm)的对数坐标为横坐标作图,如图1a所示。由图1a可以看到,当na
+
浓度在10-400mmol/l(mm)范围内时,相比无标签的wd,含组氨酸标签的nd实现了选择性的沉淀。
[0158]
与nacl的操作类似,分别将nacl变更为na2so4(图1b),licl(图1c),kcl(图1d),nh4cl(图1e),(nh4)2so4(图1f),赖氨酸(图1g),咪唑(图1h)和盐酸胍(图1i)。由图1b至图1i可以看到,当这些一价阳离子浓度在约10-约400mm的范围内时,尤其是在15-300mm范围内,相比无标签的wd,带有组氨酸标签的nd实现了选择性的沉淀。
[0159]
此外,与nacl的实验类似,采用浓度为100mm的组氨酸阳离子或氨基葡萄糖阳离子或精氨酸的体系,结果发现95%或97%或97.5%的带有组氨酸标签的nd发生沉淀,而没有组氨酸标签的wd几乎没有发生任何沉淀。
[0160]
作为对比例,与nacl的操作类似,分别将nacl变更为脲(nh
2-c(=o)-nh2),结果如图1j所示。由于脲在水溶液中不解离产生阳离子,所以不能使得目标蛋白发生选择性沉淀。
[0161]
此外,以nh4cl为例,考察了不同浓度下获得的nd一步沉淀的收率和纯度。取500μl的nd,加入500μl的nh4cl溶液,使得nh
4+
的对应终浓度分别为50,100,200mm,混合样品ph值为6.2,4℃沉淀1h。12000rpm离心2min,检测上清中的荧光和蛋白浓度,计算nd的一步沉淀收率和纯度。纯度以比荧光的方式计算。
[0162]
沉淀收率=(原始荧光-上清残留荧光)/原始荧光
[0163]
比荧光=样品的荧光/样品的蛋白浓度
[0164]
纯化倍数=纯化后样品的比荧光/粗蛋白液的比荧光
[0165]
结果见下表1。
[0166]
表1:nh4cl对nd的一步沉淀收率及纯度
[0167][0168]
如图1d和1f所示,wd在加入这些浓度的nh4cl不能产生沉淀,而如上表1所示,目标蛋白nd在加入这些浓度的nh
4+
可以选择性地沉淀,而且收率很高,且纯度有较大幅度的提高。
[0169]
从实施例1的结果可以看出,非h
+
一价阳离子在一定的浓度范围内能够很好地选择性沉淀带有组氨酸标签的红色荧光蛋白。
[0170]
实施例2:使用二价阳离子沉淀选择性沉淀带有组氨酸标签的红色荧光蛋白
[0171]
使用实施例1中的粗蛋白液1(nd)和粗蛋白液2(wd)。以与实施例1类似的操作方式,只是分别使用mgcl2(图2a),mgso4(图2b),cacl2(图2c),和mncl2(图2d),用酶标仪检测上清液中的荧光值,结果见图2a至图2d。从图2a至图2d可以看到,这些二价阳离子浓度在1-80mm的范围内,特别是在1.5-40mm范围内,相比无标签的wd,含组氨酸标签的nd实现了选择性的沉淀。
[0172]
此外,以cacl2为例,考察了不同浓度下获得的nd一步沉淀的收率和纯度。取500μl的nd,加入500μl的cacl2溶液,使得ca
2+
的对应终浓度分别为5,10,30mm体系,混合样品ph值为6.2,4℃沉淀1h。12000rpm离心2min,检测上清中的荧光和蛋白浓度,计算nd的一步沉淀收率和纯度。纯度以比荧光的方式计算。结果见下表2。
[0173]
沉淀收率=(原始荧光-上清残留荧光)/原始荧光
[0174]
比荧光=样品的荧光/样品的蛋白浓度
[0175]
纯化倍数=纯化后样品的比荧光/粗蛋白液的比荧光
[0176]
表2:用不同浓度的cacl2一步沉淀nd的收率及纯度
[0177][0178]
如图2c所示,wd在加入这些浓度的cacl2不能产生沉淀,而如上表2所示,目标蛋白
nd在加入这些浓度的ca
2+
可以选择性地沉淀,而且收率很高,且纯度有较大幅度的提高。
[0179]
此外,与mgcl2的实验类似,采用浓度为10mm的co
2+
阳离子或fe
2+
阳离子的体系,结果发现100%的带有组氨酸标签的nd发生沉淀,而没有组氨酸标签的wd几乎没有发生任何沉淀。此外,采用浓度为100mm的co
2+
阳离子或fe
2+
阳离子的体系,发现全部带有组氨酸标签的nd又重新溶解。
[0180]
作为对比例,与mgcl2的操作类似,分别将mgcl2变更为nicl2(图2e),zncl2(图2f)和cucl2(图2g)。从图2e至图2g可以看到,尽管在1mm的离子浓度下含组氨酸标签的目标蛋白nd就会明显沉淀,但无标签的原始蛋白wd在大部分的浓度范围内也会出现沉淀,因此常规用于imac的ni
2+
,zn
2+
,cu
2+
对于目标蛋白没有选择性沉淀作用。
[0181]
从以上结果可以看出,ca
2+
,mg
2+
,mn
2+
,co
2+
,fe
2+
阳离子在本发明浓度范围内能够很好地选择性沉淀带有组氨酸标签的红色荧光蛋白。
[0182]
对二价阳离子的沉淀物进行分析。使用实施例1中的粗蛋白液1(nd),分别使用2mm的ca
2+
,mg
2+
,mn
2+
,co
2+
,ni
2+
,cu
2+
,zn
2+
进行沉淀操作,体系ph值6.2,4℃静置1小时,然后12000rpm离心2min,所得结果如图3a照片所示。在图3a中,从左至右分别是空白对照、ca
2+
,mg
2+
,mn
2+
,co
2+
,ni
2+
,cu
2+
,zn
2+
的沉淀结果,可以看出,ni
2+
,cu
2+
,zn
2+
产生了显著更多的沉淀物,说明目标蛋白和杂蛋白都被同时沉淀下来了。相应地,对每个试管中的沉淀物与上清液分别进行电泳,电泳结果如图3b所示,在图3b中从左到右的条带分别是蛋白质标准marker(m)、ca
2+
上清(1),ca
2+
沉淀(2)、mg
2+
上清(3)、mg
2+
沉淀(4)、mn
2+
上清(5),mn
2+
沉淀(6)、co
2+
上清(7),co
2+
沉淀(8)、ni
2+
上清(9),ni
2+
沉淀(10)、cu
2+
上清(11),cu
2+
沉淀(12)、zn
2+
上清(13),zn
2+
沉淀(14)。从图3b可以看出,在ca
2+
,mg
2+
,mn
2+
,co
2+
体系的沉淀物中目标蛋白占主要部分而杂蛋白主要保留在上清液中,在ni
2+
,cu
2+
,zn
2+
体系中,几乎所有蛋白都在沉淀物中,而上清液中只有非常少量或者几乎没有什么蛋白。图3a和图3b的结果说明了ca
2+
,mg
2+
,mn
2+
,co
2+
对目标蛋白具有较好的选择性沉淀作用。
[0183]
实施例3:使用一价阳离子对沉淀物复溶以及复溶选择性分析
[0184]
使用实施例1中的粗蛋白液1(nd)。取若干个离心管,分别移取500μl的nd,加入500μl的200mm nacl(或nh4cl),混合样品ph值约为6.2,4℃静置1h。离心后分离上清和沉淀,沉淀分别用水,10,20,80,200,400,600mm nacl(或nh4cl)重悬。检测重悬后上清的荧光和蛋白浓度,结果如表3和表4所示。可以看到,这些一价阳离子浓度在低于30mm时,特别是在0-20mm范围内,或者是在高于300mm时,特别是在400-600mm范围内,可以对含组氨酸标签的nd沉淀进行复溶,并且复溶后的蛋白的纯度有所提高。
[0185]
复溶收率=重悬后上清的荧光/(原始粗蛋白液荧光-沉淀后上清残留荧光)
[0186]
纯化倍数=(重悬后上清的荧光/重悬后上清的蛋白浓度)/(原始粗蛋白液荧光/原始粗蛋白液的蛋白浓度)
[0187]
表3:100mm nacl得到的nd沉淀用不同浓度的nacl溶液进行重悬
[0188][0189]
表4:100mm nh4cl得到的nd沉淀用不同浓度的nh4cl溶液进行重悬
[0190][0191]
实施例4:使用二价阳离子对沉淀物复溶以及复溶选择性分析
[0192]
分别取950μl实施例1中的粗蛋白液1(nd),分别向其中加入50μl的200mm的mgcl2水溶液,使得体系中最终mg
2+
浓度分别为10mm,混合样品ph值约为6.2。4℃静置1小时,然后12000rpm离心2min,将获得的沉淀物与上清液分离,然后在沉淀物中加入mgcl2水溶液,使得体系中mg
2+
浓度分别为0mm,0.2mm,1mm,2mm,4mm,10mm,20mm,40mm,100mm,200mm,4℃静置30min后,12000rpm离心2min,通过酶标仪检测上清液在554nm激发波长下的591nm下荧光吸收,检测上清液中残留的荧光比例。以mg
2+
浓度为横坐标,以与原始样品荧光的比例为纵坐标,结果如图4所示。
[0193]
由图4可以看到,当镁离子浓度低于2mm或高于40mm时,沉淀蛋白样品出现了明显的溶解。
[0194]
对复溶的蛋白溶液进行蛋白浓度和荧光值的检测,评价目标蛋白的纯化效果。结果发现,在0、0.2、1、40、100mm浓度下,复溶的蛋白溶液中目标蛋白的纯度相比原始蛋白溶液分别提高了3、3.2、2.7、4.1、4.2倍。这说明在沉淀物的复溶过程中,可以对目标蛋白选择性地溶解,从而提高目标蛋白的纯度。
[0195]
实施例5:一价阳离子对l-苏氨酸醛缩酶的沉淀与复溶
[0196]
对带有组氨酸标签的l-苏氨酸醛缩酶(4个亚基,4个组氨酸标签)进行一价阳离子的沉淀和复溶操作。
[0197]
取500μl的l-苏氨酸醛缩酶粗酶液,分别加入水及2m nacl(或nh4cl)使酶液中的阳离子终浓度分别为50、100、200mm,混合样品ph值约为6.2,4℃静置1h。离心后分离上清和沉淀,用pb溶液(20mm磷酸钠,500mm nacl,500mm咪唑,ph 8.0)重悬沉淀样品,按照前述方法检测沉淀的酶活和蛋白浓度,计算沉淀收率和纯化倍数,结果如表5。可以看到,这些一价阳离子浓度在所采用的范围内,可以对含组氨酸标签的l-苏氨酸醛缩酶进行沉淀,并且沉淀的目标蛋白的纯度有所提高。
[0198]
表5:采用nacl和nh4cl对l-苏氨酸醛缩酶进行沉淀
[0199][0200]
对采用100mm nh4cl沉淀的样品进行水和600mm对应一价阳离子溶液的复溶,4℃静置1h。离心后分离上清和沉淀,按照前述方法检测复溶上清样品的酶活和蛋白浓度,计算复溶收率和纯化倍数,结果见表6。可以看到,这些采用高浓度的一价阳离子溶液对含组氨酸标签的l-苏氨酸醛缩酶进行复溶,目标样品可以被溶解,并且复溶的目标蛋白的纯度有所提高。
[0201]
表6:采用nh4cl对l-苏氨酸醛缩酶沉淀样品进行重悬
[0202] 原始沉淀水重悬上清600mm nh4复溶上清
复溶收率(%)1.000.570.96纯化倍数1.001.663.88
[0203]
实施例6:二价阳离子对l-苏氨酸醛缩酶、甲酸脱氢酶、l-亮氨酸脱氢酶的沉淀与复溶
[0204]
对l-苏氨酸醛缩酶(4个亚基,4个组氨酸标签)进行不同浓度的二价阳离子的沉淀操作。
[0205]
取950μl l-苏氨酸醛缩酶粗酶液,加入50μl不同浓度的mgso4溶液混匀后使得镁离子终浓度分别为0,0.1,0.2,1,2,4,6,8,10,20,50,100mm,混合样品ph值约为6.2,4℃静置过夜。12000rpm离心1min,分别去上清和沉淀样品进行蛋白电泳。结果见图5。
[0206]
在图5中,泳道1,2,4,6,8,10,12,14,16,18,20,22分别为0,0.1,0.2,1,2,4,6,8,10,20,50,100mm镁离子处理后离心的上清样品,泳道3,5,7,9,11,13,15,17,19,21,23分别为0.1,0.2,1,2,4,6,8,10,20,50,100mm镁离子处理后离心的沉淀样品,泳道m为蛋白质marker,箭头标示为目标蛋白条带。
[0207]
结果可以发现目标蛋白在低浓度镁离子处理下不沉淀,在1-50mm范围内有明显的沉淀,但在较高浓度下(100mm)目标蛋白基本不沉淀。
[0208]
对l-苏氨酸醛缩酶进行二价阳离子的沉淀和复溶操作,电泳结果见图6。取950μl的l-苏氨酸醛缩酶粗酶液(1泳道),加入50μl的200mm的mgso4溶液混匀(镁离子终浓度为10mm),混合样品ph值约为6.2,静置30min,离心分离得到上清(2泳道)和蛋白沉淀(3泳道);蛋白沉淀用100μl的100mm或200mm mgso4溶液吹打重悬(也即是复溶)后离心分离,得到沉淀(4泳道,7泳道),溶有目标蛋白的上清液移入新离心管(镁离子浓度为100或200mm);向装有100μl复溶蛋白溶液的离心管中加入900μl去离子水稀释(使镁离子浓度变为10或20mm),液体变浑浊,离心,固液分离,得到上清(5泳道,8泳道)和沉淀(6泳道,9泳道),6泳道和9泳道的沉淀即为纯化的目标蛋白。10泳道为marker,箭头标示为目标蛋白条带。
[0209]
从图6可以看到,粗酶液中加入10mm镁离子可以实现目标蛋白的充分沉淀;在10mm镁离子的沉淀物中加入100mm或200mm镁离子可以使目标蛋白较好地溶解,而杂蛋白依然留在沉淀中;对100mm或200mm镁离子复溶的蛋白溶液进行稀释,可以将目标蛋白充分沉淀出来,且目标蛋白的纯度很高。
[0210]
对甲酸脱氢酶(2个亚基,2个组氨酸标签)进行二价阳离子的沉淀和复溶操作,电泳结果见图7。取900μl的甲酸脱氢酶粗酶液(1泳道),加入100μl的100mm或200mm的mgso4溶液混匀,使镁离子终浓度分别为10mm或20mm,混合样品ph值约为6.2,静置30min,离心分离得到上清(2泳道和6泳道)和蛋白沉淀;蛋白沉淀用100μl的200mm mgso4溶液吹打重悬(也即是复溶)后离心分离,得到沉淀(3泳道,7泳道),溶有目标蛋白的上清液移入新离心管(镁离子浓度为200mm);向装有100μl复溶蛋白溶液的离心管中加入900μl去离子水稀释(使镁离子浓度变为20mm),液体变浑浊,离心,固液分离,得到上清(4泳道,8泳道)和沉淀(5泳道,9泳道),5泳道和9泳道的沉淀即为纯化的目标蛋白。泳道m为蛋白质marker,箭头标示为目标蛋白条带。
[0211]
从图7可以看到,粗酶液中加入10mm或20mm镁离子可以实现目标蛋白的沉淀;在10mm或20mm镁离子的沉淀物中加入200mm镁离子复溶可以使目标蛋白较好地溶解,而大量杂蛋白依然留在沉淀中;对200mm镁离子复溶的蛋白溶液进行稀释,可以将目标蛋白沉淀出
来,且目标蛋白的纯度较高。
[0212]
对含组氨酸标签的l-亮氨酸脱氢酶(8个亚基,8个组氨酸标签)进行二价阳离子的沉淀和复溶操作,电泳结果见图8。取900μl的l-亮氨酸脱氢酶粗酶液(1泳道),加入100μl的100mm或200mm的mgso4溶液混匀,使镁离子终浓度分别为10mm或20mm,混合样品ph值约为6.2,静置30min,离心分离得到上清(2泳道和6泳道)和蛋白沉淀;蛋白沉淀用100μl的200mm mgso4溶液吹打重悬(也即是复溶)后离心分离,得到沉淀(3泳道,7泳道),溶有目标蛋白的上清液移入新离心管(镁离子浓度为200mm);向装有100μl复溶蛋白溶液的离心管中加入900μl去离子水稀释(使镁离子浓度变为20mm),液体变浑浊,离心,固液分离,得到上清(4泳道,8泳道)和沉淀(5泳道,9泳道),5泳道和9泳道的沉淀即为纯化的目标蛋白。泳道m为蛋白质marker,箭头标示为目标蛋白条带。
[0213]
从图8可以看到,粗酶液中加入10mm或20mm镁离子可以实现目标蛋白的充分沉淀;在10mm或20mm镁离子的沉淀物中加入200mm镁离子复溶可以使目标蛋白较好地溶解,而大量杂蛋白依然留在沉淀中;对200mm镁离子复溶的蛋白溶液进行稀释,可以将目标蛋白沉淀出来,且目标蛋白的纯度较高。
[0214]
对含有组氨酸标签的氨基酸酯酰基转移酶(2亚基蛋白,含2个组氨酸标签)蛋白样品,结果如图9。加入终浓度为10mm的mgso4,混合样品ph值约为6.2,离心得到上清液(2泳道)和沉淀(3泳道),对所得沉淀中加入终浓度为100mm的mgso4进行重悬复溶,混合样品ph值约为6.2,离心得到沉淀(4泳道)。对100mm mgso4复溶上清液加水稀释至mgso4的浓度为10mm,目标蛋白重新产生沉淀,离心得到上清液(5泳道)和最终纯化的目标蛋白沉淀(6泳道)。泳道1为粗酶液;泳道m为蛋白质marker;箭头标示为目标蛋白条带。
[0215]
从图9中结果显示,采用低浓度阳离子沉淀、高浓度阳离子重悬、再稀释沉淀的策略可以得到高收率和高纯度的目标蛋白。
[0216]
实施例7:体系ph对含组氨酸标签蛋白的沉淀的影响
[0217]
分别取实施例1中的粗蛋白液1(nd),加入nah2po4使得体系中na
+
的浓度为100mmol/l。用100mm naoh调节ph值,静置1小时,测定溶液中的荧光残留百分比,结果发现,在ph分别为5.0,5.5,6.0,6.6,7.0,7.2时,nd的沉淀率分别为99%,99%,97%,95%,21%,2%。
[0218]
类似地,在粗蛋白液1(nd)加入nh4cl,使得体系中nh
4+
的浓度为100mmol/l,用100mm nh3·
h2o调节ph值,静置1小时,测定溶液中的荧光残留百分比,结果发现,在ph分别为5.0,5.5,6.2,6.7,7.1,7.3时,nd的沉淀率分别为99%,99%,99%,97%,36%,2%。
[0219]
类似地,在粗蛋白液1(nd)加入cacl2,使得体系中ca
2+
的浓度为10mmol/l,用10mm ca(oh)2调节ph值,静置1小时,测定溶液中的荧光残留百分比,结果发现,在ph分别为5.0,5.5,6.2,6.6,7.0,7.2时,nd的沉淀率分别为100%,100%,100%,88%,17%,3%。
[0220]
类似地,在粗蛋白液1(nd)加入mgcl2,使得体系中mg
2+
的浓度为10mmol/l,用10mm naoh调节ph值(混合体系中的na
+
的浓度不超过1mm),静置1小时,测定溶液中的荧光残留百分比,结果发现,在ph分别为5.0,5.5,6.2,6.7,7.0,7.2时,nd的沉淀率分别为100%,100%,99%,97%,35%,7%。
[0221]
此外,取实施例1中的nd的菌液1ml,经水洗离心后得到菌体,分别用浓度为100mm的ph5,ph6,ph7,ph8的磷酸钠溶液进行重悬,经超声破碎后离心,沉淀用1ml水重悬。电泳结
果见图10,其中泳道1,3,5,7分别为ph8,ph7,ph6,ph5处理后得到的上清,泳道2,4,6,8分别为ph8,ph7,ph6,ph5处理后得到的沉淀,m为蛋白质marker,箭头标示为目标蛋白条带。
[0222]
结果表明,ph5和ph6的条件下,目标蛋白nd基本都沉淀下来,在ph7时有少量nd沉淀,而在ph8时nd不能沉淀。这说明较低的ph对nd的沉淀是有必要的。
[0223]
实施例8:温度对nd沉淀的影响
[0224]
取实施例1中的nd蛋白样品,分别加入终浓度为10mm的mgcl2或100mm的nacl,混合样品ph值约为6.2,分别在4℃,20℃,28℃下静置1h。12000rpm离心2min,检测上清的荧光和蛋白浓度。结果见表7。结果显示,不同温度下目标蛋白均可获得很高的沉淀收率和纯度。
[0225]
表7:不同温度下nd的沉淀结果
[0226][0227]
实施例9:总蛋白浓度对含组氨酸标签的目标蛋白的沉淀的影响
[0228]
取实施例1中的含目标蛋白nd的粗蛋白液,在总蛋白浓度分别为1.16mg/ml、0.5mg/ml、0.3mg/ml、0.17mg/ml和0.05mg/ml体系里分别加入不同浓度的mgcl2,测定溶液中荧光残留百分比。结果参见图11。从图11可见,溶液中总蛋白浓度对于沉淀效果没有影响。
[0229]
在4750μl总蛋白的浓度为8.59mg/ml的粗蛋白液中,加入250μl 200mm mgcl2,使得终浓度为10mm mgcl2。12000rpm 2min离心,测定溶液中荧光残留百分比,计算目标蛋白nd的一次沉淀收率为98%。沉淀用5ml的100mm mgcl2重悬,4℃静置1h后12000rpm离心2min,加水将上清mgcl2稀释至10mm后4℃静置1h,12000rpm离心2min后收集沉淀,计算沉淀nd蛋白的收率为85%,其纯度相比原始粗蛋白液提高了3.1倍。
[0230]
实施例10:含双组氨酸标签的单亚基蛋白的阳离子选择性沉淀
[0231]
对于单亚基绿色荧光蛋白gfp,分别构建了在n端、c端和同时在n端和c端融合了组氨酸标签的重组蛋白,在大肠杆菌中分别表达并制备了含有1个组氨酸标签或2个组氨酸标签的重组蛋白的粗酶液。对无标签绿色荧光蛋白gfp(wg),c端添加组氨酸标签(6个组氨酸残基)gfp(cg),n端添加组氨酸标签(6个组氨酸残基)gfp(ng)以及两端添加6组氨酸标签(6个组氨酸残基)(dg)的粗酶液进行操作,在粗酶液中分别加入10mm mgcl2,混合样品ph值约为6.2,离心得到上清液和沉淀,对各样品进行蛋白电泳检测,结果见图12。其中泳道m为蛋白质marker,泳道1为wg粗酶液,泳道2为ng粗酶液,泳道3为cg粗酶液,泳道4为dg粗酶液,泳道5为加入mgcl2的wg上清,泳道6为加入mgcl2的ng上清,泳道7为加入mgcl2的cg上清,泳道8为加入mgcl2的dg上清,泳道9为加入mgcl2的wg沉淀,泳道10为加入mgcl2的ng沉淀,泳道11为加入mgcl2的cg沉淀,泳道12为加入mgcl2的dg沉淀,箭头标示为目标蛋白条带。
[0232]
从图12中可以看到,在加入mgcl2后,不带组氨酸标签或只带一个组氨酸标签的绿色荧光蛋白基本不沉淀,但带有2个组氨酸标签的蛋白可以实现沉淀。
[0233]
对于单亚基蛋白焦磷酸硫胺素激酶,构建了同时在n端和c端融合了组氨酸标签的重组蛋白,在大肠杆菌中表达并制备了含有2个组氨酸标签的重组蛋白的粗酶液。在粗酶液中分别加入终浓度为100mm的kcl、nacl和nh4cl,混合样品ph值约为6.2,离心得到上清和沉
淀,蛋白电泳结果见图13,其中泳道m为蛋白质marker,泳道1为粗酶液,泳道2为加入kcl的上清,泳道3为加入kcl的沉淀,泳道4为加入nacl的上清,泳道5为加入nacl的沉淀,泳道6为加入nh4cl的上清,泳道7为加入nh4cl的沉淀,箭头标示为目标蛋白条带。从图13可以看到,目标蛋白可以在k
+
、na
+
和nh
4+
离子的作用下发生选择性的沉淀。
[0234]
对于单亚基蛋白多聚磷酸钠激酶,构建了同时在n端和c端融合了组氨酸标签的重组蛋白,在大肠杆菌中表达并制备了含有2个组氨酸标签的重组蛋白的粗酶液。在粗酶液中加入终浓度为100mm的kcl、nacl和nh4cl,混合样品ph值约为6.2,离心得到上清和沉淀,蛋白电泳结果见图14,其中泳道m为蛋白质marker,泳道1为粗酶液,泳道2为加入kcl的上清,泳道3为加入kcl的沉淀,泳道4为加入nacl的上清,泳道5为加入nacl的沉淀,泳道6为加入nh4cl的上清,泳道7为加入nh4cl的沉淀,箭头标示为目标蛋白条带。从图14可以看到,目标蛋白可以在k
+
、na
+
和nh
4+
离子的作用下发生选择性的沉淀。
[0235]
实施例11:先高浓度阳离子沉淀杂蛋白然后稀释沉淀目标蛋白的纯化方案
[0236]
在500μl的实施例1中带有组氨酸标签的红色荧光蛋白nd的粗蛋白液中,加入500μl200mm mgcl2,使得终浓度为100mm mgcl2,混合样品ph值约为6.2,4℃静置1h。12000rpm离心2min,将得到的上清用水稀释至mgcl2终浓度为10mm,4℃静置1h。12000rpm离心2min,收集沉淀,检测沉淀中目标蛋白的收率为96%,相比粗蛋白液的纯度提高了3.68倍。
[0237]
类似地,在nd的粗蛋白液中加入终浓度为600mm的nacl,混合样品ph值约为6.2,4℃静置1h。12000rpm离心2min,将得到的上清用水稀释至nacl终浓度为100mm,4℃静置1h。12000rpm离心2min,收集沉淀,检测沉淀中目标蛋白的收率为96%,相比粗蛋白液的纯度提高了4.08倍。
[0238]
这说明,可以用较高浓度的一价或二价阳离子溶液先将部分杂蛋白沉淀出来,带有组氨酸标签的目标蛋白会保留在溶液上清中。经离心得到的上清液再用水稀释至低浓度,杂蛋白会保留在上清中,而带有组氨酸标签的目标蛋白会沉淀出来,从而实现了目标蛋白的纯化。
[0239]
实施例12:先低浓度沉淀、高浓度重悬、再稀释沉淀对目标蛋白的纯化方案
[0240]
以大肠杆菌pet28a质粒为载体克隆表达n端携带6个组氨酸标签的l-亮氨酸脱氢酶(ldh,8个亚基,8个标签),得到的菌体用去离子水重悬,破碎菌体后得到粗蛋白液。对于一价阳离子钠和铵离子的纯化方法为:于950μl粗蛋白液中加入50μl 2m nacl或nh4cl(终浓度为100mm的nacl或nh4cl),混合样品ph值约为6.2,4℃静置1h然后12000rpm离心2min,沉淀用100μl 800mm nacl重悬溶解,静置1h,然后重悬液12000rpm离心2min,于离心后的上清中加去离子水稀释nacl或nh4cl浓度至80mm,再次12000rpm离心2min,得到的沉淀为高纯度的目标蛋白ldh。
[0241]
对于二价阳离子镁的纯化方法为:于950μl粗蛋白液中加入50μl 200mm mgso4(终浓度为10mm的mgso4),混合样品ph值约为6.2,4℃静置1h,然后12000rpm离心2min,沉淀用100μl 100mm mgso4/cacl2重悬溶解,静置1h,然后重悬液12000rpm离心2min,于离心后的上清中加去离子水稀释mgso4浓度至10mm,再次12000rpm离心2min,得到的沉淀为高纯度的目标蛋白ldh。
[0242]
采用金属离子亲和层析方法(imac)作为对比。采用ge的hitrap预装柱(ni-imac)对ldh进行纯化。首先,用五倍柱体积去离子水3ml/min冲洗柱子;将要纯化的酶液与结合缓
冲液(20mm pb,500mm nacl,20mm咪唑,ph 8.0)按1:1混合后,1ml/min上样;用五倍柱体积的结合缓冲液洗涤未结合的蛋白;用五倍柱体积的洗脱缓冲液(20mm pb,500mm nacl,500mm咪唑,ph 8.0)洗脱目标蛋白。
[0243]
将用钠、铵、镁离子沉淀样品及imac纯化样品进行蛋白质电泳,结果见图15,其中泳道m为蛋白质marker,泳道1为粗酶液,泳道2为imac纯化的ldh,泳道3为镁离子纯化的样品,泳道4为钠离子纯化的样品,泳道5铵离子纯化的样品,箭头标示为目标蛋白条带。
[0244]
从图15可以看到,经镁、钠、铵沉淀方法获得的目标蛋白纯度与imac纯化样品相当,表明本发明的方法对含组氨酸标签的l-亮氨酸脱氢酶具有非常好的纯化效果。
[0245]
相同的方法用于n端带有组氨酸标签(6个组氨酸残基)的红色荧光蛋白(nd,4个亚基,4个标签),带有组氨酸标签的l-苏氨酸醛缩酶(lta,4个亚基,4个标签),得到结果如图16和图17。在图16中,泳道m为蛋白质marker,泳道1为imac纯化的nd,泳道2为粗酶液,泳道3为镁离子纯化的样品,泳道4为钠离子纯化的样品,泳道5铵离子纯化的样品,箭头标示为目标蛋白条带。在图17中,泳道m为蛋白质marker,泳道1为粗酶液,泳道2为imac纯化的lta,泳道3为镁离子纯化的样品,泳道4为钠离子纯化的样品,泳道5铵离子纯化的样品,箭头标示为目标蛋白条带。
[0246]
从图16和图17可以看到,用本发明的方法对含组氨酸标签的红色荧光蛋白和l-苏氨酸醛缩酶同样具有很好的纯化效果。
[0247]
实施例13:不同长度组氨酸标签的对沉淀的影响
[0248]
分别构建含有3个组氨酸残基、9个组氨酸残基、12个组氨酸残基的组氨酸标签的荧光蛋白(3nd,9nd,12nd),分别获得粗蛋白液。取500μl粗蛋白液,加入不同体积的2mol/lmgcl2水溶液和去离子水,使体系总体积为1ml,且体系中mg
2+
浓度分别为3和8mm,混合样品ph值约为6.2,4℃静置1小时,然后12000rpm离心2min,通过酶标仪检测上清液在554nm激发波长下的591nm下荧光吸收,检测溶液中残留的荧光百分比。发现在3mm mg
2+
条件下,3nd,9nd,12nd的沉淀率分别为93.2%,98.2%,93%;在8mm mg
2+
条件下,3nd,9nd,12nd的沉淀率分别为82.5%,99.7%,99.4%。
[0249]
实施例14:使用不同组合的离子分别沉淀-溶解蛋白
[0250]
对实施例1中的nd蛋白样品,加入终浓度10mm的mgso4进行沉淀,离心得到的沉淀,分别加入100mm cacl2或500mm nh4cl充分重悬沉淀,混合样品ph值约为6.2,离心得到上清液,加水稀释(钙稀释至10mm,氨稀释至100mm),对各个样品进行电泳,结果见图18,其中,泳道1为原始nd样品;泳道2为10mm的mgso4处理后离心的上清液;泳道3为用100mm的cacl2充分重悬沉淀后的残留沉淀;泳道4为100mm的cacl2充分重悬沉淀后的上清液经水稀释后,离心得到的沉淀;泳道5为100mm的cacl2充分重悬沉淀后的上清液经水稀释后,离心得到的上清液;泳道6为用500mm的nh4cl充分重悬沉淀后的残留沉淀;泳道7为500mm的nh4cl充分重悬沉淀后的上清液经水稀释后,离心得到的沉淀;泳道8为500mm的nh4cl充分重悬沉淀后的上清液经水稀释后,离心得到的上清液;泳道m为蛋白质marker;箭头标示为目标蛋白条带。
[0251]
图18结果显示,用不同组合的离子分别对nd样品进行沉淀和溶解,最终都可以得到高收率、高纯度的目标蛋白。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1