MMP-9纳米抗体及其制备方法与应用
mmp
‑
9纳米抗体及其制备方法与应用
技术领域
1.本技术属于生物医药技术领域,尤其涉及一种mmp
‑
9纳米抗体及其制备方法与应用。
背景技术:
2.基质金属蛋白酶(matrix metalloproteins,mmps),是一类由28个家族成员组成的一种钙依赖含锌内肽酶,可以通过裂解细胞外基质中几乎所有的成分,在ecm的转换过程中起关键作用。
3.其中,基质金属蛋白酶9(matrix metalloprotein 9,mmp
‑
9)是mmps家族的重要成员之一,分子量为92kda,属于明胶酶的一种,其作用底物广泛使mmp
‑
9参与了许多与基体自身稳定相关的功能,且mmp
‑
9的表达主要发生在中性粒细胞、单核细胞、巨噬细胞、小胶质细胞、淋巴细胞、树突状细胞、成纤维细胞、血管内皮细胞、角质形成细胞和肿瘤细胞中。目前,mmp
‑
9在血管生成、肿瘤转移和侵袭中的作用已证实,此外mmp
‑
9还负责癌细胞的生存和扩散,主要的,mmp
‑
9基因多态性在乳腺癌患者中具有重要作用,并可识别乳腺癌的发生风险;更有研究发现,mmp
‑
9与乳腺肿瘤的不良预后直接相关,通过抑制mmp
‑
9可以阻碍肿瘤的进展作为治疗肿瘤的有效策略。
4.目前,mmp
‑
9被认为是治疗乳腺癌的关键治疗靶点,但当前的抑制剂药物效果不尽人意,且具有巨大的副作用,均止步于临床。究其原因,第一代抑制剂主要靶向mmp
‑
9酶催化位点上的zn离子来抑制酶活性,然而它有胃肠道毒性,炎症,纤维化,出血和组织坏死等主要不良反应,且溶解性差。第二,mmp
‑
9的抗体均为传统的单克隆抗体,单克隆抗体药物分子量大不能进入酶活性位点,虽然特异性结合mmp
‑
9,但不足以抑制mmp
‑
9的酶活性,同时单克隆抗体表达效率低,且亲和力和稳定性较差,导致无法广泛应用。
技术实现要素:
5.本技术的目的在于提供一种mmp
‑
9纳米抗体及其制备方法与应用,旨在解决现有技术中mmp
‑
9抑制剂特异结合能力差,且稳定性弱并具有较大副作用的问题。
6.为实现上述申请目的,本技术采用的技术方案如下:
7.第一方面,本技术提供一种mmp
‑
9纳米抗体,所述mmp
‑
9纳米抗体为单域抗体,且所述单域抗体包括互补决定区cdr,所述互补决定区包括cdr1、cdr2、cdr3;
8.其中,所述cdr1的氨基酸序列选自seq.id no.1~seq.id no.5中的任一种,
9.所述cdr2的氨基酸序列选自seq.id no.6~seq.id no.9中的任一种,
10.所述cdr3的氨基酸序列选自seq.id no.10~seq.id no.14中的任一种。
11.第二方面,本技术提供一种mmp
‑
9纳米抗体的制备方法,包括如下步骤:
12.通过对多个天然文库大量测序比对分析,分别设计cdr区中cdr1、cdr2和cdr3的氨基酸突变位点并合成cdrs突变引物;
13.提供合成得到的纳米抗体模板序列,对所述纳米抗体模板序列进行密码子优化并
引入限制性内切酶的酶切位点,得到优化纳米抗体模板序列;
14.将所述优化纳米抗体模板序列插入噬菌粒载体构建重组噬菌粒,将所述重组噬菌粒进行噬菌体展示后提取单链dna,利用kunkel突变法把所述cdrs突变引物与所述单链dna进行配对合成异源双链dna,并转化至到大肠杆菌中培养得到噬菌体突变文库;
15.用所述噬菌体突变文库针对mmp
‑
9进行筛选、纯化得到mmp
‑
9纳米抗体。
16.第三方面,本技术提供一种抗乳腺癌肿瘤转移的药物,所述药物包括mmp
‑
9纳米抗体,且所述mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的。
17.第四方面,本技术提供一种抗乳腺癌肿瘤转移的药物组合物,所述药物组合物包括mmp
‑
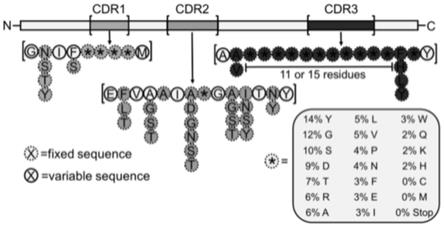
9纳米抗体和pd
‑
l1抑制剂,其中,所述mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的。
18.本技术第一方面提供的一种mmp
‑
9纳米抗体,所述mmp
‑
9纳米抗体为单域抗体,且所述单域抗体包括互补决定区cdr,所述互补决定区包括cdr1、cdr2、cdr3,并提供了cdr1、cdr2、cdr3可选的具体氨基酸序列,其中,得到的该mmp
‑
9纳米抗体为特异性针对mmp
‑
9催化域的活性位点的单域抗体,由于其对互补决定区的各个区域的氨基酸进行突变选择,并且将cdr3区延长,使整个cdr3区从原来的16个氨基酸延长到20个氨基酸,能够提高对mmp
‑
9催化域的亲和性,使该纳米抗体能够特异性且强有力与催化域的活性位点结合,并且分子量小,穿透能力强,稳定性高,副作用低,能够大量进行表达,使得该纳米抗体能够较好抑制mmp
‑
9的活性,能够代替传统单克隆抗体用于快速检测相关蛋白,进而具有良好的抑制乳腺癌肿瘤转移的作用。
19.本技术第二方面提供的一种mmp
‑
9纳米抗体的制备方法,该制备方法以噬菌体展示技术,利用进行密码子优化及添加了限制性内切酶位点的纳米抗体为模板,通过kunkel突变在cdr区引入突变,构建噬菌体展示纳米抗体文库,并通过筛选、纯化得到mmp
‑
9纳米抗体,该制备方法简单方便,能够确保具有更大的库容量,有利于筛选得到mmp
‑
9纳米抗体。
20.本技术第三方面提供的一种抗乳腺癌肿瘤转移的药物,所述药物包括mmp
‑
9纳米抗体,且所述mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的;由于mmp
‑
9纳米抗体对mmp
‑
9的催化域的活性位点具有特异性的结合能力以及较强的亲和力,因此包括了mmp
‑
9纳米抗体的药物能够较好地抑制mmp
‑
9的活性,进而抑制乳腺癌肿瘤转移。
21.本技术第四方面提供的一种抗乳腺癌肿瘤转移的药物组合物,所述药物组合物包括mmp
‑
9纳米抗体和pd
‑
l1抑制剂,其中,所述mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的。由于抗pd
‑
l1/pd
‑
1治疗是当前肿瘤治疗的重要靶点,但单独使用抗pd
‑
l1/pd
‑
1治疗的有效率只有大约20%,因此,将mmp
‑
9纳米抗体和pd
‑
l1抑制剂进行联合使用,二者通过调控肿瘤微环境,提高t细胞浸润等作用机制,进而具有优异的抑制乳腺癌肿瘤转移的作用。
附图说明
22.为了更清楚地说明本技术实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附
图获得其他的附图。
23.图1是本技术实施例提供的cdr区突变位点的氨基酸类型示意图。
24.图2是本技术实施例提供的优化后的纳米抗体的序列图。
25.图3是本技术实施例提供的纯化后得到的g3cc的sds
‑
page图。
26.图4是本技术实施例提供的纳米抗体的亲和作用和抑制作用分析图。
27.图5是本技术实施例提供的g3cc对4t1细胞集落形成的影响图。
28.图6是本技术实施例提供的体外纳米抗体对乳腺癌细胞的形态分布的影响分析图。
29.图7是本技术实施例提供的纳米抗体对乳腺癌细胞增殖的影响分析图。
30.图8是本技术实施例提供的体内纳米抗体对小鼠乳腺癌细胞转移的抑制作用分析图。
31.图9是本技术实施例提供的注射纳米抗体g3cc联合pd
‑
l1可以显著抑制小鼠乳腺癌细胞的转移分析图。
32.图10是本技术实施例提供的空白组、对照组、单独注射g3cc、注射g3cc和pd
‑
l1的混合物、注射pd
‑
l1的小鼠的肺部体重测定图。
33.图11是本技术实施例提供的空白组、对照组、单独注射g3cc、注射g3cc和pd
‑
l1的混合物、注射pd
‑
l1的小鼠的肺部细胞染色分析图。
具体实施方式
34.为了使本技术要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
35.本技术实施例第一方面提供一种mmp
‑
9纳米抗体,mmp
‑
9纳米抗体为单域抗体,且单域抗体包括互补决定区cdr,互补决定区包括cdr1、cdr2、cdr3;
36.其中,所述cdr1的氨基酸序列选自seq.id no.1~seq.id no.5中的任一种,
37.所述cdr2的氨基酸序列选自seq.id no.6~seq.id no.9中的任一种,
38.所述cdr3的氨基酸序列选自seq.id no.10~seq.id no.14中的任一种。
39.本技术第一方面提供的一种mmp
‑
9纳米抗体,mmp
‑
9纳米抗体为单域抗体,且单域抗体包括互补决定区cdr,互补决定区包括cdr1、cdr2、cdr3,并提供了cdr1、cdr2、cdr3可选的具体氨基酸序列,其中,得到的该mmp
‑
9纳米抗体为特异性针对mmp
‑
9催化域的活性位点的单域抗体,由于其对互补决定区的各个区域的氨基酸进行突变选择,并且将cdr3区延长,使整个cdr3区从原来的16个氨基酸延长到20个氨基酸,能够提高对mmp
‑
9催化域的亲和性,使该纳米抗体能够特异性且强有力与催化域的活性位点结合,并且分子量小,穿透能力强,稳定性高,副作用低,能够大量进行表达,使得该纳米抗体能够较好抑制mmp
‑
9的活性,能够代替传统单克隆抗体用于快速检测相关蛋白,进而具有良好的抑制乳腺癌肿瘤转移的作用。
40.具体的,cdr区域组成ig的抗原结合部位,该部位能与相应抗原表位互补结合,不同抗体的cdr氨基酸组成及序列不同,决定着抗体与相应抗原表位结合的特异性,负责识别及结合抗原,从而发挥免疫效应。根据互补决定区cdr1、cdr2、cdr3的氨基酸序列不同,可以
得到不同的mmp
‑
9纳米抗体,具体的各个抗体的互补决定区cdr1、cdr2、cdr3的氨基酸序列如表1所示。
41.在一些实施例中,mmp
‑
9纳米抗体为b11cc,b11cc的互补决定区为:所述cdr1的氨基酸序列选自seq.id no.1、所述cdr2的氨基酸序列选自seq.id no.6、所述cdr3的氨基酸序列选自seq.id no.10。
42.在一些实施例中,mmp
‑
9纳米抗体为g3cc,g3cc的互补决定区为:所述cdr1的氨基酸序列选自seq.id no.2、所述cdr2的氨基酸序列选自seq.id no.7、所述cdr3的氨基酸序列选自seq.id no.11。
43.在一些实施例中,mmp
‑
9纳米抗体为c2cc,c2cc的互补决定区为:所述cdr1的氨基酸序列选自seq.id no.3、所述cdr2的氨基酸序列选自seq.id no.7、所述cdr3的氨基酸序列选自seq.id no.12。
44.在一些实施例中,mmp
‑
9纳米抗体为a2cc,a2cc的互补决定区为:所述cdr1的氨基酸序列选自seq.id no.4、所述cdr2的氨基酸序列选自seq.id no.8、所述cdr3的氨基酸序列选自seq.id no.13。
45.在一些实施例中,mmp
‑
9纳米抗体为a3cc,a3cc的互补决定区为:所述cdr1的氨基酸序列选自seq.id no.5、所述cdr2的氨基酸序列选自seq.id no.9、所述cdr3的氨基酸序列选自seq.id no.14。
46.本技术实施例提供的5个mmp
‑
9纳米抗体均可以与mmp
‑
9催化域的活性位点特异性结合,但是由于各个纳米抗体的cdr序列各不相同,因此与mmp
‑
9催化域的活性位点的亲和力也有所不同,因此对mmp
‑
9的抑制效果也有所不同。
47.表1
[0048][0049]
在一些实施例中,mmp
‑
9纳米抗体为单域抗体,单域抗体包括框架区fr,框架区包括fr1、fr2、fr3、fr4。框架区是免疫球蛋白可变区内超变区之外的氨基酸组成和排列顺序变化相对较小的区域序列,主要是起到稳定支撑的作用。
[0050]
所述单域抗体包括框架区fr,所述框架区包括fr1、fr2、fr3、fr4;
[0051]
其中,所述fr1的氨基酸序列选自seq.id no.15~seq.id no.19中的任一种,
[0052]
所述fr2的氨基酸序列选自seq.id no.20~seq.id no.24中的任一种,
[0053]
所述fr3的氨基酸序列选自seq.id no.25~seq.id no.29中的任一种,
[0054]
所述fr4的氨基酸序列选自seq.id no.30~seq.id no.34中的任一种。
[0055]
具体的,每个不同编号的抗体所选的框架区都不同,具体选择如表2所示,
[0056]
表2
[0057][0058][0059]
在一些实施例中,mmp
‑
9纳米抗体b11cc的氨基酸全序列如seq.id no.38所示,为:
[0060]
mkktaiaiavalagfatvaqaaqvqlqesggglvqaggslrlscaasgnispytnmgwyrqapgkerelvaaitagsttyyadsvkgrftisrdnakntvylqmnslkpedtavyycaareighvaprrphgrsysywgqgtqvtvssgqagqhhhhhhgaypydvpdyas*。
[0061]
在一些实施例中,mmp
‑
9纳米抗体g3cc的氨基酸全序列如seq.id no.39所示,为:
[0062]
mkktaiaiavalagfatvaqaaqvqlqesggglvqaggslrlscaasgnifryrsmgwyrqapgkerelvagisrgtttyyadsvkgrftisrdnakntvylqmnslkpedtavyycavyrnqrvygrgpvlrplkywgqgtqvtvssgqagqhhhhhhgaypydvpdyas*。
[0063]
在一些实施例中,mmp
‑
9纳米抗体a3cc的氨基酸全序列如seq.id no.40,为:
[0064]
mkktaiaiavalagfatvaqaaqvqlqesggglvqaggslrlscaasgsisasrrmgwyrqapgkerelvatinigsityyadsvkgrftisrdnakntvylqmnslkpedtavyycaagnprmppnyanrrspymywgqgtqvtvssgqagqhhhhhhgaypydvpdyas*。
[0065]
在一些实施例中,mmp
‑
9纳米抗体a2cc的氨基酸全序列如seq.id no.41,为:
[0066]
mkktaiaiavalagfatvaqaaqvqlqesggglvqaggslrlscaasgsifnnhrmgwyrqapgkerelvatinpgtntyyadsvkgrftisrdnakntvylqmnslkpedtavyycaarehfrytphyrmpwhhrywgqgtqvtvssgqagqhhhhhhgaypydvpdyas*。
[0067]
在一些实施例中,mmp
‑
9纳米抗体c2cc的氨基酸全序列如seq.id no.42,为:
[0068]
mkktaiaiavalagfatvaqaaqvqlqesggglvqaggslrlscaasgyissrptmgwyrqapgkerelvagisrgtttyyadsvkgrftisrdnakntvylqmnslkpedtavyycaakrvtgrrplipsynmhwywgqgtqvtvssgqagqhhhhhhgaypydvpdyas*。
[0069]
本技术实施例第二方面提供一种mmp
‑
9纳米抗体的制备方法,包括如下步骤:
[0070]
s01.通过对多个天然文库大量测序比对分析,分别设计cdr区中cdr1、cdr2和cdr3的氨基酸突变位点并合成cdrs突变引物;
[0071]
s02.提供合成得到的纳米抗体模板序列,对纳米抗体模板序列进行密码子优化并引入限制性内切酶的酶切位点,得到优化纳米抗体模板序列;
[0072]
s03.将优化纳米抗体模板序列插入噬菌粒载体构建重组噬菌粒,将重组噬菌粒进行噬菌体展示后提取单链dna,利用kunkel突变法把cdrs突变引物与单链dna进行配对合成异源双链dna,并转化至到大肠杆菌中培养得到噬菌体突变文库;
[0073]
s04.用噬菌体突变文库针对mmp
‑
9进行筛选、纯化得到mmp
‑
9纳米抗体。
[0074]
本技术第二方面提供的一种mmp
‑
9纳米抗体的制备方法,该制备方法以噬菌体展示技术,利用进行密码子优化及添加了限制性内切酶位点的纳米抗体为模板,通过kunkel突变在cdr区引入突变,构建噬菌体展示纳米抗体文库,并通过筛选、纯化得到mmp
‑
9纳米抗体,该制备方法简单方便,能够确保具有更大的库容量,有利于筛选得到mmp
‑
9纳米抗体。
[0075]
具体的,步骤s01中,通过对多个天然文库大量测序比对分析,分别设计cdr区中cdr1、cdr2和cdr3的氨基酸突变位点并合成cdrs突变引物。
[0076]
其中,由于cdr1和cdr2的突变区间隔较短,二者的突变区间只有13个氨基酸,即约39个核苷酸,极可能影响突变效率,故对第47位氨基酸进行固定,固定为模板的亮氨酸(l)。其次,使用iub code(简并碱基)结合的方式进行突变引物的设计,分析比较各位点氨基酸的类型及对应的密码子,选择适宜的iub code,氨基酸类型较多时使用nnc或nnb简并密码子进行突变。图1为cdr区突变位点的氨基酸类型示意图,为了文库的多样性和对抗原的亲和性,把cdr3区延长,从原来的连续14个氨基酸突变延长到连续18个氨基酸位点突变,故整个cdr3区从原来的16个氨基酸延长到20个氨基酸。
[0077]
在一些实施例中,cdrs突变引物包括cdr1突变引物,cdr2突变引物和cdr3突变引物,其中,cdr1突变引物的碱基序列为seq.id no.35,seq.id no.35为:
[0078]3’‑
ttaagctgtgcagcatctggtwvcatttytnncnncnncnncatgggttggtatcgtcaagca
‑5’
。
[0079]
在一些实施例中,cdrs突变引物包括cdr1突变引物,cdr2突变引物和cdr3突变引物,其中,cdr2突变引物的碱基序列为seq.id no.36,seq.id no.36为:
[0080]3’‑
aaagaacgcgaattagttgccrscattrvcnncggtrscancaccwattatgcggatagcgtgaaag
‑5’
。
[0081]
在一些实施例中,cdrs突变引物包括cdr1突变引物,cdr2突变引物和cdr3突变引物,其中,cdr3突变引物的碱基序列为seq.id no.37,seq.id no.37为:
[0082]3’‑
ctgcagtgtattattgtgcagygnnbnnbnnbnnbnnbnnbnnbnnbnnbnnbnnbywtnnbtattggggtcaaggtactcaa
‑5’
。
[0083]
选择上述三种不同的突变引物进行后续的定点突变,能够得到丰富的突变库,有利于纳米抗体的筛选。
[0084]
步骤s02中,提供合成得到的纳米抗体模板序列,对纳米抗体模板序列进行密码子优化并引入限制性内切酶的酶切位点,得到优化纳米抗体模板序列。
[0085]
在一些实施例中,采用的模板纳米抗体是骆驼科来源并且经过人源化的纳米抗体,通过对纳米抗体天然文库大量测序分析来确定了模板序列并采用基因合成的方法合成得到纳米抗体模板序列。
[0086]
在一些实施例中,对纳米抗体模板序列进行密码子优化并引入限制性内切酶的酶切位点,得到优化纳米抗体模板序列。通过对模板序列的密码子进行优化可以提高后续的突变效率,同时引入限制性内切酶的酶切位点,便于在后期突变效率不理想时进行酶切,去
除模板,最大限度的保证多样性,进而得到优化后的模板序列。
[0087]
在一些实施例中,限制性内切酶选自xhoi、xbai、bamhi中的至少一种。引入的限制性内切酶的位点及得到的纳米抗体模板序列如图2所示。
[0088]
步骤s03中,将优化纳米抗体模板序列插入噬菌粒载体构建重组噬菌粒,将重组噬菌粒进行噬菌体展示后提取单链dna,利用kunkel突变法把cdrs突变引物与单链dna进行配对合成异源双链dna,并转化至到大肠杆菌中培养得到噬菌体突变文库。
[0089]
在一些实施例中,噬菌粒载体选自pcomb3xss噬菌粒载体。
[0090]
在一些实施例中,大肠杆菌选自e.coli ss320+helper phage超级感受态大肠杆菌细胞。
[0091]
在一些实施例中,将优化纳米抗体模板序列插入噬菌粒载体构建重组噬菌粒,将重组噬菌粒进行展示后提取单链dna的步骤中,包括:将优化后的纳米抗体模板vhh的c末端引入ha标签用于后续elisa检测以及his标签用于后续的蛋白纯化,并插入到pcomb3xss噬菌粒载体中,构建含有纳米抗体模板序列的重组噬菌粒pcomb3xss
‑
vhh;将重组噬菌粒转化到e.coli cj236(dut
‑
ung
‑
)中,加入辅助噬菌体进行超感染,帮助重组噬菌粒完整复制和展示蛋白;然后提取du
‑
ssdna,并以之为模板进行后续实验。
[0092]
在一些实施例中,利用kunkel突变法把cdrs突变引物与单链dna进行配对合成异源双链dna,并转化至到大肠杆菌中培养得到噬菌体突变文库的步骤中,包括:使用cdr区定点突变引物通过kunkel反应制备ccc
‑
dsdna;然后将ccc
‑
dsdna产物电转化到e.coli ss320(dut
+
ung
+
)+helper phage超级感受态细胞,得到噬菌体突变库,并进行滴度测定来估计文库的库容;随机挑取100个单克隆进行测序,通过clc seqence viewer进行氨基酸序列比对分析文库的基因正确插入和多样性。
[0093]
步骤s04中,用噬菌体突变文库针对mmp
‑
9进行筛选、纯化得到mmp
‑
9纳米抗体。
[0094]
在一些实施例中,纯化的方法选自:先采用histrap ff镍柱进行第一纯化处理后,采用hitrap q hp柱进行第二纯化处理。
[0095]
在具体实施例中,将从噬菌体突变文库进行筛选并测序正确的纳米抗体质粒进行表达纯化,包括如下步骤:
[0096]
1)将测序验证无误的纳米抗体质粒到e.coli transetta(de3)感受态细胞中。
[0097]
2)挑取转化后的单克隆至3ml lb(含有100mg/l amp)液体培养基,37℃,200rpm培养至od600nm=0.5,取出两份1ml菌液,其中一份加入终浓度为1mm的iptg,另一份不加,继续37℃,200rpm培养4h,剩余的菌液为诱导前样品保存于4℃备用;
[0098]
3)分别适量取步骤2中三份菌液进行sds
‑
page凝胶电泳以分析蛋白表达情况以及是否需要诱导;
[0099]
4)将验证了有表达的菌液按1:100接种即吸取1ml到100ml tb(含有100mg/l amp)液体培养基中,37℃,200rpm培养4h;
[0100]
5)转移至1l的tb(含有100mg/l amp)液体培养基37℃,200rpm培养至od 600nm=0.5,加入终浓度为1mm的iptg于28℃,200rpm过夜诱导培养;
[0101]
6)制备纳米抗体纯化前样品:菌液室温离心(6000rpm,10min),弃上清,使用pbs缓冲液重悬并洗涤,然后离心(6000rpm,10min)取沉淀,重复洗涤两次;pbs重悬沉淀后用5ml注射器(0.45mm针头)过滤,用jn
‑
02c低温高压细胞破碎机破碎(4℃,1200bar,3次),将破碎
完的样品于超声破碎,在200w的功率下超声破碎每次10s,间歇10s,3次,以破坏菌体中的dna,使菌液不会过于黏稠,从而影响纯化;于4℃,15000rpm离心20min,分离沉淀与上清;
[0102]
7)histrap ff镍柱纯化:将过蛋白样品溶液用0.45μm滤膜过滤,置冰上并以1ml/min的流速通过5ml histrap ff预装柱进行亲和层析;在所有样品通过层析柱后继续使用binding buffer(50mm磷酸二氢钠,300mm氯化钠,20mm咪唑,ph为7.4)冲洗镍柱5
‑
10个柱体积,洗下可能存在非特异性吸附的杂蛋白;使用镍柱elution buffer(50mm磷酸二氢钠,300mm氯化钠,300mm咪唑,ph为7.4)洗脱并收集吸附在镍柱上的蛋白;
[0103]
8)hitrap q hp柱纯化:过镍柱纯化后需进行二次纯化,以得到纯度更高的目的蛋白。在网站expasy计算得到纳米抗体的等电点为9.75,因此在ph为7.4的缓冲液中以阳离子形式存在,可通过选择阴离子交换柱(5ml的hitrap q hp柱),使目的蛋白直接从ff(fast flow)流出并收集,其他杂蛋白结合在柱上的方法快速进行纯化。将经镍柱纯化洗脱的蛋白用截留分子量为3kda的透析膜于q柱binding buffer(tris 10mm,ph为7.4)中过夜透析离心收集上清过0.45μm滤膜后,以每分钟1ml的流速通过5ml hitrap q hp预装柱进行亲和层析,收集样品过柱后的穿透液ff(fast flow),进行sds
‑
page凝胶电泳以分析蛋白二次纯化情况;
[0104]
9)将纳米抗体透析于含有1mm dtt,1mm edta,5%甘油的pbs缓冲液中,测定蛋白浓度,分装存于
‑
20℃备用。
[0105]
本技术实施例第三方面提供一种抗乳腺癌肿瘤转移的药物,药物包括mmp
‑
9纳米抗体,且mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的。
[0106]
本技术第三方面提供的一种抗乳腺癌肿瘤转移的药物,药物包括mmp
‑
9纳米抗体,且mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的;由于mmp
‑
9纳米抗体对mmp
‑
9的催化域的活性位点具有特异性的结合能力以及较强的亲和力,因此包括了mmp
‑
9纳米抗体的药物能够较好地抑制mmp
‑
9的活性,进而抑制乳腺癌肿瘤转移。
[0107]
本技术实施例第四方面提供一种抗乳腺癌肿瘤转移的药物组合物,药物组合物包括mmp
‑
9纳米抗体和pd
‑
l1抑制剂,其中,mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的。
[0108]
本技术第四方面提供的一种抗乳腺癌肿瘤转移的药物组合物,药物组合物包括mmp
‑
9纳米抗体和pd
‑
l1抑制剂,其中,mmp
‑
9纳米抗体选自mmp
‑
9纳米抗体或由mmp
‑
9纳米抗体的制备方法制备得到的。由于抗pd
‑
l1/pd
‑
1治疗是当前肿瘤治疗的重要靶点,但单独使用抗pd
‑
l1/pd
‑
1治疗的有效率只有大约20%,因此,将mmp
‑
9纳米抗体和pd
‑
l1抑制剂进行联合使用,二者通过调控肿瘤微环境,提高t细胞浸润等作用机制,进而具有优异的抑制乳腺癌肿瘤转移的作用。
[0109]
下面结合具体实施例进行说明。
[0110]
实施例1
[0111]
mmp
‑
9纳米抗体及其制备方法
[0112]
mmp
‑
9纳米抗体
[0113]
mmp
‑
9纳米抗体g3cc的氨基酸全序列如seq.id no.39所示,为:
[0114]
mkktaiaiavalagfatvaqaaqvqlqesggglvqaggslrlscaasgnifryrsmgwyrqapgkerelvagisrgtttyyadsvkgrftisrdnakntvylqmnslkpedtavyycavyrnqrvygrgpvlrplkywgqgtqv
tvssgqagqhhhhhhgaypydvpdyas*。
[0115]
mmp
‑
9纳米抗体的制备方法
[0116]
mmp
‑
9纳米抗体的制备方法,包括如下步骤:
[0117]
s01.通过对多个天然文库大量测序比对分析,分别设计cdr区中cdr1、cdr2和cdr3的氨基酸突变位点并合成cdrs突变引物,其中,cdr1、cdr2和cdr3的突变引物如下所示;
[0118][0119]
s02.提供合成得到的纳米抗体模板序列,对纳米抗体模板序列进行密码子优化并引入限制性内切酶的酶切位点,得到优化纳米抗体模板序列(如附图2);
[0120]
s03.优化后的纳米抗体模板vhh的c末端引入ha标签用于后续elisa检测以及his标签用于后续的蛋白纯化,并插入到pcomb3xss噬菌粒载体中,构建含有纳米抗体模板序列的重组噬菌粒pcomb3xss
‑
vhh;将重组噬菌粒转化到e.coli cj236(dut
‑
ung
‑
)中,加入辅助噬菌体进行超感染,帮助重组噬菌粒完整复制和展示蛋白;然后提取du
‑
ssdna,并以之为模板,使用cdr区定点突变引物通过kunkel反应制备ccc
‑
dsdna;然后将ccc
‑
dsdna产物电转化到e.coli ss320(dut
+
ung
+
)+helper phage超级感受态细胞,收获噬菌体突变库(如图)并进行滴度测定来估计文库的库容;随机挑取100个单克隆进行测序,通过clc seqence viewer进行氨基酸序列比对分析文库的基因正确插入和多样性;
[0121]
s04.对噬菌体突变文库进行筛选、纯化得到mmp
‑
9纳米抗体g3cc;
[0122]
纯化方法包括:1)将测序验证无误的纳米抗体质粒转化到e.coli transetta(de3)感受态细胞中。
[0123]
2)挑取转化后的单克隆至3ml lb(含有100mg/l amp)液体培养基,37℃,200rpm培养至od 600nm=0.5,取出两份1ml菌液,其中一份加入终浓度为1mm的iptg,另一份不加,继续37℃,200rpm培养4h,剩余的菌液为诱导前样品保存于4℃备用;
[0124]
3)分别适量取步骤2中三份菌液进行sds
‑
page凝胶电泳以分析蛋白表达情况以及是否需要诱导;
[0125]
4)将验证了有表达的菌液按1:100接种即吸取1ml到100ml tb(含有100mg/l amp)液体培养基中,37℃,200rpm培养4h;
[0126]
5)转移至1l的tb(含有100mg/l amp)液体培养基37℃,200rpm培养至od 600nm=0.5,加入终浓度为1mm的iptg于28℃,200rpm过夜诱导培养;
[0127]
6)制备纳米抗体纯化前样品:菌液室温离心(6000rpm,10min),弃上清,使用pbs缓冲液重悬并洗涤,然后离心(6000rpm,10min)取沉淀,重复洗涤两次;pbs重悬沉淀后用5ml注射器(0.45mm针头)过滤,用jn
‑
02c低温高压细胞破碎机破碎(4℃,1200bar,3次),将破碎完的样品于超声破碎,在200w的功率下超声破碎每次10s,间歇10s,3次,以破坏菌体中的
dna,使菌液不会过于黏稠,从而影响纯化;于4℃,15000rpm离心20min,分离沉淀与上清;
[0128]
7)histrap ff镍柱纯化:将过蛋白样品溶液用0.45μm滤膜过滤,置冰上并以1ml/min的流速通过5ml histrap ff预装柱进行亲和层析;在所有样品通过层析柱后继续使用binding buffer(50mm磷酸二氢钠,300mm氯化钠,20mm咪唑,ph为7.4)冲洗镍柱5
‑
10个柱体积,洗下可能存在非特异性吸附的杂蛋白;使用镍柱elution buffer(50mm磷酸二氢钠,300mm氯化钠,300mm咪唑,ph为7.4)洗脱并收集吸附在镍柱上的蛋白;
[0129]
8)hitrap q hp柱纯化:过镍柱纯化后需进行二次纯化,以得到纯度更高的目的蛋白。在网站expasy计算得到纳米抗体的等电点为9.75,因此在ph为7.4的缓冲液中以阳离子形式存在,可通过选择阴离子交换柱(5ml的hitrap q hp柱),使目的蛋白直接从ff(fast flow)流出并收集,其他杂蛋白结合在柱上的方法快速进行纯化。将经镍柱纯化洗脱的蛋白用截留分子量为3kda的透析膜于q柱binding buffer中过夜透析离心收集上清过0.45μm滤膜后,以每分钟1ml的流速通过5ml hitrap q hp预装柱进行亲和层析,收集样品过柱后的穿透液ff(fast flow),进行sds
‑
page凝胶电泳以分析蛋白二次纯化情况;
[0130]
9)将纳米抗体透析于含有1mm dtt,1mm edta,5%甘油的pbs缓冲液中,测定蛋白浓度,分装存于
‑
20℃备用。
[0131]
性能测试
[0132]
性能测试(一)
[0133]
将实施例1得到的g3cc进行大量诱导表达并进行纯化,采用sds
‑
page凝胶电泳进行分析并测定纳米抗体g3cc的纯度。
[0134]
性能测试(二)
[0135]
纳米抗体的亲和作用和抑制作用分析
[0136]
(1)梯度稀释g3cc(起始浓度为400nm,3倍梯度稀释即400、133.33、44.44
……
,共8个浓度)分别与商业化人源mmp
‑
9(4μg)和实验室纯化的mmp
‑
9(4μg)进行elisa验证,分析其亲和效果。
[0137]
(2)使用fortebio公司基于生物膜干涉(biolayer interferometry,bli)技术的分子相互作用仪,先将生物素化的mmp
‑
9固定合到链霉素亲和素修饰的传感器上,随后分别测定浓度为1000nm、500nm、250nm的g3cc与mmp
‑
9的结合和以及解离常数,分析其结合常数、解离常数和亲和常数。
[0138]
(3)用mmp
‑
9荧光底物fs
‑
6检测g3cc对mmp
‑
9酶活性的抑制作用,并以商业化的抗人源mmp
‑
9单克隆抗体同时作比较,分别加入mmp
‑
9蛋白(1μm)和纳米抗体/单克隆抗体(1μm)混匀反应溶液中混匀,于37℃水浴孵育20min,随后加入fs
‑
6检测实时荧光强度,并计算每个时间点下抗体对mmp
‑
9的抑制率,以观察分析g3cc和mab对mmp
‑
9抑制作用。
[0139]
性能测试(三)
[0140]
体外纳米抗体对乳腺癌细胞的抑制作用分析
[0141]
细胞集落形成是活性的干细胞的增殖能力的指标。而干细胞是肿瘤治疗中的主要靶细胞,对于干细胞的抑制作用比单纯抑制其他非干细胞更有意义。细胞集落形成数的下降表明细胞群体中干细胞比例减少,产生了对肿瘤细胞的抑制增殖作用。
[0142]
使用平板集落形成实验检测g3cc对乳腺癌细胞集落形成的影响,进而分析体外纳米抗体对乳腺癌细胞的抑制作用。其中,细胞集落形成实验步骤如下:
[0143]
1)取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的4t1专用培养液中备用。
[0144]
2)在细胞悬液中分别加入含有pbs(对照组)或g3cc(给药组)(终浓度为0.2mg/ml)的4t1专用培养基。按每组200个细胞密度接种于37℃预温的6孔板中,并轻轻转动,使细胞分散均匀。置37℃,5%co2及饱和湿度的细胞培养箱中培养7~10d。
[0145]
3)经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用pbs小心浸洗2次。加甲醇1ml固定细胞固定15分钟。然后去固定液,加适量1%结晶紫染色液染10分钟,然后用流水缓慢洗去染色液,空气干燥。
[0146]
4)将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。
[0147]
性能测试(四)
[0148]
体外纳米抗体对乳腺癌细胞的形态分布的影响分析
[0149]
步骤:1)将乳腺癌4t1细胞用4t1专用培养基调整为1
×
104/ml,以每孔1
×
103个/孔的密度接种于3cm细胞培养板,置于37℃,5%co2培养箱过夜培养。
[0150]
2)待细胞贴壁后,第二天吸去培养基,加入新培养基,培养基中加入pbs、g3cc(终浓度:0.2mg/ml)置于37℃,5%co2培养箱过夜培养。
[0151]
3)于加药后的第1,2,3,4,5d进行拍摄。
[0152]
性能测试(五)
[0153]
纳米抗体对乳腺癌细胞增殖的影响
[0154]
步骤:1)将4t1细胞用4t1专用培养基调整为5
×
104个/ml,以每孔5
×
103个/孔的密度接种于96孔细胞培养板,每孔体积为100μl,每组(分为对照组和g3cc组)设6个重复孔,置于37℃,5%co2培养箱过夜培养。
[0155]
2)待细胞贴壁后,第二天吸去培养基(小心吸取避免破坏贴壁细胞),加入新培养基,培养基中加入pbs(对照组)、g3cc(终浓度:0.2mg/ml)置于37℃,5%co2培养箱过夜培养。
[0156]
3)于加药后的第1、2、3、4、5d进行测量,加入10μl/孔的cck8溶液,置于37℃,5%co2培养箱中继续孵育2小时后,酶标仪测定450nm波长处的吸光度值。
[0157]
性能测试(六)
[0158]
体内纳米抗体对小鼠乳腺癌细胞转移的抑制作用
[0159]
单独注射纳米抗体g3cc可以抑制小鼠乳腺癌细胞的转移
[0160]
细胞培养及处理
[0161]
将小鼠4t1
‑
luc乳腺癌细胞置于专用完全培养基中,置于37℃5%co2培养箱中培养,每1d更换培养液1次,每2d用0.25%胰酶消化传代一次,细胞汇合率达90%时,收集细胞,离心去上清,加入生理盐水吹打,使细胞悬浮于生理盐水中,台盼蓝染色细胞活力测定大于95%,并进行细胞计数,调整细胞浓度为1
×
106/ml的细胞悬液备用。使用尾静脉操作台,将100μl细胞悬液注射进尾部静脉,注射g3cc抗体100μg/只(5mg/kg),并进行荧光拍照,观察。
[0162]
性能测试(七)
[0163]
注射纳米抗体g3cc联合pd
‑
l1可以显著抑制小鼠乳腺癌细胞的转移
[0164]
试验步骤与性能测试(六)相同,其中,注射g3cc抗体100μg/只(5mg/kg),或pd
‑
l1(200μg/只)(10mg/kg),造模第15d拍摄荧光表示肿瘤大小。
[0165]
性能测试(八)
[0166]
将空白组、对照组、单独注射g3cc、注射g3cc和pd
‑
l1的混合物、注射pd
‑
l1的小鼠的肺部体重进行测定,并对肺部细胞进行染色,步骤如下:
[0167]
1)切片入苏木色精中染色约10~30min,用自来水流水冲洗约15min。冲洗过程中使切片颜色发蓝。
[0168]
2)分化:就是将细胞质着的色褪去,使细胞核着色更加鲜明,也称分色。将切片放入1%盐酸酒精液(盐酸1份+70%乙醇100份)中褪色,见切片变红,颜色较浅时即可,约数秒至数十秒钟。
[0169]
3)复染:用0.5%伊红酒精液(伊红0.5g+95%乙醇100ml)对比染色2~5min。
[0170]
结果分析
[0171]
结果分析(一)
[0172]
将实施例1得到的g3cc进行大量诱导表达并进行纯化,采用sds
‑
page凝胶电泳进行分析,如图3所示,其中,条带1为通过hitrap q hp柱后收集的目的蛋白,条带2为透析到储存缓冲液后的目的蛋白,可以看出得到的纳米抗体g3cc纯度约为90%,纯度较高,满足后续实验。
[0173]
结果分析(二)
[0174]
纳米抗体的亲和作用和抑制作用分析
[0175]
(1)梯度稀释g3cc(起始浓度为400nm,3倍梯度稀释即400、133.33、44.44
……
,共8个浓度)分别与商业化人源mmp
‑
9(4μg)和实验室纯化的mmp
‑
9(4μg)进行elisa验证,结果如图4(a),显示g3cc对商业化人源mmp
‑
9与实验室纯化的mpp9的亲合作用相当,证明了筛选的纳米抗体是特异性作用于mmp
‑
9催化域,普遍适用于其他人源mmp
‑
9蛋白。
[0176]
(2)使用fortebio公司基于生物膜干涉(biolayer interferometry,bli)技术的分子相互作用仪,先将生物素化的mmp
‑
9固定合到链霉素亲和素修饰的传感器上,随后分别测定浓度为1000nm、500nm、250nm的g3cc与mmp
‑
9的结合和以及解离常数,结果如图4(b)所示,结果表明g3cc与mmp
‑
9的结合速度较快,但也存在一定的解离,使用分子相互作用仪配套软件计算得出:结合常数ka=1.498
×
105(1/ms),解离常数kd=1.156
×
10
‑2(1/s),亲和常数kd=7.72
×
10
‑8(m),说明g3cc对mmp
‑
9有较理想的亲和力。
[0177]
(3)用mmp
‑
9荧光底物fs
‑
6检测g3cc对mmp
‑
9酶活性的抑制作用,并以商业化的抗人源mmp
‑
9单克隆抗体同时作比较,分别加入mmp
‑
9蛋白(1μm)和纳米抗体/单克隆抗体(1μm)混匀反应溶液中混匀,于37℃水浴孵育20min,随后加入fs
‑
6检测实时荧光强度,结果如图4(c),计算每个时间点下抗体对mmp
‑
9的抑制率,以观察分析g3cc和mab对mmp
‑
9抑制作用,结果如图4(d)。结果显示g3cc在加入fs
‑
6进行检测后,在360s以前的抑制率大于90%,而后随着时间的增加,抑制作用开始减弱,直到2460s,抑制率降到50%左右,基本保持稳定,一直到3600s检测结束,g3cc的抑制率基本稳定在40%以上;而单克隆抗体的抑制率刚开始则是随着时间缓慢增加,在反应660s后抑制率基本达到最大,在40%
‑
50%之间,而后抑制率也开始减小,直到2610s时,小于40%,基本稳定在38%左右;这说明了与单克隆抗体相比,g3cc由于其分子量小,与mmp
‑
9的结合更加快速有效;但是由于g3cc与mmp
‑
9结合后存
在一定的解离,又因在fs
‑
6小分子短肽的竞争下,可能发生了更多的解离,所以后期抑制率会下降,直到竞争达到平衡,g3cc对mmp
‑
9的抑制率基本稳定在40%以上;而单克隆抗体一开始其抑制率较低是可能因为其分子较大,与mmp
‑
9结合后空间缝隙也较大,故小分子短肽fs
‑
6依然可以通过空间缝隙与mmp
‑
9反应产生荧光,随着时间的增加,小分子短肽fs
‑
6浓度被消耗,故缓慢到达平衡,后期抑制作用轻微减弱可能是也是因为单克隆抗体与mmp
‑
9的结合发生了一定的解离。
[0178]
结果分析(三)
[0179]
体外纳米抗体对乳腺癌细胞的抑制作用分析
[0180]
使用平板集落形成实验检测g3cc对4t1细胞集落形成的影响,结果如图5所示,加入g3cc共培养后,与对照组相比g3cc组的细胞克隆数明显减少,且具有显著的统计学差异,说明g3cc抑制了4t1细胞的细胞单克隆形成。
[0181]
结果分析(四)
[0182]
体外纳米抗体对乳腺癌细胞的形态分布的影响分析
[0183]
为了观察g3cc对乳腺癌细胞形态学影响,在激光共聚焦显微镜观察加入g33c共培养不同时间后4t1
‑
luc稳转小鼠乳腺癌细胞的形态分布情况,如图6所示,图6(a)~图6(e)为对照组培养了1~5天后4t1
‑
luc稳转小鼠乳腺癌细胞的形态分布情况,图6(f)~图6(j)为g3cc组培养了1~5天后4t1
‑
luc稳转小鼠乳腺癌细胞的形态分布情况,发现与对照组相比,g3cc明显的限制了乳腺癌细胞的增殖和迁移。
[0184]
结果分析(五)
[0185]
纳米抗体对乳腺癌细胞增殖的影响
[0186]
为了研究特异性mmp
‑
9的纳米抗体g3cc对乳腺癌细胞增殖的影响,我们加入g3cc与4t1细胞共培养后,采用cck8法验检测细胞增殖结果显示,如图7所示,在第4d和5d与对照组相比,g3cc组的细胞增殖明显被抑制,从而验证了g3cc对乳腺癌细胞的增殖具有抑制作用。
[0187]
结果分析(六)
[0188]
体内纳米抗体对小鼠乳腺癌细胞转移的抑制作用
[0189]
如图8所示,进行注射后,第15d拍摄荧光表示肿瘤大小。结果表明,单独注射g3cc可以限制乳腺细胞向肺部转移。
[0190]
结果分析(七)
[0191]
注射纳米抗体g3cc联合pd
‑
l1可以显著抑制小鼠乳腺癌细胞的转移
[0192]
如图9所示,注射g3cc抗体100μg/只(5mg/kg),或pd
‑
l1(200μg/只)(10mg/kg),造模第15d拍摄荧光表示肿瘤大小。结果显示,g3cc的保护效果与pd
‑
l1的效果相当,两者联合治疗可以明显抑制乳腺癌细胞向肺部转移。
[0193]
结果分析(八)
[0194]
将空白组、对照组、单独注射g3cc、注射g3cc和pd
‑
l1的混合物、注射pd
‑
l1的小鼠的肺部体重进行测定,如图10所示,可以看出,单独使用g3cc治疗小鼠肺部重量明显减轻,表明肿瘤向肺部转移数目明显减少,且与单独注射pd
‑
l1的效果相当,当两者联合治疗可以明显抑制乳腺癌细胞向肺部转移,肺部重量明显减轻。
[0195]
进一步,对肺部细胞进行染色,如图11所示,图11(a)~图11(e)分别为5倍镜下空
白组、肿瘤对照组、g3cc组、g3cc+pd
‑
l1组、pd
‑
l1组的肺部细胞染色分析图;图11(f)~图11(j)分别为20倍镜下空白组、肿瘤对照组、g3cc组、g3cc+pd
‑
l1组、pd
‑
l1组的肺部细胞染色分析图;结果表明,单独使用g3cc治疗限制了乳腺癌细胞向肺部的转移,转移数目明显减少,且与单独注射pd
‑
l1的效果相当,当两者联合治疗可以明显抑制乳腺癌细胞向肺部转移。
[0196]
综上,本技术提供的mmp
‑
9纳米抗体,该单域抗体适用的表达体系选择灵活,既可以在原核系统中表达也可以在酵母细胞或哺乳动物细胞的真核系统中表达,且其在原核表达系统中的表达成本低,可降低后期生产成本。由于该单域抗体为单结构域抗体,所以其抗体的多组合形式改造更为简单,通过基因工程的方式简单的串联即可以获得多价、多特异性的抗体,并且其免疫异质性很低,在不经过人源化改造的情况下也不会产生较强的免疫反应。该单域抗体的亲和力范围更为宽泛,在未进行亲和力成熟之前,其亲和力范围可以从nm级别至pm级别,为后期不同用途的抗体提供多个选择。由于mmp
‑
9纳米抗体对mmp
‑
9的催化域的活性位点具有特异性的结合能力以及较强的亲和力,因此该单域抗体可以偶联药物分子起到双重或多重靶点治疗作用,应用范围更广。
[0197]
以上所述仅为本技术的较佳实施例而已,并不用以限制本技术,凡在本技术的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1