一种三嗪基聚离子液体及其合成方法与应用
1.本发明属于环境友好型催化技术领域,涉及一种三嗪基聚离子液体及其合成方法与应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.全世界每年向大气中排放大量二氧化碳,这严重破坏了自然界的碳循环平衡,而且造成了温室效应和生态环境的破坏。同时,二氧化碳作为一种廉价易得的c1资源制备出具有附加值的化工产品,此举不仅可以缓解二氧化碳对环境造成的巨大破坏而且又可以解决工业上的重大需求。在二氧化碳参与的化学转化来制备化工产品的过程中,二氧化碳与环氧化合物制备环状碳酸酯的反应可以把原料二氧化碳和环氧化合物完全转化为产物环状碳酸酯,这符合绿色化学中的原子经济性的理念,从而可以减少对环境的破坏。而且产出的环状碳酸酯可以用作锂电电解液、增塑剂、燃料分散剂等,而且可以广泛应用于超临界流体分离和金属萃取等领域。
4.据发明人研究了解,目前已经研发出了很多的多孔材料用于二氧化碳与环氧化合物的环加成反应的催化剂,不过大多数催化剂含有金属离子,这会造成产物中的金属残留,影响其工业应用。而无金属的催化剂往往只能在高温高压的苛刻反应条件下才可以高效合成出环状碳酸酯,这增大了能源消耗。
技术实现要素:
5.为了解决现有技术的不足,本发明的目的是提供一种三嗪基聚离子液体及其合成方法与应用,本发明提供的三嗪基聚离子液体能够作为无金属非均相催化剂,实现相对温和条件下的二氧化碳和环氧化合物的化学转化。
6.为了实现上述目的,本发明的技术方案为:
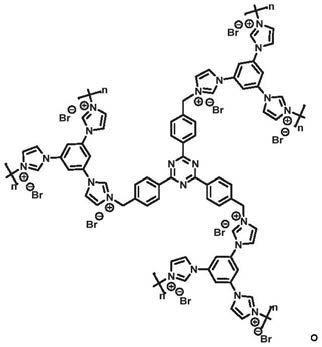
7.一方面,一种三嗪基聚离子液体,具有如下重复单元:
8.9.另一方面,一种上述三嗪基聚离子液体的制备方法,将三咪唑基苯单体与含三嗪的三苄基溴单体进行季铵化反应获得;
10.其中,所述三咪唑基苯单体为1,3,5
‑
三咪唑基苯;所述含三嗪的三苄基溴单体为2,4,6
‑
三(4
‑
溴甲基苯基)
‑
1,3,5
‑
三嗪。
11.第三方面,一种上述三嗪基聚离子液体在催化二氧化碳环加成反应制备环状碳酸酯中的应用。
12.第四方面,一种二氧化碳与环氧化合物进行环加成反应的方法,将环氧化合物与上述三嗪基聚离子液体混合后,在二氧化碳气氛中,加热加压进行反应;
13.其中,所述环氧化合物为r1为烷基、卤代烷基、苯基、苯氧烷基。
14.本发明的有益效果为:
15.(1)本发明提供了一种三嗪基聚离子液体作为非均相催化剂,利用该非均相催化剂催化二氧化碳与环氧化合物的环加成反应,得到产物环状碳酸酯;使用上述方法制备环碳酸酯具有较高的选择性和转化率,得到的环状碳酸酯产物的产率可达99%。
16.(2)本发明提供的三嗪基聚离子液体作为二氧化碳与环氧化合物的环加成反应的催化剂,具有无金属、不需要加入溶剂、反应条件相对温和、容易从液相中分离等诸多优点,具有较高的工业化应用价值。
附图说明
17.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
18.图1为本公开实施例1制备的三嗪基聚离子液体的红外吸收光谱图;
19.图2为本公开实施例1制备的三嗪基聚离子液体的
13
c固体核磁图;
20.图3为本公开实施例1制备的三嗪基聚离子液体的xrd图;
21.图4为本公开实施例1制备的三嗪基聚离子液体的扫描电镜图;
22.图5为本公开实施例1制备的三嗪基聚离子液体的高分辨率透射电镜图;
23.图6为本公开实施例1制备的三嗪基聚离子液体的n2吸附曲线;
24.图7为本公开实施例1制备的三嗪基聚离子液体的孔径分布图;
25.图8为本公开实施例1制备的三嗪基聚离子液体的二氧化碳程序升温脱附图。
具体实施方式
26.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
27.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
28.为了解决现有二氧化碳与环氧化合物的环加成反应的催化剂含有金属离子造成金属残留的问题,本发明提出了一种三嗪基聚离子液体及其合成方法与应用。
29.本发明的一种典型实施方式,提供了一种三嗪基聚离子液体,具有如下重复单元:
[0030][0031]
上述重复单元之间通过连接。
[0032]
本发明的另一种实施方式,提供了一种上述三嗪基聚离子液体的制备方法,将三咪唑基苯单体与含三嗪的三苄基溴单体进行季铵化反应获得;
[0033]
其中,所述三咪唑基苯单体为1,3,5
‑
三咪唑基苯;所述含三嗪的三苄基溴单体为2,4,6
‑
三(4
‑
溴甲基苯基)
‑
1,3,5
‑
三嗪。
[0034]
1,3,5
‑
三咪唑基苯的结构式为
[0035]
2,4,6
‑
三(4
‑
溴甲基苯基)
‑
1,3,5
‑
三嗪的结构式为
[0036]
在一些实施例中,在惰性气氛下,将三咪唑基苯单体与含三嗪的三苄基溴单体加入至溶剂中,加热进行季铵化反应。本发明所述的惰性气氛是指氮气气氛、氦气气氛、氖气
气氛、氩气气氛等。
[0037]
在一种或多种实施例中,季铵化反应的温度为75~85℃。反应时间为20~36h。
[0038]
在一种或多种实施例中,溶剂为n,n
‑
二甲基甲酰胺。
[0039]
在一种或多种实施例中,采用schlenck反应管作为反应容器。
[0040]
在一些实施例中,季铵化反应后采用n,n
‑
二甲基甲酰胺与甲醇进行交替反复洗涤。
[0041]
本发明的第三种实施方式,提供了一种上述三嗪基聚离子液体在催化二氧化碳环加成反应制备环状碳酸酯中的应用。
[0042]
本发明的第四种实施方式,提供了一种二氧化碳与环氧化合物进行环加成反应的方法,将环氧化合物与上述三嗪基聚离子液体混合后,在二氧化碳气氛中,加热加压进行反应;
[0043]
其中,所述环氧化合物为r1为烷基、卤代烷基、苯基、苯氧烷基。
[0044]
对应制备的环状碳酸酯为对应制备的环状碳酸酯为对应制备的环状碳酸酯为
[0045]
例如
‑
ch2cl(氯甲基)、
‑
c6h5(苯基)、
‑
ch2oc6h5(苯氧甲基)和
‑
c8h
17
(辛基)等。
[0046]
当r1为
‑
ch2cl、
‑
c6h5、
‑
ch2oc6h5和
‑
c8h
17
。r1为
‑
ch2cl时,反应物为碳酸环氯丙烯酯;当r1为
‑
c6h5时,产物为碳酸苯乙烯酯;当r1为
‑
ch2oc6h5时,产物为碳酸苯基醚丙烯酯;当r1为
‑
c8h
17
时,碳酸癸烯酯;当环氧化物为环氧环己烷时,产物为碳酸环己烯酯。
[0047]
在一些实施例中,反应温度为80~140℃。例如80~100℃、100~120℃、120~140℃、80℃、120℃、140℃等。
[0048]
在一些实施例中,反应时间为12~48h。例如12~24h、24~36h、36~48h、12h、24h、48h等。
[0049]
在一些实施例中,反应压力为0.8~1.2mpa。例如0.8~1.0mpa、1.0~1.2mpa、1.0mpa等。
[0050]
在一些实施例中,环氧化合物与三嗪基聚离子液体的质量比为8.2~13.6:1。例如8.2~8.7:1、8.7~9.2:1、9.2~9.7:1、9.7~10.2:1、10.2~10.7:1、10.7~11.2:1、11.2~11.7:1、11.7~12.2:1、12.2~12.7:1、12.7~13.2:1、13.2~13.6:1、8.2:1、8.7:1、10.6:1、13.3:1、13.6:1等。
[0051]
在一些实施例中,环氧化合物为环氧氯丙烷、环氧苯乙烯或苯基缩水甘油醚。
[0052]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0053]
实施例1
[0054]
在25ml schlenck反应管中加入1,3,5
‑
三咪唑基苯(0.1382g,0.50mmol)与2,4,6
‑
三(4
‑
溴甲基苯基)
‑
1,3,5
‑
三嗪(0.2947g,0.50mmol),加入10ml的n,n
‑
二甲基甲酰胺溶剂,抽真空,通入n2,在80℃加热搅拌24h。反应结束后,用n,n
‑
二甲基甲酰胺、甲醇溶剂交替洗涤得到的固体产物3次,之后将合成产物60℃真空干燥12h,得到淡黄色粉末状物质,即为三嗪基聚离子液体,记为triazine
‑
pil。
[0055]
制备的三嗪基聚离子液体结构表征结果如图1~8所示,
[0056]
图1为红外吸收光谱图,该图表明成功制备得到含三嗪环的聚离子液体。其中,1197cm
‑1和1188cm
‑1处的吸收峰为咪唑环上的c
‑
n键的伸缩振动峰。1361cm
‑1和1513cm
‑1为三嗪环的特征吸收峰。
[0057]
图2为
13
c固体核磁图,33、50、120和133ppm处的峰分别为亚甲基、ch基团、咪唑环上的c4和c5的特征峰。168ppm处的峰为三嗪环上的碳原子的特征峰。该图也表明成功制备得到含三嗪环的聚离子液体。
[0058]
图3为xrd吸收谱图,表明该三嗪基聚离子液体无结晶性。
[0059]
图4为sem图,表明该三嗪基聚离子液体高度多孔。
[0060]
图5为tem图,表明该三嗪基聚离子液体为短程有序结构,暴露的晶面间距为0.21nm。
[0061]
图6为n2吸附
‑
脱附曲线,表明该三嗪基聚离子液体为介孔材料。brunauer
‑
emmett
‑
teller(bet)比表面积和孔体积分别为128.9m2/g和0.64cm3/g。
[0062]
图7为孔径分布图,表明该三嗪基聚离子液体中的孔径集中在2.2和17.4nm附近。
[0063]
图8为co2程序升温脱附测试,表明该三嗪基聚离子液体在co2程序升温脱附测试过程中,有两个co2脱附温度,分别为118℃和212℃。证明该三嗪基聚离子液体中有两个碱性不同的co2吸附位点,分别是咪唑环和三嗪环。
[0064]
以下实施例中产物的产率通过岛津公司生产的gcms
‑
qp2010 se型气相色谱质谱联用仪进行定性和定量测定。
[0065]
实施例2
[0066]
在干净的25ml的高压反应釜中放入一枚合适的磁子,然后将6mmol的环氧化合物、68mg的三嗪基聚离子液体置于25ml的高压反应釜中混合均匀,通入二氧化碳,置换其中的空气,然后反应釜内通入二氧化碳气体至釜内反应体系的压力在1mpa,维持反应釜温度在80℃,进行加成反应12h。待反应釜冷至室温后,释放釜内剩余的二氧化碳,然后加入一定量的正丁醇作为内标物,一定量的n,n
‑
二甲基甲酰胺作为溶剂进行稀释,混合均匀后过滤得到部分滤液进行气相色谱质谱联用分析,得到产物碳酸环氯丙烯酯,碳酸环氯丙烯酯的产率为99.0%,选择性为99%。
[0067]
实施例3
[0068]
同实施例2,所用环氧化合物为苯基环氧乙烷,反应温度为120℃,其他条件不变。
[0069]
实施例3得到产物碳酸苯乙烯酯的产率为92.8%,选择性为97%。
[0070]
实施例4
[0071]
同实施例2,所用环氧化合物为苯基环氧丙基醚,反应温度为120℃,其他条件不变。
[0072]
实施例4得到产物碳酸苯基醚丙烯酯的产率为96.7%,选择性为99%。
[0073]
实施例5
[0074]
同实施例2,所用环氧化合物为环氧癸烷,反应温度为120℃,反应时间为48h,其他条件不变。
[0075]
实施例5得到产物碳酸癸烯酯的产率为87.0%,选择性为99%。
[0076]
实施例6
[0077]
同实施例2,所用环氧化合物为环氧环己烷、反应温度为120℃,反应时间为48h,其他条件不变。
[0078]
实施例6得到产物碳酸环己烯酯的产率为79.4%,选择性为85%。
[0079]
实施例7
[0080]
采用triazine
‑
pil催化二氧化碳与化合物的环加成反应的循环实验,如下:
[0081]
第一次循环:
[0082]
68mg triazine
‑
pil、6mmol环氧氯丙烷、高压釜内二氧化碳压力为1.0mpa,在80℃下反应12h,得到碳酸环氯丙烯酯的产率为98.5%,选择性99%。
[0083]
第二次循环:
[0084]
68mg triazine
‑
pil、6mmol环氧氯丙烷、高压釜内二氧化碳压力为1.0mpa,在80℃下反应12h,得到碳酸环氯丙烯酯的产率为96.5%,选择性99%。
[0085]
第三次循环:
[0086]
68mg triazine
‑
pil、6mmol环氧氯丙烷、高压釜内二氧化碳压力为1.0mpa,在80℃下反应12h,得到碳酸环氯丙烯酯的产率为95.6%,选择性96%。
[0087]
第四次循环:
[0088]
68mg triazine
‑
pil、6mmol环氧氯丙烷、高压釜内二氧化碳压力为1.0mpa,在80℃下反应12h,得到碳酸环氯丙烯酯的产率为95.6%;选择性99%。
[0089]
第五次循环:
[0090]
68mg triazine
‑
pil、6mmol环氧氯丙烷、高压釜内二氧化碳压力为1.0mpa,在80℃下反应12h,得到碳酸环氯丙烯酯的产率为94.8%。选择性99%。
[0091]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1