一种获得两种夏天无多糖的提取方法、两种夏天无多糖及其应用
1.本发明属于医药技术领域,特别是涉及一种获得两种夏天无多糖的提取方法、两种夏天无多糖及其应用。
背景技术:
2.夏天无为罂粟科植物伏生紫堇(corydalis decumbens)的干燥块茎。其性苦、微辛,常用于治疗头痛、卒中偏瘫、腰腿疼痛。现代药理学研究显示,夏天无具有抗炎、抗脑梗死、抗心律失常和保护脑神经等作用。目前,对于夏天无活性成分的研究主要集中在生物碱类物质,如原阿片碱、延胡索乙素和巴马汀等,现阶段对夏天无含有的多糖的研究较少,难以高效的提取获得夏天无中含有的多糖,并对其进行深入的研究。
技术实现要素:
3.为了解决上述问题,本发明提供了一种获得两种夏天无多糖的提取方法、两种夏天无多糖及其应用。本发明提供的提取方法能够利用一套提取方法高效地提取获得两种不同的夏天无多糖(夏天无多糖cps1和夏天无多糖cpw2)。这两种夏天无多糖具有显著的抗炎作用。
4.为了实现上述目的,本发明提供了如下技术方案:
5.本发明提供了一种获得两种夏天无多糖的提取方法,所述提取方法包括以下步骤:
6.将夏天无与水混合进行水提得到水提液,浓缩水提液得到浓缩液;
7.所述浓缩液浓缩至水提液的体积的1/25~1/35;
8.将无水乙醇和所述浓缩液混合,进行离心,取沉淀得到第一粗提取物;所述无水乙醇和所述浓缩液的体积比为2:1;
9.将无水乙醇和所述离心的上清液混合,进行离心,取沉淀得到第二粗提物;所述无水乙醇和所述离心的上清液混合的体积比为(0.7~1):1;
10.将胰蛋白酶和所述第一粗提物混合,进行酶解,得到酶解液,使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对所述酶解液进行第一洗脱得到第一洗脱液,对所述第一洗脱液进行纯化得到夏天无多糖cps1;
11.所述第一洗脱包括以下步骤:利用蒸馏水洗脱,不收集洗脱液,蒸馏水洗脱结束后,以0.25mol/l~0.45mol/l的nacl水溶液进行线性梯度洗脱,得到第一洗脱液;
12.使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对所述第二粗提物进行第二洗脱得到第二洗脱液,对所述第二洗脱液进行纯化,得到夏天无多糖cpw2;
13.所述第二洗脱包括以下步骤:利用蒸馏水洗脱,得到第二洗脱液。
14.优选的,所述水提时,夏天无与水的质量比为1:(10~100)。
15.优选的,所述第一洗脱和第二洗脱时流速分别为0.8ml/min。
16.优选的,所述胰蛋白酶与第一粗提物中蛋白质的质量比为1:(15~20)。
17.优选的,所述酶解的温度为37℃,酶解的时间为20h。
18.本发明还提供了一种根据上述提取方法提取获得的夏天无多糖cps1,所述夏天无多糖cps1为均一杂多糖,分子量为360kda,由葡萄糖,半乳糖,甘露糖和阿拉伯糖组成;
19.所述葡萄糖,半乳糖,甘露糖和阿拉伯糖组成的摩尔比为4.9:2.0:1:1.9。
20.本发明还提供了一种根据上述提取方法提取获得的夏天无多糖cpw2,所述夏天无多糖cpw2由同多糖聚合而成,所述同多糖的单糖元为葡萄糖;
21.所述同多糖为分子量为550kda和55kda;所述分子量为550kda的同多糖和分子量为55kda的同多糖的摩尔比为1:4。
22.本发明还提供了上述提取方法提取获得的两种夏天无多糖或上述夏天无多糖cps1或上述夏天无多糖cpw2在制备抗炎的制剂和/或药剂中的应用。
23.本发明还提供了上述提取方法提取获得的两种夏天无多糖或上述夏天无多糖cps1或上述夏天无多糖cpw2在制备抑制炎症因子表达的制剂和/或药剂中的应用;所述炎症因子包括tnf
‑
α、il
‑
1β、il
‑
6和cox
‑
2。
24.本发明提供了一种获得两种夏天无多糖的提取方法,所述提取方法包括粗提、醇沉、酶解和柱层析,经过上述提取方法能够分别获得夏天无多糖cps1和夏天无多糖cpw2。本发明提供的提取方法通过一套方法准确地获得两种产物,能够有效提高夏天无多糖的提取效率。
25.本发明提供的两种夏天无多糖具有显著的抗炎效果。由实施例可知,本发明提供的夏天无多糖cps1能显著降低lps诱导的raw264.7细胞中的tnf
‑
α,il
‑
1β,il
‑
6和cox
‑
2四种炎症因子的mrna相对表达量;夏天无多糖cpw2则能显著降低tnf
‑
α,cox
‑
2和inos基因的表达量(p<0.05)。
附图说明
26.图1为实施例1中,夏天无总糖的提取率与液料比关系曲线;
27.图2为实施例1中,夏天无总糖的提取率与提取时间关系曲线;
28.图3为实施例1中,夏天无总糖的提取率随提取温度变化曲线;
29.图4为实施例1的残差正态概率分布图;
30.图5为实施例1的模型诊断图
‑
残差图;
31.图6为实施例1的模型诊断图
‑
预测值与实际值散点图;
32.图7为实施例2中,酶解后第一粗提物经deae
‑
sepharose cl
‑
6b以0.25mol/l~0.45mol/l的nacl水溶液线性梯度洗脱后糖含量分布曲线;
33.图8为实施例2中,第二粗提物经deae
‑
sepharose cl
‑
6b以蒸馏水洗脱后糖含量分布曲线;
34.图9为应用例1中,夏天无多糖cps1的高效体积排阻色谱图;
35.图10为应用例1中,夏天无多糖cps1的全波长扫描图;
36.图11为应用例1中,夏天无多糖cps1
‑
p的高效体积排阻色谱图;
37.图12为应用例1中,未经酶解的夏天无多糖cps1
‑
e的高效体积排阻色谱图;
38.图13为应用例1中,未经酶解的夏天无多糖cps1
‑
e的全波长扫描图;
39.图14为应用例1中,夏天无多糖cpw2的高效体积排阻色谱图;
40.图15为应用例1中,夏天无多糖cpw2的全波长扫描图;
41.图16为应用例1中,第一粗多糖纯化样cpw的高效体积排阻色谱图;
42.图17为应用例2中,夏天无多糖cps1的气相色谱图;
43.图18为应用例2中,夏天无多糖cpw2的气相色谱图;
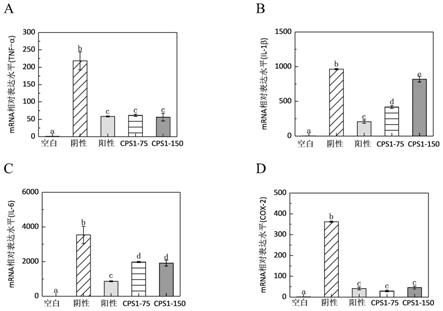
44.图19为应用例3中,夏天无多糖cps1对lps刺激raw264.7小鼠巨噬细胞炎症因子mrna表达的影响;
45.图20为应用例3中,夏天无cpw2对lps刺激raw264.7小鼠巨噬细胞炎症因子mrna表达的影响。
具体实施方式
46.本发明提供了一种获得两种夏天无多糖的提取方法,所述提取方法包括以下步骤:
47.将夏天无与水混合进行水提得到水提液,浓缩水提液得到浓缩液;
48.所述浓缩液浓缩至水提液的体积的1/25~1/35;
49.将无水乙醇和所述浓缩液混合,进行离心,取沉淀得到第一粗提取物;所述无水乙醇和所述浓缩液的体积比为2:1;
50.将无水乙醇和所述离心的上清液混合,进行离心,取沉淀得到第二粗提物;所述无水乙醇和所述离心的上清液混合的体积比为(0.7~1):1;
51.将胰蛋白酶和所述第一粗提物混合,进行酶解,得到酶解液,使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对所述酶解液进行第一洗脱得到第一洗脱液,对所述第一洗脱液进行纯化得到夏天无多糖cps1;
52.所述第一洗脱包括以下步骤:利用蒸馏水洗脱,不收集洗脱液,蒸馏水洗脱结束后,以0.25mol/l~0.45mol/l的nacl水溶液进行线性梯度洗脱,得到第一洗脱液;
53.使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对所述第二粗提物进行第二洗脱得到第二洗脱液,对所述第二洗脱液进行纯化,得到夏天无多糖cpw2;
54.所述第二洗脱包括以下步骤:利用蒸馏水洗脱,得到第二洗脱液。
55.本发明提供的提取方法耗能少,且具有极高的提取率,同时,本发明采用乙醇进行分步沉淀,提取得到的夏天无多糖成分明确,两种夏天无多糖的糖含量均超过97%,且不含有蛋白质和核酸等杂质,且使用一种方法可以同时制备得到两种夏天无多糖,简单有效、方便易操作。
56.本发明将夏天无与水混合进行水提得到水提液,浓缩水提液得到浓缩液。在本发明中,所述水提时,所述夏天无多与水的质量比优选为1:(10~100),在本发明中,所述夏天无优选包括新鲜的或干燥的夏天无,进一步优选为干燥的夏天无。当夏天无为干燥的夏天无时,所述干燥的夏天无与水的质量比优选为1:60。在本发明中,所述水提的方法优选包括恒温水浴,所述恒温水浴的温度优选为50℃~80℃,进一步优选为68℃,恒温水浴的时间优选为150~330min,进一步优选为250min。
57.水提结束后,本发明优选进行离心处理,所述离心的转速优选为3500~5000r/min,进一步优选为3500r/min,离心的时间优选为5~10min,进一步优选为5min。
58.离心结束后,本发明进行浓缩,所述浓缩液浓缩至水的体积的1/25~1/35,进一步优选为1/30。本发明能够通过上述提取方法获得夏天无总糖,该提取方法能够最大程度的提取获得夏天无总糖,并有效节约能源。
59.得到浓缩液后,本发明将无水乙醇和所述浓缩液混合,进行离心,取沉淀得到第一粗提取物。在本发明中,所述无水乙醇和所述浓缩液的体积比为2:1。
60.在本发明中,所述浓缩液与无水乙醇混合时,优选一边搅拌,一边缓慢向浓缩液中加入无水乙醇。本发明将无水乙醇与所述浓缩液混合后,优选还包括静置,所述静置的温度优选为2℃~5℃,进一步优选为4℃,静置的时间优选为10~24h,进一步优选为15h。在本发明中,所述离心的转速优选为3500~5000r/min,进一步优选为5000r/min,离心的时间优选为5~10min,进一步优选为5min。
61.取所述离心得到的上清液,将所述上清液和无水乙醇混合,进行离心,取沉淀得到第二粗提物。在本发明中,所述上清液与无水乙醇混合时,优选一边搅拌,一边缓慢向浓缩液中加入无水乙醇。在本发明中,所述无水乙醇和所述离心的上清液混合的体积比优选为(0.7~1):1,进一步优选为0.7:1。在本发明中,所述上清液和无水乙醇混合后,优选还包括静置的操作。在本发明中,所述静置和离心的条件优选与上文相同,在此不再赘述。在本发明中,所述离心后,优选对离心获得的沉淀进行干燥的操作,所述干燥优选包括冷冻干燥。本发明提供的第一粗提取物和第二粗提取物的分离过程中,利用乙醇进行分步沉淀,能够准确的获得含有目标物质的中间产物。
62.得到第一粗提取物后,本发明将胰蛋白酶和第一粗提物混合,进行酶解,得到酶解液,使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对所述酶解液进行第一洗脱得到第一洗脱液,对第一洗脱液进行纯化得到夏天无多糖cps1。
63.本发明优选将第一粗提物与水混合进行溶解,得到第一粗提物的水溶液。所述第一粗提物与水的质量体积比优选为(150~300)mg:(10~20)ml,进一步优选为300mg:10ml,溶解的温度优选为40℃~60℃,进一步优选为50℃。
64.得到第一粗提物的水溶液后,本发明优选检测第一粗提物的水溶液中的蛋白质含量。
65.得到第一粗提物的水溶液中的蛋白质含量后,进行酶解,得到酶解液。在本发明中,所述酶优选包括胰蛋白酶;本发明优选以第一粗提物的水溶液中的蛋白质含量为基础,胰蛋白酶与蛋白质的质量比优选为1:(15~20),进一步优选为1:20。在本发明中,所述酶解的温度为37℃,时间优选为20~24h,进一步优选为20h。
66.得到酶解液后,本发明使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对所述酶解液进行第一洗脱得到第一洗脱液。在本发明中,所述第一洗脱包括以下步骤:利用蒸馏水洗脱,不收集洗脱液,蒸馏水洗脱结束后,以0.25mol/l~0.45mol/l的nacl水溶液进行线性梯度洗脱,得到第一洗脱液。
67.在本发明中,所述蒸馏水洗脱的时间优选为21~24h,进一步优选为21h。
68.得到第一洗脱液后,本发明对所述第一洗脱液进行纯化得到夏天无多糖cps1。在本发明中,所述纯化优选包括透析;所述透析的方法优选包括使用截留分子量5000的透析袋进行透析;
69.所述透析时优选利用流水透析再利用蒸馏水透析,所述流水的透析时间优选为18
~24h,进一步优选为18h,蒸馏水的透析时间优选为18~24h,进一步优选为18h。本发明提供的提取方法通过酶解和特定的氯化钠水溶液的线性梯度洗脱,能够准确、高纯度的提取获得夏天无多糖cps1。
70.得到第二粗提物后,本发明使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对第二粗提物进行第二洗脱得到第二洗脱液,对第二洗脱液进行纯化,得到夏天无多糖cpw2。
71.进行第二洗脱前,本发明优选将第二粗提物与水混合溶解,得到第二粗提物的水溶液。在本发明中,所述第二粗提物与水的质量体积比优选为(150~300)mg:(10~20)ml,进一步优选为300mg:10ml。
72.得到第二粗提物的水溶液后,本发明优选离心第二粗提取物的水溶液,得到第二粗提取物的水溶液的上清液。在本发明中,所述离心的转速优选为3500~5000r/min,进一步优选为5000r/min,离心的时间优选为5~10min,进一步优选为5min。
73.得到第二粗提物的水溶液的上清液后,本发明使用装有deae
‑
sepharose cl
‑
6b凝胶的层析柱对第二粗提物进行第二洗脱得到第二洗脱液。
74.在本发明中,所述第二洗脱包括以下步骤:利用蒸馏水洗脱,得到第二洗脱液。
75.在本发明中,所述蒸馏水洗脱的时间优选大于等于6h,进一步优选为12h。
76.在本发明中,得到第二洗脱液后,本发明对第二洗脱液进行纯化,得到夏天无多糖cpw2。所述纯化优选包括透析,所述透析的方法优选包括使用截留分子量5000的透析袋进行透析;
77.所述透析时优选利用流水透析再利用蒸馏水透析,所述流水的透析时间优选为18~24h,进一步优选为18h,蒸馏水的透析时间优选为18~24h,进一步优选为18h。本发明提供的提取方法通过上述夏天无多糖cps1的提取方法后再次进行分离,能够准确、高纯度的提取获得夏天无多糖cpw2。
78.如无特殊说明,本发明对上述材料的来源没有特殊限定,采用本领域技术人员熟知的常规市售产品即可。
79.本发明还提供了一种根据上述提取方法提取获得的夏天无多糖cps1,所述夏天无多糖cps1为均一杂多糖,分子量为360kda,由葡萄糖,半乳糖,甘露糖和阿拉伯糖组成;所述葡萄糖,半乳糖,甘露糖和阿拉伯糖组成的摩尔比为4.9:2.0:1:1.9。本发明提供的夏天无多糖cps1能够显著降低lps诱导的raw264.7细胞中的tnf
‑
α,il
‑
1β,il
‑
6和cox
‑
2四种炎症因子的mrna相对表达量。
80.本发明还提供了一种根据上述提取方法提取获得的夏天无多糖cpw2,所述夏天无多糖cpw2由同多糖聚合而成,所述同多糖的单糖元为葡萄糖;
81.所述同多糖为分子量为550kda和55kda;所述分子量为550kda的同多糖和分子量为55kda的同多糖的摩尔比为1:4。本发明提供的夏天无多糖cpw2能够显著降低tnf
‑
α,cox
‑
2和inos基因的表达量。
82.本发明还提供了上述提取方法提取获得的两种夏天无多糖或上述夏天无多糖cps1或上述夏天无多糖cpw2在制备抗炎的制剂和/或药剂中的应用。本发明提供的两种夏天无多糖具有显著的抑制炎症因子的作用,炎症因子的过量表达与脑出血疾病相关,脑出血急性期会大量表达il
‑
1β,脑出血病人发病后,tnf
‑
α浓度与出血量呈正相关,il
‑
6的过量表达可加重血脑屏障损伤,inos基因的过表达会释放大量的一氧化氮,从而加剧神经元细
胞的损伤,本发明提供的两种夏天无多糖能有效抑制炎症因子的表达,并且没有毒副作用,有效成分明确,可以作为医药用抗炎制剂,如脑出血疾病二级预防的辅助药物。
83.本发明还提供了上述提取方法提取获得的两种夏天无多糖或上述夏天无多糖cps1或上述夏天无多糖cpw2在制备抑制炎症因子相对表达量的制剂和/或药剂中的应用;所述炎症因子包括tnf
‑
α、il
‑
1β、il
‑
6和cox
‑
2。本发明提供的夏天无多糖cps1能显著降低lps诱导的raw264.7细胞中的tnf
‑
α,il
‑
1β,il
‑
6和cox
‑
2四种炎症因子的mrna相对表达量(p<0.05),具体实施例证明质量浓度为75μg/ml或150μg/ml的夏天无多糖cps1能显著降低lps诱导的raw264.7细胞中的tnf
‑
α,il
‑
1β,il
‑
6和cox
‑
2四种炎症因子的mrna相对表达量;夏天无多糖cpw2能显著降低tnf
‑
α,cox
‑
2和inos基因的表达量(p<0.05),具体实施例证明,质量浓度为75μg/ml或150μg/ml的夏天无多糖cpw2能显著降低tnf
‑
α,cox
‑
2和inos基因的表达量。
84.为了进一步说明本发明,下面结合附图和实施例对本发明提供的一种获得两种夏天无多糖的提取方法、两种夏天无多糖及其应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
85.实施例1
86.响应曲面法优化夏天无总糖的提取工艺
87.实验方法:设计单因素实验,研究料液比,提取时间和提取温度对夏天无总糖提取率的影响。具体实验方案是,在固定两个因素的实验条件下,改变另外1个因素的实验条件,从而可以得到该因素在不同实验水平下对夏天无总糖提取率的影响。
88.采用box
‑
behnken模型安排实验,以液料比、提取温度、提取时间为主要实验因素。称取1g粉碎的干燥夏天无,按照表1实验设计加入相应的蒸馏水,在特定的提取温度下按特定时间提取得到粗提液,采用苯酚硫酸法检测所得粗提液的总糖提取率。
89.表1夏天无总糖提取的box
‑
behnken设计方案及提取率
90.[0091][0092]
结果:单因素实验结果见图1~图3,根据图1~图3的单因素实验结果,以液料比、提取时间、提取温度3个因素为自变量,安排响应曲面实验的实验水平(见表2)。
[0093]
采用响应面分析法在三因素三水平上对夏天无多糖提取过程进行优化,以达到最大限度提取夏天无多糖的目的(如表1)。利用design
‑
expert.v11.1.0软件对表1数据进行二次多项数学拟合回归分析,得到夏天无多糖提取率对提取因素的二次多项回归方程为:
[0094]
y=
‑
166.55168+0.122058a+0.531025b+3.78316c+0.000450ab
‑
0.000288ac
‑
0.000475bc
‑
0.001738a2‑
0.001046b2‑
0.026881c2。
[0095]
表2响应面试验设计因素水平及编码
[0096][0097]
为验证该模型对提取方案进行预测的效果,进一步确定各因素对夏天无多糖提取率的影响程度,对试验结果进行方差分析,该模型系数的显著性检验结果如表3所示。
[0098]
表3回归方程方差分析和显著性结果
[0099][0100][0101]
由表3可看出,此模型的p值为0.0083(<0.05),说明试验模型具有显著性;模型的失拟项p值为0.0889(>0.05),说明模型的失拟项检验不显著,说明模型选择较合适,试验相
对误差较小。从回归方程中各参数对夏天无总糖的提取率的影响程度来看,提取时间、提取温度的二次项(b2、c2)对夏天无多糖提取率影响极显著(p<0.01)。
[0102]
方程的r2为0.9021,方程拟合程度较好,可以用来对夏天无总糖提取率的工艺研究进行初步分析和预测。残差的正态图如图4所示,残差沿直线的分布表明残差服从正态分布。如图5所示,所有数据点在可接受范围内(
±
4.82),诊断图的结果证明了模型的适用性和准确性。
[0103]
结合回归模型的数学分析,得到夏天无总糖的最适工艺条件为:a(液料比)=60:1,b(时间)=250min,c(温度)=68℃,按此方案进行3次平行试验,测得夏天无总糖的平均提取率为32.740%,与理论值相差0.364%。表明本发明提供的夏天无总糖的提取条件能够最大程度地提取获得夏天无总糖。
[0104]
实施例2
[0105]
同时制备两种夏天无多糖
[0106]
(1)取干燥的夏天无根部50g放入3000ml蒸馏水中,恒温水浴锅68℃水浴提取250min,3500r/min离心5min,取提取液;
[0107]
(2)将步骤(1)所得的提取液浓缩至100ml,浓缩的时候进行了搅拌处理,搅拌同时向浓缩液中缓慢加入200ml的无水乙醇,盖上保鲜膜放在冰箱内冷藏静置,冷藏静置的温度为4℃,冷藏静置的时间为15h;
[0108]
冷藏静置结束后进行离心处理,离心的条件为5000r/min,离心的时间为5min,离心得到第一沉淀和上清液;
[0109]
第一沉淀干燥后得第一粗提物,上清液倒入新的烧杯中,搅拌同时缓慢加入200ml无水乙醇,在冰箱中4℃放置15h,冷藏放置结束后进行离心,5000r/min离心5min,离心得到第二沉淀;
[0110]
向第二沉淀中加入少量蒸馏水溶解,再进行冷冻干燥得到第二粗提物;
[0111]
(3)取deae
‑
sepharose cl
‑
6b凝胶,使用循环水式真空泵将凝胶中的气体全部排除,使用玻璃棒轻引流,将凝胶悬浮液装入玻璃层析柱中,避免产生气泡;
[0112]
打开恒流泵,用2000ml蒸馏水平衡层析柱。平衡结束后,制备得到直径为4.6cm,高度为37cm,装有deae
‑
sepharose cl
‑
6b凝胶的层析柱;
[0113]
层析柱的使用条件为:恒流泵流速0.8ml/min,自动部分收集器收集,设定每管收集10ml;
[0114]
(4)取步骤(2)所得第一粗提物300毫克,溶解于10ml蒸馏水中,放置于50℃水浴锅中待其全部溶解,得到第一粗提取的水溶液;
[0115]
测定第一粗提物水溶液中蛋白质的含量,按照蛋白质:胰蛋白酶的质量比为20:1加入胰蛋白酶,封口,37℃水浴锅中保温20h,酶解得到酶解液;
[0116]
取酶解液缓慢上样于步骤(3)制备好的装有deae
‑
sepharose cl
‑
6b凝胶的层析柱中,用蒸馏水洗脱21h,不收集洗脱液,然后使用0.25mol/l~0.45mol/l的nacl水溶液进行线性梯度洗脱,自动部分收集器收集;流速为0.8ml/min,每收集10ml层析液为1管;
[0117]
对收集液进行检测,利用苯酚
‑
硫酸法测定收集液中的糖含量分布(如图7所示),利用紫外分光光度计检测法检测蛋白质分布,根据糖及蛋白质的含量分布情况,合并第37~50管收集液,用截留分子量5000的透析袋对收集液进行透析,先流水透析18h,再利用蒸
馏水透析18h,透析结束后得到透析液a,对透析液a进行旋浓缩得到多糖浓缩液a,多糖浓缩液a冷冻干燥后,得到夏天无多糖cps1。
[0118]
(5)取步骤(2)所得的第二粗提物300毫克,溶解于10ml蒸馏水中,离心处理(5000r/min,离心时间5min)后,取上清液缓慢上样于步骤(3)制备好的装有deae
‑
sepharose cl
‑
6b凝胶的层析柱中,打开恒流泵,用蒸馏水洗脱12h,自动部分收集器收集;
[0119]
对收集液进行检测,利用苯酚
‑
硫酸法测定收集液糖含量分布(如图8所示),利用紫外分光光度计检测蛋白质分布,根据糖及蛋白质含量分布情况,合并第28~56管的收集液,用截留分子量5000的透析袋对收集液进行透析,先流水透析18h,再蒸馏水透析18h。透析完成后得到透析液b,对透析液b进行浓缩得到多糖浓缩液b,多糖浓缩液b冷冻干燥后,得到夏天无多糖cpw2。
[0120]
对比例1
[0121]
其余步骤与实施例2一致。
[0122]
该对比例与实施例2的区别点在于,步骤(4)中使用浓度为0和1mol/l的nacl溶液进行线性梯度洗脱,即以0~1mol/l的nacl水溶液进行线性梯度洗脱,将得到的多糖命名为cps1
‑
p。
[0123]
对比例2
[0124]
其余步骤与实施例2一致。
[0125]
该对比例与实施例2的区别点在于,步骤(4)中不进行酶解,对第一粗提物直接进行deae
‑
sepharose cl
‑
6b层析,对得到的多糖命名为cps1
‑
e。
[0126]
对比例3
[0127]
其余步骤与实施例2一致。
[0128]
该对比例与实施例2的区别点在于,将第一粗提取直接通过步骤(5)进行纯化,获得第一粗多糖纯化样cpw。
[0129]
应用例1
[0130]
均一性及纯度鉴定
[0131]
1、夏天无多糖cps1的均一性及纯度鉴定
[0132]
1)检测方法
[0133]
采用高效体积排阻色谱法(hpsec)鉴定样品夏天无多糖cps1及对比例1和对比例2的组分均一性。
[0134]
使用sugarks
‑
804色谱柱,流动相为超纯水,流速1ml/min,柱温50℃,利用示差折光检测器(riu)检测。取0.5~1mg/ml夏天无多糖cps1水溶液进行全波谱扫描(190~800nm),检测夏天无多糖cps1及对比例1和对比例2的纯度。
[0135]
2)结果
[0136]
夏天无多糖cps1的高效体积排阻色谱结果如图9所示。图9表明夏天无多糖cps1在6.214min仅有1个峰出现,该峰峰型尖锐且对称,说明cps1均一性好,成分单一。
[0137]
经190~800nm全波长扫描,全波长扫描图如图10所示,夏天无多糖cps1不含有蛋白质和核酸类杂质,说明提取获得的夏天无多糖cps1纯度高。
[0138]
cps1
‑
p的高效体积排阻色谱图如图11所示,图11表明,未经过特定浓度盐水洗脱的产物cps1
‑
p中,除了含有目标夏天无多糖cps1外,在1.889min、4.914min和8.926min还出
现了其它杂质峰,根据峰面积计算这3处杂质约占35%。说明扩大线性梯度洗脱所使用的nacl水溶液的浓度范围,虽然可以洗脱得到目标多糖,但杂质较多,不利于目标产物的获得。
[0139]
cps1
‑
e的高效体积排阻色谱图如图12所示,全波长扫描图如图13所示,图12显示cps1
‑
e在5.009min出现吸收峰,为水溶性杂质吸收峰,根据峰面积计算该杂质约占14%。图13显示cps1
‑
e在280nm出现吸收峰,说明cps1
‑
e含有杂蛋白。
[0140]
综上,本发明实施例1中对第一粗提物水溶液先进行酶解后再利用特定浓度nacl水溶液进行层析分离,可以有效除去各种杂质。
[0141]
2、夏天无多糖cpw2的均一性及纯度鉴定
[0142]
1)检测方法
[0143]
检测方法同夏天无多糖cps1的检测方法。
[0144]
2)结果
[0145]
夏天无多糖cpw2的高效体积排阻色谱结果如图14所示。图14表明夏天无多糖cpw2在5.947min和8.882min出现2个峰,说明夏天无cpw2的多糖组分不均一。经190~800nm全波长扫描,全波长扫描图如图15所示,表明夏天无多糖cpw2中不含有蛋白质和核酸类杂质,纯度高。
[0146]
cpw的高效体积排阻色谱图如图16所示,图16中显示至少出现5个峰,说明cpw中组分多,杂质多。通过图16与图14、图15的对比可知,第一粗提物中不含有目标多糖cpw2。
[0147]
应用例2
[0148]
夏天无多糖cps1和夏天无多糖cpw2的特性分析
[0149]
1、分子量分析
[0150]
采用高效体积排阻色谱法(hpsec)鉴定样品夏天无多糖cps1和夏天无多糖cpw2的组分均一性,根据葡聚糖标准品,以sugarks
‑
804色谱柱的出峰时间为基础,制作分子量标准曲线,计算夏天无多糖cps1和夏天无多糖cpw2的相对分子质量。
[0151]
2、糖类特征官能团鉴定
[0152]
使用红外光谱(ftir)法分析样品的化合物类型,将2mg样品(夏天无多糖cps1或夏天无多糖cpw2)进行kbr压片,利用nicoletnexus 470型红外光谱仪测定。
[0153]
3、单糖组成分析
[0154]
取30mg样品(夏天无多糖cps1或夏天无多糖cpw2)用1mol/l硫酸在100℃水解8h,水解液用碳酸钡中和至中性,分离后取上清液进行冷冻干燥,得到单糖水解产物。水解产物经三甲基硅醚化衍生后,将衍生物进行气相色谱分析:hp
‑
5毛细管色谱柱,程序升温160℃
→
180℃(20℃/min)
→
220℃(8℃/min,保持2min)
→
250℃(2min),检测器温度为280℃。
[0155]
4、结果
[0156]
1)根据标准葡聚糖制作分子质量标准曲线,得出方程y=
‑
3.92x+6.314(r2=0.99),根据夏天无多糖cps1的hpsec出峰时间6.214min,计算得出夏天无多糖cps1分子质量为360kda。
[0157]
根据标准单糖衍生物的gc结果及夏天无多糖cps1的气相色谱结果(图17,图中1~4的标记分别代表葡萄糖,半乳糖,甘露糖和阿拉伯糖异构体)可知,夏天无多糖cps1由葡萄糖,半乳糖,甘露糖和阿拉伯糖组成,摩尔比为4.9:2.0:1:1.9。红外光谱结果显示,夏天无
多糖cps1在3400cm
‑1,2900cm
‑1,1650cm
‑1和1100cm
‑1均出现糖类物质特征官能团。
[0158]
2)根据标准葡聚糖制作分子质量标准曲线,得出方程y=
‑
3.92x+6.314(r2=0.99),计算得出夏天无多糖cpw2由分子量为550kda和55kda的不均一多糖聚合而成,根据峰面积计算得出二者的摩尔比为1:4。
[0159]
根据标准单糖衍生物的gc结果及夏天无多糖cpw2的气相色谱结果(图18,图中1的标记代表葡萄糖异构体)可知,夏天无多糖cpw2由单一葡萄糖组成,夏天无多糖cpw2是同多糖。红外光谱结果显示,cpw2在3400cm
‑1,2900cm
‑1,1650cm
‑1和1100cm
‑1均出现糖类物质特征官能团。
[0160]
应用例3
[0161]
夏天无多糖cps1和夏天无多糖cpw2的抗炎作用研究
[0162]
1、细胞毒性
[0163]
使用dmem培养基培养raw264.7细胞,完全培养基含有10%血清和1%双抗,细胞在37℃和5%二氧化碳培养箱中培养48h后进行传代。
[0164]
使用mtt法检测夏天无多糖cps1和夏天无多糖cpw2对raw264.7的细胞毒性,96孔板培养细胞后,设置600μg/ml,300μg/ml,150μg/ml,75μg/ml,25μg/ml和1μg/ml六个夏天无多糖质量浓度。
[0165]
一般认为抑制率在20%以下即没有细胞毒,经过细胞毒检验,确认添加75μg/ml或150μg/ml的夏天无多糖cps1对raw264.7细胞生长的抑制作用分别是15.7%和16.1%,无细胞毒性;添加质量浓度为600μg/ml以下的夏天无多糖cpw2对raw264.7细胞生长没有细胞毒性。
[0166]
2、抗炎作用
[0167]
使用1μg/ml脂多糖(lps)诱导raw264.7细胞产生炎症,安排空白组(没有诱导炎症)、阴性对照组(1μg/ml lps诱导炎症)、阳性对照组(dxms,75μg/ml地塞米松)、夏天无多糖cps1(75μg/ml或150μg/ml)和夏天无多糖cpw2(75μg/ml或150μg/ml)的样品组,每组设置3个平行样。
[0168]
按照总rna提取试剂盒(promega公司)说明书提取各组细胞内总rna,反转录试剂盒反转录得到cdna,qpcr mastermix试剂盒(promega公司)进行实时荧光定量pcr,以持家基因gapdh为内参基因,2
‑
δδct
法计算各炎症因子的mrna相对表达量。检测结果如表4、表5和图19、图20所示;
[0169]
图19中,a为tnf
‑
α的表达图,b为il
‑
1β的表达图,c为il
‑
6的表达图,d为cox
‑
2的表达图;
[0170]
图20中,a为tnf
‑
α的表达图,b为il
‑
6的表达图,c为cox
‑
2的表达图,d为inos的表达图。
[0171]
表4 cps1对脂多糖诱导的raw264.7细胞中炎症因子的抑制作用
[0172][0173]
夏天无多糖cps1的抗炎结果如图19和表4所示,图19中不同字母对应的直方图显示不同组别对不同炎症因子的表达影响,经显著性分析可知,差异显著(p<0.05)。质量浓度为75μg/ml或150μg/ml的夏天无多糖cps1样品组均能显著降低炎症因子tnf
‑
α和cox
‑
2的mrna相对表达量(p<0.05),两个样品组与阳性对照组对tnf
‑
α和cox
‑
2表达抑制率无显著差异(p>0.05),说明夏天无多糖cps1的抗炎效果与dxms相当。夏天无多糖cps1也能显著降低脂多糖诱导的raw264.7细胞中炎症因子il
‑
1β和il
‑
6的mrna相对表达量(p<0.05)。
[0174]
表5 cpw2对脂多糖诱导的raw264.7细胞中炎症因子的抑制作用
[0175][0176]
夏天无多糖cpw2的抗炎结果如图20和表5所示,图20中不同字母对应的直方图显示不同组别对不同炎症因子的表达影响,经显著性分析可知,差异显著(p<0.05)。质量浓度为75μg/ml或150μg/ml的夏天无多糖cpw2样品组均能显著降低炎症因子tnf
‑
α和cox
‑
2的mrna相对表达量(p<0.05),两个不同质量浓度样品组无显著差异,说明没有量效关系。夏天无多糖cpw2也能显著降低脂多糖诱导的raw264.7细胞中炎症因子inos的mrna相对表达量(p<0.05)。
[0177]
综上,本发明提供的夏天无多糖cps1和夏天无多糖cpw2具有良好的抗炎作用。
[0178]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1