一种氰基化或硫氰基化中氮茚及其衍生物的制备方法
1.本发明属于有机合成技术领域,具体涉及一种氰基化或硫氰基化中氮茚及其衍生物的制备方法。
背景技术:
2.氰基存在于多种治疗药物中,发挥着独特的作用
[1
‑
3]
。氰基作为一种多功能官能团,可以很方便地转化成许多其他有用的官能团,如氨基甲酰、羧基、氨甲基、羰基、含氮杂环等,因此在有机合成中有广泛的应用
[4
‑
8]
。另一方面,杂环类化合物无疑在有机化合物中占有极其重要的地位,特别是在药物化学中,因此,杂环腈类化合物的合成在过去几十年里引起了有机合成工作者们的极大关注。杂环的直接氰化反应是获得杂环腈的主要途径,钯催化杂芳基卤化物与几种氰化物如(nacn、kcn、zn(cn)2、k4[fe(cn)6]等)的交叉偶联是杂环化合物氰基化的常用方法
[9
‑
18]
。但这些方法仍有一定的局限性,经常出现如杂环范围窄、氰化使催化剂失活等问题。近年来,以dmf、异腈、k4[fe(cn)6]、nacn和硝基甲烷为氰化试剂,开发了pd
[19
‑
23]
、cu
[24]
、zn
[25]
、rh
[26
‑
28]
、ru
[29
‑
30]
等一系列过渡金属催化芳香族杂环氰化反应。鉴于杂环化合物的多样性和复杂性,以及大多数氰化试剂的高毒性,开发高效实用的低毒性氰化试剂,以及绿色高效的杂环氰化方法是一项具有挑战性的任务。
[0003]
有机硫化合物具有广泛的生物活性和药理活性,属于一类重要的化合物
[31
‑
32]
。因此,在有机碳骨架中直接引入硫的方法已经得到了大量的研究
[33
‑
38]
。其中,硫氰化反应是快速便捷形成碳
‑
硫键的一种方式。硫氰化的产物
‑
硫氰酸盐,在合成含硫杂环中是用途广泛的关键中间体
[39
‑
43]
。此外,硫氰酸盐可以很容易地转化为其他硫官能团,如硫三氟甲基、磺酸基、硫醚、二硫化物、硫醇、硫代氨基甲酸盐
[44]
。以can、高价碘试剂、过硫酸钾、mn(oac)3等作为氧化剂,已经开发了许多使用硫氰酸盐进行亲电硫氰化的方法
[45
‑
47]
。然而,这些方法通常存在缺点:需要大剂量氧化剂;产生大量重金属废物。近年来,可见光催化的有氧氧化已被证明是一种多功能和环境友好的策略
[48
‑
50]
。我们设想硫氰酸盐阴离子将在光氧化还原条件下被氧化,形成硫氰酸盐自由基,硫氰酸盐自由基将参与自由基偶联硫氰化反应。
[0004]
可见光作为一种廉价易得的可再生能源,完全符合当今时代可持续发展的需求,利用可见光催化合成化学近年来引起大多数有机合成研究者的兴趣。光催化转化被认为是在温和条件下激活c
‑
h键的一种有前景的替代方法
[51
‑
60]
。它们提供了独特的直接途径,可以直接进入通常难以使用其他反应类型合成的分子结构。光催化反应的发展是合成化学中一个有吸引力的合成策略。与过渡金属催化剂相比,有机染料具有成本低、合成通用性强、无毒环保等优点
[61
‑
70]。鉴于杂环化合物的多样性和复杂性,以及大多数氰化试剂的高毒性,开发高效实用的低毒性氰化试剂,以及绿色高效的杂环氰化/硫氰基化方法是一项具有挑战性的任务。
[0005]
因此,我们开发了一种简单、绿色高效的可见光诱导的中氮茚氰基化或硫氰基化反应。
[0006]
参考文献:
[0007]
[1]murdochd.,keams.j.drugs.2005,65(16):2379
‑
2404.
[0008]
[2]flemingf.f.,yaol.,ravikumarp.c.,etal.journalofmedicinalchemistry.2010,53(22):7902
‑
7917.
[0009]
[3]wangj.,hongl.chinesejournaloforganicchemistry.2012,32(9):1643
‑
1652.
[0010]
[4]liskeyc.w.,liaox.,hartwigj.f.journaloftheamericanchemicalsociety.2010,132(33):11389
‑
11391.
[0011]
[5]pengh.,hub.,liuq.,etal.angewandtechemieinternationaledition.2017,56(13):3655
‑
3659.
[0012]
[6]huangy.,yuey.,etal.thejournaloforganicchemistry.2017,82(14):7621
‑
7627.
[0013]
[7]liul
‑
y.,yeungk
‑
s.,yuj
‑
q.chemistryaeuropeanjournal.2019,25(9):2119
‑
2202.
[0014]
[8]nautha.m.,otton.,opatzt.advancedsynthesis&catalysis.2016,47(16):3424
‑
3428.
[0015]
[9]ellisg.p,romney
‑
alexandert.m.chemicalreviews.1987,87(4):779
‑
794.
[0016]
[10]anbarasanp.,schareinat.,bellerm.chemicalsocietyreviews.2011,40(10):5049
‑
5067.
[0017]
[11]littkea.,soumeillantm.,etal.organicletters.2007,9(9):1711
‑
1714.
[0018]
[12]ushkova.v.,grushinv.v.journaloftheamericanchemicalsociety.2011,42(51):10999
‑
11005.
[0019]
[13]zhangd.,sunh.,etal.chemicalcommunications.2012,48(23):2909
‑
2911.
[0020]
[14]senecalt.d.,weis.,buchwalds.l.angewandtechemieinternationaledition.2013,9(12):1338
‑
1338.
[0021]
[15]cohend.t.,buchwalds.l.organicletters.2015,46(2):202
‑
205.
[0022]
[16]kimk.,hongs.h.advancedsynthesis&catalysis.2017,359(14):2345
‑
2351.
[0023]
[17]zhangx.,xiaa.,etal.organicletters.2017,19(8):2118
‑
2121.
[0024]
[18]coombsj.r.,fraunhofferk.j.,etal.thejournaloforganicchemistry.2017,82(13):7040
‑
7044.
[0025]
[19]dings.,jiaon.journaloftheamericanchemicalsociety.2011,133(32):12374
‑
12377.
[0026]
[20]xus.,huangx.,hongx,etal.organicletters.2012,14(17):4614
‑
4617.
[0027]
[21]yang.,kuangc.,yanz,etal.organicletters.2010,12(5):1052
‑
1055.
[0028]
[22]yeungp.y.,soc.m.,lauc.p.,etal.organicletters.2011,13(4):
648
‑
651.
[0029]
[23]zhangd.,sunh.,etal.chemicalcommunications.2012,48(23):2909
‑
2911.
[0030]
[24]doh.q.,dauguliso.organicletters.2010,12(11):2517
‑
2519.
[0031]
[25]nagasey.,sugiyamat.,nomiyamas.,etal.advancedsynthesis&catalysis.2014,356(2
‑
3):347
‑
352.
[0032]
[26]anbarasanp.,neumannh.,bellerm.angewandtechemieinternationaledition.2011,50(2):519
‑
522.
[0033]
[27]gongt
‑
j.,xiaob.,chengw
‑
m.,etal.journaloftheamericanchemicalsociety.2013,135(29):10630
‑
10633.
[0034]
[28]chaitanyam.,anbarasanp.organicletters.2015,46(46):3766
‑
3769.
[0035]
[29]vardhanreddyk.h.,satishg.,prakashreddyv.,etal.rscadvances.2012,2(29):11084
‑
11088.
[0036]
[30]mishraa.,vatst.k.debi.thejournaloforganicchemistry.2016,81(15):6525
‑
6534.
[0037]
[31]castanheirot.,suffertj.,donnardm.,etal.chemicalsocietyreviews.2015,45(3):494
‑
505.
[0038]
[32]lawsona.p.,longm.,coffeyr.t.,etal.cancerresearch.2015,75(23):5130
‑
5142.
[0039]
[33]liuh.,jiangx.chemistryanasianjournal.2013,8(11):2546
‑
2563.
[0040]
[34]yangh.,duanx
‑
h.,zhaoj
‑
f.,etal.organicletters.2015,17(8):1998
‑
2001.
[0041]
[35]browns.p.,amosb.smithⅲ.journaloftheamericanchemicalsociety.2015,137(12):4034
‑
4037.
[0042]
[36]qiaoz.,liuh.,xiaox.,etal.organicletters.2013,15(11):2594
‑
2597.
[0043]
[37]xiy.,dongb.,mcclaine.j.,etal.angewandtechemieinternationaledition.2013,53(18):4657
‑
4661.
[0044]
[38]byeuna.,baekk.,hanm.s.,etal.tetrahedronletters.2013,54(49):6712
‑
6715.
[0045]
[39]zhangz.,liebeskindl.s.,etal.organicletters.2006,8(19):4331
‑
4333.
[0046]
[40]wangf.,chenc.,dengg.,etal.thejournaloforganicchemistry.2012,77(8):4148
‑
4151.
[0047]
[41]palsuledesaic.c.,murrus.,sahoos.k.,etal.organicletters.2009,11(15):3382
‑
3385.
[0048]
[42]lux.,wangh.,gaor.,etal.rscadvances.2014,4(54):28794
‑
28797.
[0049]
[43]pawliczekm.,garvel.,werzd.b.organicletters.2015,46(7):1716
‑
1719.
[0050]
[44]ke f.,qu y.,jiang z.,et al.organic letters.2011,42(19):454
‑
457.
[0051]
[45]yadav j.s.;reddy b.v.s.;murali krishna,b.b.synthesis.2008, 2008(23):3779
‑
3782.
[0052]
[46]wu guaili.,liu q.,shen y.,et al.tetrahedron letters.2005,46(35): 5831
‑
5834.
[0053]
[47]pan x
‑
q.,lei m
‑
y.,zou j.
‑
p.,zhang z.w.tetrahedron letters.2009, 50(3):347
‑
349.
[0054]
[48]gu x.,li x.,chai y.,et al.green chemistry.2013,15(2):357
‑
361.
[0055]
[49]liu d.,zhou h.,gu x.,et al.chinese journal of chemistry.2014,32(2): 117
‑
122.
[0056]
[50]li x.,gu x.,li y.,et al.acs catalysis.2014,4(6):1897
‑
1900.
[0057]
[51]m.h.shaw,j.twilton and d.w.c.macmillan,j.org.chem.,2016,81, 6898
‑
6926.
[0058]
[52]n.corrigan,s.shanmugam,j.xu and c.boyer,chem.soc.rev.,2016,45, 6165
‑
6212.
[0059]
[53]s.barata
‑
vallejo,s.m.bonesi and a.postigo,org.biomol.chem.,2015, 13,11153
‑
11183.
[0060]
[54]c.k.prier,d.a.rankic and d.w.c.macmillan,chem.rev.,2013,113, 5322
‑
5363.
[0061]
[55]y.xi,h.yi and a.lei,org.biomol.chem.,2013,11,2387
‑
2403.
[0062]
[56]j.m.r.narayanam and c.r.j.stephenson,chem.soc.rev.,2011,40, 102
‑
113.
[0063]
[57]x.lang,x.chen and j.zhao,chem.soc.rev.,2014,43,473
‑
486.
[0064]
[58]l.shi and w.xia,chem.soc.rev.,2012,41,7687
‑
7697.
[0065]
[59]j.r.chen,x.q.hu,l.q.lu and w.j.xiao,chem.soc.rev.,2016,45, 2044
‑
2056.
[0066]
[60]x.lang,j.zhao and x.chen,chem.soc.rev.,2016,45,3026
‑
3038.
[0067]
[61]y.pan,c.w.kee,l.chen and c.h.tan,green chem.,2011,13, 2682
‑
2685.
[0068]
[62]d.a.nicewicz and t.m.nguyen,acs catal.,2014,4,355
‑
360.
[0069]
[63]w.j.yoo and s.kobayashi,green chem.,2013,15,1844
‑
1848.
[0070]
[64]g.kibriya,s.mondal and a.hajra,org.lett.,2018,20,7740
‑
7743.
[0071]
[65]g.kibriya,a.k.bagdi and,a.hajra,j.org.chem.,2018,83, 10619
‑
10626.
[0072]
[66]g.kibriya,a.k.bagdi and a.hajra,org.biomol.chem.,2018,16, 3473
‑
3478.
[0073]
[67]r.rahaman,s.das and p.barman,green chem.,2018,20,141
‑
147.
[0074]
[68]y.gao,y.liu and j.p.wan,j.org.chem.,2019,84,2243
‑
2251.
[0075]
[69]s.cao,s.zhong,l.xin,j.p.wan and c.wen,chemcatchem.,2015,7, 1478
‑
1482.
[0076]
[70]y,qing,y.zhang and j.p.wan.green chem.,2019.21,3436
‑
3441.
技术实现要素:
[0077]
基于现有技术中存在的问题:
[0078]
本发明的目的是提供一种中氮茚及其衍生物的制备方法;
[0079]
术语:
[0080]
1、中氮茚:是一类非常重要的具有10π电子的芳香氮杂环化合物,他是吲哚的同分异构体,最早是由angeli于1890年发现的。中氮茚衍生物是一类天然的生物碱,在生物、农药和医药上具有广泛的用途。中氮茚的母核系统命名为pyrrolo[1,2
‑
a]pyridine。ca上用的名称为indolizine。
[0081]
2、催化剂:在化学反应里能改变反应物的化学反应速率(既能提高也能降低) 而不改变化学平衡,且本身的质量和化学性质在化学反应前后都没有发生改变的物质,固体催化剂也叫触媒。
[0082]
3、氧化剂:在氧化还原反应中,获得电子的物质称作氧化剂;又可以指可以使另一物质得到氧的物质。
[0083]
4、溶剂:是一种可以溶化固体、液体或气体溶质的液体,继而成为溶液,溶剂通常拥有比较低的沸点和容易挥发,或是可以由蒸馏来去除,从而留下被溶物,因此,溶剂不可以对溶质产生化学反应。
[0084]
首先,本发明提供了一种催化体系,其特征在于:所述的催化体系用于选择性合成3位取代中氮茚,所述的催化体系包括:光源、催化剂、氧化剂和溶剂。
[0085]
所述的光源为led灯;所述的led灯照射的条件为:照射功率为10w,照射波长为455nm
±
10nm。
[0086]
所述的催化剂为孟加拉玫瑰红、曙红y、荧光素和罗丹明6g中的一种或几种。
[0087]
优选地,所述的催化剂为孟加拉玫瑰红、荧光素和罗丹明6g中的一种或几种;
[0088]
再优选地,所述的催化剂为孟加拉玫瑰红和罗丹明6g中的一种或几种;
[0089]
进一步优选地,所述的催化剂为孟加拉玫瑰红。
[0090]
孟加拉玫瑰红:别名为食用色素红色105号,紫色至红褐色颗粒或粉末。易溶于水(30g/100ml)及乙醇,难溶于硬度高的水;溶于甘油、乙二醇;不溶于油脂、乙醚;1%水溶液ph值为6.5
‑
10,呈带蓝的红色;耐光、耐酸性弱;耐热性(105℃)、耐氧化性、耐还原性较好。耐碱性、耐食盐性强;遇酸生成沉淀。
[0091]
曙红y:又称四溴荧光黄,它是一种染料及颜料,其分子式为c
20
h6br4na3o5,分子量为714.8434。
[0092]
荧光素:中文别名为荧光素,水溶,cas号为2321
‑
07
‑
5,分子式为c
20
h
12
o5,为橙色粉末,保持容器密封,放入紧密的储藏器内,储存在阴凉,干燥的地方;是一种吸附指示剂。
[0093]
罗丹明6g:是一种水溶性阳离子荧光染料,其水溶液在紫外光照射下发出绿黄色荧光,碱性溶液显暗绿色荧光,乙醇溶液呈现红黄色带绿黄色荧光,被广泛用于荧光标记或定量分析,结构式为:
[0094][0095]
所述的氧化剂选自过氧化氢、叔丁基过氧化氢、二叔丁基过氧化物和氧气中的一种或几种;
[0096]
优选地,所述的氧化剂选自过氧化氢、二叔丁基过氧化物和氧气中的一种或几种;
[0097]
再优选地,所述的氧化剂选自过氧化氢和氧气中的一种或几种;
[0098]
进一步优选地,所述的氧化剂选自过氧化氢。
[0099]
所述的溶剂选自1,2
‑
二氯乙烷、二甲基亚砜、乙腈、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0100]
优选地,所述的溶剂选自1,2
‑
二氯乙烷、乙腈、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0101]
再优选地,所述的溶剂选自1,2
‑
二氯乙烷、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0102]
进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷、二氯甲烷和甲苯中的一种或几种;
[0103]
再进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷和甲苯中的一种或几种;
[0104]
更进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷。
[0105]
其次,本发明还提供了一种中氮茚及其衍生物的制备方法,所述的中氮茚及其衍生物为3位取代中氮茚及其衍生物;
[0106]
所述的方法为:以2
‑
芳基中氮茚原料,以硫氰酸铵作为氰基源,加权利要求 1所述的催化体系,在led灯照射下,制备得到中氮茚。
[0107]
所述的2
‑
芳基中氮茚的结构式为:其中,r1、r2分别独立的选自芳基、烷基或者吸电子基。
[0108]
优选地,所述的r1、r2分别独立的选自芳基、c1
‑
c5烷基或f。
[0109]
所述的3位取代中氮茚为氰基化中氮茚及其衍生物或硫氰基化中氮茚及其衍生物。
[0110]
所述的氰基化中氮茚及其衍生物的结构式为:其中,r1、r2分别独立的选自芳基、烷基或者吸电子基。
[0111]
优选地,所述的r1、r2分别独立的选自芳基、c1
‑
c5烷基或f。
[0112]
所述的氰基化中氮茚及其衍生物的结构式为:其中, r1、r2分别独立的选自芳基、烷基或者吸电子基。
[0113]
优选地,所述的r1、r2分别独立的选自芳基、c1
‑
c5烷基或f
[0114]
所述的2
‑
芳基中氮茚与硫氰酸铵的摩尔比优选为1:0.6
‑
3;优选为1:0.7
‑
2.9;再优选为1:0.8
‑
2.8;进一步优选为1:0.9
‑
2.7;再进一步优选为1:1.0
‑
2.6;更进一步优选为1:1.1
‑
2.5;更进一步优选为1:1.2
‑
2.4;更进一步优选为1:1.3
‑
2.3;更进一步优选为1:1.4
‑
2.2;更进一步优选为1:1.5
‑
2.1;更进一步优选为1:1.6
‑
2.0;更进一步优选为1:1.7
‑
1.9;更进一步优选为1:1.7
‑
1.8。
[0115]
所述的孟加拉玫瑰红与2
‑
芳基中氮茚的摩尔比为0.001
‑
3:1;优选为 0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。
[0116]
所述的曙红y与2
‑
芳基中氮茚摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0117]
所述的荧光素与2
‑
芳基中氮茚摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0118]
所述的罗丹明6g与2
‑
芳基中氮茚的摩尔比为0.001
‑
3:1;优选为 0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0119]
所述的过氧化氢与2
‑
芳基中氮茚的摩尔比优选为0.01
‑
3:1;优选为 0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0120]
所述的叔丁基过氧化氢与2
‑
芳基中氮茚摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0121]
所述的二叔丁基过氧化物与2
‑
芳基中氮茚摩尔比优选为0.01
‑
3:1;优选为 0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0122]
所述的氧气与2
‑
芳基中氮茚摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0123]
所述的led灯照射的条件为:照射功率为10w,照射波长为455nm
±
10nm。
[0124]
另一方面,本发明的目的是提供一种氰基化中氮茚及其衍生物的制备方法,其反应方程式如下式(ⅰ)所示:
[0125][0126]
其中,r1、r2分别独立的选自芳基、烷基或者吸电子基;
[0127]
优选地,所述的r1、r2分别独立的选自芳基、c1
‑
c5烷基或f。
[0128]
所述的反应物1与硫氰酸铵的摩尔比优选为1:0.6
‑
3;优选为1:0.7
‑
2.9;再优选为1:0.8
‑
2.8;进一步优选为1:0.9
‑
2.7;再进一步优选为1:1.0
‑
2.6;更进一步优选为1:1.1
‑
2.5;更进一步优选为1:1.2
‑
2.4;更进一步优选为1:1.3
‑
2.3;更进一步优选为1:1.4
‑
2.2;更进一步优选为1:1.5
‑
2.1;更进一步优选为1:1.6
‑
2.0;更进一步优选为1:1.7
‑
1.9;更进一步优选为1:1.7
‑
1.8。
[0129]
所述的催化剂为孟加拉玫瑰红、曙红y、荧光素和罗丹明6g中的一种或几种;
[0130]
优选地,所述的催化剂为孟加拉玫瑰红、荧光素和罗丹明6g中的一种或几种;
[0131]
再优选地,所述的催化剂为孟加拉玫瑰红和罗丹明6g中的一种或几种;
[0132]
进一步优选地,所述的催化剂为孟加拉玫瑰红。
[0133]
孟加拉玫瑰红:别名为食用色素红色105号,紫色至红褐色颗粒或粉末。易溶于水(30g/100ml)及乙醇,难溶于硬度高的水;溶于甘油、乙二醇;不溶于油脂、乙醚;1%水溶液ph值为6.5
‑
10,呈带蓝的红色;耐光、耐酸性弱;耐热性(105℃)、耐氧化性、耐还原性较好。耐碱性、耐食盐性强;遇酸生成沉淀。
[0134]
曙红y:又称四溴荧光黄,它是一种染料及颜料,其分子式为c
20
h6br4na3o5,分子量为714.8434。
[0135]
荧光素:中文别名为荧光素,水溶,cas号为2321
‑
07
‑
5,分子式为c
20
h
12
o5,为橙色粉末,保持容器密封,放入紧密的储藏器内,储存在阴凉,干燥的地方;是一种吸附指示剂。
[0136]
罗丹明6g:是一种水溶性阳离子荧光染料,其水溶液在紫外光照射下发出绿黄色荧光,碱性溶液显暗绿色荧光,乙醇溶液呈现红黄色带绿黄色荧光,被广泛用于荧光标记或定量分析,结构式为:
[0137][0138]
所述的孟加拉玫瑰红与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0139]
所述的曙红y与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0140]
所述的荧光素与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0141]
所述的罗丹明6g与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0142]
所述的氧化剂选自过氧化氢、叔丁基过氧化氢、二叔丁基过氧化物和氧气中的一种或几种;
[0143]
优选地,所述的氧化剂选自过氧化氢、二叔丁基过氧化物和氧气中的一种或几种;
[0144]
再优选地,所述的氧化剂选自过氧化氢和氧气中的一种或几种;
[0145]
进一步优选地,所述的氧化剂选自过氧化氢。
[0146]
所述的过氧化氢与反应物1的摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0147]
所述的叔丁基过氧化氢与反应物1的摩尔比优选为0.01
‑
3:1;优选为 0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0148]
所述的二叔丁基过氧化物与反应物1的摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0149]
所述的氧气与反应物1的摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0150]
所述的溶剂选自1,2
‑
二氯乙烷、二甲基亚砜、乙腈、n,n
‑
二甲基甲酰胺、二氯甲烷
和甲苯中的一种或几种;
[0151]
优选地,所述的溶剂选自1,2
‑
二氯乙烷、乙腈、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0152]
再优选地,所述的溶剂选自1,2
‑
二氯乙烷、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0153]
进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷、二氯甲烷和甲苯中的一种或几种;
[0154]
再进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷和甲苯中的一种或几种;
[0155]
更进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷。
[0156]
所述的led灯照射的条件为:照射功率为10w,照射波长为455nm
±
10nm。
[0157]
另一方面,本发明的目的是提供一种硫氰基化中氮茚及其衍生物的制备方法,其反应方程式如下式(ⅱ)所示:
[0158][0159]
其中,r1、r2分别独立的选自芳基、烷基或者吸电子基;
[0160]
优选地,所述的r1、r2分别独立的选自芳基、c1
‑
c5烷基或f。
[0161]
所述的反应物1与硫氰酸铵的摩尔比优选为1:0.6
‑
3;优选为1:0.7
‑
2.9;再优选为1:0.8
‑
2.8;进一步优选为1:0.9
‑
2.7;再进一步优选为1:1.0
‑
2.6;更进一步优选为1:1.1
‑
2.5;更进一步优选为1:1.2
‑
2.4;更进一步优选为1:1.3
‑
2.3;更进一步优选为1:1.4
‑
2.2;更进一步优选为1:1.5
‑
2.1;更进一步优选为1:1.6
‑
2.0;更进一步优选为1:1.7
‑
1.9;更进一步优选为1:1.7
‑
1.8。
[0162]
所述的催化剂为孟加拉玫瑰红、曙红y、荧光素和罗丹明6g中的一种或几种;
[0163]
优选地,所述的催化剂为孟加拉玫瑰红、荧光素和罗丹明6g中的一种或几种;
[0164]
再优选地,所述的催化剂为孟加拉玫瑰红和罗丹明6g中的一种或几种;
[0165]
进一步优选地,所述的催化剂为孟加拉玫瑰红。
[0166]
孟加拉玫瑰红:别名为食用色素红色105号,紫色至红褐色颗粒或粉末。易溶于水(30g/100ml)及乙醇,难溶于硬度高的水;溶于甘油、乙二醇;不溶于油脂、乙醚;1%水溶液ph值为6.5
‑
10,呈带蓝的红色;耐光、耐酸性弱;耐热性(105℃)、耐氧化性、耐还原性较好。耐碱性、耐食盐性强;遇酸生成沉淀。
[0167]
曙红y:又称四溴荧光黄,它是一种染料及颜料,其分子式为c
20
h6br4na3o5,分子量为714.8434。
[0168]
荧光素:中文别名为荧光素,水溶,cas号为2321
‑
07
‑
5,分子式为c
20
h
12
o5,为橙色粉末,保持容器密封,放入紧密的储藏器内,储存在阴凉,干燥的地方;是一种吸附指示剂。
[0169]
罗丹明6g:是一种水溶性阳离子荧光染料,其水溶液在紫外光照射下发出绿黄色荧光,碱性溶液显暗绿色荧光,乙醇溶液呈现红黄色带绿黄色荧光,被广泛用于荧光标记或定量分析,结构式为:
[0170][0171]
所述的孟加拉玫瑰红与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0172]
所述的曙红y与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0173]
所述的荧光素与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0174]
所述的罗丹明6g与反应物1的摩尔比为0.001
‑
3:1;优选为0.003
‑
0.25:1;再优选为0.005
‑
0.2:1;进一步优选为0.007
‑
0.15:1;再进一步优选为0.01
‑
0.1。。
[0175]
所述的氧化剂选自过氧化氢、叔丁基过氧化氢、二叔丁基过氧化物和氧气中的一种或几种;
[0176]
优选地,所述的氧化剂选自过氧化氢、二叔丁基过氧化物和氧气中的一种或几种;
[0177]
再优选地,所述的氧化剂选自过氧化氢和氧气中的一种或几种;
[0178]
进一步优选地,所述的氧化剂选自过氧化氢。
[0179]
所述的过氧化氢与反应物1的摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0180]
所述的叔丁基过氧化氢与反应物1的摩尔比优选为0.01
‑
3:1;优选为 0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0181]
所述的二叔丁基过氧化物与反应物1的摩尔比优选为0.01
‑
3:1;优选为 0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0182]
所述的氧气与反应物1的摩尔比优选为0.01
‑
3:1;优选为0.05
‑
2.5:1;再优选为0.1
‑
2.0:1;进一步优选为0.5
‑
1.5:1;再进一步优选为1
‑
1.5:1。
[0183]
所述的溶剂选自1,2
‑
二氯乙烷、二甲基亚砜、乙腈、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0184]
优选地,所述的溶剂选自1,2
‑
二氯乙烷、乙腈、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0185]
再优选地,所述的溶剂选自1,2
‑
二氯乙烷、n,n
‑
二甲基甲酰胺、二氯甲烷和甲苯中的一种或几种;
[0186]
进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷、二氯甲烷和甲苯中的一种或几种;
[0187]
再进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷和甲苯中的一种或几种;
[0188]
更进一步优选地,所述的溶剂选自1,2
‑
二氯乙烷。
[0189]
所述的led灯照射的条件为:照射功率为10w,照射波长为455nm
±
10nm。
[0190]
本发明还提供了上述中氮茚及其衍生物在制备荧光材料中的应用。
[0191]
本发明还提供了上述氰基化中氮茚及其衍生物或硫氰基化中氮茚及其衍生物在制备荧光材料中的应用。
[0192]
本发明制备得到的氰基化中氮茚及其衍生物或硫氰基化中氮茚衍生物在蓝色区域(442
‑
446nm)显示出强烈的荧光发射,最大荧光激发和发射波长 (λex
‑
max和λem
‑
max)几乎没有随溶剂极性的变化而变化(393
‑
398纳米)。
[0193]
与现有技术相比,本发明的有益效果在于:
[0194]
本发明技术方案制备氰基化/硫氰基化中氮茚的方法,操作简单,不含金属参与,反应底物适用范围广,区域选择性好,收率高,可绿色高效的合成一系列氰基化/硫氰基化中氮茚,在农用化学品、药物制备和荧光材料方面具有广阔的应用前景。
附图说明
[0195]
图1为本发明实施例1制备的化合物的氢谱图;
[0196]
图2为本发明实施例1制备的化合物的碳谱图;
[0197]
图3为本发明实施例2制备的化合物的氢谱图;
[0198]
图4为本发明实施例2制备的化合物的碳谱图;
[0199]
图5为本发明实施例3制备的化合物的氢谱图;
[0200]
图6为本发明实施例3制备的化合物的碳谱图;
[0201]
图7为本发明实施例4制备的化合物的氢谱图;
[0202]
图8为本发明实施例4制备的化合物的碳谱图;
[0203]
图9为本发明实施例5制备的化合物的氢谱图;
[0204]
图10为本发明实施例5制备的化合物的碳谱图;
[0205]
图11为本发明实施例6制备的化合物的氢谱图;
[0206]
图12为本发明实施例6制备的化合物的碳谱图;
[0207]
图13为本发明实施例7制备的化合物的氢谱图;
[0208]
图14为本发明实施例7制备的化合物的碳谱图;
[0209]
图15为本发明实施例8制备的化合物的氢谱图;
[0210]
图16为本发明实施例8制备的化合物的碳谱图;
[0211]
图17本发明实施例2制备的化合物的激发光谱;
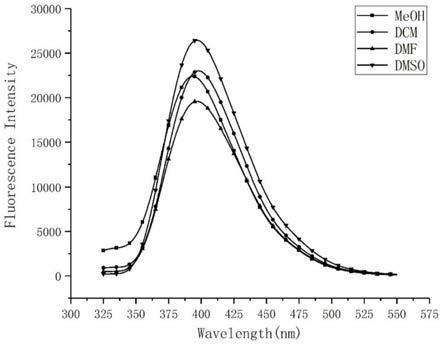
[0212]
图18本发明实施例2化合物的发射光谱。
具体实施方式
[0213]
本发明中提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所解释的所有特征可与任意方法形式并用,说明书中揭示的各个特征,可被任何可提供相同、均等或相似目的的取代性特征取代。因此除有特殊说明,所揭示的特征仅为均等或相似特征的一般性例子。
[0214]
下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中为注明具体条件的实施方法,通常按照常规条件或按照制造厂商所建议的条件。除非特殊说明,否则所有的百分比和分数按重量计。
[0215]
除非另行定义,文中所使用的所有专业与科学用语与本领域技术人员所熟知的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的优选实施方法与材料仅做示范作用。
[0216]
本发明涉及的硫氰酸铵、过氧化氢、孟加拉玫瑰红等基础原料均可以通过商业途径购得。
[0217]
实施例1:
[0218]
将19.3mg(0.1mmol)2
‑
苯基中氮茚、1.1mg
‑
10.2mg(0.001mmol
‑
0.01mmol) 孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1 mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,76%产率。
[0219][0220]
1h nmr(400mhz,chloroform
‑
d)δ8.27(d,j=6.9hz,1h),7.81(d,j=7.7 hz,2h),7.51
–
7.44(m,3h),7.39(t,j=7.4hz,1h),7.06
–
6.98(m,1h),6.81(t,j =6.8hz,1h),6.68(s,1h).
[0221]
13c nmr(101mhz,chloroform
‑
d)δ137.5,136.6,132.4,128.96,128.4,127.4, 125.2,122.5,119.2,114.8,113.1,99.7,92.5.
[0222]
hr
‑
esi
‑
ms m/z calcd.for c15h10n2[m+h]+:219.0922,found:219.0922.
[0223]
实施例2:
[0224]
将18.3mg(0.1mmol)2
‑
呋喃基中氮茚、1.1mg
‑
10.2mg(0.001mmol
‑
0.01mmol) 孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1 mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,64%产率。
[0225][0226]
1h nmr(400mhz,chloroform
‑
d)δ8.21(d,j=6.9hz,1h),7.52(d,j=1.5 hz,1h),7.45(d,j=9.0hz,1h),7.04
–
6.97(m,1h),6.92(d,j=3.4hz,1h),6.79 (t,j=6.8hz,1h),6.68(s,1h),6.52(dd,j=3.3,1.8hz,1h).
[0227]
13c nmr(101mhz,chloroform
‑
d)δ147.3,142.6,136.6,127.8,125.2,122.6, 119.2,114.2,113.2,111.8,108.1,97.5,91.0.
[0228]
hr
‑
esi
‑
ms m/z calcd.for c13h8n2o[m+h]+:209.0719,found:209.0715.
[0229]
实施例3:
[0230]
将27.1mg(0.1mmol)2
‑
(4
‑
溴苯基)中氮茚、1.1mg
‑
10.2mg (0.001mmol
‑
0.01mmol)孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,63%产率。
[0231]
[0232]
1h nmr(400mhz,chloroform
‑
d)δ8.28(d,j=6.9hz,1h),7.68(d,j=8.2 hz,2h),7.60(d,j=8.4hz,2h),7.50(d,j=8.9hz,1h),7.07
–
7.01(m,1h),6.85 (t,j=6.8hz,1h),6.66(s,1h).
[0233]
13c nmr(101mhz,chloroform
‑
d)δ136.7,136.3,132.2,131.5,129.0,125.4, 122.8,122.6,119.3,113.4,99.7.
[0234]
hr
‑
esi
‑
ms m/z calcd.for c15h9brn2[m+h]+:297.0029,found:297.0027.
[0235]
实施例4:
[0236]
将20.7mg(0.1mmol)7
‑
甲基
‑2‑
苯基中氮茚、1.1mg
‑
10.2mg (0.001mmol
‑
0.01mmol)孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,70%产率。
[0237][0238]
1h nmr(400mhz,chloroform
‑
d)δ8.17(d,j=6.8hz,1h),7.83(d,j=8.3 hz,2h),7.48(t,j=7.3hz,2h),7.39(t,j=6.8hz,1h),6.83(d,j=6.8hz,1h), 6.76(t,j=6.8hz,1h),6.67(s,1h),2.48(s,3h).
[0239]
13c nmr(101mhz,chloroform
‑
d)δ137.5,137.1,132.6,129.0,128.6,128.3, 127.4,123.1,121.7,115.0,113.2,98.3,92.9,18.0.
[0240]
hr
‑
esi
‑
ms m/z calcd.for c16h12n2[m+h]+:233.1079,found:233.1079.
[0241]
实施例5:
[0242]
将19.3mg(0.1mmol)2
‑
苯基中氮茚、1.1mg
‑
10.2mg(0.001mmol
‑
0.01mmol) 孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1 mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,77%产率。
[0243][0244]
1h nmr(400mhz,chloroform
‑
d)δ8.42(d,j=7.0hz,1h),7.75
–
7.66(m, 2h),7.51(t,j=7.5hz,3h),7.43(t,j=7.4hz,1h),7.07
–
7.00(m,1h),6.87(t,j= 6.9hz,1h),6.73(s,1h).
[0245]
13c nmr(101mhz,chloroform
‑
d)δ138.4,137.4,133.7,129.2,128.6,127.9, 123.8,121.4,119.2,112.6,109.4,101.8,92.1.
[0246]
hr
‑
esi
‑
ms m/z calcd.for c15h10n2s[m+h]+:251.0637,found:251.0643.
[0247]
实施例6:
[0248]
将18.3mg(0.1mmol)2
‑
呋喃基中氮茚、1.1mg
‑
10.2mg(0.001mmol
‑
0.01mmol) 孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1 mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,71%产率。
[0249][0250]
1h nmr(400mhz,chloroform
‑
d)δ8.36(d,j=7.0hz,1h),7.56(d,j=1.7 hz,1h),7.45(d,j=8.9hz,1h),7.03
–
6.95(m,2h),6.88
–
6.80(m,2h),6.56(dd, j=3.4,1.8hz,1h).
[0251]
13c nmr(101mhz,chloroform
‑
d)δ148.0,142.5,137.5,128.0,123.6, 121.5,119.2,112.7,111.7,108.6,108.5,99.3,90.0.
[0252]
hr
‑
esi
‑
ms m/z calcd.for c13h8n2os[m+h]+:241.0438,found:241.0436.
[0253]
实施例7:
[0254]
将20.7mg(0.1mmol)2
‑
(对甲苯基)中氮茚、1.1mg
‑
10.2mg (0.001mmol
‑
0.01mmol)孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,73%产率。
[0255][0256]
1h nmr(400mhz,chloroform
‑
d)8.41(d,j=7.0hz,1h),7.61
–
7.49(m, 2h),7.46
–
7.38(m,1h),7.29(t,j=7.5hz,1h),7.25
–
7.18(m,1h),7.08
–
7.01(m, 1h),6.90(t,j=7.4hz,1h),6.75(s,1h).
[0257]
13c nmr(101mhz,chloroform
‑
d)δ159.8(q,j=246.0hz),137.27,132.15, 132.0(q,j=3.0hz),129.9(q,j=8.0hz),124.2(q,j=3.0hz),123.78,121.6(q,j= 15.0hz),121.28,119.36,116.0(q,j=22.0hz),112.85,109.02,103.1(q,j=3.0hz), 93.72.
[0258]
hr
‑
esi
‑
ms m/z calcd.for c15h9fn2s[m+h]+:237.0818,found:237.0828.
[0259]
实施例8:
[0260]
将21.1mg(0.1mmol)2
‑
(2
‑
氟苯基)中氮茚、1.1mg
‑
10.2mg (0.001mmol
‑
0.01mmol)孟加拉玫瑰红、4.6mg
‑
22.8mg(0.06mmol
‑
0.3mmol)硫氰酸铵置于25ml带有搅拌子的试管中,于室温加入1ml1,2
‑
二氯乙烷后,再分别加入3.4mg
‑
5.1mg(0.1mmol
‑
0.15mmol)过氧化氢,在蓝光照射下搅拌6小时,旋干后快速柱层析得到目标产物,69%产率。
[0261][0262]
1h nmr(400mhz,chloroform
‑
d)δ8.41(d,j=7.0hz,1h),7.61
–
7.49(m, 2h),7.46
–
7.38(m,1h),7.29(t,j=7.5hz,1h),7.25
–
7.18(m,1h),7.08
–
7.01(m, 1h),6.90(t,j=7.4hz,1h),6.75(s,1h).
[0263]
13c nmr(101mhz,chloroform
‑
d)δ159.8(q,j=246.0hz),137.27,132.15, 132.0(q,j=3.0hz),129.9(q,j=8.0hz),124.2(q,j=3.0hz),123.78,121.6(q,j= 15.0hz),121.28,119.36,116.0(q,j=22.0hz),112.85,109.02,103.1(q,j=3.0hz), 93.72.
[0264]
hr
‑
esi
‑
ms m/z calcd.for c15h9fn2s[m+h]+:237.0818,found:237.082。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1