一种CHO细胞表达的重组新型冠状病毒NCP-RBD蛋白的制备方法及其应用与流程
fusion培养基。
14.优选地,所述的细胞扩增培养的具体过程如下:将细胞复苏培养物,转接至新鲜的 无血清培养基中,初始密度不低于3.0
×
105个/ml,置于37
±
1℃,5
±
1%co2,100~150rpm 条件下悬浮培养2~4天,如此进行2~5次传代扩增培养,得到细胞扩增培养物;其中, 所述的无血清培养基为ex
‑
cell cd cho fusion培养基。
15.优选地,所述的罐培养的具体过程如下:
16.将检定合格的细胞扩增培养物,转接至新鲜的无血清培养基中,进行罐培养,初始 密度不低于3.0
×
105个/ml,置于生长温度36.5
±
1℃,溶氧不低于45%,ph值不低于6.5 条件下进行罐培养;
17.当培养3~4天时,开始补加补料培养基,补加体积为初始体积的10
±
1%,每次补料 间隔1~2天;当培养4~5天时,开始补糖,使培养期间葡萄糖浓度不低于1g/l;
18.罐培养时间达到7~13天且细胞活率为90
±
10%时,进行收获,得到细胞收获液,作 为生产收获物;
19.其中,所述的无血清培养基为ex
‑
cell
‑
advanced cho基础培养基;
20.所述的补料培养基为ex
‑
celladvanced cho feed 1补料培养基;
21.检定合格的细胞扩增培养物为细胞密度不小于1.0
×
106个/ml且细胞活率不低于 90%的细胞扩增培养物。
22.优选地,所述的纯化包括如下步骤:
23.澄清过滤:对细胞收获液进行离心、过滤,得到ncp
‑
rbd澄清液;
24.超滤浓缩:对澄清过滤得到的ncp
‑
rbd澄清液进行浓缩和超滤,得到浓缩液;
25.离子交换层析:对浓缩液进行离子交换层析处理,得到纯化液;
26.灭活:对纯化液进行灭活,得到灭活液;
27.过滤病毒和细菌:对灭活液进行过滤除去病毒和细菌,得到所需产物。
28.优选地,所述的澄清过滤的具体过程如下:采用低速离心及深层过滤进行细胞收获 澄清液,获得ncp
‑
rbd澄清液;
29.其中,低速离心的条件为200~1000g,5~20min;
30.深层过滤采用supracap 100囊式滤器,标称精度为0.5~15μm,缓冲液为10~30mmpb缓冲液。
31.优选地,所述的超滤浓缩的具体过程如下:
32.采用10~50kda超滤膜包对ncp
‑
rbd澄清液进行浓缩和超滤,浓缩倍数为2~10倍, 超滤缓冲液为10~30mm pb缓冲液,洗滤倍数为2~10倍,获得浓缩液。
33.优选地,所述的离子交换层析包括以下步骤:
34.阴离子交换层析:将浓缩液经过阴离子交换层析柱,使其与阴离子交换填料相互作 用后以流穿模式收集流穿液,即为第一步柱纯化液;
35.阳离子交换层析:将第一步柱纯化液再次经过阳离子交换层析柱,使其与阳离子交 换填料相互作用后洗脱,收集目的蛋白洗脱液,即为第二步柱纯化液。
36.优选地,所述的阴离子交换层析中阴离子交换填料为带有
‑
ch2n+(ch3)3季铵基功能 基团的阴离子交换填料;
37.所述的阴离子交换层析具体包括以下步骤:
38.用10~30mm pb缓冲液平衡层析柱至基线平稳;
39.将浓缩液经过阴离子交换层析柱,使其与阴离子交换填料相互作用,并收集流穿液, 即为第一步柱纯化液。
40.优选地,所述的阳离子交换层析中阳离子交换填料为带有
‑
ch2ch2chso3黄丙基功 能基团的阳离子交换填料;
41.所述的阳离子交换层析具体包括以下步骤:
42.用10~30mm pb缓冲液平衡层析柱至基线平稳;
43.将第一步柱纯化液经过阳离子交换层析柱,使其与阳离子交换填料相互作用;
44.上样结束后,用10~30mm pb缓冲液平衡缓冲液再次平衡层析柱至基线平稳;
45.使用含nacl的10~30mm pb缓冲液洗脱,收集目的蛋白洗脱液,即为第二步柱纯 化液,其中,nacl的浓度不低于0.1m。
46.优选地,所述的灭活的具体过程如下:将第二步柱纯化液稀释至蛋白质含量为 400~800μg/ml时,用磷酸溶液将其ph值调节至3~4,混匀后,置于15~26℃,灭活2~4h; 用naoh溶液回调ph值至6~8,即得灭活液。
47.优选地,所述的过滤病毒和细菌的具体过程如下:将灭活液依次进行经过sv4除病 毒过滤器去除病毒和supor ekv膜acropak20过滤器过滤除菌。
48.本发明的目的之二是:提供一种cho细胞表达的重组新型冠状病毒ncp
‑
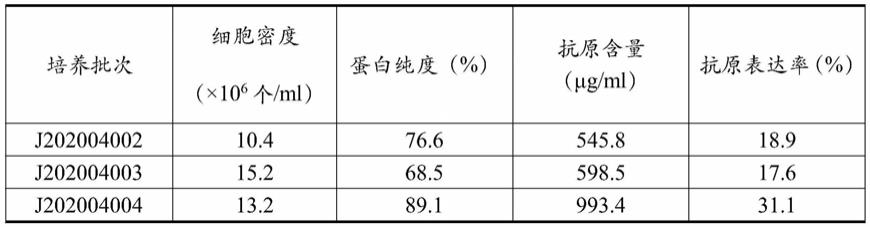
rbd蛋 白,所述的蛋白采用上述方法制备而成。
49.本发明的目的之三是:提供一种cho细胞表达的重组新型冠状病毒ncp
‑
rbd蛋 白的应用,用于制备新冠疫苗。
50.本发明的有益效果在于:
51.采用本发明所述方法,可以将cho细胞表达的重组新型冠状病毒ncp
‑
rbd蛋白 高效的分离和纯化,适用于规模化生产,同时能有效地用于生产新冠疫苗。
附图说明
52.图1重组新型冠状病毒蛋白填料筛选q柱层析样品纯度(电泳法)检测图谱, m:marker26616;其中,每条电泳条带代表柱层析步骤中的每步收集的样品,具体含义 如下:1.q流穿;2.q
‑
0.2m nacl
‑
1;3.q
‑
0.2m nacl
‑
2;4.q
‑
0.2m nacl
‑
3;5.q
‑
0.2m nacl
‑
4; 6.q
‑
0.4m nacl;
53.图2重组新型冠状病毒蛋白填料筛选deae柱层析样品纯度(电泳法)检测图谱, m:marker26616;其中,每条电泳条带代表柱层析步骤中的每步收集的样品,具体含义 如下:1.deae流穿;2.deae
‑
0.2m nacl
‑
1;3.deae
‑
0.2m nacl
‑
2;4.deae
‑
0.2mnacl
‑
3。
54.图3重组新型冠状病毒蛋白填料筛选cm柱层析样品纯度(电泳法)检测图谱, m:marker26616;其中,每条电泳条带代表柱层析步骤中的每步收集的样品,具体含义 如下:1.澄清液;2.cm流穿。
55.图4重组新型冠状病毒蛋白填料筛选poros柱层析样品纯度(电泳法)检测图谱, m:marker26616;其中,每条电泳条带代表柱层析步骤中的每步收集的样品,具体含义 如下:1.q原液;2.poros流穿1;3.poros流穿2;4.poros流穿3;5.poros流 穿4;6.poros
‑
0.5mnacl;7.poros
‑
0.5m naoh。
56.图5重组新型冠状病毒蛋白灭活工艺实验样品纯度(电泳法)检测图谱,m:marker26616;1.空白对照;2.β
‑
丙内酯灭活(24h)对照组;3.β
‑
丙内酯灭活(24h)实验组;4.低ph灭活(4h)对照组;5.低ph灭活(4h)实验组;6.甲醛灭活(24h)对照组;7.甲醛灭活(24h)实验组。
57.图6重组新型冠状病毒蛋白纯化中间品纯度(电泳法)检测图谱,m:marker26616;
58.1.澄清液,纯度96.3%;2.浓缩液,纯度85.7%;3.第一步柱纯化液,纯度95.8%;4.第二步柱纯化液,纯度97.8%。
59.图7重组新型冠状病毒蛋白纯化终产物高效液相(分子排阻法)检测图谱。
60.图8重组新型冠状病毒蛋白纯化终产物高效液相(反相色谱法)检测图谱。
61.图9重组新型冠状病毒ncp
‑
rbd蛋白罐培养细胞密度和抗原表达曲线。
具体实施方式
62.以下实施例进一步详细地描述本发明。然而应当理解,列举这些实施例、只是为了起说明作用,而并不是用来限制本发明。
63.实施例1:重组新型冠状病毒蛋白ncp
‑
rbd在5l生物反应器中的规模化培养
64.本重组蛋白规模化培养生产工艺分为两部分,细胞复苏与扩增培养和罐培养,细胞复苏与扩增培养采用ex
‑
cellcdchofusion培养基,罐培养采用ex
‑
cell
‑
advancedchofed
‑
batch基础培养基作为起始培养,ex
‑
cell
‑
advancedchofeed1补料培养基进行流加培养增加重组蛋白表达,工艺参数具体如下:
65.(1)细胞复苏
66.从液氮罐中取工作细胞株(细胞株为表达重组新型冠状病毒ncp
‑
rbd蛋白的重组cho细胞株,购买于北京智仁美博生物科技有限公司,购买的细胞株可以直接用于下面的操作,作为优选地方案,将购买的细胞株进行三级细胞库的建立后在进行下面的操作),按初始密度不低于3.0
×
105个/ml接种至ex
‑
cellcdchofusion培养基中,置于37
±
1℃,5
±
1%co2,100~150rpm条件下培养2~4天,作为细胞复苏培养物。
67.(2)细胞扩增培养
68.将细胞复苏培养物,按初始密度不低于3.0
×
105个/ml接种至ex
‑
cellcdchofusion培养基中,置于37
±
1℃,5
±
1%co2,100~150rpm条件下培养2~4天,如此进行2~5次传代扩增培养,作为细胞扩增培养物。
69.(3)罐培养
70.将检定合格的细胞扩增培养物(检定合格的细胞扩增培养物为细胞密度不小于1.0
×
106个/ml且细胞活率不低于90%的细胞扩增培养物。),接种至生物反应器中进行罐培养,初始密度不低于3.0
×
105个/ml,采用ex
‑
cell
‑
advancedcho基础培养基作为罐培养起始培养基,起始工作体积3l,设定温度36.5
±
1℃,转速不高于350rpm,ph不低于6.5,控制溶氧不低于45%:当培养3~4天时,开始流加补充ex
‑
celladvancedchofeed1补料培养基,补料量占比起始工作体积10
±
1%,每次补料间隔1~2天;当培养4~5天时,开始补糖,通过补加葡萄糖控制培养液中葡萄糖含量≥1g/l。当培养时间达到7~13天且细胞活率为90
±
10%时,下罐,得到细胞收获液,即为生产收获物。
71.(4)在培养过程中每天取样检测细胞密度、抗原含量和蛋白纯度,发现细胞密度、
抗原含量、和抗原纯度均随着培养的天数增加而增加,在培养至7天时细胞密度达到 1.0
×
107个/ml以上,抗原含量达到600μg/ml以上,抗原纯度达到71.7%,结果见图9。
72.实施例2:三批连续规模化培养表达重组新型冠状病毒蛋白ncp
‑
rbd
73.(1)通过实例1的方法进行连续三批罐培养,验证重组新型冠状病毒蛋白ncp
‑
rbd 的中试规模化培养工艺。
74.(2)在培养过程中每天取样检测细胞密度、抗原含量和蛋白纯度,发现细胞密度、 抗原含量、和抗原纯度均随着培养的天数增加而增加,在培养至8天时细胞密度达到 1.0
×
107个/ml以上,抗原含量均达到500μg/ml以上,最终产物的抗原纯度(蛋白纯度) 均达到50%以上,具体结果见如下表1。
75.表1连续三批罐培养所得产物中细胞密度和抗原含量测定
[0076][0077]
实施例3:重组新型冠状病毒蛋白ncp
‑
rbd的纯化工艺
[0078]
采用实施例1生产的表达重组新型冠状病毒蛋白ncp
‑
rbd的生产收获物(细胞收 获液),用于重组蛋白的分离纯化,具体步骤如下:
[0079]
(1)澄清过滤,采用低速离心及深层过滤进行细胞收获澄清液,获得ncp
‑
rbd 澄清液。
[0080]
1)低速离心200~1000g,5~20min,优先选择220g,10min;
[0081]
2)深层过滤滤器为supracap 100囊式滤器,标称精度为0.5~15μm;
[0082]
3)膜包清洗:用纯化水清洗5~10个膜体积,再用10~30mm pb缓冲液(ph6.0~7.0) 润洗1~5个膜体积;
[0083]
4)离心后上清液用深层过滤囊式滤器进行过滤;过滤后用10~30mm pb缓冲液 (ph6.0~7.0)顶洗至少1个膜体积,即为澄清液。
[0084]
(2)超滤浓缩:采用超滤膜包对澄清液进行浓缩和洗滤,获得浓缩液。
[0085]
1)超滤膜包为10kd~50kd超滤膜包(pellicon 2mini cassette);
[0086]
2)膜包清洗:用纯化水清洗5~10个膜体积,再用0.5mnaoh清洗1~5个膜体积, 循环至少30min;最后用纯化水清洗5~10个膜体积;
[0087]
3)膜包润洗:用10~30mm pb缓冲液(ph6.0~7.0)润洗1~5个膜体积;
[0088]
4)澄清液用10kd~50kd超滤膜包浓缩2~10倍;浓缩后样品用10~30mm pb缓冲 液(ph6.0~7.0)洗滤2~10倍,即为浓缩液。
[0089]
(3)阴离子柱层析
[0090]
1)层析填料名称:选用带有
‑
ch2n+(ch3)3季铵基功能基团的阴离子交换填料,如 q sephorase hp、q betarose hp等;
[0091]
2)柱平衡:用10~30mm pb缓冲液(ph6.0~7.0)平衡8~15个柱体积;
[0092]
3)上样:将浓缩液直接上样,uv
280
达到100~300mau开始收集流穿峰;
[0093]
4)复平衡:上样结束后用10~30mm pb缓冲液(ph6.0~7.0)复平衡5~10个柱体 积,uv280下降至100~300mau停止收集流穿峰;
[0094]
5)浓缩液经阴离子柱层析,杂蛋白与填料结合,目的蛋白以流穿模式收集,电泳 检测纯度图谱见图6,第一步柱纯化液纯度达到70%以上。
[0095]
(4)阳离子柱层析
[0096]
1)层析填料名称:采用带有
‑
ch2ch2chso3黄丙基功能基团的阳离子交换填料, 如poros 50hs、diamond spmustang;
[0097]
2)柱平衡:用10~30mm pb缓冲液(ph6.0~7.0)平衡5~10个柱体积;
[0098]
3)上样:将第一步柱纯化液直接上样;
[0099]
4)复平衡:上样结束后用10~30mm pb缓冲液(ph6.0~7.0)复平衡5~10个柱体 积;
[0100]
5)洗脱:用含不低于0.1m nacl的10~30mm pb缓冲液(ph6.0~7.0)洗脱,uv
280
达到100~300mau开始收集洗脱峰,至uv280下降至100~300mau停止收峰;
[0101]
6)q流穿经阳离子柱层析,目的蛋白以洗脱模式收集,电泳检测纯度图谱见图6, 第二步柱纯化液纯度达到95%以上。
[0102]
(5)灭活,采用低ph法对第二步柱纯化液稀释液进行病毒灭活。
[0103]
1)稀释:向第二步柱纯化液加入适量的10~30mm pb缓冲液(ph6.0~7.0)稀释至 蛋白质含量400~800μg/ml;
[0104]
2)灭活:用磷酸溶液将稀释后的蛋白溶液ph值调节至3~4,混匀后,置于15~26℃, 灭活2~4h;用naoh溶液回调ph值至6~8,即为灭活液;
[0105]
(6)纳滤去除病毒和除菌过滤,将灭活液依次进行纳滤去除病毒和0.2μm滤膜过 滤除菌。
[0106]
1)除病毒预过滤滤器为fluorodyne ii filter,纳滤滤器为sv4除病毒过滤器,滤器 供应商:pall
[0107]
2)滤膜清洗:无菌水冲洗5~10个膜体积;
[0108]
3)滤膜润洗:用10~30mm pb缓冲液(ph6.0~7.0)润洗1~5个膜体积;
[0109]
4)纳滤除病毒:灭活液通过纳滤去除病毒。
[0110]
5)除菌过滤滤器为supor ekv膜acropak20过滤器,滤器供应商:pall;
[0111]
6)除菌过滤:纳滤除病毒后样品经0.2μm过滤器除菌,即为原液。
[0112]
最终,4l细胞收获液可获得蛋白达到1062mg,纯化终产物经高效液相色谱法(分 子排阻色谱法和反相色谱法)检测,纯度均为100%,检测图谱分别见图7和图8;各 步骤关键中间品的蛋白回收率和抗原回收率见如下表2,最终纯化的蛋白回收率为 13.0%,抗原回收率为44.2%。
[0113]
表2纯化过程关键步骤蛋白回收率及抗原回收率
[0114]
中间品名称蛋白回收率(%)抗原回收率(%)澄清液//浓缩液22.160.5第一步柱纯化液16.960.1第二步柱纯化液13.640.8
原液13.044.2
[0115]
本实施例得到的cho细胞表达的重组新型冠状病毒ncp
‑
rbd蛋白可以用于制备 新冠疫苗,优选地,选择本发明的纯化后得到的重组新型冠状病毒ncp
‑
rbd蛋白,加 入氢氧化铝佐剂制成新冠疫苗,新冠疫苗中蛋白浓度为50μg/ml。
[0116]
实施例4:三批连续中试规模纯化重组新型冠状病毒蛋白ncp
‑
rbd
[0117]
(1)通过实例3的纯化方法进行连续三批中试规模纯化,验证重组新型冠状病毒 蛋白ncp
‑
rbd的中试规模纯化工艺。
[0118]
(2)在纯化过程中,对关键步骤的中间品,即澄清液、浓缩液、第一步柱纯化液、 第二步柱纯化液取样检测蛋白质含量、抗原含量和蛋白纯度,以考察关键工艺参数控制 范围的合理性以及纯化过程中杂质去除的有效性。
[0119]
3批次关键步骤的中间品和原液采用电泳法检测抗原纯度,澄清液、浓缩液、第一 步柱纯化液、第二步柱纯化液和原液的纯度分别大于50%、60%、70%、95%和95%, 最终纯化的蛋白回收率可以达到10%以上,抗原回收率可达到30%以上,结果见如下表 3。说明每步纯化步骤均能提高蛋白的纯度,并可以获得较高的蛋白或抗原回收率,故 原液制备过程中的纯化工艺各关键步骤相关参数的设置是合理的,生产工艺可以保证抗 原纯度和回收率符合要求,结果的重现性良好,工艺稳定、可控。
[0120]
表3连续三批纯化中间品的纯度和回收率检测结果
[0121][0122]
一、重组新型冠状病毒蛋白ncp
‑
rbd的柱层析工艺填料对比实验
[0123]
根据重组新型冠状病毒ncp
‑
rbd蛋白性质,以及不同层析填料的特性,分别选用 强阳离子交换树脂(poros 50hs)、弱阳离子交换树脂(cm sepharose ff)、强阴离 子交换
树脂(q sepharose hp)、弱阴离子交换树脂(deae sepharose ff)等填料进行对 比实验。
[0124]
对比例1:q柱层析
[0125]
采用q sepharose hp填料,使用10~30mm pb缓冲液(ph7.0~8.0)平衡填料;取 实施例1制得的细胞收获液,经澄清获得澄清液,上样4个柱体积,若流穿出峰,则收 集流穿峰,并取样;用含不同nacl浓度(0.2m~1.0m)的10~30mm pb缓冲液(ph7.0~8.0) 洗脱,收集洗脱峰后混匀取样;q柱层析样品电泳检测结果见图1,上样ph8.0时,均 以流穿模式捕获目的抗原,大分子杂蛋白与填料结合后被去除。
[0126]
对比例2:deae柱层析
[0127]
采用deae sepharose ff填料,使用10~30mm pb缓冲液(ph7.0~8.0)平衡填料; 取实施例1制得的细胞收获液,经澄清获得澄清液,上样4个柱体积,若流穿出峰,则 收集流穿峰,并混匀取样;用含不同nacl浓度(0.2m~1.0m)的10~30mm pb(ph7.0~8.0) 缓冲液洗脱,收集洗脱峰后混匀取样;deae柱层析样品电泳检测结果见图2,由于小 部分抗原与deae sepharose ff填料结合,洗脱中含有目的抗原,造成抗原损失。
[0128]
对比例3:cm柱层析
[0129]
采用cm sepharose ff填料,使用10~30mm pb缓冲液(ph7.0~8.0)平衡填料;取 实施例1制得的细胞收获液,经澄清获得澄清液,上样4个柱体积,若流穿出峰,则收 集流穿峰,并取样;用含不同nacl浓度(0.2m~1.0m)的10~30mm pb缓冲液(ph7.0~8.0) 洗脱,收集洗脱峰后取样;cm柱层析样品电泳检测结果见图3,上样ph7.0时,采用 cm sepharose ff层析,目的抗原和大分子杂蛋白均以流穿模式被收集,无法提高目的 抗原纯度,同时也未达到去除杂质的目的。
[0130]
对比例4:poros柱层析
[0131]
采用poros 50hs填料,使用10~30mm pb缓冲液(ph7.0~8.0)平衡填料;取实 施例1制得的细胞收获液,经澄清获得澄清液,上样15~25个柱体积,调ph值至7.0 上样,若流穿出峰,则收集流穿峰,并取样;用含0.5m nacl的10~30mm pb缓冲液 (ph7.0~8.0)洗脱,收集洗脱峰后混匀取样;poros柱层析样品电泳检测结果见图4, poros流穿中无目的抗原,因此目的抗原几乎全部与poros 50hs填料结合,用含0.5mnacl的10~30mm pb缓冲液(ph7.0~8.0)进行洗脱,经电泳检测,抗原可以被洗脱液 完全洗脱。
[0132]
根据对比例1、2、3、4可以看出:选择q sepharose hp作为阴离子交换层析填料, poros 50hs作为阳离子交换层析填料,其中q sepharose hp层析以流穿方式捕获目的 抗原;poros 50hs层析,以洗脱模式捕获目的抗原。
[0133]
二、重组新型冠状病毒蛋白ncp
‑
rbd的灭活工艺对比实验
[0134]
参照《中国药典》(现行版),对目前病毒类疫苗现有的三种灭活工艺β
‑
丙内酯灭 活、低ph灭活、甲醛灭活进行研究,取样进行抗原纯度、抗原含量检测,通过比较对 照组和实验组抗原纯度和抗原比活的差异,进而分析灭活工艺对抗原是否存在影响,从 而选择对抗原影响最小的灭活方式。
[0135]
按照下表4的灭活工艺取第二步柱纯化液稀释液分别进行β
‑
丙内酯灭活、低ph灭 活以及甲醛灭活三种灭活方式。
[0136]
(1)β
‑
丙内酯灭活工艺:取第二步柱纯化液稀释液,按照1:4000的比例加入β
‑
丙 内酯,2~8℃灭活24h,37℃水解2h;另设不加β
‑
丙内酯作为对照组,2~8℃灭活24h, 37℃
水解2h。
[0137]
(2)低ph灭活工艺:取第二步柱纯化液稀释液,调节ph至3.5,室温放置4h后 调ph7.0;另设不调节ph作为对照组,室温放置4h。
[0138]
(3)甲醛灭活工艺:取第二步柱纯化液稀释液,加入终浓度为100μg/ml的甲醛, 37℃放置24h;另设不加甲醛作为对照组,37℃放置24h。
[0139]
表4灭活工艺对比表
[0140][0141]
表5灭活工艺研究抗原纯度及抗原比活检测结果
[0142]
序号样品名称纯度(hplc)抗原比活1空白对照组100.0%1.182β
‑
丙内酯灭活(24h)对照组100.0%1.183β
‑
丙内酯灭活(24h)实验组100.0%1.054低ph灭活(4h)对照组100.0%1.215低ph灭活(4h)实验组100.0%1.186甲醛灭活(24h)对照组//7甲醛灭活(24h)实验组//
[0143]
甲醛37℃灭活24h后,电泳检测对照组出现降解带,电泳结果见图5,因此排除甲 醛灭活的方法。β
‑
丙内酯灭活和低ph灭活,实验组电泳检测均未出现降解带,且纯度 检测均为100%,抗原比活均与灭活前基本一致(如上表5所示);但两种方法相比, 低ph法安全性较高,操作方便,无其他物质残留,且该方法在目前抗体制备中应用广 泛;因此,选择低ph灭活的方法作为重组新型冠状病毒疫苗(cho细胞)原液灭活工 艺,β
‑
丙内酯灭活作为备选方法。
[0144]
尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理 解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征 进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例 技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1