化合物、中间体及其制备方法与有机电致发光器件、显示装置与流程
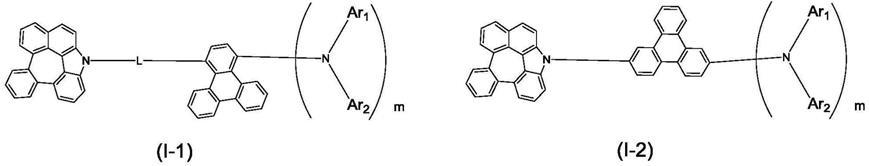
1.本技术涉及电致发光领域,特别涉及化合物、中间体及其制备方法与有机电致发光器件、显示装置。
背景技术:
2.当前,有机电致发光(oled)显示技术已经在智能手机,平板电脑等领域获得应用,进一步还将向电视等大尺寸应用领域扩展。在近30年的发展过程中,人们研制出了各种性能优良的oled材料,并通过对器件结构的不同设计,和对器件寿命、效率等性能的优化,加快了oled的商业化进程,使得oled在显示和照明领域得到了广泛应用。
3.然而,由于oled的外量子效率和内量子效率之间存在巨大差距,极大地制约了oled的发展,其中最主要的因素之一就是器件的效率仍未达到理想水平。这是由于基板的模式损失、表面等离子的损失以及波导效应,使大部分的光被限制在发光器件内部,从而降低了器件的发光效率。改善器件的发光效率,利用光取出材料是行之有效的方法之一。光取出层(capping layer,cpl)通过降低金属电极的表面等离子体效应,调节出光方向和出光效率,能够有效提高器件的光取出效率,从而提高器件的发光效率。目前光取出材料的种类较为单一,效果不尽理想,研发出较为有效的光取出材料是oled工作者们面临的较为严峻的挑战之一。
4.除此之外,发光层以及其他有机功能层材料的选择也对器件的电流效率以及驱动电压产生较大的影响,目前仍在探索具有更高性能的功能层材料。
5.因此,为了满足人们对于oled器件的更高要求,本领域亟待开发更多种类、更高性能的oled材料。
技术实现要素:
6.本技术公开了化合物、中间体及其制备方法与有机电致发光器件、显示装置,使用本技术化合物的材料得到的有机电致发光器件具有较低的驱动电压、较高的电流效率。
7.为达到上述目的,本技术提供以下技术方案:
8.一种化合物,所述化合物的结构式如式(ⅰ)和式(ia)所示:
[0009][0010]
其中,l选自含有6~40个碳原子的芳香基、二苯并呋喃或二苯并噻吩中的一种;
[0011]
m选自0~4之间的整数,n选自0或者1;
[0012]
ar选自三亚苯、荧蒽、二苯并呋喃或二苯并噻吩中的一种;并且,ar选自荧蒽时,m+n大于1;
[0013]
ar1和ar2分别选自含有6~40个碳原子的芳香基、二苯并呋喃或二苯并噻吩中的一种;
[0014]
r、r1、r2分别选自c1~c
20
的烷基、含有6~40个碳原子的芳香基、二苯并呋喃或二苯并噻吩中的一种;
[0015]
ar1和ar之间、ar2和ar之间以及ar1、ar2之间可各自独立地通过单键、o、s、cr1r2、nr连接或者桥接。
[0016]
式(ⅰ)和式(ia)所示化合物中的h可被f、cn、d、含有1~6个碳原子的烷基、含有1~6个碳原子的烷氧基、苯、联苯、萘、菲、蒽、芴、苯并芴、二苯并芴、三亚苯、荧蒽、芘、苝、螺芴、茚并芴或氢化的苯并蒽中的一种替代。
[0017]
优选地,所述式(i)和式(ia)所示化合物中的h可被f、cn、d、1~3个碳原子的烷基、含有1~3个碳原子的烷氧基、苯、联苯、三亚苯、荧蒽至少一种替代。
[0018]
进一步地,所述l、ar1、ar2各自独立地选自苯、联苯、萘、菲、蒽、芴、苯并芴、二苯并芴、三亚苯、荧蒽、芘、苝、螺芴、茚并芴或氢化的苯并蒽中的至少一种。
[0019]
进一步地,所述化合物选自以下结构:
[0020][0021][0022]
其中,l选自苯。
[0023]
进一步地,所述化合物选自式(1)~(112)所示化合物及其异构体中的一种;其中,式(1)~(112)所述化合物如下所示:
[0024]
[0025]
[0026]
[0027][0028]
以上所列具体化合物中,当n=1,m=1时,l上特定的sp2杂化碳原子和上的n原子连接,并且ar和l通过特定的sp2杂化的碳原子参与连接,ar上特定的sp2杂化的碳原子和上的n原子连接,ar1和ar2也均是特定的sp2杂化碳原子和n原子连接。
[0029]
当n=0,m=1时,以上所列具体化合物,ar上特定的sp2杂化碳原子和上的n原子连接,ar上特定的sp2杂化的碳原子和上的n原子连接,ar1和ar2也均是特定的sp2杂化碳原子和n原子连接。
[0030]
当n=1,m=0时,l上特定的sp2杂化碳原子和上的n原子连接,并且ar和l通过特定的sp2杂化的碳原子参与连接。
[0031]
所述式(1)~(112)所示化合物的异构体是指:
[0032]
以上所列具体化合物,当n=1,m=1时,l上除所述式(1)~(112)所示结构外其他任意的sp2杂化碳原子和上的n原子连接,并且ar和l通过除所述式(1)~(112)所示结构外其他任意的sp2杂化的碳原子参与连接,ar上除所述式(1)~(112)所示结构外其他任意的sp2杂化的碳原子和上的n原子连接,ar1和ar2可以除所述式(1)~(112)所示结构外其他任意的sp2杂化碳原子和n原子连接所形成的结构。
[0033]
当n=0,m=1时,以上所列具体化合物,ar上除所述式(1)~(112)所示结构外其他任意的sp2杂化碳原子和上的n原子连接,ar上除所述式(1)~(112)所示结构外其他任意的sp2杂化的碳原子和上的n原子连接,ar1和ar2可以除所述式(1)~(112)所示结构外其他任意的sp2杂化碳原子和n原子连接所形成的结构。
[0034]
当n=1,m=0时,l上除所述式(1)~(112)所示结构外其他任意的sp2杂化碳原子和上的n原子连接,并且ar和l通过除所述式(1)~(112)所示结构外其他任意的sp2杂化的碳原子参与连接所形成的结构。
[0035]
举例说明如下:
[0036]
化合物1结构如下:
[0037][0038]
其异构体包括但不限于以下结构:
[0039][0040]
化合物46结构如下:
[0041][0042]
其异构体包括但不限于以下结构:
[0043][0044]
本技术还提供一种用于制备本技术所述化合物的中间体,所述中间体包括:m
‑
1所示化合物,m
‑
2所示化合物,m
‑
3所示化合物,m
‑
4所示化合物,m
‑
5所示化合物,m
‑
8所示化合物;
[0045]
所述化合物如下所示:
[0046]
其中x、y可以相同,也可以不同,分别独立地独立的选自氯、溴、碘。
[0047]
本技术还提供一种上述中间体的制备方法,包括以下步骤:
[0048]
所述m
‑
0所示化合物和2
‑
联苯硼酸反应形成所述m
‑
1所示化合物;
[0049]
所述m
‑
1所示化合物经分子内偶联反应形成所述m
‑
2所示化合物;
[0050]
所述m
‑
2所示化合物和mx
p
化合物反应形成所述m
‑
3所示化合物;
[0051]
所述m
‑
3所示化合物经还原反应形成所述m
‑
4所示化合物;
[0052]
所述m
‑
4所示化合物经桑德迈尔反应形成所述m
‑
5所示化合物;
[0053]
所述m
‑
5所示化合物和m
‑
6所示化合物反应形成所述m
‑
8所示化合物;
[0054]
其中,mx
p
中m选自碱金属、碱土金属,p选自1或者2;
[0055]
所述m
‑
6所示化合物如下所示:
[0056][0057]
本技术还提供一种所述式(ⅰ)所示化合物的制备方法,包括以下步骤:中间体m
‑
8所示化合物和二芳胺进行c
‑
n偶联反应,得到式(ⅰ)和式(ia)所示化合物。
[0058]
作为一种示例性说明,本技术还提供一种上述式(
ⅰ‑
1)所示化合物的制备方法:
[0059][0060]
(1)合成i
‑
1(以m=1为例说明)
[0061][0062]
其中x、y可以相同,也可以不同,分别独立地独立的选自氯、溴、碘。
[0063]
具体合成步骤如下:
[0064]
(1)m
‑
0所示化合物和2
‑
联苯硼酸进行偶联反应,制备得到m
‑
1所示化合物。
[0065]
(2)m
‑
1所示化合物进行分子内偶联反应,制备得到m
‑
2所示化合物。
[0066]
(3)m
‑
2所示化合物和mx
p
反应,生成m
‑
3所示化合物,其中m选自碱金属、碱土金属,p选自1或者2。
[0067]
(4)m
‑
3所示化合物进行还原反应,生成m
‑
4所示化合物。
[0068]
(5)m
‑
4所示化合物进行桑德迈尔反应,生成m
‑
5所示化合物。
[0069]
(6)m
‑
5所示化合物和m
‑
6所示化合物进行偶联反应,制备得到m
‑
7所示化合物。
[0070]
(7)m
‑
7所示化合物和二芳胺进行c
‑
n偶联反应,制备得到i
‑
1所示化合物。
[0071]
本技术还提供一种有机电致发光器件,包括本技术所述的化合物。
[0072]
进一步地,所述有机发光器件的空穴传输层的材料为本技术的化合物。
[0073]
进一步地,所述有机发光器件的电子阻挡层的材料为本技术的化合物。
[0074]
进一步地,所述有机发光器件的发光层主体材料为本技术的化合物。
[0075]
进一步地,所述有机发光器件为红色、蓝色器件。
[0076]
进一步地,所述有机发光器件为磷光器件。
[0077]
本技术还提供一种显示装置,包括本技术提供的有机电致发光器件。
[0078]
本技术提供了一种式(i)和式(ia)所示化合物,在11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环上用特定的芳香基团特定的连接方式连接形成新的化合物,用于改善
材料性能,以使利用本技术化合物所制备的有机电致发光器件具有较低的驱动电压、较高的电流效率。
具体实施方式
[0079]
下面将结合本技术实施例,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0080]
需要说明的是:本技术中,如果没有特别的说明,本文所提到的所有实施方式以及优选实施方法可以相互组合形成新的技术方案。本技术中,如果没有特别的说明,本文所提到的所有技术特征以及优选特征可以相互组合形成新的技术方案。本技术中,如果没有特别的说明,百分数(%)或者份指的是相对于组合物的重量百分数或重量份。本技术中,如果没有特别的说明,所涉及的各组分或其优选组分可以相互组合形成新的技术方案。本技术中,除非有其他说明,数值范围“或~b或表示a到b之间的任意实数组合的缩略表示,其中a和b都是实数。例如数值范围是实~22实表示本文中已经全部列出了“示~22本之间的全部实数,“间~22的只是这些数值组合的缩略表示。本技术所公开的“范围”以下限和上限的形式,可以分别为一个或多个下限,和一个或多个上限。本技术中,除非另有说明,各个反应或操作步骤可以顺序进行,也可以不按照顺序进行。优选地,本文中的反应方法是顺序进行的。
[0081]
除非另有说明,本文中所用的专业与科学术语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法或材料也可应用于本技术中。
[0082]
合成实施例1
[0083]
化合物1的合成:
[0084][0085]
(1)11
‑
(4
‑
溴苯基)
‑
11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环(中间体1
‑
1)的合成
[0086]
200毫升三口瓶,氮气保护,加入2.91克11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环,2.83克4
‑
溴碘苯,1.06克碳酸钠,100毫升dmf,0.5克碘化亚铜,0.2克1,10
‑
邻菲咯啉,升温至回流反应24小时,降温,加入水,过滤得到的固体,固体干燥后,用甲苯加热溶解,滤去不溶物,母液浓缩至干,用乙醇和甲苯混合溶剂重结晶2次,得到11
‑
(4
‑
溴苯基)
‑
11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环2.2克。
[0087]
对11
‑
(4
‑
溴苯基)
‑
11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环进行了质
谱检测,m/z最大的两个峰为445,447,确定产品分子式为:c
28
h
16
brn。
[0088]
(2)4
‑
(11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环
‑
11
‑
基)苯硼酸(中间体1
‑
2)的合成
[0089]
0.1mol的11
‑
(4
‑
溴苯基)
‑
11h
‑
11
‑
氮杂二苯并[g,ij]萘并[2,1,8
‑
cde]甘桔环溶解在四氢呋喃中,于
‑
78℃和0.11mol的丁基锂反应,然后在
‑
78℃下加入0.15mol硼酸三甲酯,升至室温反应1小时,加入水,水解,然后加入乙酸乙酯分液,有机层浓缩至干,不经分离,直接进行下步反应。
[0090]
(3)化合物1的合成
[0091]
250毫升三口瓶,氮气保护,加入60毫升甲苯,30毫升乙醇,20毫升水,再加入3.07克2
‑
溴三亚苯,再加入上步制备得到的中间体1
‑
2所示化合物,2.12克碳酸钠,0.115克四三苯基膦钯,缓慢升温至回流反应8小时,降温,加水分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,得到的固体用硅胶柱层析分离,石油醚洗脱,得到式1所示化合物4.9克。
[0092]
对式1所示化合物进行了质谱检测,m/z为593。
[0093]
对式1所示化合物进行了核磁检测,数据解析如下:1h
‑
nmr(瑞士bruker公司,avanceⅱ400mhz核磁共振波谱仪,cdcl3),δ9.26(d,1h),δ8.81(m,1h),δ8.46~8.27(m,6h),δ8.18(m,1h),δ8.09(m,2h),δ7.95~7.88(m,4h),δ7.82(m,1h),δ7.74~7.60(m,4h),δ7.55~7.37(m,5h),δ7.18(m,1h),δ7.05(m,1h)。
[0094]
合成实施例2
[0095]
化合物3的合成:
[0096][0097]
(1)参照合成实施例1中,中间体1
‑
1的合成,只是将其中的4
‑
溴碘苯换成2
‑
溴
‑7‑
碘
‑
9,9
‑
二甲基芴,得到3
‑
1所示中间体。
[0098]
对3
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为561,563,确定分子式为c
37
h
24
brn。
[0099]
(2)参照合成实施例1中,化合物1的合成,只是改变其中相应的溴代物和硼酸的种类,得到化合物3。
[0100]
对式3所示化合物进行了质谱检测,m/z为709。
[0101]
合成实施例3
[0102]
化合物7的合成:
[0103][0104]
(1)参照合成实施例1中,中间体1
‑
1的合成,只是将其中的4
‑
溴碘苯换成2
‑
溴
‑7‑
碘
‑
9,9
‑
螺二芴,得到7
‑
1所示中间体。
[0105]
对7
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为683,685,确定分子式为:c
47
h
26
brn。
[0106]
(2)参照合成实施例2中,化合物3的合成,只是将其中的3
‑
1所示中间体换成7
‑
1所示中间体,得到化合物7。
[0107]
对式7所示化合物进行了质谱检测,m/z为831。
[0108]
合成实施例4
[0109]
化合物14的合成:
[0110][0111]
(1)参照合成实施例1中,中间体1
‑
1的合成,只是将其中的4
‑
溴碘苯换成3
‑
溴
‑7‑
碘二苯并[b,d]呋喃,得到14
‑
1所示中间体。
[0112]
对14
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为537,535,确定分子式为:c
34
h
18
brno。
[0113]
(2)参照合成实施例2中,化合物3的合成,只是将其中的3
‑
1所示中间体换成14
‑
1所示中间体,将其中的三亚苯
‑2‑
硼酸换成荧蒽
‑8‑
硼酸,得到化合物14。
[0114]
对式14所示化合物进行了质谱检测,m/z为657。
[0115]
合成实施例5
[0116]
化合物21的合成:
[0117][0118]
参照合成实施例1中,化合物1的合成,只是将其中的2
‑
溴三亚苯换成7
‑
溴
‑2‑
氰基三亚苯,得到化合物21。
[0119]
对式21所示化合物进行了质谱检测,m/z为618。
[0120]
合成实施例6
[0121]
化合物30的合成:
[0122][0123]
(1)30
‑
1所示中间体的合成
[0124]
500毫升三口瓶,氮气保护,加入100毫升甲苯,40毫升乙醇,30毫升水,再加入4.33克(0.01mol)2
‑
溴
‑7‑
碘三亚苯,4.11克(0.01mol)1
‑
2所示中间体,2.12克(0.02mol)碳酸钠,0.115克(0.0001mol)四三苯基膦钯,缓慢升温至60℃反应2小时,再升温至70℃反应4小
时,降温,加水分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,得到的固体硅胶柱层析分离,石油醚洗脱,得到式30
‑
1所示中间体4.6克。
[0125]
对式30
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为671,673,确定产品分子式为c
46
h
26
brn。
[0126]
(2)式30所示化合物的合成
[0127]
1000毫升三口瓶,氮气保护,加入400毫升干燥的甲苯,6.73克(0.01mol)式30
‑
1所示中间体,2.69克(0.011mol)n
‑
苯基
‑
[1,1'
‑
联苯]
‑4‑
胺,0.0575克(0.0001mol)pd(dba)2(双二亚苄基丙酮钯),0.4克(0.0002mol)含有10%三叔丁基膦的甲苯溶液,1.44克(0.015mol)叔丁醇钠,加热至回流反应8小时,降温,加水分液,有机层水洗至中性,硫酸镁干燥,过滤除去硫酸镁后,浓缩至干,硅胶柱层析分离,石油醚:乙酸乙酯=10:1(体积比)洗脱,得到式30所示化合物7.6克。
[0128]
对式30所示化合物进行了质谱检测,确定分子m/z为:836。
[0129]
合成实施例7
[0130]
化合物31的合成:
[0131][0132]
参照合成实施例6中,化合物30的合成,只是将其中的n
‑
苯基
‑
[1,1'
‑
联苯]
‑4‑
胺换成9,9
‑
二甲基
‑
n
‑
苯基
‑
9h
‑
芴
‑2‑
胺,得到化合物31。
[0133]
对式31所示化合物进行了质谱检测,m/z为876。
[0134]
合成实施例8
[0135]
化合物41的合成:
[0136][0137]
(1)中间体41
‑
1的合成
[0138]
参照合成实施例6中,化合物30的合成,只是将其中的n
‑
苯基
‑
[1,1'
‑
联苯]
‑4‑
胺
换成双(9,9
‑
二甲基芴
‑2‑
基)胺,将其中的30
‑
1所示中间体换成8
‑
溴荧蒽,得到中间体41
‑
1。
[0139]
对中间体41
‑
1进行了质谱检测,m/z为601。
[0140]
(2)中间体41
‑
2的合成
[0141]
100毫升三口瓶,加入60毫升二氯甲烷,6.02克中间体41
‑
1,控制温度20~25℃,滴加1.9克液溴的10毫升二氯甲烷溶液。加毕升温至回流反应4小时,降温,水洗,亚硫酸氢钠溶液洗涤,有机层浓缩至干,硅胶柱层析分离,石油醚洗脱,得到41
‑
2所示中间体1.6克,对41
‑
2所示中间体进行了质谱检测,m/z最大的两个峰位为681、679,确定产品分子式为c
46
h
34
brn。
[0142]
对式41
‑
2所示中间体进行了核磁检测,数据解析如下:1h
‑
nmr(瑞士bruker公司,avanceⅱ400mhz核磁共振波谱仪,cdcl3),δ8.07(m,1h),δ7.95(d,1h),δ7.93~7.81(m,5h),δ7.67(t,1h),δ7.58~7.52(m,5h),δ7.41~7.30(m,5h),δ7.22(m,2h),δ7.16(m,1h),δ6.92(d,1h),δ1.68(s,12h)。
[0143]
(3)化合物41的合成
[0144]
参照合成实施例1中,化合物1的合成,只是改变其中相应的溴代物和硼酸的种类,得到化合物41。
[0145]
对式41所示化合物进行了质谱检测,m/z为966。
[0146]
合成实施例9
[0147]
化合物47的合成:
[0148][0149]
(1)中间体47
‑
1的合成
[0150]
参照合成实施例1中,中间体1
‑
1的合成,只是将其中的4
‑
溴碘苯换成2
‑
溴
‑7‑
碘三亚苯,得到47
‑
1所示中间体。
[0151]
对47
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为595,597,确定分子式为c
40
h
22
brn。
[0152]
(2)化合物47的合成
[0153]
参照合成实施例7中,化合物31的合成,只是将其中的30
‑
1所示中间体换成47
‑
1所示中间体,得到化合物47。
[0154]
化合物47进行了质谱检测,m/z为800。
[0155]
合成实施例10
[0156]
化合物55的合成:
[0157][0158]
(1)m55
‑
1的合成
[0159]
250毫升三口瓶,氮气保护,加入50毫升甲苯,20毫升乙醇,10毫升水,再加入2.37克(0.01mol)2,3
‑
二氯对二硝基苯,1.98克(0.01mol)联苯
‑2‑
硼酸,2.12克(0.02mol)碳酸钠,0.115克(0.0001mol)四三苯基膦钯,缓慢升温至60℃反应2小时,再升温至70℃反应4小时,降温,加水分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,得到的固体用乙醇结晶2次,得到式m55
‑
1所示中间体2.3克。
[0160]
对式m55
‑
1所示中间体进行了质谱检测,m/z为354。
[0161]
(2)m55
‑
2的合成
[0162]
500毫升三口瓶加入10g中间体m55
‑
1,200毫升dmf,1.2克醋酸钯,5克碳酸钾,缓慢加热至回流反应12小时,降温,加水和甲苯分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,得到的固体乙醇和甲苯混合溶剂结晶,得到式m55
‑
2所示中间体5.3克。
[0163]
对式m55
‑
2所示中间体进行了质谱检测,m/z为318。
[0164]
(3)m55
‑
3的合成
[0165]
250毫升三口瓶,氮气保护,加入5.2g(0.016mol)中间体m55
‑
2,3.0克(0.018mol)碘化钾,50毫升dmf,0.2克醋酸钯,1.6克氧化亚铜,5.2克碳酸钾,缓慢加热至回流反应24小时,降温,加水和甲苯分液,有机层水洗后,硫酸镁干燥,过滤除去硫酸镁后,减压除去溶剂,硅胶柱层析分离,石油醚洗脱,得到式m55
‑
3所示中间体2.8克。
[0166]
对式m55
‑
3所示中间体进行了质谱检测,m/z为399。
[0167]
(4)m55
‑
4的合成
[0168]
250三口瓶内加入100毫升乙醇,3.99克m55
‑
3,1.0克无水三氯化铁,0.5克活性炭,升温至回流,缓慢滴加10.2克浓度为80%的水合肼溶液。滴加完以后,保持回流反应6小时,热滤,母液降温后加水,析出固体,将得到的固体用乙醇结晶,得到m55
‑
4所示化合物2.6克。
[0169]
对式m55
‑
4所示中间体进行了质谱检测,m/z为369。
[0170]
(5)m55
‑
5的合成
[0171]
500毫升三口瓶中,加入48%的氢溴酸40克,60%的磷酸10克,然后加入5.1克m55
‑
4所示中间体,升温至回流保持1小时,然后迅速降温至0℃,加入1.0克溴化亚铜,搅拌30分
钟后,升温至40~50℃,并保持40~50℃缓慢滴加1克亚硝酸钠溶于5毫升水所制备的溶液,加毕升温至80℃反应2小时,再升温至100℃反应2小时,降温,过滤得到固体,固体用甲醇和氯仿混合溶剂结晶,得到m55
‑
5所示化合物4.1克。
[0172]
对m55
‑
5所示化合物进行了质谱检测,m/e最大的两个峰分别为432,434,确定产品的分子式为c
18
h
10
bri。
[0173]
对m55
‑
5所示化合物体进行了核磁检测,数据解析如下:1h
‑
nmr(瑞士bruker公司,avanceⅱ400mhz核磁共振波谱仪,cdcl3),δ8.97(m,2h),δ8.30(m,2h),δ7.91(d,1h),δ7.73~7.59(m,4h),δ7.49(d,1h)。
[0174]
(6)55
‑
1的合成
[0175]
参照合成实施例6中中间体30
‑
1的合成,只是将其中的2
‑
溴
‑7‑
碘三亚苯换成m55
‑
5所示的1
‑
溴
‑4‑
碘三亚苯,得到55
‑
1所示中间体。
[0176]
对55
‑
1所示中间体进行了质谱检测,m/e最大的两个峰为671,673,确定产品的分子式为c
46
h
26
brn。
[0177]
(7)化合物55的合成
[0178]
参照合成实施例6中化合物30的合成,只是将其中的30
‑
1所示中间体换成55
‑
1所示中间体,将该其中的n
‑
苯基
‑
[1,1'
‑
联苯]
‑4‑
胺换成9,9
‑
二甲基
‑
n
‑
苯基
‑
9h
‑
芴
‑2‑
胺,得到55所示化合物。
[0179]
对55所示化合物进行了质谱检测,m/e为876。
[0180]
需要说明的是,在m55
‑
3的制备过程中,当增加ki的用量至0.03mol,并且反应时间增加到48小时,可以得到两个硝基均被碘取代的化合物:1,4
‑
二碘三亚苯。
[0181]
对1,4
‑
二碘三亚苯进行了质谱检测,m/e为480。
[0182]
使用0.03mol的溴化钾替代碘化钾,并且反应时间增加到106小时,可以得到1,4
‑
二溴三亚苯。
[0183]
对1,4
‑
二溴三亚苯进行了质谱检测,m/e为386。
[0184]
等物质量的1,4
‑
二碘三亚和1
‑
2所示中间体进行偶联反应,可以制备得到以下化合物:
[0185]
对55
‑
2所示化合物进行了质谱检测,m/e为719。
[0186]
55
‑
2所示化合物和9,9
‑
二甲基
‑
n
‑
苯基
‑
9h
‑
芴
‑2‑
胺反应,可以得到55所示化合物。
[0187]
等物质量的1,4
‑
二溴三亚和1
‑
2所示中间体进行偶联反应,可以制备得到55
‑
1所示中间体。
[0188]
合成实施例11
[0189]
化合物64的合成:
[0190][0191]
(1)中间体64
‑
1的合成
[0192]
照合成实施例1中,中间体1
‑
1的合成,只是将其中的4
‑
溴碘苯换成4
‑
溴
‑6‑
碘二苯并[b,d]呋喃,得到64
‑
1所示中间体。
[0193]
对64
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为537,535,确定分子式为c
34
h
18
brno。
[0194]
(2)化合物64的合成
[0195]
参照合成实施例7中,化合物31的合成,只是将其中的30
‑
1所示中间体换成64
‑
1所示中间体,将其中的9,9
‑
二甲基
‑
n
‑
苯基
‑
9h
‑
芴
‑2‑
胺换成n
‑
([1,1'
‑
联苯]
‑4‑
基)
‑
9,9
‑
二甲基芴
‑2‑
胺,得到化合物64。
[0196]
对化合物64进行了质谱检测,m/z为816。
[0197]
合成实施例12
[0198]
化合物85的合成:
[0199][0200]
参照化合物47的合成,只是将其中的9,9
‑
二甲基
‑
n
‑
苯基
‑
9h
‑
芴
‑2‑
胺换成咔唑,得到式85所示化合物。
[0201]
对化合物85进行了质谱检测,m/z为682。
[0202]
合成实施例13
[0203]
化合物105的合成:
[0204][0205]
参照化合物21的合成,只是相应改变其中得到溴代物和硼酸类化合物的种类,得到化合物105。
[0206]
对化合物105进行了质谱检测,m/z为800。
[0207]
合成实施例14
[0208]
化合物109的合成:
[0209][0210]
(1)中间体109
‑
1的合成
[0211]
照合成实施例1中,中间体1
‑
1的合成,只是将其中的4
‑
溴碘苯换成1
‑
溴
‑4‑
碘三亚苯,得到109
‑
1所示中间体。
[0212]
对109
‑
1所示中间体进行了质谱检测,m/z最大的两个峰为595,597,确定分子式为c
40
h
22
brn。
[0213]
(2)化合物109合成
[0214]
参照化合物21的合成,只是相应改变其中得到溴代物和硼酸类化合物的种类,得到化合物109。
[0215]
对化合物109进行了质谱检测,m/z为758。
[0216]
器件实施例中所用的材料:
[0217][0218]
器件实施例1
[0219]
实施例选用本技术的化合物作为有机电致发光器件中的空穴传输材料,比较例选用d4、d5作为有机电致发光器件中的空穴传输材料。
[0220]
有机电致发光器件结构为:ito/空穴传输材料(40nm)/em1(30nm)/alq3(30nm)/lif(0.5nm)/al(150nm)。
[0221]
有机电致发光器件制备过程如下:
[0222]
将涂布了ito透明导电层(作为阳极)的玻璃基板在清洗剂中进行超声处理,然后在去离子水中冲洗,再在丙酮与乙醇混合溶剂中超声除油,再在洁净环境下烘烤至完全除
水,用紫外光和臭氧清洗,并用低能阳离子束轰击表面,以改善表面的性质,提高与空穴注入层的结合能力;
[0223]
将上述玻璃基板置于真空腔内,抽真空至1
×
10
‑5~9
×
10
‑3pa,在阳极上分别真空蒸镀本发明材料和对比材料作为空穴传输层,蒸镀速率为0.1nm/s,蒸镀膜厚为40nm;
[0224]
在空穴传输层之上真空蒸镀em1作为器件的有机发光层,蒸镀速率为0.1nm/s,蒸镀总膜厚为30nm;
[0225]
在有机发光层之上真空蒸镀alq3作为有机电致发光器件的电子传输层;其蒸镀速率为0.1nm/s,蒸镀总膜厚为30nm;
[0226]
在电子传输层上真空蒸镀0.5nm的lif、150nm的al作为电子注入层和阴极。
[0227]
测量了所制备有机电致发光器件的亮度、驱动电压、电流效率,如表1所示。
[0228]
表1
[0229]
空穴传输材料要求亮度cd/m2驱动电压v电流效率cd/ad410005.161.09d510005.670.883110005.091.193210004.911.213710004.921.0946
‑
110003.611.774710003.891.685510003.661.89
[0230]
从表1可得,使用本发明所述化合物作为空穴传输材料的oled器件,其电压效率均有改善,尤其化合物46
‑
1、47、55改善明显。
[0231]
器件实施例2
[0232]
实施例选用本技术的化合物作为有机电致发光器件中的电子阻挡材料,比较例选用d1、d2、d3作为有机电致发光器件中的电子阻挡材料。
[0233]
有机电致发光器件结构为:ito/npb(40nm)/电子阻挡材料(20nm)/em1(30nm)/alq3(30nm)/lif(0.5nm)/al(150nm)。
[0234]
对于没有电子阻挡层的oled器件,器件结构为:ito/npb(40nm)/em1(30nm)/alq3(30nm)/lif(0.5nm)/al(150nm)。
[0235]
有机电致发光器件制备过程如下:
[0236]
将涂布了ito透明导电层(作为阳极)的玻璃基板在清洗剂中进行超声处理,然后在去离子水中冲洗,再在丙酮与乙醇混合溶剂中超声除油,再在洁净环境下烘烤至完全除水,用紫外光和臭氧清洗,并用低能阳离子束轰击表面,以改善表面的性质,提高与空穴注入层的结合能力;
[0237]
将上述玻璃基板置于真空腔内,抽真空至1
×
10
‑5~9
×
10
‑3pa,在阳极上真空蒸镀npb作为空穴传输层,蒸镀速率为0.1nm/s,蒸镀膜厚为40nm;
[0238]
在空穴传输层之上真空蒸镀本发明化合物和对比材料作为器件的电子阻挡层,蒸镀速率为0.1nm/s,蒸镀总膜厚为20nm;
[0239]
在电子阻挡层之上真空蒸镀em1作为器件的有机发光层,蒸镀速率为0.1nm/s,蒸
镀总膜厚为30nm;
[0240]
对于没有电子阻挡层的oled器件,直接在空穴传输层上,真空蒸镀em1作为器件的有机发光层,蒸镀速率为0.1nm/s,蒸镀总膜厚为30nm;
[0241]
在有机发光层之上真空蒸镀alq3作为有机电致发光器件的电子传输层;其蒸镀速率为0.1nm/s,蒸镀总膜厚为30nm;
[0242]
在电子传输层上真空蒸镀0.5nm的lif、150nm的al作为电子注入层和阴极。
[0243]
测量了所制备有机电致发光器件的亮度、驱动电压、电流效率,如表2所示。
[0244]
表2
[0245]
电子阻挡材料要求亮度cd/m2驱动电压v电流效率cd/ad110006.160.92d210005.881.06d310005.791.09110005.561.38710005.611.421410005.441.402110005.381.512210005.621.32无10005.660.31
[0246]
从表2可得,使用本发明化合物作为空穴传输材料的oled器件,其驱动电压、电流效率均有改善。
[0247]
器件实施例3
[0248]
实施例选用本技术的化合物作为有机电致发光器件中的红光主体材料,比较实施例选用d5、d6作为有机电致发光器件中的红光主体材料。
[0249]
有机电致发光器件的结构为:ito/npb(20nm)/红光主体材料:ir(piq)3[10%](35nm)/tpbi(10nm)/alq3(15nm)/lif(0.5nm)/al(150nm)。其中“ir(piq)3[10%]/”是指红光染料的掺杂比例,即红光主体材料与ir(piq)3的体积比为100:10。
[0250]
有机电致发光器件制备过程如下:
[0251]
将涂布了ito透明导电层的玻璃板在商用清洗剂中超声处理,在去离子水中冲洗,在丙酮:乙醇混合溶剂中超声除油,在洁净环境下烘烤至完全除去水份,用紫外光和臭氧清洗,并用低能阳离子束轰击表面。
[0252]
把上述带有阳极的玻璃基片置于真空腔内,抽真空至1
×
10
‑5~9
×
10
‑3pa,在上述阳极层膜上真空蒸镀空穴传输层npb,蒸镀速率为0.1nm/s,蒸镀膜厚为20nm;
[0253]
在空穴传输层之上真空蒸镀红光主体材料和染料ir(piq)3,作为有机电致发光器件的发光层,蒸镀速率为0.1nm/s,蒸镀总膜厚为35nm。
[0254]
在发光层之上依次真空蒸镀电子传输层tpbi和alq3,其蒸镀速率均为0.1nm/s,蒸镀膜厚分别为10nm和15nm。
[0255]
在电子传输层上真空蒸镀0.5nm的lif,150nm的al作为电子注入层和阴极。
[0256]
所有有机电致发光器件均采用上述方法制备得到,区别仅在于红光主体材料的选择,具体详见下表3。
[0257]
测量了所制备有机电致发光器件的亮度、驱动电压、电流效率,如表3所示。
[0258]
表3
[0259]
发光层主体材料要求亮度cd/m2驱动电压v电流效率cd/ad510004.5921.89d610004.4922.378210004.1221.118310004.1119.688410003.9521.186410003.5726.416510003.6226.197010003.4224.578510004.2133.198710004.3335.8110910004.3327.0210510004.4225.11
[0260]
从表3可得,化合物82,83,84电压降低,化合物64、65、70驱动电压降低明显,电流效率提高,化合物85、87电流效率提高明显。
[0261]
器件实施例4
[0262]
实施例选用本技术的化合物作为有机电致发光器件中的蓝光主体材料,比较实施例选用d5、d6作为有机电致发光器件中的蓝光主体材料。
[0263]
有机电致发光器件的结构为:ito/npb(20nm)/蓝光主体材料:firpic[6%](35nm)/tpbi(10nm)/alq3(15nm)/lif(0.5nm)/al(150nm)。其中“firpic[6%]/”是指蓝光染料的掺杂比例,即蓝光主体材料与firpic的体积比为100:6。
[0264]
有机电致发光器件制备过程如下:
[0265]
将涂布了ito透明导电层的玻璃板在商用清洗剂中超声处理,在去离子水中冲洗,在丙酮:乙醇混合溶剂中超声除油,在洁净环境下烘烤至完全除去水份,用紫外光和臭氧清洗,并用低能阳离子束轰击表面。
[0266]
把上述带有阳极的玻璃基片置于真空腔内,抽真空至1
×
10
‑5~9
×
10
‑3pa,在上述阳极层膜上真空蒸镀空穴传输层npb,蒸镀速率为0.1nm/s,蒸镀膜厚为20nm;
[0267]
在空穴传输层之上真空蒸镀蓝光主体材料和染料firpic,作为有机电致发光器件的发光层,蒸镀速率为0.1nm/s,蒸镀总膜厚为35nm。
[0268]
在发光层之上依次真空蒸镀电子传输层tpbi和alq3,其蒸镀速率均为0.1nm/s,蒸镀膜厚分别为10nm和15nm。
[0269]
在电子传输层上真空蒸镀0.5nm的lif,150nm的al作为电子注入层和阴极。
[0270]
所有有机电致发光器件均采用上述方法制备得到,区别仅在于蓝光主体材料的选择,具体详见下表4。
[0271]
测量了所制备有机电致发光器件的亮度、驱动电压、电流效率,如表4所示。
[0272]
表4
[0273]
发光层主体材料要求亮度cd/m2驱动电压v电流效率cd/a
d510007.030.88d610006.814.588510005.266.338710005.626.8110510006.115.0910910005.517.09
[0274]
从表4可得,化合物85,87,105,109驱动电压降低,电流效率增高;尤其化合物85,87,109驱动电压明显降低,电流效率明显增高。
[0275]
显然,本领域的技术人员可以对本技术实施例进行改动和变形而不脱离本技术的精神和范围。这样,倘若本技术的这些修改和变形属于本技术权利要求及其等同技术的范围之类,则本技术也意图包含这些改动和变形在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1