小麦秆锈病抗性蛋白及其编码基因和应用
1.本发明涉及生物技术领域,具体而言,涉及一种小麦秆锈病抗性蛋白及其编码基因和应用。
背景技术:
2.小麦是最重要的粮食作物之一,保障其安全生产对于我国粮食安全至关重要。小麦秆锈病是由禾柄锈菌小麦专化型(puccinia graminis pers.var.tritici eriks et henn.)引起的气传性真菌病害,是危害小麦安全生产最重要的病害之一。秆锈病在多数种植小麦的国家和地区均有发生,流行年份可使小麦减产50%-70%,严重时甚至绝收。我国秆锈病的常发区和易发区包括东北和西北麦区,其次为江淮和东南沿海地区,此外还有西南麦区的部分地区。20世纪60年代以前,我国曾爆发过几次秆锈病大流行,造成了严重的产量损失。
3.近年来,小麦秆锈病在世界多个小麦主产区发病范围不断扩大,危害程度日益严重,造成了非常严重的小麦产量损失。出现了ug99系列强毒性小种以及多个非ug99类型的强毒性小种,包括trttf、tkttf、ttrtf和jrcqc等。目前我国主栽的小麦品种95%以上对秆锈病都没有抗性,毒性小种一旦传入我国,将严重威胁我国小麦的安全生产。
4.克隆和利用抗秆锈病基因,培育抗病小麦品种是控制该病害最经济、安全和环保的措施。硬粒小麦t.durum蕴含丰富的抗秆锈病基因资源,从中定位和克隆新的秆锈病抗性基因,将为小麦抗病育种提供重要的基因资源和理论基础。迄今为止,已经有超过60个小麦秆锈病抗性基因被正式命名,但由于普通小麦是异源六倍体,基因组非常庞大(约17gb)且重复序列多等原因,在开展小麦基因图位克隆研究时需要进行基因的精细定位、染色体步移、候选基因预测、基因功能验证等繁琐的步骤,致使小麦功能基因的图位克隆进展缓慢,目前只有少部分基因被成功克隆。
技术实现要素:
5.本发明的主要目的在于提供一种小麦秆锈病抗性蛋白及其编码基因和应用,以解决现有技术中此类抗性蛋白少的问题。
6.为了实现上述目的,根据本发明的一个方面,提供了一种小麦秆锈病抗性蛋白质,该蛋白质包括:
7.(a)具有seq id no:3所示的氨基酸序列组成的蛋白质;或
8.(b)在(a)中的氨基酸序列经过取代和/或缺失和/或添加一个或几个氨基酸且具有抗小麦秆锈病活性的蛋白质;或
9.(c)与(a)和(b)中任一所限定的氨基酸序列具有80%以上同源性且具有相同功能的蛋白质。
10.进一步地,该小麦秆锈病抗性蛋白质包括与(a)和(b)中任一所限定的氨基酸序列具有85%以上,优选90%以上,更优选95%以上,进一步优选99%以上同源性且具有相同功
能的蛋白质。
11.根据本技术的第二个方面,提供了一种小麦秆锈病抗性基因,该基因包括:
12.(a)编码上述小麦秆锈病抗性蛋白质的核苷酸序列;或
13.(b)在严格条件下与(a)限定的dna分子杂交且上述小麦秆锈病抗性蛋白质的核苷酸序列;或
14.(c)具有seq id no:2所示的核苷酸序列;或
15.(d)与(a)至(c)中限定的任一种核苷酸序列具有70%以上同源性且编码具有相同功能蛋白质的基因。
16.进一步地,该基因包括与(a)至(c)中限定的任一种核苷酸序列具有75%以上,优选85%以上,更优选95%以上,进一步优选99%以上同源性且编码具有相同功能蛋白质的基因。
17.根据本技术的第三种方面,提供了一种表达盒,该表达盒包含调控序列和上述小麦秆锈病抗性基因。
18.进一步地,上述调控序列包括启动子;优选地,启动子包括如下启动子中的一种或几种:组成型、增强型、组织特异型及诱导型。
19.根据本技术的第四种方面,提供了一种重组载体,该重组载体包含上述小麦秆锈病抗性基因或上述表达盒;优选地,重组载体包括翻译控制信号;优选地,翻译控制信号包括增强子;优选地,增强子包括翻译增强子和/或转录增强子;优选地,翻译控制信号来源于天然序列或人工合成序列;优选地,重组载体包括植物表达载体;优选地,植物表达载体包括农杆菌转化的双元载体和基因枪轰击的载体;优选地,上述植物表达载体包括pcambia1300。
20.进一步地,上述重组载体包括报告基因;优选地,报告基因包括抗性基因或表达产生颜色变化的酶或发光化合物的基因;优选地,上述抗性基因包括抗生素抗性基因或化学试剂抗性基因。
21.根据本技术的第五种方面,提供了一种非植物的宿主细胞,该宿主细胞转化有上述重组载体;优选地,宿主细胞包括大肠杆菌或根瘤农杆菌;优选地,大肠杆菌包括dh5α;优选地,根瘤农杆菌包括eha105。
22.根据本技术的第六种方面,提供了一种上述小麦秆锈病抗性蛋白质、小麦秆锈病抗性基因、表达盒、重组载体、或宿主细胞在调控植物对秆锈病的抗性、增强或降低植物对秆锈病的抗性或培育对秆锈病的抗性增强或降低的转基因植物中的应用。
23.根据本技术的第七种方面,提供了一种制备转基因植物的方法,该方法包括将上述小麦秆锈病抗性基因、或上述携带小麦秆锈病抗性基因的表达盒、重组载体、宿主细胞导入目的植物中,得到对秆锈病具有抗性的转基因植物。
24.进一步地,重组载体通过植物病毒载体、基因枪或农杆菌侵染的方法导入到目的植物中。
25.进一步地,目的植物为双子叶植物或单子叶植物;优选地,目的植物为小麦;优选地,小麦为fielder小麦;优选地,小麦秆锈病抗性基因由组成型启动子驱动。
26.根据本技术的第八种方面,提供了一种增加或降低植物对秆锈病抗性的方法,该方法包括增加或降低目的植物中小麦秆锈病抗性蛋白质的活性或含量,使得植物对秆锈病
的抗性增强或降低。
27.进一步地,该方法可以用于植物育种;优选地,目的植物为双子叶植物或单子叶植物;优选地,目的植物为小麦;优选地,小麦为fielder小麦;优选地,秆锈病为秆锈菌生理小种引起的秆锈病;优选地,秆锈菌生理小种为国外流行秆锈菌毒性小种或中国流行秆锈菌毒性小种,国外流行秆锈菌毒性小种包括trttf和/或bccbc,中国流行秆锈菌毒性小种包括rtjrm、21c3ctttm、34mkgqm、34mtgsm和34c3rtgqm中的任意一种或多种。
28.应用本发明的技术方案,提供了一种新的秆锈病抗性蛋白及其编码基因及应用,有助于解析抗病基因对病原菌的抗病机制的研究,提高小麦对秆锈病的抗性,为小麦分子育种提供可靠、有效的秆锈病抗源。
附图说明
29.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
30.图1a,1b及1c示出了根据本发明实施例1的示意图,为抗病亲本t4-3102(t4-3102是sr13提前终止的突变体家系)、感病亲本rusty,它们杂交产生的f2群体部分单株对秆锈病生理小种trttf和bccbc的抗性鉴定结果。其中,图1a为t4-3102、rusty、部分f2单株接种秆锈病生理小种trttf培养12天后的表型;图1b为t4-3102、rusty、部分f2单株接种秆锈病生理小种bccbc培养12天后的表型;图1c为t4-3102和rusty接种秆锈菌生理小种rtjrm、21c3ctttm、34mkgqm、34mtgsm和34c3rtgqm培养12天后的表型。1为抗病亲本t4-3102;2为感病亲本rusty;3-5为f2群体中分离出的抗病植株;6-8为f2群体中分离出的感病植株。
31.图2a,2b,2c及2d示出了根据本发明实施例2和3的示意图,为秆锈病抗性基因srkn的图位克隆。其中,图2a为小麦2b染色体;图2b为srkn的精细定位遗传图谱;图2c为四倍体硬粒小麦svevo参考基因组中srkn候选区间表达的nbs-lrr(nlr)基因的示意图;图2d为候选基因srkn的结构。
32.图3a及3b示出了根据本发明实施例4的示意图,为srkn基因的ems突变体验证。其中,图3a为硬粒小麦kronos的ems突变体库中鉴定到srkn提前终止的点突变家系t4-3163(造成r1348*的突变);图3b为双突变体家系19059-26(-srkn-sr13)和单突变体家系19059-27(-sr13)接菌trttf培养12天后的表型差异。19059-26是srkn突变体t4-3163(-srkn)和sr13突变体t4-3102(-sr13)杂交得到的纯合双突变f3家系;19059-27是19059-26的姊妹系,只含有sr13的单突变体(-sr13)。
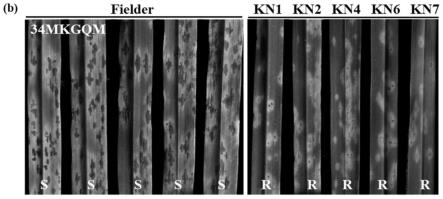
33.图4a及4b示出了根据本发明实施例5的示意图,为srkn基因的转基因互补验证。其中,图4a为用于转基因互补验证的srkn染色体片段,包括基因上游3371bp、基因全长5197bp(从atg到taa)和基因下游2406bp;图4b为对照品种fielder和t0代转基因植株kn1、kn2、kn4、kn6和kn7对秆锈菌生理小种34mkgqm接菌培养12天后的表型差异。
具体实施方式
34.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
35.术语解释:
36.秆锈病:由小麦秆锈菌即禾柄锈菌小麦专化型所引起的小麦秆锈病。
37.翻译控制信号:即蛋白质翻译控制信号,指在基因上游或下游存在,可以调控目的基因的转录从而影响蛋白质翻译的核苷酸序列,如增强子。
38.图位克隆:即定位克隆,指基于目标基因紧密连锁的分子标记在染色体上的位置来逐步确定和分离目标基因的技术方法。
39.如背景技术所提到的,由于我国主栽的小麦品种大部分对秆锈病没有抗性,毒性小种一旦传入我国,将严重威胁我国小麦的安全生产。克隆和利用抗秆锈病基因,培育抗病小麦品种是控制该病害最经济、安全和环保的措施。但是迄今为止,虽然已经有超过60个小麦秆锈病抗性基因被正式命名,但其中只有少部分基因被成功克隆。
40.因而在本技术中发明人对四倍体硬粒小麦中的秆锈病抗性基因进行了深入研究,精细定位、图位克隆并功能验证了抗秆锈病基因srkn,发现该基因编码的抗性蛋白具有抗小麦秆锈病活性。因而提出了本技术的一系列保护方案。
41.在本发明第一种实施方式中,提供了一种小麦秆锈病抗性蛋白质,该蛋白质包括:
42.(a)具有seq id no:3所示的氨基酸序列组成的蛋白质;或
43.(b)在(a)中的氨基酸序列经过取代和/或缺失和/或添加一个或几个氨基酸且具有抗小麦秆锈病活性的蛋白质;或
44.(c)与(a)和(b)中任一所限定的氨基酸序列具有80%以上同源性且具有相同功能的蛋白质。
45.在上述蛋白质中,与(a)和(b)中任一所限定的氨基酸序列具有85%以上,优选90%以上,更优选95%以上,进一步优选99%以上同源性且具有相同功能的蛋白质。
46.上述小麦秆锈病抗性蛋白质,具有抗小麦秆锈病的活性。在(a)序列的基础上对蛋白质进行突变,取代和/或缺失和/或添加一个或几个氨基酸,若突变发生在该蛋白质的活性位点,可能会导致该蛋白质关键的氨基酸结合位点发生改变,影响该蛋白质抗小麦秆锈病的活性,导致其活性升高或降低乃至失去活性;若突变发生在该蛋白质的非活性位点,可能会影响该蛋白质的折叠方式、三维结构等性质,从而影响蛋白质的理化性质和活性。80%、85%、90%、95%、99%以上同源性且具有相同功能的蛋白质,其活性位点、活性口袋、活性机制等均和(a)序列提供的蛋白质大概率相同,为通过氨基酸突变获得的同源蛋白。
47.在本发明第二种实施方式中,提供了一种小麦秆锈病抗性基因,该基因包括:
48.(a)编码上述小麦秆锈病抗性蛋白质的核苷酸序列;或
49.(b)在严格条件下与(a)限定的dna分子杂交且编码上述小麦秆锈病抗性蛋白质的核苷酸序列;或
50.(c)具有seq id no:2所示的核苷酸序列;或
51.(d)与(a)至(c)中限定的任一种核苷酸序列具有70%以上同源性且编码具有相同功能蛋白质的基因。
52.在上述基因中,与(a)至(c)中限定的任一种核苷酸序列具有75%以上,优选85%以上,更优选95%以上,进一步优选99%以上同源性且编码具有相同功能蛋白质的基因。
53.上述小麦秆锈病抗性基因,可以编码具有抗小麦秆锈病活性的蛋白质。在(a)序列的基础上对核苷酸进行突变,在严格条件下与(a)限定的dna分子杂交,且不发生移码突变,若突变发生在编码蛋白质活性位点的核苷酸上,可能会导致编码出的蛋白质关键的氨基酸
结合位点发生改变,影响该基因编码的蛋白质的抗小麦秆锈病活性,导致其活性升高或降低乃至失去活性;若突变发生在编码蛋白质非活性位点的核苷酸上,可能会影响编码蛋白质的折叠方式、三维结构等性质,从而影响蛋白质的理化性质和活性。70%、75%、85%、95%或99%以上同源性且编码具有相同功能蛋白质的小麦秆锈病抗性基因,其编码的蛋白质的活性位点、活性口袋、活性机制等均和(a)序列提供的基因大概率相同,为通过核苷酸突变获得的同源基因。
54.本发明的抗性亲本kronos,存在一个部分组装的参考基因组数据库和一个甲基磺酸乙酯(ethyl methane sulfonate,ems)化学诱变的突变体库,上述两个数据库均是公开的。但是,该抗性亲本中含有的抗病基因srkn的功能在数据库中是未知的,即在数据库中,该抗性亲本kronos的数据被部分测序组装,但基因组没有被注释,组装数据中包含有几万个基因,并未注释哪个基因是秆锈病抗性基因srkn。
55.本发明利用图位克隆的方法结合kronos部分组装的基因组序列找到了该基因,并利用它的ems突变体和转基因互补实验进行了功能验证。本发明获取该基因srkn的方法是图位克隆,需要进行基因的精细定位、序列的注释分析、候选基因预测、基因功能验证等繁琐的步骤,通过正向遗传的方法来图位克隆一个未知的新基因,由于小麦是异源多倍体且基因组庞大、复杂,因此获得该新基因是非常困难的。
56.在本发明第三种实施方式中,提供了一种表达盒,包含调控序列和上述小麦秆锈病抗性基因。
57.在上述表达盒中,调控序列包括但不限于启动子;优选其启动子包括但不限于如下启动子中的一种或几种:组成型、增强型、组织特异型及诱导型。
58.上述表达盒,即基因表达盒,由调控序列、上述小麦秆锈病抗性基因组成,也可包含其他核酸片段。通过调控序列对上述小麦秆锈病抗性基因的转录、翻译等表达产生影响。调控序列可以是启动子、增强子、沉默子、调节蛋白附着位点等核酸片段,其中启动子可以由组成型启动子、增强型启动子、组织特异型启动子、诱导型启动子或其他类型的启动子中的一种或几种联合发挥作用,达到调控基因表达的目的。
59.在本发明第四种实施方式中,提供了一种重组载体,其特征在于,包含上述小麦秆锈病抗性基因或表达盒;优选地,重组载体包括翻译控制信号;翻译控制信号可以来源于天然序列或人工合成序列,包括但不限于增强子;增强子包括翻译增强子和/或转录增强子;重组载体包括植物表达载体;植物表达载体包括农杆菌转化的双元载体和基因枪轰击的载体,如pcambia1300。
60.上述重组载体,包含小麦秆锈病抗性基因或上述表达盒,也可包含其他核酸片段如复制起始位点、多克隆位点、翻译控制信号等。来源于天然序列或人工合成序列的翻译控制信号,包括增强子、分子伴侣及其他可以对蛋白质翻译产生影响的核苷酸序列。上述增强子包括翻译增强子和/或转录增强子,可以单独使用或联合发挥作用,调控蛋白质转录、翻译。上述重组载体可以为植物表达载体,可以转化入植物中,在植物中表达目的基因,产生目的蛋白质从而发挥作用;植物表达载体包括但不限于农杆菌转化的双元载体和基因枪轰击的载体,可以通过不同转化方法导入植物细胞中以提高转化效率,上述植物表达载体载体包括实施例5中使用的pcambia1300。
61.在上述重组载体中包含报告基因;优选地,报告基因包括但不限于抗性基因或表
达产生颜色变化的酶或发光化合物的基因;其中抗性基因包括但不限于抗生素抗性基因或化学试剂抗性基因。
62.上述重组载体中还可以包括报告基因,报告基因可以为抗性基因或表达产生颜色变化的酶或发光化合物的基因或其他基因,从而通过抗性筛选、颜色筛选、荧光筛选等多种方式判断重组载体是否成功转化并表达;抗性基因包括但不限于抗生素抗性基因或化学试剂抗性基因,可以通过抗生素、化学试剂等药品对转化的母体进行高效的筛选,判断重组载体是否成功转化并表达。从转基因安全性考虑,也可不加任何报告基因,直接以表型筛选转化是否成功。
63.在本发明第五种实施方式中,提供了一种非植物的宿主细胞,该宿主细胞转化有上述重组载体。优选地,上述宿主细胞包括但不限于大肠杆菌、根瘤农杆菌;大肠杆菌可以为dh5α;根瘤农杆菌可以为eha105。
64.上述宿主细胞中转化有重组载体,可以携带重组载体进行如重组载体拷贝、基因表达、基因整合到染色体等多种作用。宿主细胞可以为大肠杆菌、根瘤农杆菌等多种菌株,其中大肠杆菌可以为常用的dh5α,根瘤农杆菌可以为常用的、实施例5中使用的eha105。
65.在本发明第六种实施方式中,提供了一种在转基因植物中的应用,该应用利用上述小麦秆锈病抗性蛋白质、基因、表达盒、重组载体或宿主细胞,以调控植物对秆锈病的抗性、增强或降低植物对秆锈病的抗性、或培育对秆锈病的抗性增强或降低的转基因植物。
66.上述应用利用小麦秆锈病抗性蛋白质、基因、表达盒、重组载体或宿主细胞,通过抗性蛋白质、抗性基因编码的蛋白质等调控植物对秆锈病的抗性;通过调控序列、翻译控制信号等增强或降低植物对秆锈病的抗性;将携带有重组载体的宿主细胞利用多种转化手段转化入母本植物中,从而培育对秆锈病的抗性增强或降低的转基因植物。
67.在本发明第七种实施方式中,提供了一种制备转基因植物的方法,该方法将上述小麦秆锈病抗性基因、表达盒、重组载体或宿主细胞导入目的植物中,得到对秆锈病的抗性增强的转基因植物。
68.在上述方法中,上述重组载体通过植物病毒载体、基因枪或农杆菌侵染的方法导入到目的植物中。
69.在上述方法中,上述目的植物为双子叶植物或单子叶植物;优选地,目的植物可以为小麦;小麦包括但不限于fielder小麦;小麦秆锈病抗性基因由组成型启动子驱动。
70.上述制备转基因植物的方法,利用植物病毒载体、基因枪或农杆菌侵染等多种方法,将小麦秆锈病抗性基因、表达盒、重组载体或宿主细胞导入目的植物中,得到对秆锈病的抗性增强的转基因植物。目的植物为双子叶植物或单子叶植物;优选地,单子叶植物可以为小麦,小麦的品种包括但不限于使用fielder小麦。上述方法可以通过如建立突变体库,获得突变体家系,在抗性基因的核苷酸位点上发生突变等方式,影响小麦秆锈病抗性基因的表达、蛋白质的活性或翻译,从而得到对秆锈病的抗性降低或增强的转基因植物。
71.在本发明第八种实施方式中,提供了一种增加或降低植物对秆锈病抗性的方法,包括:
72.增加或降低目的植物中小麦秆锈病抗性蛋白质的活性或含量,使得植物对秆锈病的抗性增强或降低。
73.上述方法,可以通过核苷酸序列突变、改变调控序列和/或翻译控制信号等方法,
增加或降低目的植物中小麦秆锈病抗性蛋白质的活性或含量,从而增强或降低植物对秆锈病的抗性。
74.上述方法可以用于植物育种;优选地,目的植物为双子叶植物或单子叶植物;目的植物可以为小麦;小麦可以为fielder小麦;秆锈病为秆锈菌生理小种引起的秆锈病;秆锈菌生理小种为国外流行秆锈菌毒性小种或中国流行秆锈菌毒性小种,国外流行秆锈菌毒性小种包括但不限于trttf和bccbc,中国流行秆锈菌毒性小种包括但不限于rtjrm、21c3ctttm、34mkgqm、34mtgsm和34c3rtgqm。
75.下面将结合具体的实施例来进一步详细解释本技术的有益效果。
76.实施例1:秆锈病抗性基因srkn的遗传分析和抗谱鉴定
77.在之前的研究中发现四倍体硬粒小麦(t.durum)材料kronos(即pi 576168)中含有两个秆锈病抗性基因,其中一个是已经被图位克隆的基因sr13,另外一个基因则暂时被命名为srkn。利用不含有sr13基因的kronos突变家系t4-3102为起始材料,将其与感病亲本rusty杂交,对它们产生的f2群体分别接种非洲和美洲的秆锈菌生理小种trttf和bccbc,接种12天后对材料进行秆锈病表型鉴定(结果见图1a和1b,其中r表示抗病,s表示感病)。其中,抗病亲本t4-3102和约四分之三的f2单株表现出良好的抗性,而感病亲本rusty和另外四分之一的f2单株表现出高感的表型(图1a和1b),1号为抗病亲本t4-3102;2号为感病亲本rusty;3-5号为f2群体中分离出的抗病植株;6-8号为f2群体中分离出的感病植株。通过分析f2群体的抗感分离比,说明t4-3102中存在一个显性的秆锈病抗性基因,命名为srkn。
78.对抗病和感病亲本材料分别接种另外5个秆锈菌生理小种,包括rtjrm、21c3ctttm、34mkgqm、34mtgsm和34c3rtgqm。结果表明:抗病亲本t4-3102均表现为抗病,而感病亲本均表现为高感(图1c),1号为抗病亲本t4-3102;2号为感病亲本rusty。
79.实施例2:秆锈病抗性基因srkn的精细定位
80.为了对srkn进行遗传定位,对抗病亲本t4-3102、感病亲本rusty、23个抗病f2单株和23个感病f2单株进行90k snp芯片分析,将srkn初步定位于染色体2bl上(图2a)。
81.为了精细定位秆锈病抗病基因srkn,利用已经测序(但未完整组装)的抗病亲本kronos的参考基因组和感病亲本rusty的外显子组测序数据,快速鉴定候选染色体区域内双亲之间的多态性位点,并开发分子标记。利用1683个f2单株的分离群体以及得到的关键重组体f
2:3
家系,抗性基因srkn被精细定位在分子标记pku4856f2r2和pku4917f3r3之间,遗传距离为0.29cm(图2b),在四倍体小麦svevo的参考基因组中对应的物理区间是5.6mb。
82.实施例3:秆锈病抗性基因srkn候选基因的确定
83.两份四倍体硬粒小麦材料vernal和svevo对上述的秆锈菌生理小种表现出与t4-3102类似的抗病表型。利用t4-3102的选择家系td31-5r分别与vernal(vernal-bf9e)和svevo进行杂交,得到的f2群体进行大规模的等位性检测,结果表明它们可能都含有相同的抗性基因srkn。
84.利用已经完整测序的svevo参考基因组,发现5.6mb候选区间内存在52个注释的高可信的候选基因,其中有9个典型的nbs-lrr基因。同时,比较svevo基因组和部分组装的kronos基因组,发现52个候选基因的序列在svevo和kronos中是完全一样的。利用已经公布的kronos转录组数据库(https://dubcovskylab.ucdavis.edu/wheat_blast)进行候选基因的表达分析,结果表明其中7个重点关注的nbs-lrr候选基因有表达,包括
tritd2bv1g223210、tritd2bv1g223370、tritd2bv1g223450、tritd2bv1g223460、tritd2bv1g223490、tritd2bv1g223550和tritd2bv1g223640(图2c)。
85.为了进一步缩小候选基因范围,开展了不同四倍体小麦材料的单倍型分析。抗谱和抗病反应型分析得到多份可能含有srkn的四倍体小麦品种和不含有该基因的感病小麦品种,设计引物对七个nbs-lrr候选基因进行全长扩增并测序。结果表明,tritd2bv1g223210(简称为cnl1)最有可能是srkn的候选基因(图2d)。该基因全长为5197bp(从atg到taa,包含在seq id no:1中),由3个外显子组成,编码区核苷酸序列为4857bp(如seq id no:2所示),编码蛋白包含1618个氨基酸(如seq id no:3所示)。
86.实施例4:秆锈病抗性基因srkn的ems突变体验证
87.利用已有的kronos的ems突变体库(https://dubcovskylab.ucdavis.edu/wheat_blast),通过blast检索、基因注释和突变位点分析,从中鉴定得到一个突变体家系t4-3163,该家系在候选基因cnl1的编码区存在一个点突变,导致了其编码的蛋白翻译提前终止(图3a)。
88.由于kronos中还含有秆锈病抗性基因sr13,该基因对秆锈菌小种trttf具有抗性。因此,将t4-3163与抗病亲本t4-3102(sr13提前终止突变体)进行杂交,在f2群体中进行基因型鉴定,得到1个含有纯合双突变的f2单株,该f2单株自交得到f3家系19059-26,在该家系中srkn候选基因和sr13基因编码的蛋白都提前终止;同时得到它的姊妹系19059-27,在该家系中srkn候选基因不发生突变,而sr13基因编码的蛋白提前终止。
89.对得到的家系19059-26和19059-27进行室内秆锈菌接种。如图3b所示,双突变体家系19059-26中所有植株都表现出感病,而它的姐妹系19059-27中所有单株都表现出抗病,证明了该候选基因cnl1是srkn提供秆锈病抗性所必需的。
90.实施例5:秆锈病抗性基因srkn的转基因互补验证
91.为了确定候选基因cnl1是否能提供秆锈病抗性,进行了候选基因的转基因互补验证。
92.1、互补载体p1300-srkn的构建
93.克隆的kronos染色体片段如seq id no:1所示,包括基因起始密码子上游3371bp,基因全长(从atg到taa,5197bp)和终止密码子下游2406bp的基因组序列(图4a)。利用引物p1300-srknf1/r1、p1300-srknf2/r2进行pcr扩增,然后按照宝日医生物技术(北京)有限公司的hd cloning kit试剂盒的方法将候选基因重组到线性化的pcambia1300上。
94.其中引物序列如下:
95.p1300-srknf1:(seq id no:4)
96.ccatgattacgaattcgagctcttgtgatccatgtagtctcatcagctga
97.p1300-srknr1:(seq id no:5)
98.tccaaatattcatgccctgtttcctccaatct
99.p1300-srknf2:(seq id no:6)
100.gggcatgaatatttggaaaaattagtggatttgggcttct
101.p1300-srknr2:(seq id no:7)
102.acggccagtgccaagcttgtactacaatataacttggtcggatagaaaagacat
103.2、t0代转基因植株的获得
104.利用质粒提取试剂盒(购自天根生化科技北京有限公司),提取并纯化互补载体p1300-srkn的质粒,转入农杆菌菌株eha105,通过农杆菌侵染的方法转入普通小麦fielder,获得了14株srkn互补t0代转基因植株。
105.3、转基因植株(家系)的抗性鉴定
106.首先利用标记对获得的t0代互补转基因植株进行阳性鉴定,结果表明获得的14株转基因植株都是阳性材料。接下来我们对阳性转基因植株接种秆锈菌生理小种34mkgqm,培养12天后进行表型鉴定发现:t0代转基因植株(阳性转基因植株)kn1、kn2、kn4、kn6和kn7全部都表现出抗病,而对照fielder全部为感病(图4b)。收获t0代转基因植株的种子,获得t1代家系,每个家系选取25粒种子进行种植,待两叶一心期进行秆锈菌接种。表型鉴定结果表明,其中10个家系分离出抗病和感病单株,而另外4个家系中所有的后代单株都是抗病的。基因型鉴定结果表明,基因型和表型存在共分离关系。上述结果证明候选基因cnl1就是t4-3102中的秆锈病抗性基因srkn。
107.从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本发明从四倍体硬粒小麦中获得抗秆锈病基因srkn,有助于解析抗病基因对病原菌的抗病机制的研究;将编码srkn蛋白的核苷酸序列导入到小麦中,提高小麦对秆锈病的抗性,为小麦分子育种提供了可靠、有效的秆锈病抗源。
108.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1