一种暗褐脉柄牛肝菌子实体多糖及其提取分离纯化方法
1.本发明涉及一种暗褐脉柄牛肝菌子实体多糖及其提取分离纯化方法。
背景技术:
2.暗褐脉柄牛肝菌(phlebopus portentosus),有多个不同的名称,如常被人们称为暗褐网柄牛肝菌、黑牛肝菌以及不常称的名字,异样脉柄牛肝菌,怪形褐圆牛肝菌。暗褐脉柄牛肝菌的分布地比较广泛,在国内外都有,如泰国、墨西哥、斯里兰卡、新西兰等地,在国内,调查发现其主要分布在我国南部,如海南、云南、广西等地。暗褐脉柄牛肝菌子实体味道鲜美,含有很多营养成分,如钙、铁、核黄素、糖类、蛋白质等,其含有的8种必需氨基酸具有很高的营养价值,同时,还含有生物碱类物质,如腺嘌呤、腐胺等,其药用方面有清热解烦、补虚提神、疏筋活血的功效,可以治疗妇女白带、手足麻木、腰腿疼痛等症状。在云南西双版纳的农贸市场中,它是一种深受当地消费者喜爱的食用菌。
3.近些年关于真菌多糖提取分离纯化的研究中,多用水提醇沉法,为了提高多糖的提取率,有的结合了超声提取法,而后再进行sevage 法除蛋白,再依次进行脱色、多糖的分离纯化,如deae
‑
52纤维素法,有的进一步用葡聚糖凝胶柱色谱法将多糖分离纯化。郑婷婷采用水提醇沉法从牛肝菌子实体提取多糖。邓加聪在以水提醇沉的前提下,同时结合超声提取法。王亚涛在水提醇沉后,用sevage法除蛋白,得到牛肝菌粗多糖。唐贤又用了deae
‑
52纤维素法,对粗多糖进行分离。吴双艳在deae
‑
52纤维素法分离提纯多糖后,又用 sephadex g
‑
100葡聚糖凝胶柱色谱对多糖进行再分离提纯。
4.暗褐脉柄牛肝菌近几年的国内外研究中,关于其多糖的相关研究不多,目前主要集中在生物学特性、人工栽培和营养、质量评价与鉴定以及药用价值等方面的研究。如子实体形态,孢子深黄菌丝接种到基础培养基平皿,产生的菌丝褐色,多分支等等。张春霞等发现暗褐脉柄牛肝菌子实体富含矿物质以及蛋白质,并含有十几种氨基酸,同时又把暗褐网柄牛肝菌人工、野生和半人工子实体多种营养成分进行对比。杨天伟等发明并公开一种该菌菌核快速萌发方法。关于质量评价,杨天伟等用hplc法测定该菌中尿苷和麦角甾醇含量并建立其指纹图谱,也有构建ssr指纹图谱的方法。生物活性方面主要集中在抗氧化、抗肿瘤、肝损伤。
5.据研究发现多糖具有良好的生物活性并广泛应用于保健品、医药及功能食品中,研究多糖的提取、分离和纯化可为进一步研究奠定基础。而当前关于暗褐脉柄牛肝菌子实体中多糖的提取分离、纯化,结构鉴定研究很少。
技术实现要素:
6.为了深入开发利用暗褐脉柄牛肝真菌资源,本发明提供了一种暗褐脉柄牛肝菌子实体多糖及其提取分离纯化方法。
7.本发明的目的是通过以下技术方案实现的:
8.一种暗褐脉柄牛肝菌子实体多糖,由甘露糖man、葡萄糖glc、半乳糖gal、l
‑
岩藻糖
fuc四种单糖组成,甘露糖man、葡萄糖glc、半乳糖gal、l
‑
岩藻糖fuc的摩尔百分比依次为4.4%、22.8%、60.2%、 12.6%。
9.一种上述暗褐脉柄牛肝菌子实体多糖的提取分离纯化方法,包括如下步骤:
10.步骤一、暗褐脉柄牛肝菌子实体粗多糖的提取与分离
11.(1)子实体干燥
12.将新鲜的暗褐脉柄牛肝菌切成薄片,在温度为40~60℃的条件下干燥后粉碎;
13.(2)粗多糖的提取
14.采用水提醇沉法制备粗多糖,具体步骤如下:
15.(a)取暗褐脉柄牛肝菌粉末于烧杯中,按照液料比3~5:1加入乙醇,密封保存,浸渍过夜,离心弃去上清液;
16.(b)取离心后残渣置于烧杯中按照液料比6~10:1加入蒸馏水,水浴加热3h,离心,将上清液进行浓缩;
17.(c)按(a)、(b)的方法重复提取2~4次,将全部的上清液浓缩至100~400ml,将浓缩后的上清液按照体积比1:3~5的比例加入乙醇,充分搅拌后静置过夜,沉淀冷冻干燥,得到粗多糖;
18.(3)sevage法脱蛋白
19.取粗多糖粉末,按照料液比1:10~30加入蒸馏水溶解,置分液漏斗中,将1/5~1/3体积的粗多糖溶液与sevage试剂混合,震荡5~15min 静置10~30min,下层溶液从下口流出,中间变性蛋白丢弃,上层液体从上口倒出,继续萃取,重复4~6次,将上层液离心,取上清液;
20.(4)脱色
21.采用sp825大孔吸附树脂除去粗多糖溶液的色素;
22.(5)粗多糖的沉淀
23.取sp825大孔树脂脱色后的溶液过滤,向滤液中加入乙醇,静置过夜,离心,沉淀冷冻干燥,得粗多糖;
24.步骤二、deae
‑
52纤维素柱色谱分离纯化
25.称取暗褐脉柄牛肝菌粗多糖0.5~1.0g,加入蒸馏水溶解,离心,取上清液上样,分别用蒸馏水、0.1、0.2、0.3、0.4、0.5mol/lnacl 溶液依次洗脱,设定自动收集装置5~10min一次,平均每管6~10ml,用苯酚浓硫酸显色的方法每隔5管测定吸光度,绘制deae
‑
52洗脱曲线,再将各个峰的溶液收集在一起,浓缩至10~20ml;
26.步骤三、粗多糖的纯化
27.将暗褐脉柄牛肝菌多糖浓缩液装入透析袋中,先用自来水透析 16~24h,再用去离子水透析12~24h,透析后,冷冻干燥,得到暗褐脉柄牛肝菌多糖各个洗脱组分;
28.步骤四、丙烯葡聚糖凝胶s
‑
400hr纯化
29.(1)取20~30%乙醇保存的丙烯葡聚糖凝胶s
‑
400hr,用无菌去离子水洗至无醇味,再用磷酸缓冲溶液浸泡脱气;
30.(2)湿法装柱于层析柱,用磷酸缓冲液平衡35~40h,用去离水洗2~3个柱体积使磷酸缓冲液尽可能的流出;
31.(3)将浓度为3~5mg/ml暗褐脉柄牛肝菌粗多糖溶液上样,上样量为4ml,用去离子
水洗脱,洗脱液速度为0.8~1.0ml/min,每 6~8min收集一管,洗脱时间320~330min。
32.相比于现有技术,本发明具有如下优点:
33.本发明从暗褐脉柄牛肝菌子实体中制备得到了一种多糖,并对其结构特征进行了一定的表征,为暗褐脉柄牛肝菌多糖的制备及结构解析积累了实验数据。
附图说明
34.图1为葡萄糖的标准曲线;
35.图2为暗褐脉柄牛肝菌多糖的deae
‑
52纤维素色谱洗脱曲线;
36.图3为丙烯葡聚糖凝胶s
‑
400hr图谱;
37.图4为暗褐脉柄牛肝菌多糖的gpc测定图;
38.图5为紫外分光光度波长扫描图;
39.图6为13种单糖混标的hplc色谱图;
40.图7为样品中单糖的hplc色谱图;
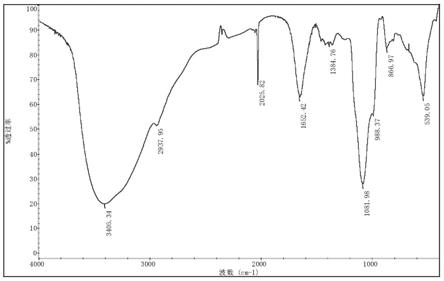
41.图8为暗褐脉柄牛肝菌多糖的红外光谱图;
42.图9为暗褐脉柄牛肝菌多糖的1h
‑
nmr;
43.图10为暗褐脉柄牛肝菌多糖的1h
‑
nmr放大图;
44.图11为暗褐脉柄牛肝菌多糖的
13
c
‑
nmr;
45.图12为暗褐脉柄牛肝菌多糖的
13
c
‑
nmr放大图;
46.图13为暗褐脉柄牛肝菌多糖的电镜扫描图,(a)500放大倍率,(b)1000放大倍率,(c)2000放大倍率。
具体实施方式
47.下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
48.本发明提供了一种暗褐脉柄牛肝菌子实体多糖的提取分离纯化方法,所述方法将暗褐脉柄牛肝菌子实体低温干燥后粉碎,采用水提醇沉法制备粗多糖,sevage试剂除蛋白,考察不同型号大孔吸附树脂除色素效果确定树脂型号,deae
‑
52纤维素柱色谱分离纯化,透析袋透析除去无机盐及小分子杂质,再用丙烯葡聚糖凝胶s
‑
400hr继续分离纯化制备得精制多糖ppp
‑
1。采用高效凝胶渗透法测定多糖的分子量;采用pmp柱前衍生法测定单糖组成;采用紫外光谱判断多糖是否有核酸或蛋白,对纯化的多糖,进行红外光谱和核磁共振波谱测定,对糖的构型进行分析;采用扫描电镜观察多糖形状。具体实施步骤如下:
49.步骤一、暗褐脉柄牛肝菌子实体粗多糖的提取与分离
50.(1)子实体干燥
51.将新鲜的暗褐脉柄牛肝菌切成薄片,置电热恒温鼓风干燥箱中 50℃干燥至可以掰断粉碎。
52.(2)粗多糖的提取
53.将干燥后的暗褐脉柄牛肝菌子实体用粉碎机粉碎,取100g暗褐脉柄牛肝菌粉末于烧杯中,按照液料比4:1加入乙醇,密封保存,浸渍过夜,离心(4000rpm,10min)弃去上清液,
取离心后残渣置1000 ml烧杯中按照液料比8:1加入蒸馏水,水浴加热3h,离心(4000rpm, 10min),将上清液进行浓缩,按上述方法重复提取3次,将全部的上清液浓缩至200ml,将浓缩后的上清液按1:4的比例加入乙醇,充分搅拌后静置过夜,沉淀冷冻干燥,得到粗多糖。
54.(3)sevage法脱蛋白
55.取粗多糖粉末,按照料液比1:20加入蒸馏水溶解,置分液漏斗中,将1/4体积的粗多糖溶液与sevage试剂混合,震荡10min静置 20min,下层溶液从下口流出,中间变性蛋白丢弃,上层液体从上口倒出,继续萃取,重复5次。将上层液离心(4000rpm,10min),取上清液。
56.(4)脱色
57.采用大孔吸附树脂除去粗多糖溶液的色素。
58.对hp2mgl、hp20、sp850、sp825几种型号的大孔树脂进行筛选,测定多糖脱色前后的吸光度,分别计算溶液前后的色素去除率、多糖保留率、蛋白质去除率,按照多糖保留率50%、色素去除率30%、蛋白质去除率20%进行加权,再选择合适的大孔吸附树脂。最终确定 sp 825进行脱色。
59.(5)粗多糖的沉淀及含量测定
60.取大孔树脂脱色后的溶液过滤,向滤液中加入乙醇,静置过夜,离心,沉淀冷冻干燥,称量,得粗多糖质量0.8677g,测定粗多糖中多糖含量。
61.步骤二、deae
‑
52纤维素预处理与装柱及分离
62.(1)预处理:将deae
‑
52纤维素,加入蒸馏水,搅拌密封,浸泡溶胀48h,抽滤,用0.5mol/l的naoh溶液浸泡2h,用蒸馏水洗至ph 6左右,上柱,依据体积计算deae
‑
52纤维素45g。
63.(2)装柱:将层析柱(2cm
×
50cm)垂直固定,加入50ml去离子水,将预处理好的deae
‑
52纤维素搅拌均匀,缓慢倒入层析柱,静置12h。
64.(3)deae
‑
52柱色谱分离:称取暗褐脉柄牛肝菌粗多糖0.8g,加入蒸馏水溶解,离心,取上清液上样,分别用蒸馏水、0.1、0.2、 0.3、0.4、0.5mol/lnacl溶液依次洗脱,设定自动收集装置7min一次,平均每管8ml左右。用苯酚浓硫酸的方法每隔5管测定吸光度,绘制deae
‑
52洗脱曲线,再将各个峰的溶液收集在一起,浓缩至 10~20ml。
65.步骤三、粗多糖的纯化
66.将暗褐脉柄牛肝菌多糖浓缩液装入透析袋(截留分子量mwco= 3500da)中,先用自来水透析24h,再用去离子水透析12h,透析后,冷冻干燥,得暗褐脉柄牛肝菌多糖各个洗脱组分。
67.步骤四、丙烯葡聚糖凝胶s
‑
400hr纯化
68.取20%
‑
30%乙醇保存的丙烯葡聚糖凝胶s
‑
400hr,用无菌去离子水洗至无醇味,再用磷酸缓冲溶液(ph为7.2~7.4)浸泡脱气。湿法装柱于层析柱(2cm
×
50cm),用磷酸缓冲液平衡36h,用去离水洗2 个柱体积使磷酸缓冲液尽可能的流出。再将浓度为4mg/ml暗褐脉柄牛肝菌粗多糖溶液上样,上样量为4ml,用去离子水洗脱,洗脱液速度为0.85ml/min,每7min收集一管,洗脱时间329min。用苯酚浓硫酸法测定,绘制曲线。
69.步骤五、粗多糖的含量测定
70.通过配制不同浓度的葡萄糖溶液,制作标准曲线,进行测定。将葡萄糖标准品在
105~110℃下烘干至恒重,精密称取46.4mg的葡萄糖,加蒸馏水溶解于烧杯中,在500ml的容量瓶中进行定容处理,得葡萄糖标准溶液。
71.6%苯酚溶液的配制:将苯酚放在40℃水浴锅里进行融化,准确称取6.0g苯酚,置于100ml棕色容量瓶中,放入冰箱,避光保存备用。
72.(1)标准溶液的制备
73.称取葡萄糖标准品10mg于100ml容量瓶中,加蒸馏水溶解并定容至刻度,配成浓度为0.1mg/ml的葡萄糖标准溶液备用。
74.(2)标准曲线的建立
75.移取0.1mg/ml葡萄糖标准溶液0ml、0.1ml、0.2ml、0.3ml、 0.4ml、0.5ml、0.6ml、0.7ml分别置于10ml具塞试管中,每个试管加蒸馏水补至1.0ml。在试管中加入6%苯酚溶液1.0ml后再快速加浓硫酸5.0ml,混匀静置10min再于40℃水浴内加热15min,然后取出快速冷却至室温。取出在490nm测定吸光度值。
76.步骤六、测定多糖的分子量
77.采用水相gpc测定多糖的分子量,色谱条件:示差折光检测器(waters2414)、色谱柱(pl aquqgel
‑
oh mixed 8μm),柱温30℃,流动相(0.2mol/l nano3和0.01mol/l nah2po4.ph7)、流速1 ml/min,进样量10μl,进行不同分子量的葡聚糖标准品(1
×
103~ 1
×
105)和样品的分析。通过breeze软件进行数据分析,最后确定该多糖的平均分子量。
78.步骤七、多糖中单糖组成的测定
79.(1)多糖水解
80.称取10mg(精确到0.1mg)多糖样品于20ml的钳口瓶中,加入5ml的2mol/l tfa,充n2封管(10l/min,1min),100℃烘箱中水解2h;冷却后打开盖,取1ml加入1ml甲醇后,70℃水浴下用n2吹干,如此重复加甲醇并用n2吹干2次,以去除tfa;加入 1ml 0.3mol/l naoh溶液充分溶解残渣,为多糖水解液,做一定稀释后衍生测定。
81.(2)单糖衍生化
82.分别取400μl的混合单糖标准液或多糖水解液于5ml的具塞试管中,加400μl pmp甲醇溶液,漩涡混匀;于70℃水浴中反应2h;取出放置冷却至室温;加400μl 0.3mol/l的hcl中和(ph 6~7);加水1200μl,再加等体积的氯仿,涡旋混匀振摇,静置,弃去氯仿相,如此萃取2次。将水相用0.45μm微孔膜(水系)过滤后供hplc 进样分析。
83.(3)hplc检测条件
84.仪器型号:agilent1100,配dad检测器。
85.色谱条件:色谱柱c
18
柱,250mm
×
4.6mm,5μm;流动相a: 90mmol/l磷酸钠缓冲液(ph=7.8);流动相b:乙腈;检测波长: 250nm;柱温30℃;流速1ml/min;进样量:10μl。
86.表1梯度洗脱程序表
[0087][0088]
步骤八、紫外光谱分析
[0089]
取暗褐脉柄牛肝菌粗多糖10mg,置10ml容量瓶中定容,在 200~400nm范围进行扫描测定。
[0090]
步骤九、红外光谱分析
[0091]
取暗褐脉柄牛肝菌粗多糖2mg加入0.2g kbr固体混合研磨均匀,取约80mg压片,在4000~400cm
‑1的波数下进行红外光谱的测定。
[0092]
步骤十、核磁共振氢谱和碳谱测定
[0093]
称取暗褐脉柄牛肝菌粗多糖10mg溶于0.6ml重水(d2o)中,混匀后加入核磁管,密封。在核磁共振波谱仪上进行1h
‑
nmr和
13
c
‑
nmr测定。
[0094]
步骤十一、扫描电镜
[0095]
采用蔡司公司推出的sigma 300场发射扫描电子显微镜采用成熟的gemini光学系统设计,分辨率超过0.8nm。
[0096]
结果与分析:
[0097]
1、葡萄糖标准曲线的绘制
[0098]
葡萄糖标准曲线的绘制结果如图1所示,得到线性方程 a=12.425c
‑
0.0367(r=0.9998),表明线性关系良好。
[0099]
2、四种大孔树脂的筛选结果
[0100]
表2四种树脂对暗褐脉柄牛肝菌子实体多糖提取液的脱色试验结果
[0101][0102]
注:加权值按照多糖保留率50%、脱色率30%、蛋白质去除率20%。
[0103]
3、脱色率
[0104]
采用四种大孔树脂hp 2mgl、hp 20、sp 850、sp825进行脱色,脱色率分别为41.82%、55.72%、61.31%、63.49%。
[0105]
4、多糖的含量
[0106]
暗褐脉柄牛肝菌子实体提取除蛋白以及大孔树脂脱色后醇沉得到粗多糖0.8677g,粗多糖得率为0.8677%,粗多糖中多糖的含量为 44.13%。
[0107]
5、各峰透析后冷冻干燥后所得质量
[0108]
冷冻干燥后,用蒸馏水进行洗脱得到4个组分,分别为11.1mg、 3.8mg、3.6mg、2.6mg,0.1mol/lnacl洗脱溶液下得到3个组分,质量分别为66.8mg、5.3mg、19.5mg,0.2mol/l nacl洗脱溶液下得到1个组分,为14.2mg,0.3mol/l nacl洗脱溶液下得到一个组分为 10.1mg,0.4mol/l nacl洗脱溶液下得到1个组分9.2mg。取最高吸收峰组分66.8mg的多糖进行余下实验。
[0109]
6、凝胶柱色谱图
[0110]
从丙烯葡聚糖凝胶s
‑
400hr凝胶色谱中分析,说明该多糖为均一成分。
[0111]
7、多糖的分子量
[0112]
表3为暗褐脉柄牛肝菌多糖分子量表,图4为暗褐脉柄牛肝菌多糖的分子量色谱图,暗褐脉柄牛肝菌多糖的水相gpc洗脱曲线只有一个峰,重均相对分子量mw为31059da,说明多糖组分均一。
[0113]
表3暗褐脉柄牛肝菌多糖的分子量测定结果
[0114][0115]
注:mn为数均分子量,mw为重均相对分子量,mp为峰值分子量,polydispersity为分子量分布系数,用于衡量聚合物分子量分布的广度是mw/mn比值。
[0116]
8、多糖的紫外光谱分析法
[0117]
将配制好的暗褐脉柄牛肝菌多糖溶液进行紫外波长扫描,测定结果如图5所示。
[0118]
图5中曲线1是经deae
‑
52纤维素柱色谱分离纯化后得到的多糖溶液紫外光谱图,曲线2是该多糖经过丙烯葡聚糖凝胶s
‑
400hr 柱色谱分离纯化后的紫外光谱图,根据两图可以看到两个紫外分光光度波长扫描图中,该多糖在260nm附近有吸光度,过丙烯葡聚糖凝胶s
‑
400hr柱色谱分离纯化的紫外图中,结合多糖含量测定结果,推测可能为成分均一的糖蛋白复合体。
[0119]
9、多糖中单糖组成的测定结果
[0120]
从图6和图7中进行分析,根据13种单糖混合对照品进行对比,暗褐脉柄牛肝菌多糖由4种单糖组成,分别为甘露糖man、葡萄糖 glc、半乳糖gal、l
‑
岩藻糖fuc,其摩尔百分比为4.4%:22.8%: 60.2%:12.6%。
[0121]
10、红外光谱分析
[0122]
红外光谱图中,3405cm
‑1处的吸收峰宽又强,为多糖分子中oh 的分子间缔合的氢键,2937cm
‑1处的中等强度的吸收峰是饱和c
‑
h 伸缩振动,1652cm
‑1为酰胺羰基,说明组分中含有氨基糖,多糖中可能含有部分与糖相结合的蛋白。1348cm
‑1处出现弱的吸收峰,是由于 c
‑
h的变角振动。1081cm
‑1是醇羟基的变角振动吸收峰。这些都是典型的多糖特征峰。
988cm
‑1处的吸收峰,表明该多糖为吡喃型糖环, 866cm
‑1附近的一系列的吸收峰,表明该多糖同时存在α和β两种构型。
[0123]
11、多糖的核磁共振法分析
[0124]
一般情况下,在4.3~5.5ppm异头氢质子区,α
‑
糖苷的异头h质子的化学位移一般大于4.95ppm,β
‑
构型的糖异头h质子化学位移小于4.95ppm,根据图10,4.94ppm、4.93ppm、4.48ppm是β型h1 质子信号,5.01ppm和5.02ppm处是α型h1质子信号,表明该多糖既有β型吡喃糖环结构也有α型吡喃糖环结构,1.17ppm、1.18ppm、 1.27ppm、1.25ppm为岩藻糖ch3的质子信号。3.13ppm、3.41ppm 等化学位移在3.0~4.0ppm区域为糖残基中非异头质子的次甲基和亚甲基共振区,即结构信息共振信号。图12中,在异头碳的共振区(90 ~110ppm)中。97.91ppm是α型c1的共振信号,15.73ppm为岩藻糖的ch3上的c的共振信号,对于游离c6共振信号约在62ppm氧取代后则位移到68ppm,所以68.32ppm、68.87ppm是发生氧取代的c6信号,说明该多糖有(1
→
6)糖苷键。15.73ppm是ch3的吸收峰, 70~75ppm为c2~c5的信号峰,它们数值接近,仅凭现有数据难以判断取代情况。综合以上信息,可知该多糖包括α和β两种构型,68.32 ppm、68.87ppm是发生氧取代的c6信号,说明该多糖具有(1
→
6)糖苷键。
[0125]
12、电镜扫描图
[0126]
如图13为暗褐脉柄牛肝菌多糖的电镜扫描图,从图中可以看出,暗褐脉柄牛肝菌多糖呈片状,有的卷曲,大小不均匀,形状不是很均匀,在更高倍数下,表面相对紧密,说明此组分多糖分子间交联非常紧密,彼此间相互作用较强。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1