一种线粒体靶向的ph和粘度双通道检测荧光探针及其制备方法和用途
技术领域
1.本发明涉及一种线粒体靶向的ph和粘度双通道检测荧光探针及其制备方法和用途,以实现在溶液中和细胞中线粒体靶向的ph和粘度双通道检测荧光成像,具有选择性专一、检测高效、生物相容性良好的优点。
背景技术:2.线粒体是真核细胞母系遗传的细胞质细胞器,是重要的生物能合成工厂。线粒体在细胞新陈代谢,器官、组织以及整个生命体内包括ca
2+
平衡的调控、清除多余或者破损的细胞器和触发细胞死亡等方面都起着至关重要的作用。因此,细胞的存活需要维持正常的线粒体水平。线粒体缺陷或功能障碍与一些心血管和神经性疾病等有关。而且线粒体的微环境与其功能关系紧密,尤其是ph值和粘度直接影响其生化过程。例如线粒体表现出一种略碱性基质,穿过内膜的质子动力能驱动atp合成、离子及代谢物吸收到基质中去。由此可见,线粒体动态变化和微环境的检测对线粒体生物学及相关疾病的研究具有重要意义。
3.到目前为止,已报道的ph和粘度测定方法包括核磁共振法(nmr)、吸收光谱法、表面增强拉曼散射法(sers)、水凝胶等。而基于ph荧光探针的荧光成像方法因能排除其他信号分子的干扰,对ph具有特异性响应、灵敏度高和实时性等优点而备受关注。细胞器粘度是一种重要的微环境参数,它通过影响活细胞内生物分子和化学信号的相互作用和传递而发挥生物学功能。
4.近年来,荧光成像的方法已经被广泛应用于监测生物过程,但对细胞线粒体特异性成像还是非常少,特别是兼具粘度和ph双重检测功能,因此开发细胞ph和粘度双通道检测荧光探针是非常迫切和重要的。
技术实现要素:5.本发明旨在提供一种线粒体靶向的ph和粘度双通道检测荧光探针及其制备方法和用途,所要解决的技术问题是通过分子设计得到一种可以特异性靶向线粒体,且可以分别无干扰响应ph和粘度的有机小分子结构,可通过共聚焦荧光成像实时监测活细胞线粒体内ph和粘度的变化,具有选择性高、灵敏度高、光稳定性好等优点,以实现细胞线粒体的荧光成像。细胞毒性测试表明本发明ph和粘度检测荧光探针的细胞相容性良好。
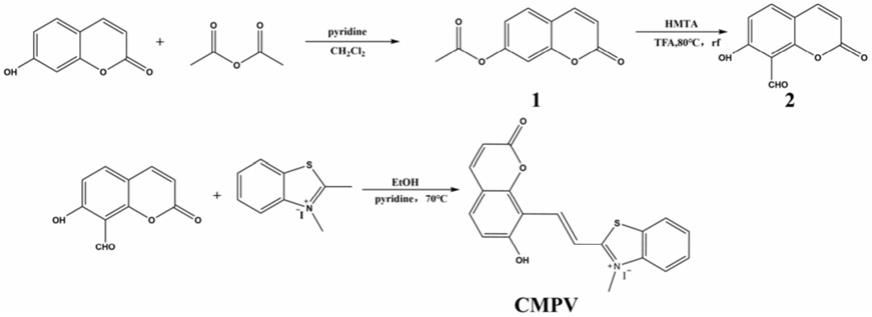
6.本发明线粒体靶向的ph和粘度双通道检测荧光探针,简记为cmpv,以香豆素为母体,其结构式如下:
[0007][0008]
本发明线粒体靶向的ph和粘度双通道检测荧光探针的制备方法,包括如下步骤:
[0009]
步骤1:将3g(18.5mmol)7
‑
羟基香豆素和5ml乙酸酐溶解在25ml二氯甲烷中,25℃活化半小时再加入0.1ml哌啶继续反应1小时;反应结束后,加冰水洗涤,抽滤得到中间体1,为白色固体,3.02g,产率80%。
[0010]
步骤2:在冰水浴条件下,在圆底烧瓶中加入磁子,20ml三氟乙酸(tfa)和3g(21.4mmol)六亚甲基四胺(hmta),保持冰水浴搅拌半小时,室温下继续反应1小时,将2g(9.8mmol)中间体1溶解在5ml tfa中然后缓慢加入体系中,80℃回流(rf)反应48h;反应结束后,柱色谱法提纯得淡黄色固体中间体2(洗脱液为石油醚:乙酸乙酯=8:1,v/v),1.21g,产率65%。
[0011]
步骤3:1.00g(5.2mmol)中间体2,1.5g(5.2mmol)苯并噻唑碘甲烷鎓化物,10ml无水乙醇作为溶剂,再滴加3滴哌啶,90℃回流反应14小时;反应结束后用丙酮洗,过滤得到灰绿色色固体目标产物cmpv。
[0012]
本发明线粒体靶向的ph和粘度双通道检测荧光探针cmpv的合成过程如下:
[0013][0014]
本发明线粒体靶向的ph和粘度双通道检测荧光探针的用途,是用于制备特异性靶向线粒体的荧光探针,所述荧光探针能够分别无干扰地响应ph和粘度,从而通过共聚焦荧光成像实时监测活细胞线粒体内ph和粘度的变化。具体检测方法如下:
[0015]
将本发明cmpv溶于dmso中制得2mm的母液,各取15μl母液于3ml不同ph的pbs溶剂中,获得10μm cmpv在不同测试液中的荧光和紫外谱图。随着ph的降低,cmpv的吸光度在370nm升高500nm降低,荧光在451nm不断降低。以上结果为表明cmpv在溶液可有效检测ph,可以作为ph检测器。使用不同比例的甘油和蒸馏水配制不同粘度体系,加入15μl探针母液配制成10μm粘度测试体系,荧光在522nm不断升高,结果表明cmpv在溶液中可有效检测粘度。使用线粒体的商业染料mtdr与cmpv在hela细胞中进行共定位研究。结果表明cmpv与
mtdr的荧光图像重叠良好,并且cmpv与mtdr的pearson共定位系数计算为0.92。以上结果表明,cmpv可以很好地定位于活细胞的细胞线粒体。探究cmpv在细胞中微环境检测的能力,对细胞使用制霉菌素处理(线粒体肿胀剂)的样品进行处理,制霉菌素处理的细胞随着时间处理增加的情况下荧光逐渐增强。用10mm尼日利亚菌素和高钾离子缓冲溶液均质化细胞内ph,当均质化后不同ph的细胞内加入探针cmpv,共聚焦显微镜下探针的蓝色荧光随着细胞内的ph降低蓝色荧光随之减弱。结果表明,在细胞内cmpv可以检测细胞内粘度和ph。
[0016]
本发明线粒体靶向的ph和粘度双通道检测探针,在溶液中和细胞中都可有效检测ph和粘度。细胞毒性测试表明cmpv的细胞相溶性良好,双光子共聚焦荧光显微成像实验表明cmpv可以有效定位细胞线粒体(定位系数为0.92),适用于细胞线粒体荧光成像。
附图说明
[0017]
图1(a)cmpv(10μm)在不同ph的pbs缓冲溶液中的紫外吸收滴定光谱;(b)cmpv(10μm)在不同ph的pbs缓冲溶液中的荧光滴定光谱。
[0018]
图2(a)cmpv(10μm)在不同ph的pbs缓冲溶液中的非线性拟合;(b)cmpv(10μm)在不同ph的pbs缓冲溶液中的线性拟合。
[0019]
图3(a)cmpv(10μm)在不同水和甘油体系中的荧光发射光谱;(b)cmpv(10μm)在不同水和甘油体系中的荧光强度与粘度的线性关系。
[0020]
图4是不同浓度(0μm、5μm、10μm、15μm、20μm)cmpv作用下的hela细胞存活率图。
[0021]
图5是10μmcmpv和1μm商用细胞线粒体荧光探针(mtdr)同时共染hela细胞的细胞线粒体共聚焦荧光成像图。探究cmpv的细胞线粒体靶向能力。
[0022]
图6是10μmcmpv在均质化细胞内ph的共聚焦荧光成像图。探究cmpv的细胞内ph检测能力。
[0023]
图7是10μmcmpv和5μm制霉菌素共聚焦荧光成像图。探究cmpv在细胞中粘度检测的能力。
具体实施方式
[0024]
下面通过具体的实施例对本发明技术方案做进一步说明。
[0025]
实施例1:cmpv的合成
[0026]
1、将3g(18.5mmol)7
‑
羟基香豆素和5ml乙酸酐溶解在25ml二氯甲烷中,25℃活化半小时再加入0.1ml哌啶继续反应1小时;反应结束后,加冰水洗涤,抽滤得到中间体1,为白色固体,3.02g,产率80%。
[0027]
2、在冰水浴条件下,在圆底烧瓶中加入磁子,20ml三氟乙酸(tfa)和3g(21.4mmol)六亚甲基四胺(hmta),保持冰水浴搅拌半小时,室温下继续反应1小时,将2g(9.8mmol)中间体1溶解在5ml tfa中然后缓慢加入体系中,80℃回流(rf)反应48h;反应结束后,柱色谱法提纯得淡黄色固体中间体2(洗脱液为石油醚:乙酸乙酯=8:1,v/v)得淡黄色固体中间体2,1.21g,产率65%。
[0028]
3、1.00g(5.2mmol)中间体2,1.5g(5.2mmol)苯并噻唑碘甲烷鎓化物,10ml无水乙醇作为溶剂,再滴加3滴哌啶,90℃回流反应14小时;反应结束后用丙酮洗,过滤得到灰绿色色固体目标产物cmpv。
[0029]1h nmr(400mhz,dmso
‑
d6,ppm)δ12.29(s,1h),8.41(d,j=8.4hz,1h),8.30
‑
8.27(m,3h),8.03(d,j=9.5hz,1h),7.93
‑
7.85(m,1h),7.80(t,j=7.7hz,1h),7.73(d,j=8.7hz,1h),7.00(d,j=8.7hz,1h),6.36(d,j=9.5hz,1h),4.26(s,3h).
13
c nmr(151mhz,dmso
‑
d6,ppm)δ173.25,163.25,159.96,154.84,145.47,142.66,137.33,133.75,130.03,128.93,128.24,124.80,117.38,116.62,114.19,112.21,111.68,109.16,36.68.
[0030]
实施例2:cmpv在不同ph溶剂中的光谱测试
[0031]
为了探究cmpv在溶剂中检测不同ph和粘度的紫外和荧光变化,将本发明cmpv溶于dmso中制得2mm的母液,取15μl母液于3ml不同ph的pbs溶剂中,获得10μm cmpv在不同测试液中的紫外和荧光谱图(图1)。随着ph的降低,cmpv的吸光度在370nm升高500nm降低,荧光在451nm不断降低。以上结果为表明cmpv在溶液可有效检测ph,可以作为ph检测器。将ph与荧光值进行线性拟合图2发现探针在ph在6.5~8.5的荧光值和ph有很好的线性关系(r2=0.99)。
[0032]
实施例3:cmpv在不同粘度溶剂中的光谱测试
[0033]
将本发明cmpv溶于dmso中制得2mm的母液,使用不同比例的甘油和蒸馏水配制不同粘度体系溶剂,加入15μl探针母液配制成10μm粘度测试体系,测试探针在不同粘度条件下荧光光谱。随着体系粘度的增大荧光最大发射在519nm不断升高,结果表明cmpv在溶液中可有效检测粘度。
[0034]
实施例4:细胞毒性测试
[0035]
我们用mtt(5
‑
二甲基噻唑
‑2‑
基
‑
2,5
‑
二苯基四唑溴化物)方法进行了细胞毒性实验。cmpv在活hela细胞中加入各种浓度(0μm,5.0μm,10.0μm,15.0μm,20.0μm),孵育24小时后测试,结果如图5所示,以上显示cmpv的生物毒性较低,可以进行生物成像应用。
[0036]
实施例5:细胞定位测试
[0037]
为了研究cmpv的细胞线粒体定位性能,这里使用细胞线粒体的商业染料(mtdr)与cmpv在hela细胞中进行共定位研究。结果表明cmpv的蓝色通道(λ
em
=420
‑
460nm,λ
ex
=405nm)和mtdr(λ
em
=650
‑
670nm,λ
ex
=633nm)的荧光图像重叠良好,并且cmpv与mtdr的pearson共定位系数计算为0.92(图5)。这些结果表明,cmpv可以很好地定位于活细胞的细胞线粒体中。
[0038]
实施例6:cmpv在细胞线粒体上的ph检测实验
[0039]
为了探究cmpv在细胞线粒体上的ph的检测能力,对探针cmpv与通过尼日利亚菌素和高钾离子缓冲溶液均质化细胞内ph的hela细胞共同孵育如图6,与hela细胞孵育30min后,cmpv通道ⅰ的蓝色荧光(channelⅰ:λ
em
=440
±
20nm.λ
ex
=405nm)随着细胞内的ph降低一同降低。这表示cmpv的适合监测细胞内的ph检测。
[0040]
实施例7:cmpv在细胞中粘度检测的能力
[0041]
制霉菌素(nystatin)能够引起细胞线粒体肿胀,是一种公认的细胞线粒体增稠剂。为了探究cmpv在细胞中产生粘度检测的能力,制霉菌素处理的hela细胞样品与探针共同孵育如图7。随着制霉菌素处理时间增加,细胞内绿色荧光明显增强(channelⅰ:λ
em
=520
±
20nm.λ
ex
=458nm)。结果表明,在细胞内cmpv在制霉菌素处理的hela细胞能很好地检测细胞线粒体粘度增加。
