蒽基大环分子及其制备方法与应用
1.本发明涉及有机合成技术领域,特别是涉及一种蒽基大环分子及其制备方法与应用。
背景技术:
2.分子识别是主体分子与客体分子进行键合的过程。分子识别,尤其是水相分子识别,在生物体系中非常常见,是构成生命现象的基础。研究水相中的分子识别,不仅有助于理解生命活动中的识别过程,而且为设计、合成人工功能性分子识别体系提供了基础。
3.大环分子在分子识别中具有广泛的应用,传统的大环主体化合物如环糊精、杯芳烃、葫芦脲、柱芳烃等由于疏水效应的驱动都能在水相中进行分子识别,但是由于疏水效应能够提供的驱动力有限,这些传统的大环分子难以满足复杂环境下的识别和应用要求。随着有机合成技术的发展,人们也陆续发展了一些新的大环分子,但仍然存在以下问题:(1)在水中对客体的识别强度通常不高,尤其是难以高强度地识别电中性的亲水性分子,以及电中性的极性官能团;(2)通常缺少荧光性能的基团,往往只能键合客体分子,而不能通过光学方法完成对客体分子的检测;(3)由于分子间非共价键(例如氢键)的本质是静电力,静电力与所在环境的介电常数成反比,大介电常数的溶剂(例如水)将削弱分子间非共价键弱相互作用的强度,因此难以在介电常数较大的溶剂中利用分子间非共价键的驱动实现分子识别。
技术实现要素:
4.基于此,有必要提供一种蒽基大环分子及其制备方法,该蒽基大环分子可以用于分子识别,尤其是在水中的分子识别,且具有能通过非共价键驱动、识别强度高、能通过光学方法实现对客体分子检测等优势。
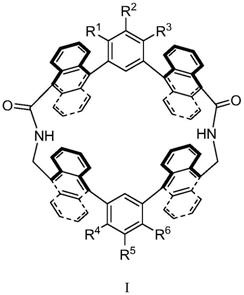
5.本发明的一个方面,提供了一种蒽基大环分子,其具有如式i所示的结构:
6.7.r1~r6分别独立地选自
‑
h、
‑
d或
‑
xr7;
8.其中,x为
‑
o
‑
或
‑
ch2‑
;
9.r7每次出现,独立选自具有1至18个c原子的直链烷基、烷氧基、酯基、羧酸盐取代基、铵盐取代基、磺酸盐取代基、磷酸盐取代基、吡啶阳离子取代基、咪唑阳离子取代基,或具有3至18个c原子的支链烷基或烷氧基。
10.本发明提供的蒽基大环分子具有深穴空腔结构,其在空腔中具有氢键键合位点,且氢键被屏蔽在这个相对非极性的深穴空腔环境中,如此,一方面可以使得氢键的强度较少地被削弱,另一方面避免了水分子对氢键位点的竞争。因此,本发明提供的蒽基大环分子可以同时利用疏水效用和氢键进行待检测分子的识别,大大增加了对客体分子的键合能力,在大环浓度较低的情况下,依旧可以与待检测分子键合,在待检测分子的浓度较低的情况下,也同样可以高强度地键合待检测分子。此外,由于蒽基这一大共轭体系的引入,使得大环分子本身具备了一定的吸光能力,为通过光学方法实现对手性分子的检测和传感奠定了基础。因此,本发明提供的大环分子在分子识别领域有着广阔的应用前景。
11.在一些实施方式中,所述x为
‑
o
‑
。
12.在一些实施方式中,所述r7每次出现,独立地选自
‑
h、具有1至4个c原子的直链烷基、烷氧基、酯基、羧酸盐取代基、或铵盐取代基。
13.在一些实施方式中,所述r7每次出现,独立地选自
‑
ch3、
‑
ch2cooch2ch3、
‑
ch2coo
‑
nh
4+
或
‑
ch2coo
‑
na
+
。
14.在一些实施方式中,所述r2和/或r5为
‑
h。
15.在一些实施方式中,所述r2=r5,且所述r1=r3=r4=r6。
16.在一些实施方式中,所述蒽基大环分子选自以下化合物:
17.18.本发明的另一方面,还提供了前述蒽基大环分子的制备方法,其包括以下步骤:
19.提供具有如式ii
‑
1所示的刚性桥联双蒽,使其发生酰基化反应,制备如式iii
‑
1所示的双醛基刚性桥联双蒽;式iii
‑
1所示的双醛基刚性桥联双蒽经过氨基化反应,制备式iv
‑
1所示的化合物;
20.提供具有如式ii
‑
2所示的刚性桥联双蒽,使其发生酰基化反应,制备如式iii
‑
2所示的双醛基刚性桥联双蒽;式iii
‑
2所示的双醛基刚性桥联双蒽经过氧化反应,制备式iv
‑
2所示的化合物;
[0021][0022]
将iv
‑
1和iv
‑
2所示的化合物进行环化反应,制备所述蒽基大环分子;
[0023]
式中r1~r6的含义同前述任一实施方式。
[0024]
在一些实施方式中,ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽进行的酰基化反应中,ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽与酰基化试剂的摩尔比为1:(4~5)。
[0025]
本发明的又一方面,还提供了前述的蒽基大环分子在分子识别中的应用。
具体实施方式
[0026]
为了便于理解本发明,下面将参照相关实施例对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
[0027]
在本发明中,“取代”表示被取代基中的氢原子被取代基所取代。
[0028]
在本发明中,同一取代基多次出现时,可独立选自不同基团。如通式含有多个r1,则r1可独立选自不同基团。
[0029]
在本发明中,“烷基”可以表示直链、支链和/或环状烷基。烷基的碳数可以为1至50、1至30、1至20、1至10或1至6。包含该术语的短语,例如,“c1‑9烷基”是指包含1~9个碳原子的烷基,每次出现时,可以互相独立地为c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6烷基、c7烷基、c8烷基或c9烷基。烷基的非限制性实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、异丁基、2
‑
乙基丁基、3,3
‑
二甲基丁基、正戊基、异戊基、新戊基、叔戊基、环戊基、1
‑
甲基戊基、3
‑
甲基戊基、2
‑
乙基戊基、4
‑
甲基
‑2‑
戊基、正己基、1
‑
甲基己基、2
‑
乙基己基、2
‑
丁基己基、环己基、金刚烷等。
[0030]
本发明中,羧酸盐取代基、铵盐取代基、磺酸盐取代基、磷酸盐取代基是指取代基
中相应的阴离子成盐后的形式,例如羧酸盐取代基是指带有已成盐的羧基的取代基,如
‑
ch2coo
‑
na
+
。
[0031]
本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
[0032]
本发明中的温度参数,如无特别限定,既允许为恒温处理,也允许在一定温度区间内进行处理。所述的恒温处理允许温度在仪器控制的精度范围内进行波动。
[0033]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0034]
本发明的一个方面,提供了一种蒽基大环分子,其具有如式i所示的结构:
[0035][0036]
r1~r6分别独立地选自
‑
h、
‑
d或
‑
xr7;
[0037]
其中,x为
‑
o
‑
或
‑
ch2‑
;
[0038]
r7每次出现,独立选自具有1至18个c原子的直链烷基、烷氧基、酯基、羧酸盐取代基、铵盐取代基、磺酸盐取代基、磷酸盐取代基、吡啶阳离子取代基、咪唑阳离子取代基,或具有3至18个c原子的支链烷基或烷氧基。
[0039]
本发明提供的蒽基大环分子具有深穴空腔结构,其在空腔中具有氢键键合位点,且氢键被屏蔽在这个相对非极性的深穴空腔环境中,如此,一方面可以使得氢键的强度较少地被削弱,另一方面避免了水分子对氢键位点的竞争。因此,本发明提供的蒽基大环分子可以同时利用疏水效用和氢键进行待检测分子的识别,大大增加了对客体分子的键合能力,在大环浓度较低的情况下,依旧可以与待检测分子键合,在待检测分子的浓度较低的情况下,也同样可以高强度地键合待检测分子。此外,由于蒽基这一大共轭体系的引入,使得大环分子本身具备了一定的吸光能力,为通过光学方法实现对手性分子的检测和传感奠定了基础。因此,本发明提供的大环分子在分子识别领域有着广阔的应用前景。
[0040]
在一些实施方式中,x为
‑
o
‑
。当x为氧时,有利于在蒽基大环分子上接入更多种类的尾链,从而通过调整尾链的种类或长度实现对蒽基大环分子疏水性能的调控,使其能应对不同客体分子的键合,大大提升了分子识别的灵敏度,实现了在客体分子低浓度,或大环
分子低浓度情况下分子识别的可能性,有效拓展了分子识别的应用场景。
[0041]
在一些实施方式中,r7每次出现,独立地选自
‑
h、具有1至4个c原子的直链烷基、烷氧基、酯基、羧酸盐取代基、或铵盐取代基。
[0042]
在一些实施方式中,r7每次出现,独立地选自
‑
ch3、
‑
ch2cooch2ch3、
‑
ch2coo
‑
nh
4+
或
‑
ch2coo
‑
na
+
。
[0043]
在一些实施方式中,r2和/或r5为
‑
h。
[0044]
在一些实施方式中,优选地,r2=r5,且r1=r3=r4=r6。
[0045]
在一些实施方式中,蒽基大环分子选自以下化合物:
[0046][0047]
本发明的另一方面,还提供了前述蒽基大环分子的制备方法,其包括以下步骤:
[0048]
提供具有如式ii
‑
1所示的刚性桥联双蒽,使其发生酰基化反应,制备如式iii
‑
1所示的双醛基刚性桥联双蒽;式iii
‑
1所示的双醛基刚性桥联双蒽经过氨基化反应,制备式iv
‑
1所示的化合物;
[0049]
提供具有如式ii
‑
2所示的刚性桥联双蒽,使其发生酰基化反应,制备如式iii
‑
2所示的双醛基刚性桥联双蒽;式iii
‑
2所示的双醛基刚性桥联双蒽经过氧化反应,制备式iv
‑
2所示的化合物;
[0050][0051]
将iv
‑
1和iv
‑
2所示的化合物进行环化反应,制备蒽基大环分子;
[0052]
式中r1~r6的含义同前述任一实施方式。
[0053]
在一些实施方式中,ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽进行的酰基化反应中,ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽与酰基化试剂的摩尔比为1:(4~5)。
[0054]
在一些实施方式中,ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽进行的酰基化反应的酰基化试剂为1,1
‑
二氯甲醚,催化剂为四氯化钛,溶剂为二氯甲烷;ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽与酰基化试剂及催化剂的摩尔比为1:(4~5):(4~5)。可选地,ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽与酰基化试剂及催化剂的摩尔比例如可以是1:(4.2~4.8):(4.2~4.8),又如还可以是1:(4.4~4.6):(4.4~4.6)。
[0055]
在一些实施方式中,酰基化反应包括以下步骤:
[0056]
将ii
‑
1和/或ii
‑
2所示的刚性桥联双蒽溶解于二氯甲烷中,加入1,1
‑
二氯甲醚,并降温至0
±
2℃,搅拌下滴入四氯化钛。滴完后继续维持体系温度在0
±
2℃下0.8h~1.2h,优选1h,然后升温至室温并维持2h~4h,优选3h;将反应液倒入冰水中,并调节ph值为6~8。然后萃取,合并有机相,减压旋蒸除去有机溶剂,通过柱层析分离提纯,得到双醛基刚性桥联双蒽。
[0057]
在一些实施方式中,环化反应包括以下步骤:
[0058][0059]
将氧化产物iv
‑
2与将六氟磷酸苯并三唑
‑1‑
基
‑
氧基三吡咯烷基磷(pybop)溶解于干燥的n,n
‑
二甲基甲酰胺(dmf)中,将氨基化产物iv
‑
1溶解于另一份干燥的dmf中。在氮气保护下,将上述两份溶液同时滴加入溶解有n,n
‑
二异丙基乙胺(dipea)的干燥dmf中,5h~7h滴完,优选6h。然后在氮气保护下室温搅拌22h~26h,优选24h。随后减压旋干大部分溶
剂,并将剩余的溶液倒入冰水中,析出沉淀;将沉淀用柱层析分离提纯,得到固体产物蒽基大环分子i。
[0060]
在一些实施方式中,氨基化产物iv
‑
1、氧化产物iv
‑
2、pybop及dipea的摩尔比为1:1:(2.5~3.5):(29~31),优选地,摩尔比为1:1:3:30。
[0061]
在一些实施方式中,氨基化反应包括以下步骤:
[0062]
将双醛基刚性桥联双蒽、三乙基硅烷、氨基甲酸叔丁酯(bocnh2)和三氟乙酸溶于乙腈和二氯甲烷混合溶液中。氮气保护下,室温搅拌11h~13h,优选12h。减压旋干溶剂,加入二氯甲烷和三氟乙酸,在氮气保护下搅拌11h~12h,优选12h。减压旋去大部分有机溶剂,加入乙醚,析出沉淀。过滤沉淀,得到氨基化产物。
[0063]
在一些实施方式中,双醛基刚性桥联双蒽、三乙基硅烷、氨基甲酸叔丁酯、三氟乙酸的摩尔比为1:(6.5~7.5):(6.5~7.5):(3~5),优选地,摩尔比为1:7:7:4。
[0064][0065]
在一些实施方式中,氧化反应包括以下步骤:
[0066]
将双醛基刚性桥联双蒽、nh2so3h和naclo2溶于h2o、meoh和thf的混合溶液中,室温下搅拌11h~12h,优选12h,倒入水中析出沉淀,过滤得到氧化产物。
[0067]
在一些实施方式中,双醛基刚性桥联双蒽、nh2so3h和naclo2的摩尔比为1:(7.5~8.5):(7.5~8.5),优选地,摩尔比为1:8:8。
[0068]
在一些实施方式中,h2o、meoh和thf的体积比为1:(0.8~1.2):(0.8~1.2),优选地,体积比为1:1:1。
[0069][0070]
在一些实施方式中,刚性桥联双蒽可以通过以下方法制备:
[0071][0072]
本发明的又一方面,还提供了前述的蒽基大环分子在分子识别中的应用。
[0073]
优选地,本发明的蒽基大环分子特别适用于醌类化合物以及含有1,4
‑
二氧六环骨架化合物的识别。
[0074]
本发明同时还提供了前述蒽基大环分子在手性分子检测和传感中的应用。本发明通过蒽基的引入,使得大环分子主体具备一定的吸光性,从而使得被键合的客体分子即使
没有圆二色光谱信号也可以通过圆二色光谱进行检测,因此,实现了对手性分子的检测和传感,具备广泛的应用前景。
[0075]
以下结合具体实施例和对比例对本发明做进一步详细的说明。可理解,以下实施例所用的仪器和原料较为具体,在其他具体实施例中,可不限于此。
[0076]
实施例1
[0077]
(1)双醛基刚性桥联双蒽化合物a的制备:
[0078][0079]
中间体化合物s0的制备:将9
‑
溴蒽(12g,45mmol)溶解于干燥四氢呋喃(300ml)中,在低温
‑
80℃,氮气保护下,加入正丁基锂的干燥四氢呋喃溶液(2.60m,19.2ml,50.6mmol)。维持
‑
80℃,搅拌两小时后,加入氯化锌(9.1g,66.7mmol)。维持
‑
80℃,搅拌四小时后,升温至室温,搅拌一天。将1,3
‑
二溴
‑
4,6
‑
二甲氧基苯(3.4g,11.5mmol),二(氰基苯)二氯化钯(0.44g,1.2mmol)和三叔丁基膦的正己烷溶液(10%wt,5.6ml,2.3mmol)加入50ml干燥四氢呋喃中,氮气保护下,室温搅拌半小时。将该溶液转移注入之前已室温搅拌一天的反应体系中,之后升温至85℃搅拌两天。之后,将反应降温至室温,过滤溶液,得到滤饼即为粗产物。用甲醇、正己烷和氯仿依次洗涤,得到黄色固体产物s0(5.0g,yield 94%)。
[0080]
化合物a的制备:将中间产物s0(4.9g,10.0mmol,1equiv.)溶解于200ml二氯甲烷中,加入1,1
‑
二氯甲醚(3.6ml,40.0mmol,4equiv.).降温至0℃,搅拌下滴入ticl4(4.0ml,40.0mmol,4equiv.)。滴完后继续维持0℃一小时,之后升温至室温并维持三小时。将反应液倒入冰水(200ml)中,并用氢氧化钠水溶液调节ph值为6~8.用二氯甲烷(200ml
×
3次)萃取。合并有机相,减压旋蒸除去有机溶剂。所得固体通过柱层析分离提纯得到黄色固体产物化合物a(4.9g,yield90%)。
[0081]
对得到的产物化合物a进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0082]1h nmr(500mhz,cd2cl2,298k)δ[ppm]=11.54(s,2h),8.98(d,j=8.8hz,4h),8.00(d,j=8.8hz,4h),7.68(dd,j=8.8,6.6hz,4h),7.54(dd,j=8.8,6.6hz,4h),7.11(s,1h),7.03(s,1h),3.81(s,6h).
13
c nmr(126mhz,cd2cl2,298k)δ[ppm]=193.32,159.04,141.86,135.00,131.58,130.45,128.50,127.72,125.63,125.20,123.61,118.56,95.97,55.99.esi
‑
tof
‑
hrms:m/z calcd for[m+h]
+
c
38
h
27
o
4+
,547.1904;found 547.1910(error=+1.1ppm).
[0083]
(2)蒽基大环分子m1的制备:
[0084][0085]
中间体化合物s3的合成:将naclo2(1.8g,20.0mmol),化合物a(1.3g,2.5mmol)及nh2so3h(1.9g,20.0mmol)溶于h2o(10ml),thf(10ml)和meoh(10ml)的混合溶液中。室温下搅拌12小时,倒入300ml水中析出沉淀。过滤得到产物s3(1.1g,yield 77%)。
[0086]
中间体化合物s4的合成:将三乙基硅烷(2.8ml,17.5mmol),化合物a(1.3g,2.5mmol),氨基甲酸叔丁酯(2.0g,17.5mmol)和三氟乙酸(0.7ml,10mmol)溶于乙腈(20ml)和二氯甲烷(20ml)混合溶液中。氮气保护下,室温搅拌12小时。减压旋干溶剂,加入二氯甲烷(20ml)和三氟乙酸(20ml),在氮气保护下搅拌12小时。减压旋去大部分有机溶剂,加入乙醚(50ml),析出沉淀。过滤沉淀,得到固体产物化合物s4(1.8g,yield 95%)。
[0087]
大环分子m1的合成:将中间体化合物s3(578mg,1mmol)与将六氟磷酸苯并三唑
‑1‑
基
‑
氧基三吡咯烷基磷(pybop,1.6g,3mmol)溶解于干燥n,n
‑
二甲基甲酰胺(30ml).将化合物s4(749mg,1mmol)溶解于另一份干燥dmf(30ml)。将上述两份溶液,在氮气保护下,滴加入溶解有n,n
‑
二异丙基乙胺(3.9g,5.0ml)的干燥n,n
‑
二甲基甲酰胺(400ml)中,6小时滴完。氮气保护下,室温搅拌24小时。减压旋干大部分溶剂,将剩余溶液倒入冰水中,析出沉淀。柱层析分离提纯得到固体产物大环分子m1(490mg,yield 45%)。
[0088]
对得到的产物大环分子m1进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0089]1h nmr(500mhz,cd2cl2,298k)δ[ppm]=8.39(d,j=8.8hz,4h),8.13(d,j=8.8hz,4h),7.68(d,j=8.8hz,4h),7.60(d,j=8.8hz,4h),7.53(dd,j=8.8,6.6,4h),7.35(m,8h),7.25(dd,j=8.8,6.6,4h),7.00(s,1h),6.99(s,1h),6.03(s,1h),5.85(s,1h),5.78(d,j=4.1hz,4h),5.04(t,j=4.2hz,2h),3.90(s,6h),3.88(s,6h).
13
c nmr(126mhz,cd2cl2,298k)δ[ppm]=168.63,158.54,158.48,138.03,136.95,135.46,135.11,131.88,130.54,129.90,129.44,128.21,127.57,127.47,126.89,126.23,126.01,125.16,125.10,124.94,123.68,119.07,118.79,95.72,95.50,56.02,55.96,36.46.esi
‑
tof
‑
hrms:m/z calcd for[m+n(ch3)4]
+
c
80
h
66
n3o
6+
,1164.4946;found 1164.4969(error=+2.0ppm).
[0090]
实施例2
[0091]
(1)双醛基刚性桥联双蒽化合物b的制备:
[0092][0093]
合成中间产物s1:将化合物s0(2.4g,5.0mmol)溶解于50ml二氯甲烷中,0℃下加入
bbr3(5.0ml,50.0mmol)。在0℃下搅拌半小时后,再升温至室温搅拌四小时。将反应液倒入冰水浴中,用naoh溶液调节ph至5
‑
6.用二氯甲烷(50ml
×
3)和乙酸乙酯(50ml
×
3)萃取。合并有机相,减压除去有机溶剂,即得固体产物s1(2.9g,90%).
[0094]
化合物b的制备:将中间产物s1(6.3g,10.0mmol)溶解于200ml二氯甲烷中,加入1,1
‑
二氯甲醚(3.6ml,40.0mmol).降温至0℃,搅拌下滴入ticl4(4.0ml,40.0mmol)。滴完后继续维持0℃一小时,之后升温至室温并维持三小时。将反应液倒入冰水(200ml)中,并用氢氧化钠水溶液调节ph值为6~8.用二氯甲烷(200ml
×
3次)萃取。合并有机相,减压旋蒸除去有机溶剂。所得固体通过柱层析分离提纯得到黄色固体产物化合物b(5.9g,yield 85%).
[0095]
对得到的产物化合物b进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0096]1h nmr(500mhz,cd2cl2,298k)δ[ppm]=11.54(s,2h),8.97(d,j=9.0hz,4h),8.02(d,j=8.7hz,4h),7.68(dd,j=9.0,6.6hz,4h),7.56(dd,j=8.7,6.6hz,2h),7.18(s,1h),6.74(s,1h),4.55(s,4h),4.16(q,j=7.1hz,4h),1.22(t,j=7.1hz,6h).
13
c nmr(126mhz,cd2cl2,298k)δ[ppm]=193.34,168.16,157.10,140.86,135.75,131.48,130.37,128.52,127.72,125.72,125.48,123.60,120.23,98.07,65.86,61.41,13.87.esi
‑
tof
‑
hrms:m/z calcd for[m+h]
+
c
44
h
35
o
8+
,691.2326;found 691.2335(error=+1.3ppm).
[0097]
(2)蒽基大环分子m2的制备:
[0098][0099]
中间体化合物s5的合成:将naclo2(1.1g,12.0mmol),化合物b(1.0g,1.5mmol)及nh2so3h(1.2g,12.0mmol)溶于h2o(8ml),thf(8ml)和meoh(8ml)的混合溶液中。室温下搅拌12小时,倒入300ml水中析出沉淀。过滤得到产物s5(0.9g,yield 87%)。
[0100]
中间体化合物s6的合成:将三乙基硅烷(1.7ml,10.5mmol),化合物b(1.0g,1.5mmol),氨基甲酸叔丁酯(1.2g,10.5mmol)和三氟乙酸(0.4ml,6mmol)溶于乙腈(15ml)和二氯甲烷(15ml)混合溶液中。氮气保护下,室温搅拌12小时。减压旋干溶剂,加入二氯甲烷(15ml)和三氟乙酸(15ml),在氮气保护下搅拌12小时。减压旋去大部分有机溶剂,加入乙醚(50ml),析出沉淀。过滤沉淀,得到固体产物化合物s6(1.1g,yield 83%)。
[0101]
大环分子m2的合成:将中间体化合物s5(723mg,1mmol)与将六氟磷酸苯并三唑
‑1‑
基
‑
氧基三吡咯烷基磷(pybop,1.6g,3mmol)溶解于干燥n,n
‑
二甲基甲酰胺(30ml).将化合物s6(921mg,1mmol)溶解于另一份干燥dmf(30ml)。将上述两份溶液,在氮气保护下,同时滴加入溶解有n,n
‑
二异丙基乙胺(3.9g,5.0ml)的干燥n,n
‑
二甲基甲酰胺(400ml)中,6小时滴完。氮气保护下,室温搅拌24小时。减压旋干大部分溶剂,将剩余溶液倒入冰水中,析出沉
淀。柱层析分离提纯得到固体产物大环分子m2(730mg,yield 53%)。
[0102]
对得到的产物大环分子m2进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0103]1h nmr(500mhz,cd2cl2,298k)δ[ppm]=8.40(d,j=8.7hz,4h),8.13(d,j=8.7hz,4h),7.72(d,j=8.7hz,4h),7.65(d,j=8.7hz,4h),7.59
–
7.50(m,4h),7.42
–
7.33(m,8h),7.31
–
7.24(m,4h),6.74(s,1h),6.73(s,1h),6.10(s,1h),5.92(s,1h),5.79(d,j=4.2hz,4h),5.09(t,j=4.2hz,2h),4.20(q,j=7.1hz,8h),1.25(t,j=7.1hz,12h).
13
c nmr(126mhz,cd2cl2,298k)δ[ppm]=168.66,168.42,168.41,156.61,156.55,138.82,137.76,134.62,134.28,132.11,130.48,129.85,129.43,128.48,127.58,127.46,126.90,126.31,126.12,125.30,125.14,125.10,123.68,120.75,120.50,98.45,97.82,65.97,65.84,61.36,36.49,31.58,22.65,13.86.esi
‑
tof
‑
hrms:m/z calcd for[m+k]
+
chemical formula:c
88
h
70
kn2o
14+
,1417.4459;found 1417.4485(error=+1.8ppm).
[0104]
实施例3
[0105]
蒽基大环分子m3的制备:
[0106][0107]
将实施例2中制备的蒽基大环分子m2(690mg,0.5mmol)溶于乙醇(10ml)和水(10ml)的混合溶液,再加入氢氧化钠(800mg)。室温搅拌12小时后,减压旋干溶剂。向残余物中滴加10%hcl溶液(5ml),生成大量固体沉淀。过滤得到固体,并减压冷冻干燥,得到固体(500mg)。将上述固体加入溶解有氢氧化钠(64mg)的水(5ml)中,并搅拌两小时。将此溶液冷冻干燥,得到固体产物大环分子m3(540mg,yield 80%)。
[0108]
对得到的产物大环分子m3进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0109]1h nmr(500mhz,d2o,298k)δ[ppm]=8.34(d,j=8.8hz,4h),7.91(d,j=8.8hz,4h),7.73(d,j=8.8hz,4h),7.65(d,j=8.8hz,4h),7.50(dd,j=8.8,8.3hz,4h),7.33(m,8h),7.23(dd,j=8.8,8.3hz,4h),6.73(s,1h),6.69(s,1h),5.83(s,1h),5.71(s,4h),5.67(s,1h),4.38(s,4h),4.36(s,4h).
13
c nmr(126mhz,d2o/dmso
‑
d6=9:1,298k)δ[ppm]=175.85,171.20,163.81,157.16,157.02,138.18,136.85,135.55,134.65,130.38,130.23,129.61,129.50,127.75,127.52,127.19,127.09,126.90,126.67,125.95,125.67,124.51,123.84,119.87,119.27,98.55,98.26,67.70,67.61,36.36.esi
‑
tof
‑
hrms:m/z calcd for[m
‑
4na
+
]3‑
c
80
h
51
n2o
143
‑
,421.1119;found 421.1112(error=
‑
1.7ppm).
[0110]
实施例4
[0111][0112]
(1)双醛基刚性桥联双蒽化合物c的制备:
[0113]
中间体化合物s7的制备:将9
‑
溴蒽(12g,45mmol)溶解于干燥四氢呋喃(300ml)中,
在低温
‑
80℃,氮气保护下,加入正丁基锂的干燥四氢呋喃溶液(2.60m,19.2ml,50.6mmol)。维持
‑
80℃,搅拌两小时后,加入氯化锌(9.1g,66.7mmol)。维持
‑
80℃,搅拌四小时后,升温至室温,搅拌一天。将1,3
‑
二溴
‑
4,5,6
‑
三甲氧基苯(3.7g,11.5mmol),二(氰基苯)二氯化钯(0.44g,1.2mmol)和三叔丁基膦的正己烷溶液(10%wt,5.6ml,2.3mmol)加入50ml干燥四氢呋喃中,氮气保护下,室温搅拌半小时。将该溶液转移注入之前已室温搅拌一天的反应体系中,之后升温至85℃搅拌两天。之后,将反应降温至室温,过滤溶液,得到滤饼即为粗产物。用甲醇、正己烷和氯仿依次洗涤,得到黄色固体产物s7(5.3g,yield 94%)。
[0114]
化合物c的制备:将中间产物s7(5.2g,10.0mmol,1equiv.)溶解于200ml二氯甲烷中,加入1,1
‑
二氯甲醚(3.6ml,40.0mmol,4equiv.).降温至0℃,搅拌下滴入ticl4(4.0ml,40.0mmol,4equiv.)。滴完后继续维持0℃一小时,之后升温至室温并维持三小时。将反应液倒入冰水(200ml)中,并用氢氧化钠水溶液调节ph值为6~8.用二氯甲烷(200ml
×
3次)萃取。合并有机相,减压旋蒸除去有机溶剂。所得固体通过柱层析分离提纯得到黄色固体产物化合物c(5.4g,yield94%)。
[0115]
对得到的产物化合物c进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0116]1h nmr(500mhz,cd2cl2,298k)δ[ppm]=11.32(s,2h),8.98(d,j=8.8hz,4h),7.87(d,j=8.8hz,4h),7.46(dd,j=8.8,6.6hz,4h),7.33(dd,j=8.8,6.6hz,4h),6.98(s,1h),3.74(s,6h),3.61(s,3h).
13
c nmr(126mhz,cd2cl2,298k)δ[ppm]=188.67,156.34,138.75,131.83,129.41,127.31,124.34,119.68,116.56,114.34,111.58,109.87,94.77,53.72,51.98.esi
‑
tof
‑
hrms:m/z calcd for[m+h]
+
c
39
h
30
o
5+
,577.2010;found 577.2018(error=+1.4ppm).
[0117][0118]
(2)蒽基大环分子m4的制备:
[0119]
中间体化合物s8的合成:将naclo2(1.8g,20.0mmol),化合物c(1.4g,2.5mmol)及nh2so3h(1.9g,20.0mmol)溶于h2o(10ml),thf(10ml)和meoh(10ml)的混合溶液中。室温下搅拌12小时,倒入300ml水中析出沉淀。过滤得到产物s8(1.3g,yield 83%)。
[0120]
中间体化合物s9的合成:将三乙基硅烷(2.8ml,17.5mmol),化合物a(1.4g,2.5mmol),氨基甲酸叔丁酯(2.0g,17.5mmol)和三氟乙酸(0.7ml,10mmol)溶于乙腈(20ml)和二氯甲烷(20ml)混合溶液中。氮气保护下,室温搅拌12小时。减压旋干溶剂,加入二氯甲烷(20ml)和三氟乙酸(20ml),在氮气保护下搅拌12小时。减压旋去大部分有机溶剂,加入乙醚(50ml),析出沉淀。过滤沉淀,得到固体产物化合物s9(1.8g,yield 87%)。
[0121]
大环分子m1的合成:将中间体化合物s8(608mg,1mmol)与将六氟磷酸苯并三唑
‑1‑
基
‑
氧基三吡咯烷基磷(pybop,1.6g,3mmol)溶解于干燥n,n
‑
二甲基甲酰胺(30ml).将化合
物s9(806mg,1mmol)溶解于另一份干燥dmf(30ml)。将上述两份溶液,在氮气保护下,同时滴加入溶解有n,n
‑
二异丙基乙胺(3.9g,5.0ml)的干燥n,n
‑
二甲基甲酰胺(400ml)中,6小时滴完。氮气保护下,室温搅拌24小时。减压旋干大部分溶剂,将剩余溶液倒入冰水中,析出沉淀。柱层析分离提纯得到固体产物大环分子m4(610mg,yield 53%)。
[0122]
对得到的产物大环分子m4进行核磁氢谱、核磁碳谱和质谱表征,其数据结果如下:
[0123]1h nmr(500mhz,cd2cl2,298k)δ[ppm]=8.28(d,j=8.8hz,4h),8.01(d,j=8.8hz,4h),7.52(d,j=8.8hz,4h),7.50(d,j=8.8hz,4h),7.38(dd,j=8.8,6.6,4h),7.24(m,8h),7.12(dd,j=8.8,6.6,4h),5.97(s,1h),5.71(s,1h),5.65(d,j=4.1hz,4h),4.90(t,j=4.2hz,2h),3.80(s,6h),3.76(s,6h),3.70(s,3h),3.64(s,3h).
13
c nmr(126mhz,cd2cl2,298k)δ[ppm]=161.32,152.38,150.54,131.98,128.33,127.68,125.34,123.47,120.34,119.53,117.49,115.98,113.75,112.63,111.04,110.84,110.56,108.93,108.67,107.94,107.63,106.70,106.21,93.59,92.14,53.83,52.77,33.44,29.36.esi
‑
tof
‑
hrms:m/z calcd for[m+n(ch3)4]
+
c
82
h
70
n3o
8+
,1224.5157;found 1224.5178(error=+1.7ppm).
[0124]
性能测试:
[0125]
(1)分子识别
[0126]
a.将实施例1制备的大环分子m1用于有机溶剂中对有机小分子苯醌(g1),萘醌(g2)和蒽醌(g3)的分子识别。通过核磁滴定法,测定大环分子对不同结构客体分子在二氯甲烷中的键合常数(k
a
),测试数据如表1所示。
[0127]
核磁仪型号为:bruker avance
‑
500 nmr spectrometer溶剂:氘代二氯甲烷;温度:25℃;主体浓度:0.3mm;客体浓度:8mm.
[0128][0129]
表1
[0130]
客体g1g2g3键合常数(k
a
/m
‑1)41194
[0131]
通过表1数据可知,大环化合物m1在有机溶剂中能识别重要的具有生物意义和医药意义的有机小分子,如醌类化合物苯醌(g1),萘醌(g2)和蒽醌(g3)。并且,对这些化合物的识别具有明显的选择性,如对蒽醌(g3)的键合常数是苯醌的(g1)的23倍。
[0132]
b.将实施例3制备的大环分子m3用于水中对有机小分子苯醌(g1),维生素k3(g4),1,
‑4‑
二氧六环(g5),色酮(g6)的分子识别。通过等温滴定量热法,测定大环分子对上述不同结构客体分子在水中的键合常数(k
a
),测试数据如表2所示。
[0133]
等温滴定量热仪型号为:malvern microcal peaq
‑
itc automated instrument;溶剂:超纯水;温度:25℃;主体浓度:0.1mm;客体浓度:1.1mm。
[0134][0135]
表2
[0136]
客体g1g4g5g6键合常数(k
a
/m
‑1)3.0
×
1045.7
×
1061.1
×
1034.1
×
105[0137]
通过表2数据可知,大环分子m3在水中能高强度识别重要的具有生物意义和医药意义的有机小分子,如醌类化合物苯醌(g1),维生素k3(g4),药物母核结构色酮(g6)。并且,对这些化合物的识别具有明显的选择性。对能与水混溶的环境污染物1,4
‑
二氧六环(g5)的键合达到了103m
‑1以上,表明大环分子m3在水中可以很好地识别亲水性分子。
[0138]
(2)手性传感:
[0139]
将实施例3制备的大环分子m3用于水相中对手性有机小分子的手性传感。大环分子m3为非手性分子,其溶液不具有圆二色光谱信号。左乙拉西坦(levetiracetam),别名乐凡替拉西坦、利维西坦、左旋乙拉西坦,化学名称(s)
‑
α
‑
乙基
‑2‑
氧代
‑1‑
吡咯烷乙酰胺,是一种白色结晶粉末的化学品;该化合物为手性化合物,但是不具有圆二色光谱信号。当将一化学当量(50μm)的左乙拉西坦加入大环分子3
‑
4的水溶液(50μm)后,复合物溶液在250~290nm,310~420nm波长处出现明显的圆二色光谱信号。这表明,大环分子3
‑
4可用于检测、传感手性分子的手性信号。
[0140][0141]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0142]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1